宋丹丹, 蒋永光, 石良


中国地质大学(武汉)环境学院, 生物科学与技术系, 湖北 武汉 430074
收稿日期:2017-10-19;修回日期:2018-01-25;网络出版日期:2018-03-05
基金项目:国家自然科学基金(41630318,41772363);湖北省“****”
作者简介:石良, 博士, 中国地质大学(武汉)环境学院生物科学与技术系教授, 中国微生物学会地质微生物学专业委员会委员。经湖北省第六批"****"、于2016年夏由美国能源部西北太平洋国家实验室引进到中国地质大学(武汉)环境学院生物科学与技术系的全职****。主持和参与美国能源部、国立卫生研究院和国家科学基金委员会15项科研项目, 个人支配额达631.1万美元。研究方向为地质微生物学, 主要包括两个方面:(1)微生物-矿物之间的胞外电子传导机理; (2)地质微生物组:地下微生物种群的结构和功能。已在Nature Reviews Microbiology、Nature Communications、Proceedings of the National Academy of Sciences of the United States of America、FEMS Microbiology Reviews、Molecular Microbiology、Applied and Environmental Microbiology、Journal of Biological Chemistry等专业刊物发表科研论文109篇, 论文总引用次数超过4100次, H-指数是37
*通信作者:石良, E-mail:liang.shi@cug.edu.cn
摘要:页岩气是一种特殊的天然气聚集,以吸附或游离状态存在于页岩之中。页岩气资源储量丰富,约占全球天然气能源的三分之一,主要分布在中国、北美、俄罗斯等国家和地区。页岩气开采所使用的水力压裂技术会对深地微生物产生显著影响,在水力压裂的不同阶段,微生物群落组成存在明显差异。其中,产甲烷菌能够提高页岩气的产量,而产酸细菌会造成设备腐蚀,降低页岩气的回收效率。本文概述了页岩气的开采现状、开采过程以及微生物种群的变化和潜在影响,以期促进页岩气开采与深地微生物相互影响的研究,最终推动页岩气的绿色、高效开采。
关键词: 页岩气 水力压裂 深地微生物 相互影响
Shale gas extraction and deep subsurface microorganisms interactions
Dandan Song, Yongguang Jiang, Liang Shi


Department of Biological Sciences and Technology, School of Environmental Studies, China University of Geosciences, Wuhan 430074, Hubei Province, China
Received 19 October 2017; Revised 25 January 2018; Published online 5 March 2018
*Corresponding author: Liang Shi, E-mail: liang.shi@cug.edu.cn
Supported by the National Natural Science Foundation of China (41630318, 41772363) and by the Handred Talent Program of Hubei Province
Abstract: Shale gas is the natural gas locked within the shale formation. It is estimated that 1/3 of natural gas is shale gas. Shale gas is found mainly in China, North America, and Russia. Hydraulic fracturing is a commonly used method to recover shale gas, which affects greatly on deep subsurface microorganisms. The microbial communities vary at different stages of hydraulic fracturing. Among them, methanogen may improve shale gas production, while the acid-producing bacteria that could corrode the equipment, may lower the gas production. With the aim of studying shale gas extraction and deep subsurface microbial interactions as well as improving extracting shale gas, this review focuses on current understandings of shale gas extraction and its impacts on deep subsurface microorganisms.
Key words: shale gas hydraulic fracturing deep subsurface microorganisms interactions
页岩气是指主体位于有机质丰富的暗色泥页岩或高碳泥页岩中,以吸附或游离状态为主要存在方式的天然气聚集[1]。全球页岩气资源储量约为煤层甲烷量的2倍[2],约占天然气能源的三分之一[3]。目前的勘探数据表明,中国、北美、俄罗斯、阿根廷、澳大利亚、巴西以及几个非洲和欧洲国家均拥有极为丰富的页岩气资源[4]。美国是世界上勘探和开发页岩气最早的国家,也是目前页岩气产量最多的国家。页岩气的大规模开发不仅极大地改变了美国的能源状况,也对世界能源格局产生了重大影响。
中国是继美国、加拿大之后,世界上第3个成功实现页岩气生产的国家[5]。我国页岩气资源潜力大、分布面积广、发育层系多,其中,四川、新疆、重庆、贵州、湖北、湖南、陕西等地区的页岩气储量占全国资源总量的一半以上。国土资源部2012年发布的《全国页岩气资源潜力调查评价及有利区优选成果》表明,除青藏区外,全国页岩气地质资源潜力约为134.42万亿m3,可采资源潜力为25.08万亿m3。尽管储量丰富,但美国的页岩气开发对象主要是海相沉积页岩,我国页岩气则以陆相沉积页岩为主,贮藏的地质条件更为复杂,埋藏深度也更大,约为数千米,还面临水资源匮乏等一系列问题[5]。采用常规的水力压裂法开采页岩气时,不但会消耗大量的水资源,压裂的过程和压裂液中携带的化学试剂还会对原本处于平衡态的深部地下微生物产生显著影响。深地微生物在甲烷等页岩气主要成分的生物成因、烃类的发酵、金属的氧化还原等方面都具有重要作用[6-7],对页岩气开采过程中深地微生物的群落变化和潜在影响进行研究,将有助于建立相应的配套措施,尽可能减少微生物造成的设备腐蚀,以促进页岩气的绿色、高效开采。
1 页岩气的开采过程 目前,页岩气的开采主要采用水力压裂法,该方法是以足够的速率和压力引入大量的水基压裂液,迫使断裂的页岩形成人工裂缝,增加并扩大油气渗流通道,使油气以最佳流速进入井筒,从而大幅度提高油气产量的一种储层改造技术[8]。水力压裂后,泵压降低,地层中的流体通过井管返流到地面,这种流体称为“返排水”,注入的流体和收集的烃的混合物称为“产出流体”。水力压裂装置的剖面图和此过程的细节如图 1所示[9],开凿页岩气井的工程阶段包括以下主要步骤:(1)在页岩层上方垂直钻孔,在钻井活动中安装多个保护套,以保护敏感的含水层和地层;(2)在储气页岩内侧向钻井,长度可达数千米;(3)用射孔套管和封隔器将侧向钻孔分成多个小区域以便集中增产;(4)在高压下注入大量液体到地层中,导致断裂处的扩展网进入地层[8]。
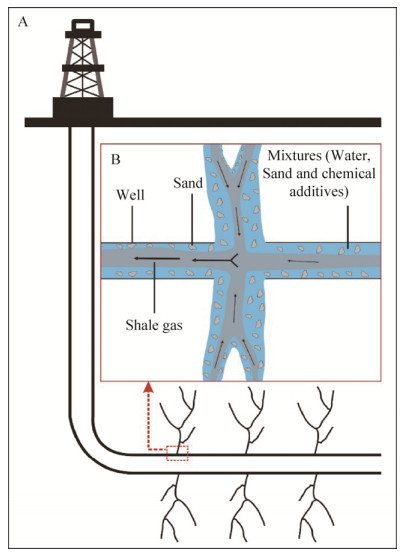 |
| 图 1 水力压裂装置剖面图(A)与水力压裂过程细节图(B)[9] Figure 1 Cross section of a hydraulically fractured well (A) and a detailed drawing of hydraulic fracturing (B)[9]. |
| 图选项 |
2 水力压裂过程中深地微生物群落的变化 据估计,陆地地下存在多达25×1029个细菌细胞,可能占地球上所有细菌细胞的40%-60%[10]。地球上生命的深度限制是未知的,由于地表以下数千米处岩石的取芯费用较高、难度太大,对原始页岩的微生物多样性知之甚少[11-12]。在页岩气开采过程中,通过研究返排水中的微生物组成可以间接地探究深地微生物群落的结构和变化[4],但返排水中的微生物可能有多种来源,包括页岩层、钻井液、压裂液改良剂或用于产生压裂液的水源水[13-14]。另一方面,深地微生物组成会受到多种因素影响,包括压裂液中含有的杀菌剂对微生物的杀灭作用,有机改良剂对微生物生长的促进作用,压裂液本身或注入过程中携带的地表微生物等[15]。页岩气所在地层存在苛刻的环境条件,如厌氧、高温、高压、酸性pH、营养限制、高盐度等[10],推测地表微生物很难定植和生存。
水力压裂过程中的微生物群落研究一般分为3个阶段:注入流体阶段(Injected fluids period),初始返排阶段(Intial flowback period)以及后期产出水阶段(Late produced water period)[16]。
在美国马塞勒斯页岩气井的研究中发现,注入流体中微生物的丰富度较高,而返排流体和产出流体中微生物的丰富度通常较低。微生物群落的改变与流体化学条件的变化相关,如pH、电导率、溶解碳浓度(无机碳和有机碳)以及离子含量(总N,Br-,总Fe和K+)的变化等。具体来说,注入流体的pH呈弱酸性,电导率较低,溶解碳含量(无机碳和有机碳)较高,离子含量(总N,Br-,总Fe和K+)较低,此时的微生物以假单胞菌、Cobetia、弓形杆菌、假交替单胞菌和海杆菌为主。其中Cobetia、假单胞菌和其他未分类细菌的平均相对丰度分别为45%、17%和15%,它们构成了注入流体中微生物的大部分数量[16]。随着压裂时间的延长,初始返排阶段(压裂后1-14 d)的流体pH略有降低,电导率增大,溶解碳含量降低,离子含量(总N,Br-,总Fe和K+)也不断增大,此时的微生物类群以Halolactibacillus、弓形杆菌、弧菌、高温球菌和海杆菌为主,它们的平均相对丰度分别为33.0%、17.0%、9.4%、8.6%和7.3%[16]。在2-4周之后,一旦返排量开始减弱,则页岩气井开始投入生产,并且随着时间的推移,液体与地层盐水达到平衡。在后期的产出水中(压裂后约330 d),pH和溶解碳含量达到最低,电导率和离子含量(总N,Br-,总Fe和K+)达到最大,与注入流体相比,pH和碳含量分别降低了1.2和4.7倍,电导率增大了3.3倍,离子含量方面,总N、Br-、总Fe和K+分别增大了1.8、6.9、78.8和5.8倍,此时微生物以盐厌氧菌、盐单胞菌科中的盐单胞菌和该科其他种类为主,平均相对丰度分别为86.0%、2.4%和5.3%[16-17],这些细菌是适应厌氧、高盐环境的典型深地微生物。值得注意的是,水力压裂过程1个多月后,产出水微生物群落仍以盐厌氧菌和盐单胞菌为主[16-20]。并且,盐厌氧菌和海杆菌始终存在于这3个阶段。相反,在水力压裂发生后2个月以上才能在产出水中检测到细菌Selenihalanaerobacter和古菌嗜盐产甲烷菌和甲烷叶菌[16]。因此,深地微生物群落在压裂液的影响下,经历了地表微生物侵入和消减,以及深地微生物适应新环境和增殖的复杂过程,这也验证了之前所做的推测,即地表微生物在进入页岩层以后受到苛刻环境条件的选择压力,难以维持长久的生存;深地微生物则在杀菌剂的作用下存活下来,逐渐适应环境中水分、营养条件的改变,生长速率也缓慢加快。在针对产出流体生物量进行的精确测定中,页岩中微生物的生长现象也得到了证实[3, 17, 19]。
总的来说,注入流体和初始返排流体(4-5 d)碳浓度和pH值较高,后期的产出流体中离子含量较高[16]。水力压裂过程的整个阶段均普遍存在盐厌氧菌[4, 16],盐单胞菌和盐单胞菌科的其他成员以及海杆菌是页岩中广泛分布的微生物类群,可能在压裂后的生物地球化学循环中发挥重要作用[16-18, 21]。马塞勒斯的宏基因组数据表明页岩系统中的盐单胞菌和海杆菌可能部分地负责页岩烃的分解,包括好氧或微好氧条件下的芳香族和脂肪族化合物的分解[3]。
3 微生物对页岩气开采的影响 页岩气的开采过程影响了深地微生物的生长环境和增殖速率,微生物的代谢活动也会直接或间接地影响页岩气的回收过程,该影响主要包括两方面,有利的一面是页岩层中产甲烷菌的增长能够增加气体回收[22],有害的一面则为细菌性硫化氢的生成(“储层酸化”)会降低回收率并导致设备腐蚀和环境污染[23]。此外,新产生的裂缝中生物量的积累会降低其渗透性,进而降低页岩气的回收率。本文接下来将就这两方面的影响做具体的阐述。
3.1 产甲烷菌 某些微生物在降解煤、页岩和油气藏中的复杂有机物的过程中,能形成天然气的主要成分甲烷。并且能够参与此类反应的微生物在地下普遍存在[24]。因此通过了解这类微生物的结构和功能并对其加以利用,人们可能会实现微生物产甲烷以促进能源回收。关于页岩中古生菌的研究十分有限,目前的测序结果表明产甲烷菌的分布最为普遍[24],约占古生菌群落的91%[25]。
甲烷的生物生成主要有三种途径,包括乙酸发酵型、氢营养型以及甲基营养型[26]。同位素分析结果表明大部分甲烷是生物成因,并且是由还原二氧化碳的氢营养型产甲烷菌产生[27-28]。在高盐度条件下,细菌生长会有较多的能量损失,因此,高盐度产出流体中利用甲基的产甲烷菌更为丰富[29-30],并且甲基营养型产甲烷菌的量随地下水中总溶解固体量的增大而增加[25]。安特里姆页岩气井的不同盐度产出流体中,高盐样品总是以甲基营养型的嗜盐产甲烷菌为主[29]。事实上,不管地形如何,嗜盐产甲烷菌都是页岩系统中最广泛存在的产甲烷菌,这一类群已在马塞勒斯[31]、伯克特[31]、安特里姆[28-29]和海内斯维尔页岩中[21]被发现。在富集实验中,用C1上含有甲基的化合物处理产出流体,能够刺激甲基营养型产甲烷菌超过氢营养型产甲烷菌[31]。
这些研究结果表明,产出流体的盐度决定了产甲烷的细菌类群。在安特里姆和新奥尔巴尼地层中,生物甲烷对总体甲烷的回收有重要贡献[32-33]。鉴于在页岩中检测到的古细菌和细菌的多样性较低,水力压裂的长期过程中,根据产甲烷菌的组成和营养类型,进行有效的靶向刺激,能提高原位甲烷的生成,将有利于增加页岩气的总产量。此外,断裂页岩中还可能存在厌氧或好氧的甲烷氧化菌,也可以通过相应措施来减少其对甲烷的消耗[34]。
3.2 产酸细菌 在页岩气的开采过程中,产酸细菌会产生酸和硫化物等代谢物,导致储层酸化和基础设施腐蚀,降低页岩气的回收效率,同时也会引起环境污染。Mand等研究了低温油藏中,产甲烷菌和产乙酸菌以碳钢为电子供体时,如何导致基础设施的腐蚀[35]。测序结果表明,在初始回流期间,返排水中含有与深海乳酸菌Halolactibacillus miurensis (98%-99%序列相似性)高度相似的微生物,可能会在乙酸盐存在的条件下发生发酵作用[36]。水力压裂期间,压力较高时,瓜尔豆胶能够促进微生物产酸和产生硫化物,造成生物腐蚀[37]。
嗜盐厌氧菌在水力压裂的各个阶段往往占据主导地位,最近的研究证明嗜盐厌氧菌具有生物腐蚀能力[3, 38],但是该种细菌不能进行硫酸盐呼吸[38],似乎只有在活性有机碳和还原态硫(如硫代硫酸盐)存在时,才能够产生相当大浓度的硫化物。基因组测序表明嗜盐厌氧菌含有类似硫氰酸酶的硫代硫酸盐还原酶,对嗜盐厌氧菌分离株的研究也证明硫氰酸酶能利用硫代硫酸盐产生硫化物[23]。
在油气开采过程中,一般会选择性地使用杀菌剂来控制油气井中的产酸细菌。但研究结果表明,杀菌剂并不能完全抑制注入流体中的和土著的微生物,包括产生酸和硫化物等代谢物的微生物种类[16]。Xue和Voordouw研究了杀菌剂和硝酸盐的组合,以控制油藏酸化[39]。目前,越来越多的研究侧重于如何利用杀菌剂更好地控制产酸细菌的影响。
4 结论和展望 页岩气开采过程中,钻井液和压裂液所含有的水、杀菌剂、有机改良剂,以及携带的外源微生物等会显著影响深地微生物群落结构的组成。不同水力压裂阶段的微生物丰富度不同,注入流体中微生物的丰富度较高,返排流体和产出流体中通常较低。注入流体中微生物群落最初以假单胞菌、Cobetia、弓形杆菌、假交替单胞菌和海杆菌为主;初始返排水中微生物群落以Halolactibacillus、弓形杆菌、弧菌、高温球菌和海杆菌为主;在水力压裂后期则以嗜盐厌氧菌和盐单胞菌为主,嗜盐厌氧菌始终存在于3个压裂阶段。页岩层中微生物的代谢活动也会直接或间接地影响页岩气的生产过程,产甲烷菌的增长能够增加页岩气产量,细菌介导硫化氢的生成则会造成储层酸化,降低页岩气回收率并引起设备腐蚀和环境污染。
中国与美国在页岩气地质条件和开发条件上都存在一定差异,目前,中国页岩气资源的开发以陆相沉积页岩为主,美国的页岩气开发对象则主要是海相沉积页岩,中国应当吸取美国页岩气开采的经验,同时结合自己本国的地形与资源特点,制定出有中国特色的页岩气开采方案。近年来应用广泛的宏基因组学技术、稳定同位素探针技术、单细胞测序、元蛋白质组学和代谢组学将有利于提高人们对地下生态系统中微生物生理生态学方面的认识[40]。但目前为止,国内外与页岩气开采有关微生物的研究主要集中在对微生物群落的定性描述,并未对与页岩气开采有关的微生物群落进行定量分析,因此,不能确定某一类具体微生物的绝对数量,也不能很好地对其在影响页岩气开采方面的贡献进行全面合理的评估。本实验室目前正在开展相关工作的研究。同时,对于环境因子的变化具体如何影响微生物群落变化,微生物对有机物的利用程度及其产甲烷所需时间等问题,目前仍不十分清楚。因此,更好地了解水力压裂过程与深地微生物间的相互影响,将有可能通过控制或增强特定种群来最大限度地促进页岩气的高效开采,并且在未来的几十年将会一直是学术界的研究热点。
References
| [1] | Zhang JC, Jin ZJ, Yuan MS. Reservoiring mechanism of shale gas and its distribution. Natural Gas Industry, 2004, 24(7): 15-18. (in Chinese) 张金川, 金之钧, 袁明生. 页岩气成藏机理和分布. 天然气工业, 2004, 24(7): 15-18. |
| [2] | Li XJ, Hu SY, Cheng KM. Suggestions from the development of fractured shale gas in North America. Petroleum Exploration and Development, 2007, 34(4): 392-400. (in Chinese) 李新景, 胡素云, 程克明. 北美裂缝性页岩气勘探开发的启示. 石油勘探与开发, 2007, 34(4): 392-400. |
| [3] | Daly RA, Borton MA, Wilkins MJ, Hoyt DW, Kountz DJ, Wolfe RA, Welch SA, Marcus DN, Trexler RV, MacRae JD, Krzycki JA, Cole DR, Mouser PJ, Wrighton KC. Microbial metabolisms in a 2.5-km-deep ecosystem created by hydraulic fracturing in shales. Nature Microbiology, 2016, 1: 16146. DOI:10.1038/nmicrobiol.2016.146 |
| [4] | Mouser PJ, Borton M, Darrah TH, Hartsock A, Wrighton KC. Hydraulic fracturing offers view of microbial life in the deep terrestrial subsurface. FEMS Microbiology Ecology, 2016, 92(11): fiw166. DOI:10.1093/femsec/fiw166 |
| [5] | Zou CN, Dong DZ, Wang YM, Li XJ, Huang JL, Wang SF, Guan QZ, Zhang CC, Wang HY, Liu HL, Bai WH, Liang F, Lin W, Zhao Q, Liu DX, Yang Z, Liang PP, Sun SS, Qiu Z. Shale gas in China:characteristics, challenges and prospects (Ⅱ). Petroleum Exploration and Development, 2016, 43(2): 166-178. (in Chinese) 邹才能, 董大忠, 王玉满, 李新景, 黄金亮, 王淑芳, 管全中, 张晨晨, 王红岩, 刘洪林, 拜文华, 梁峰, 吝文, 赵群, 刘德勋, 杨智, 梁萍萍, 孙莎莎, 邱振. 中国页岩气特征、挑战及前景(二). 石油勘探与开发, 2016, 43(2): 166-178. |
| [6] | Martini AM, Budai JM, Walter LM, Shoell M. Microbial generation of economic accumulations of methane within a shallow organic-rich shale. Nature, 1996, 383(6596): 155-158. DOI:10.1038/383155a0 |
| [7] | Shi L, Dong HL, Reguera G, Beyenal H, Lu AH, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [8] | Kargbo DM, Wilhelm RG, Campbell DJ. Natural gas plays in the marcellus shale:challenges and potential opportunities. Environmental Science & Technology, 2010, 44(15): 5679-5684. |
| [9] | Gregory KB, Vidic RD, Dzombak DA. Water management challenges associated with the production of shale gas by hydraulic fracturing. Elements, 2011, 7(3): 181-186. DOI:10.2113/gselements.7.3.181 |
| [10] | McMahon S, Parnell J. Weighing the deep continental biosphere. FEMS Microbiology Ecology, 2014, 87(1): 113-120. DOI:10.1111/1574-6941.12196 |
| [11] | Edwards KJ, Becker K, Colwell F. The deep, dark energy biosphere:intraterrestrial life on earth. Annual Review of Earth and Planetary Sciences, 2012, 40(1): 551-568. DOI:10.1146/annurev-earth-042711-105500 |
| [12] | Colwell FS, D'Hondt S. Nature and extent of the deep biosphere. Reviews in Mineralogy and Geochemistry, 2013, 75(1): 547-574. DOI:10.2138/rmg.2013.75.17 |
| [13] | Johnson K, French K, Fichter JK, Oden R. Use of microbiocides in Barnett Shale gas well fracturing fluids to control bacteria related problems//Proceedings of CORROSION 2008. New Orleans, Louisiana: NACE International, 2008: 1-14. |
| [14] | Struchtemeyer CG, Davis JP, Elshahed MS. Influence of the drilling mud formulation process on the bacterial communities in thermogenic natural gas wells of the Barnett Shale. Applied and Environmental Microbiology, 2011, 77(14): 4744-4753. DOI:10.1128/AEM.00233-11 |
| [15] | Santillan EFU, Choi W, Bennett PC, Leyris JD. The effects of biocide use on the microbiology and geochemistry of produced water in the Eagle Ford formation, Texas, U.S.A. Journal of Petroleum Science and Engineering, 2015, 135: 1-9. DOI:10.1016/j.petrol.2015.07.028 |
| [16] | Cluff MA, Hartsock A, MacRae JD, Carter K, Mouser PJ. Temporal changes in microbial ecology and geochemistry in produced water from hydraulically fractured Marcellus Shale gas wells. Environmental Science & Technology, 2014, 48(11): 6508-6517. |
| [17] | Murali Mohan A, Hartsock A, Bibby KJ, Hammack RW, Vidic RD, Gregory KB. Microbial community changes in hydraulic fracturing fluids and produced water from shale gas extraction. Environmental Science & Technology, 2013, 47(22): 13141-13150. |
| [18] | Davis JP, Struchtemeyer CG, Elshahed MS. Bacterial communities associated with production facilities of two newly drilled thermogenic natural gas wells in the Barnett Shale (Texas, USA). Microbial Ecology, 2012, 64(4): 942-954. DOI:10.1007/s00248-012-0073-3 |
| [19] | Struchtemeyer CG, Elshahed MS. Bacterial communities associated with hydraulic fracturing fluids in thermogenic natural gas wells in North Central Texas, USA. FEMS Microbiology Ecology, 2012, 81(1): 13-25. DOI:10.1111/j.1574-6941.2011.01196.x |
| [20] | Murali Mohan A, Hartsock A, Hammack RW, Vidic RD, Gregory KB. Microbial communities in flowback water impoundments from hydraulic fracturing for recovery of shale gas. FEMS Microbiology Ecology, 2013, 86(3): 567-580. DOI:10.1111/fem.2013.86.issue-3 |
| [21] | Fichter J, Wunch K, Moore R, Summer E, Braman S, Holmes P. How hot is too hot for bacteria? A technical study assessing bacterial establishment in downhole drilling, fracturing and stimulation operations//Proceedings of CORROSION 2012. Salt Lake City, Utah: NACE International, 2012: 1-21. |
| [22] | Park SY, Liang YN. Biogenic methane production from coal:a review on recent research and development on microbially enhanced coalbed methane (MECBM). Fuel, 2016, 166: 258-267. DOI:10.1016/j.fuel.2015.10.121 |
| [23] | Ravot G, Casalot L, Ollivier B, Loison G, Magot M. rdlA, a new gene encoding a rhodanese-like protein in Halanaerobium congolense and other thiosulfate-reducing anaerobes. Research in Microbiology, 2005, 156(10): 1031-1038. DOI:10.1016/j.resmic.2005.05.009 |
| [24] | Robbins SJ, Evans PN, Parks DH, Golding SD, Tyson GW. Genome-centric analysis of microbial populations enriched by hydraulic fracture fluid additives in a coal bed methane production well. Frontiers in Microbiology, 2016, 7: 731. |
| [25] | Kirk MF, Wilson BH, Marquart KA, Zeglin LH, Vinson DS, Flynn TM. Solute concentrations influence microbial methanogenesis in coal-bearing strata of the Cherokee Basin, USA. Frontiers in Microbiology, 2015, 6: 1287. |
| [26] | Thauer RK, Kaster AK, Seedorf H, Buckel W, Hedderich R. Methanogenic archaea:ecologically relevant differences in energy conservation. Nature Reviews Microbiology, 2008, 6(8): 579-591. DOI:10.1038/nrmicro1931 |
| [27] | Singh DN, Kumar A, Sarbhai MP, Tripathi AK. Cultivation-independent analysis of archaeal and bacterial communities of the formation water in an Indian coal bed to enhance biotransformation of coal into methane. Applied Microbiology and Biotechnology, 2012, 93(3): 1337-1350. DOI:10.1007/s00253-011-3778-1 |
| [28] | Kirk MF, Martini AM, Breecker DO, Colman DR, Takacs-Vesbach C, Petsch ST. Impact of commercial natural gas production on geochemistry and microbiology in a shale-gas reservoir. Chemical Geology, 2012, 332-333: 15-25. DOI:10.1016/j.chemgeo.2012.08.032 |
| [29] | Waldron PJ, Petsch ST, Martini AM, Nüsslein K. Salinity constraints on subsurface archaeal diversity and methanogenesis in sedimentary rock rich in organic matter. Applied and Environmental Microbiology, 2007, 73(13): 4171-4179. DOI:10.1128/AEM.02810-06 |
| [30] | Oren A. Thermodynamic limits to microbial life at high salt concentrations. Environmental Microbiology, 2011, 13(8): 1908-1923. DOI:10.1111/j.1462-2920.2010.02365.x |
| [31] | Akob DM, Cozzarelli IM, Dunlap DS, Rowan EL, Lorah MM. Organic and inorganic composition and microbiology of produced waters from Pennsylvania shale gas wells. Applied Geochemistry, 2015, 60: 116-125. DOI:10.1016/j.apgeochem.2015.04.011 |
| [32] | Martini AM, Walter LM, McIntosh JC. Identification of microbial and thermogenic gas components from Upper Devonian black shale cores, Illinois and Michigan basins. AAPG Bulletin, 2008, 92(3): 327-339. DOI:10.1306/10180706037 |
| [33] | Schlegel ME, McIntosh JC, Bates BL, Kirk MF, Martini AM. Comparison of fluid geochemistry and microbiology of multiple organic-rich reservoirs in the Illinois Basin, USA:Evidence for controls on methanogenesis and microbial transport. Geochimica et Cosmochimica Acta, 2011, 75(7): 1903-1919. DOI:10.1016/j.gca.2011.01.016 |
| [34] | Wuchter C, Banning E, Mincer TJ, Drenzek NJ, Coolen MJL. Microbial diversity and methanogenic activity of Antrim Shale formation waters from recently fractured wells. Frontiers in Microbiology, 2013, 4: 367. |
| [35] | Mand J, Park HS, Okoro C, Lomans BP, Smith S, Chiejina L, Voordouw G. Microbial methane production associated with carbon steel corrosion in a nigerian oil field. Frontiers in Microbiology, 2016, 6: 1538. |
| [36] | Ishikawa M, Nakajima K, Itamiya Y, Furukawa S, Yamamoto Y, Yamasato K. Halolactibacillus halophilus gen. nov., sp. nov. and Halolactibacillus miurensis sp. nov., halophilic and alkaliphilic marine lactic acid bacteria constituting a phylogenetic lineage in Bacillus rRNA group 1. International Journal of Systematic & Evolutionary Microbiology, 2005, 55(6): 2427-2439. |
| [37] | Nixon SL, Walker L, Streets MDT, Eden B, Boothman C, Taylor KG, Lloyd JR. Guar gum stimulates biogenic sulfide production at elevated pressures:implications for shale gas extraction. Frontiers in Microbiology, 2017, 8: 679. |
| [38] | Liang RX, Davidova IA, Marks CR, Stamps BW, Harriman BH, Stevenson BS, Duncan KE, Suflita JM. Metabolic capability of a predominant Halanaerobium sp. in hydraulically fractured gas wells and its implication in pipeline corrosion. Frontiers in Microbiology, 2016, 7: 988. |
| [39] | Xue Y, Voordouw G. Control of microbial sulfide production with biocides and nitrate in oil reservoir simulating bioreactors. Frontiers in Microbiology, 2015, 6: 1387. |
| [40] | Ismail WA, van Hamme JD, Kilbane JJ, Gu JD. Editorial:petroleum microbial biotechnology:challenges and prospects. Frontiers in Microbiology, 2017, 8: 833. DOI:10.3389/fmicb.2017.00833 |
