金志薇1,2, 钟文辉1,3, 吴少松2, 韩成1,3


1.南京师范大学地理科学学院, 江苏省物质循环与污染控制重点实验室, 江苏 南京 210023;
2.南京师范大学环境学院, 江苏 南京 210023;
3.江苏省地理信息资源开发与利用协同创新中心, 江苏 南京 210023
收稿日期:2018-01-24;修回日期:2018-03-29;网络出版日期:2018-05-28
基金项目:国家自然科学基金(41401293,41771286);江苏省自然科学基金(BK20141051)
*通信作者:韩成。Tel:+86-25-85891352;Fax:+86-25-85891742;E-mail:chenghan@njnu.edu.cn
摘要:[目的] 在同尺度下比较我国滇西北高寒草地土壤(GS)及其退化土壤(DGS)中细菌和真菌群落,研究植被退化对高寒草地土壤微生物群落的影响,并探索其环境驱动因子。[方法] 分别以16S rRNA基因和ITS基因作为细菌和真菌分子生态学分析的靶标基因,采用定量PCR法测定基因数量来表征微生物群落丰度,采用Illumina Hiseq测序及生物信息学分析研究土壤微生物群落组成和群落结构。[结果] 草地退化后,土壤pH值显著上升0.65个单位,土壤水分、总有机碳、可溶性氮含量和C/N比分别显著下降了18.4%、67.5%、47.2%和71.2%;草地退化显著降低了土壤细菌和真菌群落丰度,降低幅度分别为92.4%和94.9%;草地退化没有影响土壤细菌和真菌群落α-多样性,但显著改变了细菌和真菌群落β-多样性(群落结构);草地退化改变了土壤细菌和真菌在OTU水平上的物种组成,土壤真菌OTU种类变化更为显著;草地退化没有影响土壤细菌在门水平上的群落组成,但改变了细菌在纲水平上的群落组成(如Acidimicrobiia、Betaproteobacteria、Chloroplast等);草地退化没有影响土壤真菌在门水平和纲水平上的群落组成。[结论] 本研究发现植被退化后滇西北高寒草地土壤质量显著降低,寄居在土壤中的微生物群落丰度也显著降低、微生物群落结构明显改变。
关键词:草地退化微生物多样性微生物生态Illumina Hiseq测序土壤质量
Effect of vegetation degradation on microbial communities in alpine grassland soils in Northwest Yunnan
Zhiwei Jin1,2, Wenhui Zhong1,3, Shaosong Wu2, Cheng Han1,3


1.Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, School of Geography Sciences, Nanjing Normal University, Nanjing 210023, Jiangsu Province, China;
2.School of Environment Sciences, Nanjing Normal University, Nanjing 210023, Jiangsu Province, China;
3.Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, Jiangsu Province, China
Received 24 January 2018; Revised 29 March 2018; Published online 28 May 2018
*Corresponding author: Cheng Han, Tel:+86-25-85891352;Fax:+86-25-85891742;E-mail:chenghan@njnu.edu.cn
Supported by the National Natural Science Foundation of China (41401293, 41771286) and by the Natural Science Foundation of Jiangsu Province (BK20141051)
Abstract: [Objective] By comparing the bacterial and fungal communities in alpine grassland soil and their degraded soil in Northwest Yunnan, we investigated the effect of vegetation degradation on microbial communities in alpine grassland soils. [Methods] Bacterial 16S rRNA genes and fungal ITS genes were chosen as the target genes. Quantitative PCR was performed to measure the gene copies to assess the abundance of microbial communities. Illumina Hiseq sequencing and bioinformatics analysis were carried out to determine microbial community composition and community structure. [Results] After grassland degradation, soil pH value was greatly increased by 0.65 units, and soil moisture, total organic carbon, dissolved nitrogen and C/N ratio were significantly decreased by 18.4%, 67.5%, 47.2% and 1.2%, respectively. Grassland degradation significantly reduced soil bacterial and fungal community abundances by 92.4% and 94.9%, respectively. Grassland degradation significantly altered the β-diversity of soil bacterial and fungal community, but had no effect on that of α-diversity. In addition, grassland degradation changed the species composition of soil bacterial and fungal communities at the OTU level, and the fungal OTUs changed largely. Grassland degradation had no effect on bacterial community composition at the phylum level, but changed the composition at the class level (such as Acidimicrobiia, Betaproteobacteria, Chloroplast etc.). No significant difference was detected in fungal community composition between grassland soils and degraded soils. [Conclusion] These findings suggested that the vegetation degradation in alpine grassland lead to a decline in soil quality and microbial abundance, and changes in microbial community structure.
Keywords: grassland degradationmicrobial diversitymicrobial ecologyIllumina Hiseq sequencingsoil quality
2014年全球草地退化面积达到1.401×107 km2,约占全球草地面积的49.3%,草地退化已是重要的生态环境问题之一[1]。我国是世界第二草地大国,总面积近40000 ha2,其中高寒地区草地占40.1%[2]。全球气候变暖、人类不合理利用、过度放牧、旅游开发以及大型工程建设是导致高寒草地系统逐渐退化的重要原因[3]。随着退化高寒草地研究的深入,越来越多的科学家意识到地下部分已成为草地退化生态系统结构、功能和过程研究中最不确定性的因素[4]。但现有文献报道只是从放牧、围封、施肥及气候变化等人为和自然因素干扰等方面对土壤水分[5]、酶活性[6-7]和微生物量[8-9]进行研究,鲜有针对退化草地土壤微生物群落变化的研究。土壤微生物是土壤生态系统的重要组成部分,是表征土壤质量和评价土壤恢复性能的重要指标[10]。其中细菌和真菌在土壤生态系统中占有不可或缺的地位,参与肥力演变和养分循环,其群落及多样性与草地土壤质量及其生态系统健康密切相关[11]。
研究发现植被退化后土壤pH、有机质、总氮含量、含水量等性质明显改变[8-9, 12],这些因子是影响土壤微生物群落及其多样性的关键环境因子。例如,研究者发现退化草地中土壤有机质、含水量等均下降,同时土壤中微生物生物量也显著下降[8];中度、严重退化草地中微生物数量与生物量、土壤酶活性显著降低,且降低趋势与土壤有机质含量呈显著正相关[12];研究还发现退化高寒草地土壤微生物数量与含水量密切相关[9]。但是,目前对于退化高寒草地土壤微生物的研究主要还停留在微生物数量上,对微生物群落组成、结构、多样性等方面的研究还鲜见报道。另外,大部分的退化高寒草地土壤微生物研究还采用平板稀释法[9, 12]、Biolog[6]、PCR-DGGE[13]等方法,这些技术方法或是仅能分析数量占比低的可培养微生物,或是在物种分类和注释上分辨率、灵敏度较低,无法全面、系统地认识植被退化对高寒草地土壤微生物的影响。
因此,本文采用定量PCR、Illumina Hiseq高通量测序等分子生态学方法,结合生物信息学方法分析土壤细菌和真菌群落丰度、组成、结构和多样性,通过对比草地土壤和退化草地土壤微生物群落变化,探讨植被退化对土壤微生物的影响,对科学全面地评价高寒草地土壤生态系统健康状况提供实验数据。
1 材料和方法 1.1 样品采集 研究地点位于我国滇西北丽江市北部玉龙雪山风景区内(图 1),该地区属高原季风气候,年平均降水量为980 mm,年平均气温12.9 ℃ (http://data.cma.cn/site/index.html)。采样点位于玉龙雪山风景区玉龙索道附近(27°06′44ʺ N,100°13′30ʺ E),海拔约3360 m。气候变化及人类活动使得草地植被严重退化,在该地区形成典型的草地覆盖区域及退化区域。本研究采集草地覆盖的土壤样品(grassland soil,GS)和植被严重退化的土壤样品(degraded grassland soil,DGS),采样深度为0–10 cm,每份样品采集3个重复样点,每个重复样点间隔不低于50 m (图 1)。采集好的土壤样品立即置于4 ℃低温采样箱中保存,尽快运到实验室;去除植物残体和土壤动物,研磨并过2 mm筛,一份样品立即保存在–80 ℃用于土壤总DNA提取,一份样品风干后用于土壤理化性质分析。本研究土壤基本理化性质测定方法参照文献[14]。
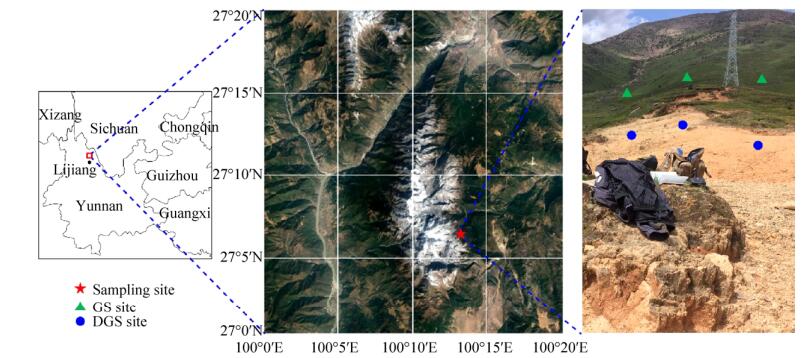 |
| 图 1 本研究区域及样品采集位点 Figure 1 Research area and sample site. |
| 图选项 |
1.2 土壤总DNA提取及微生物丰度测定 采用FastDNA?SPIN Kit for Soil (MP,Biomedicals,USA)试剂盒提取土壤总DNA,DNA含量及纯度采用NanoDrop 2000 (Thermo Scientific)测定。采用qPCR的方法测定细菌16S rRNA基因和真菌ITS基因丰度,其中16S rRNA基因扩增引物为515F (5′-GTGYCAGCMGCCGCGGTAA-3′)和926R (5′-CCGYCAATTYMTTTRAGTTT-3′)[15],扩增体系为20 μL,包括2 μL模板DNA (1–10 ng),20 μmol/μL上下游引物各0.4 μL,10 μL 2×SYBR Premix Ex Taq (TaKaRa,Japan)及7.4 μL ddH2O。反应程序:95 ℃ 3 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 20 s,40个循环。真菌ITS基因扩增引物为ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS1R (5′-GCTGCGTTCTTCATCGATGC-3′)[16],扩增体系为20 μL,包括2 μL模板DNA (1–10 ng),20 μmol/μL上下游引物各0.4 μL,10 μL 2×SYBR Premix Ex Taq (TaKaRa,Japan)及7.4 μL ddH2O。反应程序:95 ℃ 3 min;95 ℃ 20 s,53 ℃ 20 s,72 ℃ 20 s,40个循环。采用溶解曲线分析扩增产物的特异性,反应程序为65–95 ℃,每间隔0.5 ℃升温测定荧光信号。采用10倍稀释含有标靶基因的重组质粒制作标准曲线,细菌16S rRNA基因和真菌ITS基因标准曲线模板的浓度分别1.56×109– 1.56×103/μL和3.88×109–3.88×103/μL,扩增效率分别为97.3% (R2=0.990)和89.7% (R2=0.996)。每轮反应均设置3个无模板样品作为阴性对照。
1.3 高通量测序 采用Illunmina HiSeq平台分别对细菌16S rRNA基因V4+V5区和真菌ITS基因ITS1区进行高通量测序分析,扩增引物分别为515F/926R和ITS1F/ITS1R,建库及测序工作委托北京百迈客生物科技有限公司执行。采用FLASH (v1.2.7,http://ccb.Jhu.Edu/software/FLASH/)对序列进行拼接,并采用UCHIME (v4.2,http://drive5.com/uchime)软件鉴定并去除嵌合体序列。细菌样品共获得360119条有效序列数,GS样品的有效序列数为59855–61784,DGS样品的有效序列数为58558–60059。真菌样品共获得375406条有效序列数,其中GS样品的有效序列数为56728–62952,DGS样品的有效序列数为63878–65579。采用QIIME平台(v1.8.0, http://qiime.org/)对有效序列在97%序列相似度水平下进行OTU划分[17-18],并基于Silva (https://www.arb-silva.de/)和UNITE (https://unite.ut.ee/)分类学数据库分别对细菌16S rRNA基因和真菌ITS基因的OTU进行分类学注释。
1.4 数据分析 采用Mothur软件(Version1.35.1,https://www.mothur.org/)计算细菌和真菌群落α-多样性指数;在OTU水平上采用Venn图分析比较GS和DGS细菌和真菌的物种组成差异;在门、纲水平上分析细菌和真菌群落相对丰度来比较GS和DGS微生物群落组成差异,其中在纲水平上采用Z-score对细菌和真菌群落相对丰度进行标准化后进行euclidean聚类分析;在属水平上采用主坐标分析法进行β-多样性分析,比较GS和DGS细菌和真菌群落结构。采用Excel 2013、SPSS 16.0统计软件对实验数据进行处理、分析,采用独立样本T检验分析GS和DGS土壤理化指标和多样性指数在P=0.05水平上的统计差异性。
1.5 高通量数据序列号 本研究16S rRNA基因和ITS基因高通量测序数据已上传至NCBI Sequence Read Archive (SRA)数据库,序列号分别为SRP130875和SRP130874。
2 结果和分析 2.1 土壤基本理化性质 独立样本T检验分析表明(表 1),与GS相比,DGS中pH、SWC、TOC、DN、C/N有显著变化,其中pH值显著上升了0.65个单位,SWC、TOC、DN、C/N分别显著下降了18.4%、67.5%、47.2%和71.2%。可见,草地退化显著改变了土壤理化性质。
表 1. 土壤基本理化性质 Table 1. Soil basic physico-chemical properties.
| Soil | pH | SWC/% | TOC/(g/kg) | DOC/(mg/kg) | TN/(g/kg) | DN/(mg/kg) | C/N |
| GS | 6.18b | 18.5a | 23.2a | 117a | 1.40a | 26.9a | 17.7a |
| DGS | 6.73a | 15.1b | 7.53b | 93.4a | 1.96a | 14.2b | 5.10b |
| GS, grassland soil; DGS, degraded grassland soil; SWC, soil water content; TOC, total organic carbon; DOC, dissolved organic carbon; TN, total nitrogen; DN, dissolved nitrogen. | |||||||
表选项
2.2 土壤微生物群落丰度及α-多样性 土壤细菌16S rRNA基因和真菌ITS基因丰度能表征土壤细菌和真菌群落丰度(图 2)。DGS土壤中细菌16S rRNA基因丰度显著低于GS,降低幅度为92.4% (图 2-A);DGS土壤中真菌ITS基因丰度也显著低于GS,降低幅度为94.9% (图 2-B)。可见,草地退化显著降低了土壤细菌和真菌群落丰度。
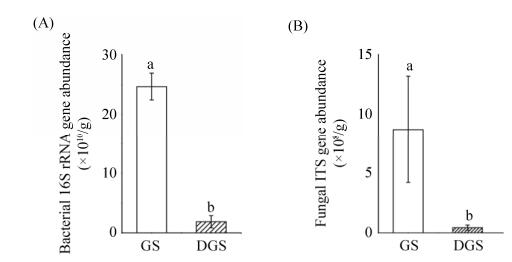 |
| 图 2 土壤细菌16S rRNA基因(A)和真菌ITS基因(B)丰度 Figure 2 Abundance of soil bacterial 16S rRNA (A) and fungal ITS (B) genes. GS and DGS refer grassland soil and degraded grassland soil, respectively. Error bars represent the standard deviation from the mean (n=3). Different letters above the columns in a cluster indicate significant differences (P < 0.05). |
| 图选项 |
微生物群落α-多样性指数分析显示GS和DGS中细菌Chao1指数分别为1269±14和1245±12,真菌Chao1指数分别为477±20和506±22,GS和DGS中细菌Shannon指数分别为5.44±0.35和5.63±0.02,真菌Shannon指数分别为3.71±0.83和3.41±1.12。独立样本T检验分析表明GS和DGS土壤细菌和真菌群落α-多样性指数无显著差异,即草地退化没有影响土壤细菌和真菌群落α-多样性。
2.3 土壤细菌和真菌群落组成 Venn图可以展示不同土壤样品间共有、特有的OTU种类,反映样品在OTU水平上的物种组成差异(图 3)。GS和DGS中一共检测到1103种土壤细菌16S rRNA基因OTU,其中GS中有953种OTU,DGS中有969种OTU;GS和DGS共有土壤细菌OTU种类占91.8%,各自特有的OTU种类分别占5.2%和3.0%。GS和DGS共检测到144种土壤真菌ITS基因OTU,其中GS中有97种OTU,DGS中101种OTU,GS和DGS共有土壤细菌OTU种类占78.7%,各自特有的OTU种类分别占9.7%和11.6%。可见,草地退化改变了土壤细菌和真菌在OTU水平上的物种组成,土壤真菌OTU种类变化更为显著。
 |
| 图 3 土壤细菌16S rRNA基因(A)和真菌ITS基因(B) OTU分布Venn图 Figure 3 Venn chart of OTUs based on bacterial 16S rRNA (A) and fungal ITS (B) genes. GS and DGS refer grassland soil and degraded grassland soil, respectively. Values are mean±standard deviation (n=3). |
| 图选项 |
各微生物类群16S rRNA基因和ITS基因相对丰度可分别反映土壤细菌和真菌群落组成(图 4)。门水平分类结果显示,在GS中,细菌的主要类群(> 5%)主要为放线菌门(Actinobacteria,24.6%)、变形菌门(Proteobacteria,17.3%)、绿弯菌门(Chlorofexi,24.3%)、酸杆菌门(Acidobacteria,5.7%)和蓝藻门(Cyanobacteria,5.5%);在DGS中,细菌的主要类群为放线菌门(Actinobacteria,31.2%)、变形菌门(Proteobacteria,26.2%)、绿弯菌门(Chlorofexi,12.9%)、酸杆菌门(Acidobacteria,5.6%)和芽单胞菌门(Gemmatimonadetes,6.7%) (图 4-A)。在GS和DGS中真菌的主要类群均为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),在GS中上述两真菌门类的相对丰度分别为73.9%和13.1%,在DGS中的相对丰度分别为83.2%和5.3% (图 4-B)。独立样本T检验分析表明在门水平上的细菌和真菌群落组成无显著差异。
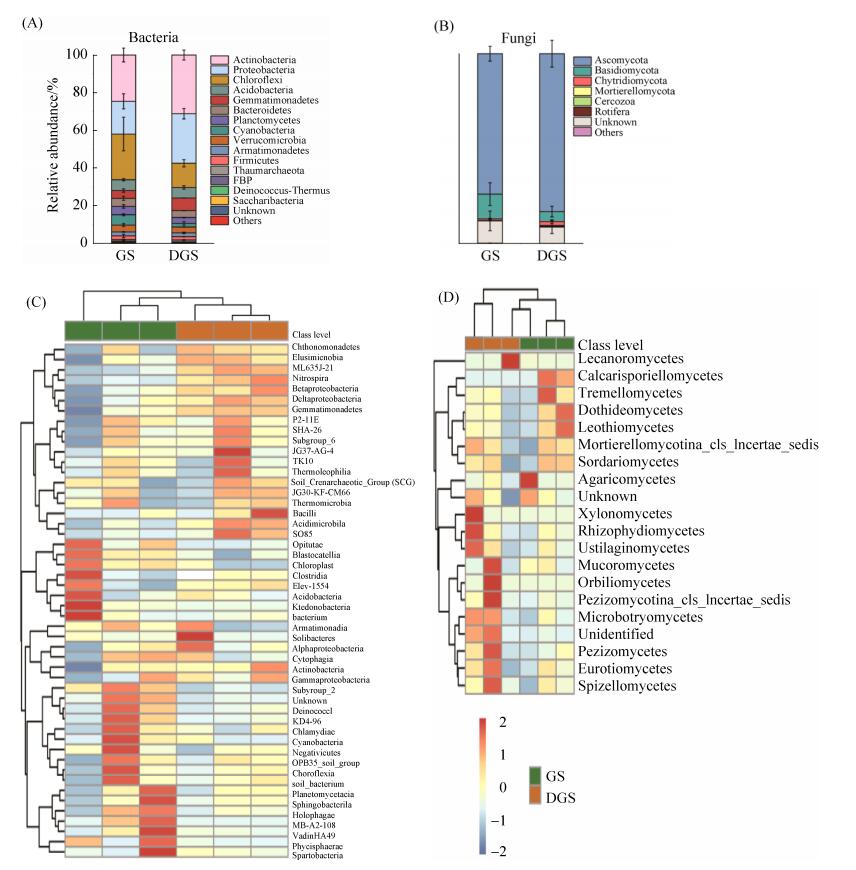 |
| 图 4 土壤细菌(A,C)和真菌(B,D)在门水平(A,B)和纲水平(C,D)上的群落组成 Figure 4 Soil bacterial (A, C) and fungal (B, D) community composition at the phylum (A, B) and class (C, D) levels. GS and DGS refer grassland soil and degraded grassland soil, respectively. Error bars represent the standard error from the mean (n=3). The taxa with relative abundance > 0.1% were listed. Three soil samples for GS and DGS were analyzed, and the cluster analysis was carried out to assess the similarity of community composition based on Euclidean distance. The relative abundance of each class in six soils was depicted by color intensity, and values indicate the standardized Z-score of the relative abundance. Symbol * and ** indicate the significant difference at P < 0.05 and P < 0.01 between GS and DGS, respectively. |
| 图选项 |
纲水平分类结果显示(图 4-C),DGS三个重复样品细菌群落组成横向聚类距离较近、枝长较短,表明DGS细菌群落组成更相似,其群落组成与GS明显不同。独立样本T检验分析显示草地土壤退化后有5个细菌纲水平分类的相对丰度发生显著变化,其中Acidimicrobiia、Betaproteobacteria和ML635J-21显著上升,而Chloroplast和Subgroup_2显著降低(P < 0.05,n=3)。GS和DGS各有2个重复样品真菌群落组成横向聚类距离较远,但各有1个重复样品真菌群落组成横向聚类距离较近(图 4-D),表明退化后的草地土壤真菌群落组成发生了变化,但聚类分析未体现显著差异。独立样本T检验分析也发现草地土壤退化后土壤真菌纲水平分类的相对丰度无显著变化。
2.4 土壤细菌和真菌群落结构 利用主坐标分析微生物群落β-多样性来表征土壤细菌和真菌群落结构,并计算GS和DGS间的Bray-Curits相似度指数(图 5)。土壤细菌群落结构的主坐标分析显示(图 5-A),第1、2主坐标的方差贡献率分别为55.75%和29.84%,样品在第1、2主坐标排列中分为2类,GS和DGS的3个样点各自聚成一簇,GS和DGS的Bray-Curits相似度指数为0.931 (P=0.017),表明草地退化显著改变了土壤细菌的群落结构。土壤真菌的主坐标分析显示(图 5-B),第1、2主坐标的方差贡献率分别为37.00%和24.46%,样品在第1、2主坐标排列中分为2类,GS和DGS的3个样点各自聚成一簇,GS和DGS的Bray-Curits相似度指数为1.000 (P=0.003),表明草地退化显著改变了土壤真菌的群落结构。因此得出结论,草地退化改变了土壤细菌和真菌群落结构。
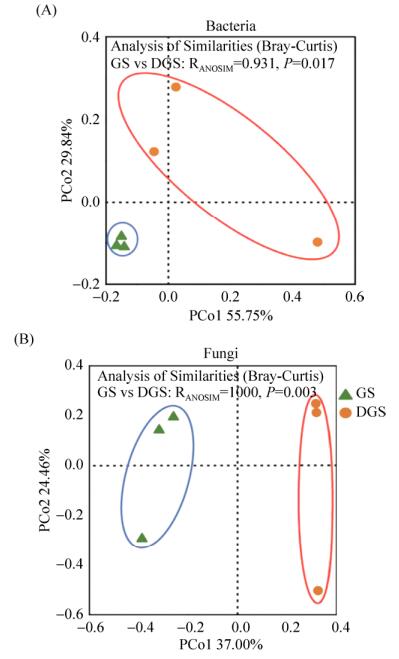 |
| 图 5 土壤微生物群落结构(OTU水平)PCoA分析 Figure 5 Principal coordinate analysis (PCoA) of soil bacterial (A) and fungal (B) community structure. GS and DGS refer grassland soil and degraded grassland soil, respectively. |
| 图选项 |
3 讨论 3.1 植被退化对土壤细菌群落的影响及环境因子分析 细菌是土壤微生物中数量最多的类群,占土壤微生物总量的70%–90%左右,对土壤养分循环有着重要作用[19]。本研究中发现草地退化后土壤细菌的丰度显著下降,其群落组成和群落结构有显著变化。蒋永梅等[7]以青藏高原东北缘祁连山高寒草地为研究对象,采用涂抹平板的方法测定土壤微生物数量,结果发现在不同退化程度的草地土壤中细菌数量显著降低,其中中度退化草地中细菌数量降低17.65%–48.43%,重度退化草地中细菌数量降低45.10%–50.94%。另外,彭岳林等[20]对退化高寒草原土壤微生物变化特性研究发现,相比正常草地,中度退化和严重退化草地土壤细菌数量呈显著下降趋势。这些结果均与本研究结果一致。本研究发现两种草地土壤中Actinobacteria、Proteobacteria、Chlorofexi和Acidobacteria均是优势类群。研究表明,以上细菌类群也是草地、森林、湿地等土壤环境中最常见的类群,而Proteobacteria和Acidobacteria门几乎是所有陆地生态系统环境中广泛分布的细菌类群[21-22]。段红芳[23]对青藏高原退化高寒草地微生物群落结构多样性变化发现,在不同程度的退化草地土壤中,Actinobacteria、Proteobacteria和Acidobacteria都是优势类群,随着退化程度的加深,Proteobacteria和Acidobacteria的相对丰度逐渐降低,而Actinobacteria的相对丰度逐渐上升。这些研究与本研究结果有相似之处,也有不同之处,充分表明在高寒草地以及类似环境中,土壤细菌优势类群既有相似之处又有各自的独特之处。其中Chlorofexi是一类通过光合作用产生能量的细菌,青藏高原常年光照时间长,特殊的地理位置为绿弯菌等微生物的繁殖和生长创造了有利的条件。
本研究发现草地退化后土壤pH、含水量、TOC、DN、C/N发生明显改变,这些因子可能是改变土壤细菌的数量、组成和结构的主要环境因子。许多研究表明土壤pH、含水量、土壤质地等土壤理化性质影响土壤细菌群落组成和多样性[24-25]。前人研究表明土壤细菌数量与土壤有机质、含水率、pH呈显著正相关[26]。邵伟等[27]对西藏高原草地退化及其成因研究发现,近10年,草地退化使土壤全氮、全磷分别下降21%–40%、20%–39%,有机质含量降低21.2%–39.8%,在有机质含量极低的土壤中,退化土壤中微生物数量亦明显减少。这与本研究发现草地退化后土壤有机质和含水率显著降低,从而导致土壤细菌丰度显著减少的结果一致。本研究发现草地退化后土壤细菌群落α-多样性指数没有显著改变,而王鑫朝等[13]对内蒙古草原研究发现,随着放牧强度的增加,即随着草地退化程度的增强,土壤有机质逐渐下降,导致
土壤细菌的多样性指数也逐渐下降。表明土壤细菌的多样性指数与土壤有机质密切相关,但也有研究发现土壤细菌多样性指数与土壤水分呈显著负相关[28],因此本研究中土壤细菌多样性受多种环境因子的影响,草地退化没有显著改变土壤细菌多样性指数。****研究青藏高原退化高寒草地发现,不同退化程度的草地中,Proteobacteria、Acidobacteria、Actinobacteria和Gemmatimonadetes存在显著差异,这与土壤有机质含量的变化密切相关[23]。本研究中这些门类均无显著差异,可能由于本研究土壤有机质的含量较高所致。另外Nacke等[29]采用测序方法对德国草地研究发现,pH是主导细菌群落结构的主要因素。一些****发现,土壤有效氮影响土壤微生物群落结构和主要细菌物种的组成,总有机碳对细菌群落组成具有重要影响[30-32]。
3.2 植被退化对土壤真菌群落的影响及环境因子分析 真菌是土壤微生物的主要组成,是一类种类繁多、分布广泛的真核微生物,真菌群落多样性在维持生态系统平衡中起到了重要作用[33]。本研究发现草地退化后,真菌的数量明显降低,真菌的群落组成和群落结构发生了显著变化。彭岳林等[20]发现在轻度退化草地土壤中真菌数量显著高于正常草地,而中度、严重退化阶段则呈显著下降趋势。顾爱星等[34]对天山北坡的退化草地研究发现,相比未退化草地,真菌在中度退化、重度退化和极度退化草地中数量都显著减少。蒋永梅等[7]发现在中度退化和重度退化高寒草地中,真菌的数量分别下降32.89%–68.00%和34.22%–62.86%。这些结果均与本结果一致。本研究发现土壤真菌的主要类群为Ascomycota和Basidiomycota。而在草地生态系统中丛枝菌根真菌的分布比较广泛,在一些极端环境中,如南北极的冻土层中则分布着丰富的子囊菌门生物[33]。张俊忠等[35]发现东祁连山高寒草地土壤真菌主要为半知菌门(Deuteromycotina)和接合菌门(Zygomycota)。这些结果与本研究结果不同,这可能由于真菌多样性受到植被类型、土地管理方式、环境条件的影响[33]。李刚等[36]以呼伦贝尔3种典型针茅草原为研究对象,发现土壤真菌结构组成存在显著差异,其中子囊菌门为土壤真菌的优势菌种,该结果与本研究结果也类似。
本研究发现草地退化后土壤理化因子的变化也可能会导致真菌数量、组成和结构的改变。卢虎[37]研究祁连山不同退化草地土壤微生物特性发现,随着草地退化程度的增加,土壤有机质含量呈下降趋势,土壤真菌数量也呈递减趋势。这表明真菌数量与有机质含量密切相关。巨天珍等[38]以红豆杉林为研究对象,发现影响土壤真菌数量和多样性的最主要因素是pH,其次是土壤的有机质和含水量。彭岳林等[24]发现藏北退化高寒草原中,土壤真菌与土壤有机质均呈不同程度的正相关,表明高寒、干旱条件下土壤有机质含量与土壤微生物间存在极为显著的相互刺激机制。这些结果均与本研究中草地退化后土壤有机质含量显著降低、导致土壤真菌数量也显著减少一致。本研究发现草地退化后土壤真菌多样性指数无显著变化。但王鑫朝等[13]采取PCR-DGGE技术研究放牧对冷嵩真菌多样性的影响发现,随着放牧强度的增加,土壤真菌的种类逐渐降低,真菌多样性指数存在明显差异,典型对应分析发现土壤真菌群落多样性与土壤pH和有机质密切相关。此结果与本研究结果不一致,这可能由于本研究中草地退化使土壤pH和TOC变化幅度较大,或者植被和放牧对土壤理化性质影响不同造成的。本研究发现草地退化后土壤真菌在门和纲水平上的群落组成无显著变化。李玲[39]采取高通量测序法比较分析5种主要草地类型土壤真菌群落结构和多样性的变化规律以及其驱动因子,结果显示Ascomycota与土壤理化指标无相关关系,但是也发现Basidiomycota与土壤含水率、有机碳含量呈显著正相关,与pH呈负相关。此结果与本研究有不同之处,这可能由于本研究中土壤含水率和有机碳含量较低导致的。
References
| [1] | Gang CC, Zhou W, Chen YZ, Wang ZQ, Sun ZG, Li JL, Qi JG, Odeh I. Quantitative assessment of the contributions of climate change and human activities on global grassland degradation. Environmental Earth Sciences, 2014, 72(11): 4273-4282. DOI:10.1007/s12665-014-3322-6 |
| [2] | 周兴民. 中国嵩草草甸. 北京: 科学出版社, 2001. |
| [3] | Tan HY, Chen BR, Yan RR, Xin XP, Tao J. Advances on soil microbiological characteristics of grassland ecosystems and its response to human disturbances. Acta Agrestia Sinica, 2014, 22(6): 1163-1170. (in Chinese) 谭红妍, 陈宝瑞, 闫瑞瑞, 辛晓平, 陶金. 草地土壤微生物特性及其对人为干扰响应的研究进展. 草地学报, 2014, 22(6): 1163-1170. |
| [4] | Karaca A, Cetin SC, Turgay OC, Kizilkaya R. Soil enzymes as indication of soil quality//Shukla G, Varma A. Soil Enzymology. Berlin Heidelberg: Springer, 2010, 22: 119-148. |
| [5] | Zhao CZ, Gao FY, Shi FX, Ren H, Sheng YP. Melica przewalskyi population spatial pattern and response to soil moisture in degraded alpine grassland. Acta Ecologica Sinica, 2011, 31(22): 6688-6695. (in Chinese) 赵成章, 高福元, 石福习, 任珩, 盛亚萍. 高寒退化草地甘肃臭草种群分布格局及其对土壤水分的响应. 生态学报, 2011, 31(22): 6688-6695. |
| [6] | Yin YL, Wang YQ, Bao GS, Wang HS, Li SX, Song ML, Shao BL, Wen YC. Characteristics of soil microbes and enzyme activities in different degraded alpine meadows. Chinese Journal of Applied Ecology, 2017, 28(12): 3881-3890. (in Chinese) 尹亚丽, 王玉琴, 鲍根生, 王宏生, 李世雄, 宋梅玲, 邵宝莲, 温玉存. 退化高寒草甸土壤微生物及酶活性特征. 应用生态学报, 2017, 28(12): 3881-3890. |
| [7] | Jiang YM, Shi SL, Tian YL, Lu H, Li HY, Li JH, Lan XJ, Yao T. Characteristics of soil microorganism and soil enzyme activities in alpine meadows under different degrees of degradation. Journal of Soil and Water Conservation, 2017, 31(3): 244-249. (in Chinese) 蒋永梅, 师尚礼, 田永亮, 卢虎, 李海云, 李建宏, 兰晓君, 姚拓. 高寒草地不同退化程度下土壤微生物及土壤酶活性变化特征. 水土保持学报, 2017, 31(3): 244-249. |
| [8] | Shao YQ, Ao XL, Song GB, Liu RF, Li H. Soil microbial biomass in degenerated and recovered grasslands of Huangfuchuan watershed. Chinese Journal of Ecology, 2005, 24(5): 578-580, 584. (in Chinese) 邵玉琴, 敖晓兰, 宋国宝, 刘瑞凤, 李华. 皇甫川流域退化草地和恢复草地土壤微生物生物量的研究. 生态学杂志, 2005, 24(5): 578-580, 584. DOI:10.3321/j.issn:1000-4890.2005.05.023 |
| [9] | Sun FD, Qing Y, Zhu C, Lu H, Hu YQ, Li Y, Chen WY. Analysis of soil enzyme activities and microbial community characteristics in degraded alpine grassland, Zoige, southwest China. Journal of Arid Land Resources and Environment, 2016, 30(7): 119-125. (in Chinese) 孙飞达, 青烨, 朱灿, 路慧, 胡亚茜, 李勇, 陈文业. 若尔盖高寒退化草地土壤水解酶活性和微生物群落数量特征分析. 干旱区资源与环境, 2016, 30(7): 119-125. |
| [10] | García C, Hernández T. Biological and biochemical indicators in derelict soils subject to erosion. Soil Biology and Biochemistry, 1997, 29(2): 171-177. DOI:10.1016/S0038-0717(96)00294-5 |
| [11] | 乔鹏云.放牧对陇东半干旱草地土壤微生物的影响.兰州大学硕士学位论文, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10730-2008163272.htm |
| [12] | Cai XB, Qian C, Zhang YQ. Characterization of soil biological properties on degraded alpine grasslands. Chinese Journal of Applied Ecology, 2007, 18(8): 1733-1738. (in Chinese) 蔡晓布, 钱成, 张永清. 退化高寒草原土壤生物学性质的变化. 应用生态学报, 2007, 18(8): 1733-1738. |
| [13] | Wang XC, Liu SZ, Ma YD, Wang JY, Wang XD, Bao YTGT, Gao Y, Zhang RM. PCR-DGGE analysis of effect of grazing on bacteria and fungal community in Rhizosphere soil of Artemisia frigida. Journal of Inner Mongolia Agricultural University, 2018, 38(6): 38-47. (in Chinese) 王鑫朝, 刘守赞, 马元丹, 汪俊宇, 王小东, 宝音陶格涛, 高岩, 张汝民. 放牧对冷蒿根际土壤细菌和真菌多样性影响的PCR-DGGE分析. 内蒙古农业大学学报, 2018, 38(6): 38-47. |
| [14] | 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 1999. |
| [15] | Parada AE, Needham DM, Fuhrman JA. Every base matters: assessing small subunit rRNA primers for marine microbiomes with mock communities, time series and global field samples. Environmental Microbiology, 2016, 18(5): 1403-1414. DOI:10.1111/1462-2920.13023 |
| [16] | Zhang LK, Kang MY, Huang YC, Yang LX. Fungal communities from the calcareous deep-sea sediments in the Southwest India Ridge revealed by Illumina sequencing technology. World Journal of Microbiology and Biotechnology, 2016, 32: 78. DOI:10.1007/s11274-016-2030-7 |
| [17] | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pe a AG, Goodrich JK, Goodrich JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [18] | Edgar RC. Search and clustering orders of magnitude faster than BLAST. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [19] | Bardgett RD, Freeman C, Ostle NJ. Microbial contributions to climate change through Carbon cycle feedbacks. The ISME Journal, 2008, 2(8): 805-814. DOI:10.1038/ismej.2008.58 |
| [20] | Peng YL, Cai XB, Xue HY. Study on the variation characteristics of soil microbial biomass in the degraded alpine steppes. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16(4): 112-115. (in Chinese) 彭岳林, 蔡晓布, 薛会英. 退化高寒草原土壤微生物变化特性研究. 西北农业学报, 2007, 16(4): 112-115. DOI:10.3969/j.issn.1004-1389.2007.04.025 |
| [21] | Lipson DA, Schmidt SK. Seasonal changes in an alpine soil bacterial community in the Colorado rocky mountains. Applied and Environmental Microbiology, 2004, 70(5): 2867-2879. DOI:10.1128/AEM.70.5.2867-2879.2004 |
| [22] | Xia WW, Jia ZJ. Comparative analysis of soil microbial communities by pyrosequencing and DGGE. Acta Microbiologica Sinica, 2014, 54(12): 1489-1499. (in Chinese) 夏围围, 贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价. 微生物学报, 2014, 54(12): 1489-1499. |
| [23] | 段红芳.青藏高原退化高寒草地生态系统中微生物群落结构多样性变化研究.兰州大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10730-1016190458.htm |
| [24] | Lauber CL, Hamady M, Knight R, Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. Applied Environmental Microbiology, 2009, 75(15): 5111-5120. DOI:10.1128/AEM.00335-09 |
| [25] | Rousk J, B??th E, Brookes PC, Lauber CL, Lozupone C, Caporaso JG, Knight R, Fierer N. Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58 |
| [26] | 吴永胜.内蒙古荒漠草原不同退化阶段土壤微生物变化的研究.内蒙古师范大学硕士学位论文, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10135-2008103375.htm |
| [27] | Shao W, Cai XB. Grassland degradation and its formation causes analysis in Tibetan plateau. Science of Soil and Water Conservation, 2008, 6(1): 112-116. (in Chinese) 邵伟, 蔡晓布. 西藏高原草地退化及其成因分析. 中国水土保持科学, 2008, 6(1): 112-116. DOI:10.3969/j.issn.1672-3007.2008.01.019 |
| [28] | Wang X, Cheng L. Soil bacterial community composition and diversity of five soil types in Qinghai-Tibetan Plateau. Acta Agriculturae Zhejiangensis, 2017, 29(11): 1882-1889. (in Chinese) 王信, 程亮. 青藏高原5种类型土壤细菌群落结构差异. 浙江农业学报, 2017, 29(11): 1882-1889. DOI:10.3969/j.issn.1004-1524.2017.11.15 |
| [29] | Nacke H, Thürmer A, Wollherr A, Will C, Hodac L, Herold N, Schoning I, Schrumpf M, Daniel R. Pyrosequencing-based assessment of bacterial community structure along different management types in german forest and grassland soils. PLoS One, 2011, 6(2): e17000. DOI:10.1371/journal.pone.0017000 |
| [30] | Frey SD, Knorr M, Parrent JL, Simpson RT. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests. Forest Ecology and Management, 2004, 196(1): 159-171. DOI:10.1016/j.foreco.2004.03.018 |
| [31] | Zhang YN, Li YL, Wang L, Tang YS, Chen JH, Hu Y, Fu XH, Le YQ. Soil microbiological variability under different successional stages of the Chongming Dongtan wetland and its effect on soil organic carbon storage. Ecological Engineering, 2013, 52: 308-315. DOI:10.1016/j.ecoleng.2012.10.002 |
| [32] | Li CH, Zhang CX, Tang LS, Xiong ZQ, Wang BZ, Jia ZJ, Li Y. Effect of long-term fertilizing regime on soil microbial diversity and soil property. Acta Microbiologica Sinica, 2014, 54(3): 319-329. (in Chinese) 李晨华, 张彩霞, 唐立松, 熊正琴, 王保战, 贾仲君, 李彦. 长期施肥土壤微生物群落的剖面变化及其与土壤性质的关系. 微生物学报, 2014, 54(3): 319-329. |
| [33] | Zhang J, Zhang HW, Li XY, Zhang CG. Research advances in soil fungal diversity and molecular ecology. Chinese Journal of Applied Ecology, 2004, 15(10): 1958-1962. (in Chinese) 张晶, 张惠文, 李新宇, 张成刚. 土壤真菌多样性及分子生态学研究进展. 应用生态学报, 2004, 15(10): 1958-1962. DOI:10.3321/j.issn:1001-9332.2004.10.051 |
| [34] | Gu AX, Fan YM, Wu HQ, Zhu JZ, Jin GL, Re ZWGL. Relationship between the number of three main microorganisms and the soil environment of degraded grassland on the north slope of the Tianshan Mountains. Acta Prataculturae Sinica, 2010, 19(2): 116-123. (in Chinese) 顾爱星, 范燕敏, 武红旗, 朱进忠, 靳瑰丽, 热孜万古丽. 天山北坡退化草地土壤环境与微生物数量的关系. 草业学报, 2010, 19(2): 116-123. |
| [35] | Zhang JZ, Chen XR, Yang CD, Xue L. A study on the diversity of soil cultured fungi in the alpine grassland of Eastern Qilian Mountains. Acta Prataculturae Sinica, 2010, 19(2): 124-132. (in Chinese) 张俊忠, 陈秀蓉, 杨成德, 薛莉. 东祁连山高寒草地土壤可培养真菌多样性分析. 草业学报, 2010, 19(2): 124-132. |
| [36] | Li G, Fan BL, Wendu RL, Yang DL. Analysis of soil fungal community structure of Stipa steppes in Hulunbuir, Inner Mongoia. Acta Pedologiga Sinca, 2011, 48(5): 1096-1102. (in Chinese) 李刚, 范宝莉, 文都日乐, 杨殿林. 呼伦贝尔针茅草原土壤真菌群落结构分析. 土壤学报, 2011, 48(5): 1096-1102. |
| [37] | 卢虎.祁连山不同退化草地土壤微生物特性研究.甘肃农业大学博士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10733-1015975633.htm |
| [38] | Ju TZ, Chen Y, Chang CH, An LZ. The diversity of soil fungi and its relations with fertility factors in Taxus chinensis (Pilg.) Rehd Community of Xiaolongshan of Tianshui City. Research of Environmental Sciences, 2008, 21(1): 128-132. (in Chinese) 巨天珍, 陈源, 常成虎, 安黎哲. 天水小陇山红豆杉(Taxus chinensis(Pilg.) Rehd)林土壤真菌多样性及其与生态因子的相关性. 环境科学研究, 2008, 21(1): 128-132. |
| [39] | 李玲.北方主要草地类型中土壤真菌多样性及群落结构的比较研究.东北师范大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10200-1015414669.htm |
