郑婷婷1, 涂宗财1,2

 , 唐平平1, 张露1, 沙小梅1, 王辉2
, 唐平平1, 张露1, 沙小梅1, 王辉2 1.江西师范大学生命科学学院, 功能有机小分子教育部重点实验室, 江西 南昌 330022;
2.南昌大学食品与科学技术国家重点实验室, 江西 南昌 330047
收稿日期:2017-11-23;修回日期:2018-01-15;网络出版日期:2018-01-19
基金项目:江西省重大生态安全问题监控协同创新中心资助项目(JXS-EW-00);江西省现代农业产业技术体系建设专项(JXARS-03);江西省产学研合作项目“植物小分子肽制备与纯化关键技术研究与产业化示范”(KJLDI3019);现代农业产业技术体系建设专项(CARS-45)
*通信作者:涂宗财, Tel:+86-791-88120965/88127901, E-mail:tuzc_mail@aliyun.com
摘要:[目的]了解水环境中磺胺嘧啶对异育银鲫肠道微生物组成及多样性的影响。[方法]异育银鲫分别暴露于0、1、100、10000μg/L的磺胺嘧啶水溶液中28 d,根据细菌16S rRNA的保守性设计引物,构建文库,进行高通量测序,最后进行数据分析。[结果]厚壁菌门、变形菌门和拟杆菌门是异育银鲫肠道中主要的细菌类群,经不同浓度磺胺嘧啶胁迫处理后,不仅弧菌、假单胞菌属和幽门螺杆菌属的数量显著减少,双歧杆菌、乳酸菌和芽孢杆菌的含量也下降。Venn图、稀释性曲线以及多样性指数分析结果表明,磺胺嘧啶胁迫处理后异育银鲫肠道微生物的多样性显著降低。[结论]磺胺嘧啶会使异育银鲫肠道微生物多样性显著降低,并且在抑制一些病原菌生长的同时对一些有益菌也产生了不良的影响。此结果为磺胺类药物的合理使用以及其对异育银鲫的健康生长和病害防控提供一定的理论支持。
关键词: 磺胺嘧啶 肠道微生物 异育银鲫
Effect of sulfadiazine on the gut microbiota of Carassius auratus gibelio
Tingting Zheng1, Zongcai Tu1,2

 , Pingping Tang1, Lu Zhang1, Xiaomei Sha1, Hui Wang2
, Pingping Tang1, Lu Zhang1, Xiaomei Sha1, Hui Wang2 1.Key Laboratory of Functional Small Organic Molecule, Ministry of Education, College of Life Sciences, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China;
2.State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, Jiangxi Province, China
Received 23 November 2017; Revised 15 January 2018; Published online 19 January 2018
*Corresponding author: Tu Zongcai, Tel:+86-791-88120965/88127901, E-mail:tuzc_mail@aliyun.com
Supported by Collaborative Innovation Center for the Major Ecological Security Issues of Jiangxi Province and Monitoring Implementation (JXS-EW-00), by the Earmarked Fund for Jiangxi Agriculture Research System (JXARS-03), by the Implementation Plan of Science and Technology in Higher Education Institutions of Jiangxi Province (KJLDI3019) and by the Earmarked fund for China Agriculture Research System (CARS-45)
Abstract: [Objective]To assess the effect of sulfadiazine on gut microbial communities and diversity of Carassius auratus gibelio.[Methods]Fishes were exposed to different concentrations of sulfadiazine (0, 1, 100 and 10000 μg/L) for 14 d. Then, primer sequences were designed according to the conservativeness of bacteria 16S rRNA, and libraries were constructed for high-throughput sequencing. Finally, data were analyzed.[Results]Firmicutes, Proteobacteria and Bacteroidates were the predominant phyla in Carassius auratus gibelio intestine. With different concentrations of sulfadiazine treated, not only the contants of Desulfovlbrlonaceae, Paeudomonas and Hellcobacter in gut decreased observably, but also the numbers of Bifidobacterium, Bacillus and Lactobacillus. The results of Rarefaction Curve, Venn and Diversity index showed that gut microbial diversity decreased siginificantly.[Conclusion]Sulfadiazine led to the microbial diversity decreased significantly and certain pathogenic bacteria could be controlled by sulfadiazine but it also had an nagative impact on some probiotics. This result provided a theoretical support for the rational use of sulfonamides and the healthy growth, disease prevention and control of Carassius auratus gibelio.
Keywords: sulfadiazine intestinal microflora Carassius auratus gibelio
随着全球集约化水产养殖的发展,“大规模、高密度”逐渐成为水产养殖的突出特点,导致部分养殖种质退化、鱼病泛滥。为提高质量,各种抗生素被大量应用于水产养殖中,以预防疾病,促进生长。鱼类肠道微生物是肠道的重要组成部分,它与鱼体及水生环境形成相互依赖、相互制约的微生态系,对鱼类的器官发育、消化吸收以及免疫反应等方面有着不可替代的作用,并且还会影响鱼类的生长、发育、生理和病理等过程[1],因此,鱼类肠道的微生态系统对鱼类的健康非常重要。鱼类肠道微生物易受很多因素的影响而发生变化,如鱼的种类、食性以及各种环境因子等[2-4]。近年来,有关鱼类肠道微生物的研究备受人们关注,研究发现,将氧四环素按一定比例添加到饲料中投喂给大西洋鲑鱼,其肠道微生物的多样性显著降低并且肠道微生物的组成也发生了改变[5],抗生素会改变人类和动物体内某些微生物种类的相对数量,并不会使肠道微生物的总数量减少[6-8]。但有关水环境中抗生素对鲫鱼肠道微生物影响的研究较少,而水环境中磺胺嘧啶对鲫鱼肠道微生物影响的研究尚未见报道。
磺胺类药物是一类具有对氨基苯磺胺结构的药物的总称,因其价值低廉且具有广谱杀菌功能而被大量应用于人类和动物疾病的治疗[9]。1932年,磺胺类药物首次用于临床试验,近几年,我国磺胺类药物的年产量已经达20000–50000 t之多。抗生素长期大量的使用,导致其在水体中的残留浓度越来越高,进而在水生生物体内的蓄积风险逐渐升高。近10年来,磺胺类药物在地表水和废水中被频繁检测出,检测浓度为8.4–211.0 μg/L[10-12]。异育银鲫(Carassius auratus gibelio)是我国淡水鱼养殖的主要种类之一,其味道鲜美,肉质细嫩,营养丰富,深受广大消费者的喜爱。2016年,我国鲫鱼产量达到300.51万吨,占我国淡水鱼养殖产量的10.67%,比2015年同期增长了3.19%[13]。常见的鲫鱼病害主要包括寄生虫病、细菌类疾病以及其他病害等,随着水产养殖规模的不断扩大,鲫鱼的病害也在不断发生。因此,本实验以磺胺类抗菌药物中比较具有代表性的磺胺嘧啶为实验药物,采用实验室模拟半静态法[14],将异育银鲫分别暴露于不同浓度的磺胺嘧啶水溶液中,研究磺胺嘧啶胁迫下异育银鲫肠道微生物的变化,旨在为磺胺嘧啶的合理使用以及鲫鱼养殖过程中病害的诊断提供理论参考和实验基础。
1 材料和方法 1.1 试验材料
1.1.1 仪器与试剂: 仪器:NanoDrop NC2000超微量分光光度计,美国Thermo Scientific公司;DYY-6C型电泳仪,中国北京六一生物科技有限公司;PCR扩增仪,美国ABI公司;FLx800型酶标仪,美国Bio-Tek公司;Centrifuge5424R型高速台式冷冻离心机,德国Eppendorf公司;移液枪,德国Eppendorf公司;BSC-1300型无菌操作台,苏州安洋科技发展有限公司。
试剂:磺胺嘧啶(纯度99.0%,Sulfadiazine,SDZ),购于美国Sigma公司;M0491L扩增聚合酶,购于美国NEB公司;DNA抽提试剂盒,购于美国Omega Bio-Tek公司;AP-GX-50型凝胶回收试剂盒,购于美国Axyprep公司。
1.1.2 试验生物: 异育银鲫购于南昌市某养殖场,平均体重(30±2) g。采用实验室模拟半静态法对其进行驯养,试验用水为经曝气去氯处理24 h的自来水,水温保持在(20±1)℃,pH为7.02–7.25。驯养期间,每天正常喂食,每次投放饲料的量不超过鱼体重的1%。因实验中药品的影响质量浓度一般为μg/L至mg/L水平,同时结合文献报道水体中磺胺类药物的检出浓度为8.4–211 μg/L[10-12],因此本试验设置了低(1 μg/L)、中(100 μg/L)、高(10000 μg/L)三个浓度组进行处理。鱼体在正式实验开始前对其进行为期1周的驯养。驯养结束后,将鱼体分别暴露于事先配好的磺胺嘧啶溶液中进行胁迫处理,为保持试验药液的浓度不低于起始浓度的80%,试验期间每隔24 h更换药液1次(新配制药液,再将鱼投入水体),饲养28 d取样检测。每个浓度组投入14条异育银鲫,水体总量为60 L。
1.2 样本采集 每个浓度随机取健康鱼样3尾,在无菌条件下取其肠道。用75%的酒精对鱼体表面进行擦拭消毒,用剪刀沿着肛门向上呈弧形剪开,取出鲫鱼肠道,用镊子除去附着于肠道表面的脂肪,并用PBS缓冲液(pH 7.4)冲洗数遍后于10 mL的无菌Eppendorf管中,于–80 ℃冰箱中保存备用。为减少鱼体个体之间差异的影响,本实验将3条鱼的肠道混在一起合成一个样品,混合均匀,进行测序分析,样品统一稀释至20 ng/μL。
1.3 DNA提取和PCR扩增 用DNA提取试剂盒提取鲫鱼肠道总DNA,并通过0.8%的琼脂糖凝胶电泳检测DNA的提取质量,同时采用紫外分光光度计对DNA进行定量。实验采用16S rRNA V3-4区通用引物进行扩增,所用前引物序列为ACTCCTACGGGAGGCAGCA,后引物序列为GGACTACHVGGGTWTCTAAT。PCR扩增体系(25 μL)为0.25 μL Q5 high-fidelity DNA Polymerase,5 μL 5× Reaction Buffer,5 μL 5× High GC Buffer,0.5 μL dNTP (10 mmol/L),1 μL模板DNA,1 μL Forward primer (10 μmol/L),1 μL Reverse primer (10 μmol/L),11.25 μL H2O。PCR程序为98 ℃变性30 s,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,25–27个循环,最后72 ℃延伸5 min,4 ℃直到停止。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测并采用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收,用Microplate reader (Bio Tek,FLx800)对其进行荧光定量,按照每个样本的测序量需求,对各样本按相应比例进行混合,构建测序文库后在Misep平台进行高通量测序。
1.4 测序数据分析 测得的基因序列与Greengenes数据库进行比对,使用(Release 13.8,http://greengenes.secondgenome.com/)进行OTU聚类,R软件计算并制作稀释性曲线图、Venn图和群落结构图,http://scikit-bio.org/docs/latest/generated/generated/skbio.diversity.alpha.diversityindex.html进行各指数分析,非加权组平均法、单一连接法和完全连接法进行距离计算和聚类分析。
2 结果和分析 2.1 总DNA提取和16S rRNA基因扩增 从异育银鲫肠道中提取的微生物总DNA比较完整且条带清晰,可用于后续实验。采用细菌16S rRNA基因通用引物进行特异性扩增,扩增后经2%琼脂糖凝胶电泳得如图 1所示的PCR扩增图。得到16S rRNA V3–4可变区的基因片段约为500 bp。
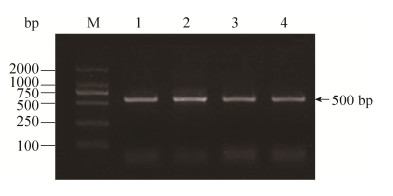 |
| 图 1 异育银鲫肠道微生物16S rRNA基因片段PCR扩增图 Figure 1 Amplification results of 16S rRNA gene of gut microbial from Carassius auratus gibelio. M: marker; lane 1 to 4 respresents sample of allogynogenetic silver crucian carp exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). |
| 图选项 |
2.2 肠道微生物群落多样性分析 由不同浓度磺胺嘧啶胁迫处理下的异育银鲫肠道样品的细菌OTU (operational taxonomic units)绘制Venn图(图 2)。由图可知,空白组(1号样)、低浓度组(2号样)、中浓度组(3号样)及高浓度组(4号样)共得到1389个OTUs。其中,每个样品的OTUs分别为941、173、105、170个,说明磺胺嘧啶胁迫处理明显降低了异育银鲫肠道微生物的多样性。4个样品共有的细菌OTU数目仅有15个,分别占浓度为0、1、100和10000 μg/L磺胺嘧啶胁迫处理的异育银鲫肠道样品细菌总OTUs数目的1.59%、8.67%、14.28%和8.82%。试验组所特有的OTUs数分别为88、22和73个,分别占所有OTUs总数的50.87%、20.95%和42.94%,比例较高且相差较大,说明各样品间细菌群落组成存在一定的差异。
 |
| 图 2 不同样品OTU分布Venn图 Figure 2 OTU Venn analysis of different samples. The number 1 to 4 respresents sample of Carassius auratus gibelio exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). |
| 图选项 |
2.3 肠道微生物群落丰度分析 表 1为异育银鲫肠道微生物功能多样性指数的统计结果。由表可知,高通量测序在对照组及低、中、高3个浓度试验组的异育银鲫肠道样品中获得的有效序列分别为506913条(941个OTUs)、552762条(173个OTUs)、458401条(105个OTUs)和31007条(170个OTUs)。空白组异育银鲫肠道微生物样品的各项指数都是最高的,ACE、Chao、Shannon以及Simpson指数分别为941、941、6.27和0.94;经磺胺嘧啶胁迫处理后各样品的所有指数都大幅度减小,说明各样品肠道微生物的多样性显著降低。其中,Shannon以及Simpson指数都随着磺胺嘧啶浓度的增加而逐渐减小,说明磺胺嘧啶胁迫使异育银鲫肠道微生物的群落越来越不均匀。
表 1. 不同浓度磺胺嘧啶处理下肠道微生物多样性指数 Table 1. Functional diversity of gut microbial community with different concentrations of sulfadiazine disposed
| Sample ID | Reads | OTU | ACE | Chao | Shannon | Simpson |
| 1 | 506913 | 941 | 941 | 941 | 6.27 | 0.94 |
| 2 | 552762 | 173 | 200.98 | 198.11 | 3.01 | 0.73 |
| 3 | 458401 | 105 | 117.94 | 113.26 | 1.97 | 0.59 |
| 4 | 31007 | 170 | 217.73 | 206.83 | 1.81 | 0.39 |
| The number 1 to 4 respresents sample of Carassius auratus gibelio exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). | ||||||
表选项
2.4 肠道微生物群落结构和组成分析 图 3为各门细菌相对丰度图。由图可知,4个样品主要由厚壁菌门、梭杆菌门、变形菌门、拟杆菌门和放线菌门组成,样品中各门类的比例存在一定的差异。空白组的鲫鱼肠道样品主要由厚壁菌门、变形菌门和拟杆菌门组成,其占比例分别为53.3%、38.6%和4.2%。经1 μg/L磺胺嘧啶溶液胁迫处理后,厚壁菌门的含量急剧减少,主要由梭杆菌门、变形菌门、拟杆菌门和放线菌门组成,其占比例分别为55.4%、23.4%、5.4%和5.3%。100 μg/L浓度组的异育银鲫肠道样品主要包含变形菌门、厚壁菌门以及梭杆菌门,所占比例分别为26.6%、3.6%和68.9%。而经高浓度组处理后的肠道样品中,厚壁菌门为优势菌群,含量高达85.6%,以上研究表明,磺胺嘧啶胁迫处理可改变样品中优势菌群的种类和含量。
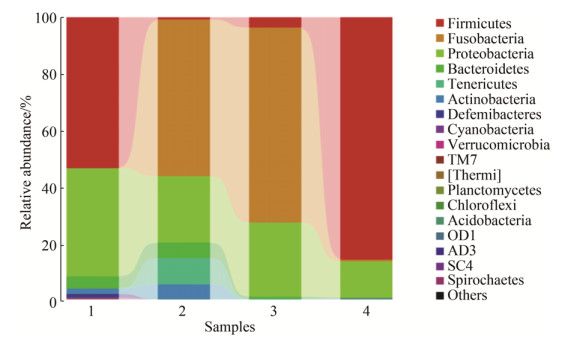 |
| 图 3 各门细菌相对丰度 Figure 3 Bacteria community structure of different samples in phylum. The number 1 to 4 respresents sample of Carassius auratus gibelio exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). |
| 图选项 |
图 4为各属细菌相对丰度图。从图中可以看出,磺胺嘧啶胁迫处理可直接影响异育银鲫肠道样品中菌群的分布情况。空白组异育银鲫肠道样品中各菌群分布比较均匀,而经不同浓度的磺胺嘧啶胁迫处理后,各组样品中的优势菌群发生了变化且优势菌群所占比例也存在较大的差异。经1、100、10000 μg/L的磺胺嘧啶胁迫处理后,异育银鲫肠道中的优势菌群分别为鲸杆菌、u114和肉食杆菌,分别占样品中总菌数的49.3%、59.2%和77.8%。以上研究结果表明,磺胺嘧啶可以扰乱异育银鲫肠道的微生态环境。
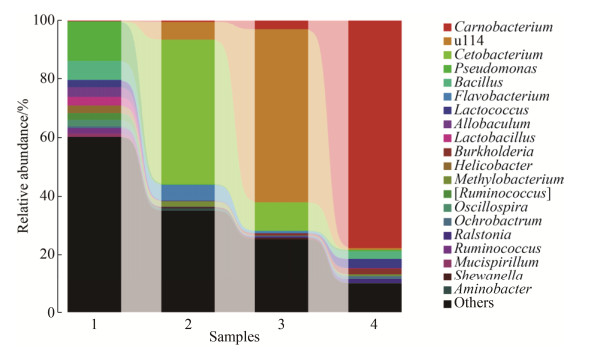 |
| 图 4 各属细菌相对丰度 Figure 4 Bacteria community structure of different samples in genus. The number 1 to 4 respresents sample of Carassius auratus gibelio exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). |
| 图选项 |
2.5 肠道微生物群落相对丰度 图 5为异育银鲫肠道微生物在属水平上群落组分相似度的聚类式热图,该图可揭示各样品细菌群落的丰富性和多样性。从图中可以看出,磺胺嘧啶处理前后,4个样本被分为两大类,样品2、3、4聚为一大类,菌落组成显著区分与样品1。样品2和样品3的肠道微生物的菌落组成较为相似。芽孢杆菌属、双歧杆菌属、乳酸菌属等在1号异育银鲫肠道中的丰度显著高于其他3个样品,说明磺胺嘧啶胁迫处理可能会对异育银鲫肠道中的一些有益菌产生抑制作用。甲基杆菌属、氨基杆菌属、根瘤菌属等在样品2号样品肠道中的富集程度显著高于其他属。u114和弓形杆菌属为样品3的优势菌群。肉食杆菌属、放线菌属等为样品4的优势菌群。说明磺胺嘧啶胁迫处理可使异育银鲫肠道微生物的群落组成发生改变。
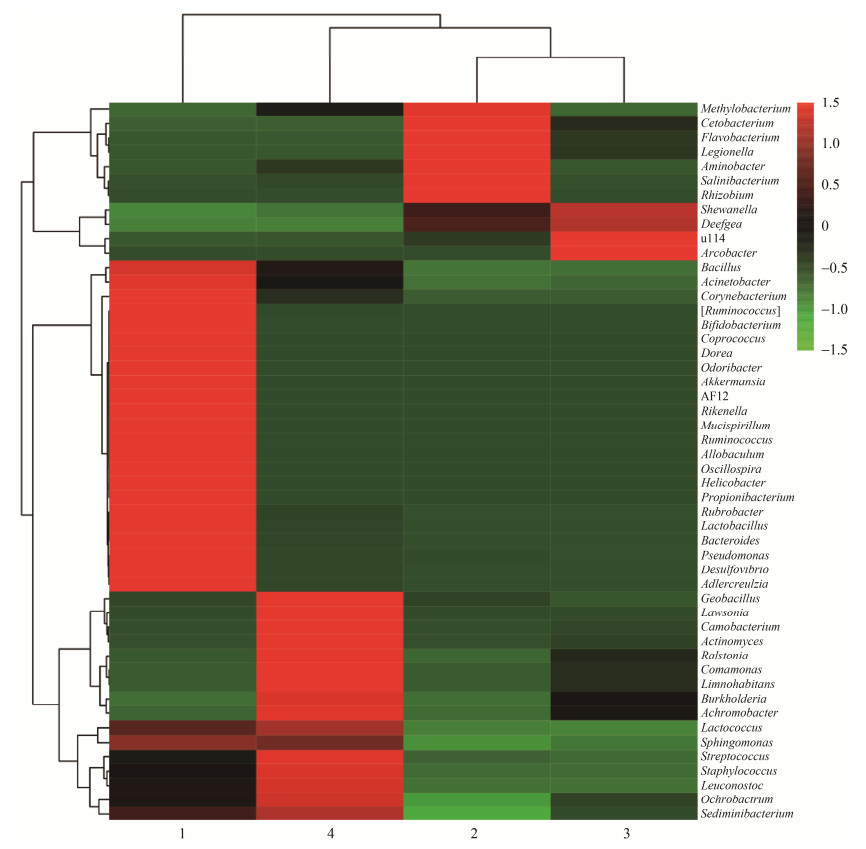 |
| 图 5 各属细菌相对丰度 Figure 5 Microbial community heatmap analysis. The number 1 to 4 respresents sample of Carassius auratus gibelio exposed to different concentrations of sulfadiazine (0, 1, 100, 10000 μg/L). |
| 图选项 |
3 讨论 肠道微生物的种类和数量可以反映出宿主间相互依赖、相互制约的微生态关系,在鱼类的生长、发育、营养水平和免疫防疫等方面也发挥着非常重要的作用[15-16]。本实验采用高通量测序技术,研究不同浓度磺胺嘧啶水溶液胁迫处理下异育银鲫肠道微生物的变化情况。研究发现,异育银鲫经磺胺嘧啶胁迫处理后其肠道微生物的多样性显著降低。Carlson等[17]将食蚊鱼暴露于利福平水溶液后,肠道微生物从暴露前的399个属变成97个属,肠道中的丛毛单胞菌科的含量从3.1%上升到45.8%,肠道微生物种类和数量都发生了很大的变化。翟少伟等[18]在吉富罗非鱼的饲料中添加抗菌肽Surfactin,投喂7周后发现乳酸杆菌的数量显著增加,而大肠杆菌的数量明显降低,但细菌总数没有显著变化。苏鹏[19]在红鳍东方鲀的饲料中添加不同质量分数的壳聚糖,投喂56 d后发现随着壳聚糖含量的增加肠道菌群中芽孢杆菌属的含量显著提高,但假单胞菌属的含量无显著性差异;说明鱼类肠道微生物易受环境变化的影响。
在未经磺胺嘧啶胁迫处理的鲫鱼肠道样品中主要存在3种细菌类群,它们分别是厚壁菌门、变形菌门和拟杆菌门。Han等[20]和Roeslers等[21]研究发现,鱼类肠道中普遍存在厚壁菌门和变形菌门,拟杆菌门的含量仅次于两者,这三种菌在肠道中的含量为厚壁菌门 > 变形菌门 > 拟杆菌门。经不同浓度磺胺嘧啶胁迫处理后,低浓度组和中浓度组异育银鲫肠道样品中厚壁菌门的含量远远低于空白组,而梭杆菌门的含量明显高于未经磺胺嘧啶胁迫处理的异育银鲫肠道样品。可能是这两个浓度下的磺胺嘧啶抑制了厚壁菌门的生长,而促进了梭杆菌门的生长。在4个样品中,只有低浓度组的样品中厚壁菌门的含量低于拟杆菌门。研究表明[22-23],和拟杆菌门相比,厚壁菌门能够更加有效地吸收能量使宿主体重增加;Rahat[24]等发现,肥胖个体肠道中厚壁菌门相对丰度增加,且厚壁菌/拟杆菌比值增高。本研究中,正常异育银鲫肠道样品中厚壁菌门和拟杆菌门的比值为12.69,其他3个样品中其比值分别为0.13、4.5和428,都与空白组相差较大,说明磺胺嘧啶对异育银鲫正常的生长具有较大的影响。本实验通过研究厚壁菌门和拟杆菌门之间比值的变化情况,可以很好地了解鱼类对能量和营养的吸收情况,为养殖业中如何健康、快速地养殖鲫鱼提供了一定的理论基础。
变形菌门是鱼类肠道微生物中主要的类群之一[25]。本实验经磺胺嘧啶胁迫处理后,异育银鲫肠道中隶属于变形菌门中的弧菌、假单胞菌属和幽门螺杆菌属的含量都低于空白组。弧菌中的副溶性弧菌可以感染多种虾及鱼类,并能造成大量死亡[26];幽门杆菌是公认的慢性活动性胃炎、胃十二指肠、胃黏膜相关淋巴组织淋巴瘤、胃癌等消化系统疾病的主要致病因素[27];假单胞菌属中的鼻疽假单胞菌是一种条件致病性人畜共患病原菌,可使人和动物患马鼻疽传染病[28]。本研究中,异育银鲫经磺胺嘧啶胁迫处理后其肠道中弧菌、假单胞菌属和幽门螺杆菌属的数量明显下降,说明磺胺嘧啶可用于治疗鱼类中由以上几种致病菌引起的疾病。磺胺类药物是第四类抗生素,属于慢效抑菌剂,细菌不能利用环境中的叶酸,而是在二氢叶酸酶的作用下利用赖氨酸、对氨基苯甲酸和二氢喋啶合成二氢叶酸,在二氢叶酸还原酶的作用下合成参与嘌呤和嘧啶合成的四氢叶酸,而嘌呤和嘧啶是DNA合成过程中不可缺少的原料。磺胺类药物与对氨基苯甲酸的结构相似,当其进入细胞后可与对氨基苯甲酸竞争二氢叶酸合成酶,大大降低了二氢叶酸的合成效率,最终导致DNA复制受阻,因此磺胺类药物会抑制菌体生长[29]。而药物对细胞的毒性强弱与其进入细胞的难易程度及其与作用靶点的结合能力等因素密切相关[30],幽门螺杆菌、弧菌以及假单胞菌都属于革兰式阴性菌,其细胞壁较薄,肽聚糖含量低,因此磺胺类药物更容易进入菌体,使其死亡。但是磺胺嘧啶虽抑制了一些病原菌的生长,降低了鱼类患病的几率,但同时其对肠道中的有益菌也产生了一定的影响。磺胺嘧啶胁迫处理后,鲫鱼肠道微生物中的有益菌双歧杆菌、芽孢杆菌和乳酸菌的含量也显著减少了。可能原因是,虽然抗生素在鱼类某些疾病的预防和治疗方面起到了非常重要的作用,但由于鱼类肠道微生物的多样性之多,存在的共生与共生细菌的数量之大,某些特定的菌在抗生素应用过程中不可避免地遭到了破坏。为减少肠道微生物的异常,进而影响异育银鲫的生长,在异育银鲫养殖过程中应尽量避免高浓度(像10000 μg/L)和较长时间持续的磺胺嘧啶用药。此结果为研究磺胺类药物对异育银鲫健康状况的影响及其养殖过程中病害的诊断奠定了一定的基础。
References
| [1] | Hou JH, Chen HW, Cao ZH, Gao ZJ, Cai K. Preliminary analysis of bacterial flora of the intestinal tract of carp. Food Science, 2010, 31(11): 178-181. (in Chinese) 侯进慧, 陈宏伟, 曹泽虹, 高兆建, 蔡侃. 鲫鱼肠道细菌菌群初步分析. 食品科学, 2010, 31(11): 178-181. |
| [2] | Larsen AM, Mohammed HH, Arias CR. Characterization of the gut microbiota of three commercially valuable warmwater fish species. Journal of Applied Microbiology, 2014, 116(6): 1396-1404. DOI:10.1111/jam.2014.116.issue-6 |
| [3] | Li J, Ni J, Li J, Wang C, Li X, Wu S, Zhang T, Yu Y, Yan Q. Comparative study on gastrointestinal microbiota of eight fish species with different feeding habits. Journal of Applied Microbiology, 2014, 117(6): 1750-1760. DOI:10.1111/jam.2014.117.issue-6 |
| [4] | Jin YX, Wu SS, Zeng ZY, Fu ZW. Effects of environmental pollutants on gut microbiota. Environmental Pollution, 2017, 222: 1-9. DOI:10.1016/j.envpol.2016.11.045 |
| [5] | Navarrete P, Mardones P, Opazo R, Espejo R, Romero J. Oxytetracycline treatment reduces bacterial diversity of intestinal microbiota of Atlantic salmon. Journal of Aquatic Animal Health, 2008, 20(3): 177-183. DOI:10.1577/H07-043.1 |
| [6] | Cho I, Yamanishi S, Cox L, Methé BA, Zavadil J, Li K, Gao Z, Mahana D, Raju K, Teitler I, Li HL, Alekseyenko AV, Blaser MJ. Antibiotics in early life alter the murine colonic microbiome and adiposity. Nature, 2012, 488(7413): 621-626. DOI:10.1038/nature11400 |
| [7] | Buffie CG, Bucci V, Stein RR, McKenney PT, Ling L, Gobourne A, No D, Liu H, Kinnebrew M, Viale A, Littmann E, van den Brink MRM, Jenq RR, Taur Y, Sander C, Cross JR, Toussaint NC, Xavier JB, Pamer EG. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature, 2015, 517(7533): 205-208. DOI:10.1038/nature13828 |
| [8] | Russell SL, Gold MJ, Reynolds LA, Willing BP, Dimitriu P, Thorson L, Redpath SA, Perona-Wright G, Blanchet MR, Mohn WW, Finlay BB, McNagny KM. Perinatal antibiotic-induced shifts in gut microbiota have differential effects on inflammatory lung diseases. The Journal of Allergy and Clinical Immunology, 2015, 135(1): 100-109. DOI:10.1016/j.jaci.2014.06.027 |
| [9] | Thuy HTT, Nga LP, Loan TTC. Antibiotic contaminants in coastal wetlands from Vietnamese shrimp farming. Environmental Science and Pollution Research, 2011, 18(6): 835-841. DOI:10.1007/s11356-011-0475-7 |
| [10] | Managaki S, Murata A, Takada H, Tuyen BC, Chiem NH. Distribution of macrolides, sulfonamides, and trimethoprim in tropical waters:ubiquitous occurrence of veterinary antibiotics in the Mekong Delta. Environmental Science & Technology, 2007, 41(23): 8004-8010. |
| [11] | Jia A, Hu JY, Wu XQ, Peng H, Wu SM, Dong ZM. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River Basin, North China. Environmental Toxicology and Chemistry, 2011, 30(6): 1252-1260. DOI:10.1002/etc.v30.6 |
| [12] | Luo Y, Xu L, Rysz M, Wang YQ, Zhang H, Alvarez PJJ. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China. Environmental Science & Technology, 2011, 45(5): 1827-1833. |
| [13] | Guo YF, Zhao WW. China fisheries statistics yearbook. Beijing: China Agriculture Press, 2017. (in Chinese) 郭云峰, 赵文武. 中国渔业统计年鉴. 北京: 中国农业出版社, 2017. |
| [14] | Zhao HX, Liu SS, Chen JW, Jiang JQ, Xie Q, Quan X. Biological uptake and depuration of sulfadiazine and sulfamethoxazole in common carp (Cyprinus carpio). Chemosphere, 2015, 120: 592-597. DOI:10.1016/j.chemosphere.2014.09.075 |
| [15] | Zhong L, Xiang JG, Zeng D, Li NQ. Effects of different diets on intestinal microbiota of Elopichthys bambusa. Acta Hydrobiologica Sinica, 2016, 40(4): 830-835. (in Chinese) 钟蕾, 向建国, 曾丹, 李宁求. 饵料对鳡肠道微生物多样性的影响. 水生生物学报, 2016, 40(4): 830-835. |
| [16] | Ji ZS, Guan WB, Su SG, Zhang MY. The intestinal microflora in silver carp Hypophthalmichthys molitrix and bighead carp Aristichthys nobilis. Journal of Dalian Ocean University, 2014, 29(1): 22-26. (in Chinese) 祭仲石, 管卫兵, 苏孙国, 张明月. 鲢、鳙肠道微生物的研究. 大连海洋大学学报, 2014, 29(1): 22-26. |
| [17] | Carlson JM, Hyde ER, Petrosino JF, Manage ABW, Primm TP. The host effects of Gambusia affinis with an antibiotic-disrupted microbiome. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2015, 178: 163-168. |
| [18] | Zhai SW, Shi QC, Chen XH. Effect of dietary antimicrobial peptides-surfactin supplemention on parameters of intestinal health indices of genetically improved farmed tilapia (gift, Oreochromis niloticus). Acta Hydrobiologica Sinica, 2016, 40(4): 823-829. (in Chinese) 翟少伟, 史庆超, 陈学豪. 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响. 水生生物学报, 2016, 40(4): 823-829. |
| [19] | Su P, Pan JL, Han YZ, Liu HY, Huo PY, Sun H, Jiang ZQ. Effects of dietary chitosan on hematological parameters and non-specific immunity of redfin puffer Takifugu rubripes. Journal of Dalian Ocean University, 2016, 31(1): 37-43. (in Chinese) 苏鹏, 潘金露, 韩雨哲, 刘海映, 霍圃宇, 孙航, 姜志强. 壳寡糖对红鳍东方鲀血液指标和非特异性免疫指标的影响. 大连海洋大学学报, 2016, 31(1): 37-43. |
| [20] | Han SF, Liu YC, Zhou ZG, He SX, Gao Y, Shi PJ, Yao B, Ring? E. Analysis of bacterial diversity in the intestine of grass carp (Ctenopharyngodon idellus) based on 16S rDNA gene sequences. Aquaculture Research, 2010, 42(1): 47-56. DOI:10.1111/are.2010.42.issue-1 |
| [21] | Roeselers G, Mittge EK, Stephens WZ, Parichy DM, Cavanaugh CM, Guilemin K, Rawls JF. Evidence for a core gut microbiota in the zebrafish. ISME Journal, 2011, 5(10): 1595-1608. DOI:10.1038/ismej.2011.38 |
| [22] | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [23] | Krajmalnik-Brown R, Ilhan ZE, Kang DW, DiBaise JK. Effects of gut microbes on nutrient absorption and energy regulation. Nutrition in Clinical Practice, 2012, 27(2): 201-214. DOI:10.1177/0884533611436116 |
| [24] | Rahat-Rozenbloom S, Fernandes J, Gloor GB, Wolever TMS. Evidence for greater production of colonic short-chain fatty acids in overweight than lean humans. International Journal of Obesity, 2014, 38(12): 1525-1531. DOI:10.1038/ijo.2014.46 |
| [25] | Cottrell MT, Kirchman DL. Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low-and high-molecular-weight dissolved organic matter. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697. DOI:10.1128/AEM.66.4.1692-1697.2000 |
| [26] | 张永华.副溶血弧菌感染斑马鱼的致病性及天然免疫应答研究.上海海洋大学硕士学位论文, 2012. |
| [27] | Correa P. Helicobacter pylori as a pathogen and carcinogen. Journal of Physiology and Pharmacology:An Official Journal of the Polish Physiological Society, 1997, 48: 19-24. |
| [28] | Sun QY, Xia LM, Lu J. The evaluation report of Shanghai city of equine infectious anemia, glanders elimination standard acceptance. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2014(4): 79-81. (in Chinese) 孙泉云, 夏炉明, 卢军. 上海市马传染性贫血、马鼻疽消灭达标验收的评估报告. 上海畜牧兽医通讯, 2014(4): 79-81. DOI:10.3969/j.issn.1000-7725.2014.04.037 |
| [29] | Brown GM. The biosynthesis of folic acid. Ⅱ. Inhibition by sulfonamides. Journal of Biological Chemistry, 1962, 237: 536-540. |
| [30] | Yao ZF, Lin ZF, Wang T, Tian DY, Zou XM, Gao Y, Yin DQ. Using molecular docking-based binding energy to predict toxicity of binary mixture with different binding sites. Chemosphere, 2013, 92(9): 1169-1176. DOI:10.1016/j.chemosphere.2013.01.081 |
