涂宗财1,2

 , 庞娟娟1, 王辉2, 张露1, 沙小梅1
, 庞娟娟1, 王辉2, 张露1, 沙小梅1 1.江西师范大学生命科学学院, 功能有机小分子教育部重点实验室, 江西 南昌 330022;
2.南昌大学食品科学与技术国家重点实验室, 江西 南昌 330047
收稿日期:2016-10-15;修回日期:2017-02-14;网络出版日期:2017-02-28
基金项目:江西省重大生态安全问题监控协同创新中心基金(JXS-EW-00);江西省现代农业产业技术体系建设专项资金(JXARS-03)
*通信作者:涂宗财, Tel:+86-791-88120965/88127901;E-mail:tuzc_mail@aliyun.com
摘要: [目的]了解水环境中重金属铜对异育银鲫肠道微生物组成及多样性的影响。[方法]采用试剂盒提取异育银鲫肠道总DNA,然后对总DNA进行16S rRNA进行扩增,构建异育银鲫肠道微生物16S rRNA基因克隆文库,最后进行数据分析。[结果]厚壁菌门、变形菌门和拟杆菌门为异育银鲫肠道中主要的细菌类群,在不同浓度的重金属铜胁迫处理后,厚壁菌门的含量明显降低。稀释性曲线、Venn图和多样性指数分析结果表明,重金属铜胁迫处理后异育银鲫肠道微生物多样性明显降低。[结论]重金属铜会使异育银鲫肠道微生物组成及多样性降低。此结果为研究重金属污染对异育银鲫健康状况的影响及异育银鲫养殖过程中病害的诊断奠定基础。
关键词: 异育银鲫 肠道微生物 重金属铜
Effect of heavy metal Cu on Allogynogenetic Carassius auratus intestinal microorganism
Zongcai Tu1,2

 , Juanjuan Pang1, Hui Wang2, Lu Zhang1, Xiaomei Sha1
, Juanjuan Pang1, Hui Wang2, Lu Zhang1, Xiaomei Sha1 1.Key Laboratory of Functional Small Organic Molecule, Ministry of Education, College of Life Sciences, Jiangxi Normal University, Nanchang 330022, Jiangxi Province, China;
2.State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, Jiangxi Province, China
Received 15 October 2016; Revised 14 February 2017; Published online 28 February 2017
*Corresponding author: Zongcai Tu, Tel: +86-791-88120965/88127901; E-mail: tuzc_mail@aliyun.com
Supported by the Collaborative Innovation Center for the Major Ecological Security Issues of Jiangxi Province and Monitoring Implementation (JXS-EW-00) and by the Earmarked Fund for Jiangxi Agriculture Research System (JXARS-03)
Abstract: [Objective]To study the effect of the heavy metal Cu on the bacterial composition and diversity in Allogynogenetic Carassius auratus intestinal.[Methods]Total DNA was extracted by DNA extraction kit. The 16S rRNA gene of intestinal microbial diversity was amplified by universal PCR primers. Then the clone library was built to analyze data.[Results]The main bacterial community in Allogynogenetic Carassius auratus intestinal contained Firmicutes, Proteobacteria and Bacteroidetes. At different concentrations of Cu, the contents of Firmicutes in Allogynogenetic Carassius auratus gut significantly decreased. The results of Rarefaction Curyiyuyiyuve, Venn and Diversity index showed that gut microbial diversity decreased obviously.[Conclusion]Cu caused the microbial diversity in Allogynogenetic Carassius auratus decreased. This result provides a basis for further studies on the health of Allogynogenetic Carassius auratus relevant to heavy metal Cu.
Key words: Allogynogenetic Carassius auratus intestinal microflora heavy metal copper
近年来矿产资源的大量开采,使得湖泊、河流等水域受到不同程度的污染,进而对水生生物的安全造成严重威胁。肠道微生物不仅是一个有着丰富细菌群落的完整生态系统,还是反应水生生物健康状况的一个重要指标[1-2]。由于动物肠道内大部分微生物难被培养,传统的方法已无法反映微生态调控全貌[3],使得飞速发展的生物技术和分子生物学,特别是基于16S rRNA基因序列测定,已被广泛运用于微生物多样性和微生物群落变化的研究[4]。肠道微生物的缺失和变化均会影响宿主的营养吸收和正常的免疫功能。导致鱼类肠道微生物变化的原因有很多,如鱼类的生活区域、种类、营养状况和环境等因素[5-8]。近年来鱼类肠道微生物研究备受关注,如邵仙萍[9]的研究发现,将碱式氯化铜添加到饲料中投喂给异育银鲫,其可使异育银鲫肠道中的大肠杆菌数量降低,芽孢杆菌数量增加。同时研究添加碱式氯化铜的饲料在团头鲂使用后,其可使团头鲂肠道微生物中的细菌种类增加,进而导致群落结构发生变化[10]。而水环境中重金属铜对鲫鱼肠道微生物影响的研究尚未见报道。
鲫鱼是欧亚地区常见的淡水鱼,也是我国重要的食用鱼类之一。因其肉质细嫩、味道鲜美、营养丰富深受广大消费者的喜爱。2014年,我国鲫鱼产量达到276.79万吨,占我国淡水鱼产品产量的10.63%,比2013年同期增长了6.69%[11]。随着养殖规模的不断扩大,鲫鱼病害也在不断地发生。鲫鱼常见的病害主要包括细菌类疾病、寄生虫病及其他病害等。因此本实验采用实验室模拟半静态法养鱼,添加重金属铜到鲫鱼的水环境中进行胁迫试验,研究在重金属铜胁迫下鲫鱼肠道微生物的变化,为研究重金属污染对鲫鱼健康状况的影响、鲫鱼养殖过程中病害的诊断等提供理论参考和实验基础。
1 材料和方法 1.1 材料
1.1.1 主要仪器和试剂: Centrifuge5424R型高速台式冷冻离心机,德国Eppendorf公司;ABI GeneAmp?9700型PCR仪,美国ABI公司;NanoDrop2000超微量分光光度计,美国Thermo Fisherscientific公司;移液器系列,德国Eppendorf公司;BSC-1300型无菌操作台,苏州安洋科技发展有限公司。五水合硫酸铜(分析纯),西陇化工股份有限公司;DNA抽提试剂盒,美国Omega Bio-Tek公司;Taq DNA聚合酶、PCR引物、购自上海生工。
1.1.2 样品的制备: 异育银鲫(Allogynogenetic Carassius auratus)由南昌市某养殖场提供。实验用鱼的平均体长和体重分别为11.9 cm和22.5 g。异育银鲫采用实验室模拟半静态法驯养,水温为(15±1) ℃,驯养期间,每天喂食2次(9:00-14:00),每次投放饲料(鱼用膨化配合饲料,通威股份有限公司南昌分公司)量为鱼体重的1%。驯养14 d后,分别用浓度为0、0.01、0.05、0.10、0.15 mg/L的五水合硫酸铜溶液胁迫处理。每个梯度放4尾鱼,为避免因鱼体吸收导致水体重金属铜浓度下降,采用虹吸法除去异育银鲫的代谢产物,并更换1/3的五水合硫酸铜溶液。饲养14 d取样。1.2 样本采集 各浓度随机取样3尾,在无菌操作台上进行鱼样处理,先用75%的酒精擦拭异育银鲫体表进行消毒,解剖剪消毒后沿肛门向上朝前呈弧形剪开,取出异育银鲫肠道并用无菌棉线结扎肠道两端。再用镊子去除附着在表面的脂肪,然后用75%酒精擦拭肠表面,并用PBS缓冲液(磷酸盐缓冲液,pH 7.4) 冲洗数遍后于10 mL无菌Eppendorf管中,保存在-80 ℃待用。本实验将3尾鱼的肠道混合作为一个样品来进行分析,以减少个体间变异的影响。
1.3 DNA的提取和PCR扩增 取鲫鱼肠道,使用DNA抽提试剂盒提取肠道总DNA。实验采用16S rDNA V3+V4区通用引物进行扩增,所用引物序列为338F (5′ -ACTCCTAC GGGAGGCAGCAG-3′ )和806R (5′ -GGACTACHV GGGTWTCTAAT-3′ )。PCR反应体系(20 μL):2 μL10×Buffer,2 μL 2.5 mmol/L dNTPs,0.8 μL引物,0.2 μL rTaq 聚合酶,0.2 μL BSA,10 ng模板DNA和ddH2O。PCR程序:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min,10 ℃直到停止,PCR产物通过1%琼脂糖凝胶电泳检测。PCR扩增产物经纯化和定量后,再对DNA双末端修复并富集同时构建文库并测序。
1.4 序列及多样性分析 测得的基因序列与NCBI数据库比对,选择同源性值最高的为测序结果。使用Usearch (vsesion7.1 http://drive5.com/uparse/)进行OTU聚类,R语言工具统计和制作稀释性曲线图、Venn图和群落结构图,mothur version v.1.30.1 http://www.mothur. org/wiki/Schloss_SOP#Alpha_diversity)进行指数分析,R语言vegan包,vegdist和hclust进行距离计算和聚类分析。
2 结果和分析 2.1 总DNA提取和16S rRNA基因扩增 提取异育银鲫肠道微生物的总DNA较完整,条带较为清晰,可用于后续实验。应用细菌16SrRNA基因通用引物进行特异性扩增,扩增以后经过2%琼脂糖凝胶电泳得到如图 1所示的PCR扩增图。得到16S rRNA V3-V4可变区的基因片段约为600 bp。
2.2 异育银鲫肠道微生物群落多样性分析 根据不同浓度处理的异育银鲫肠道样品获得的细菌OTU (operational taxonomic units)绘制Venn图(图 2)。结果显示,5个样品共得到420个OTUs。其中5个单样品分别得到了347、238、253、224、176个,说明重金属铜胁迫明显降低了异育银鲫肠道微生物的丰富度和多样性。同时还可以看出,5个样品共有的细菌OTU数目为117个,分别占浓度为0、0.01、0.05、0.10、0.15 mg/L重金属铜胁迫处理的异育银鲫肠道样品细菌总OTUs数目的33.71%、49.15%、46.24%、52.23%和66.47%。处理组所特有的OTU数是7-17个,占所有OTUs总数的3.57%-6.71%,比例很低。说明各样品间细菌群落组成存在一定的差异,但具有明显的相似。
 |
| 图 1 异育银鲫肠道微生物16S rRNA基因片段的PCR扩增图 Figure 1 Amplification results of 16S rRNA gene of intestinal microbial from crucian. M: marker; lane 1-5: 0, 0.01, 0.05, 0.10, 0.15 mg/L copper respectively. |
| 图选项 |
 |
| 图 2 不同样品OTU分布Venn图 Figure 2 OTU Venn analysis of different samples. The number 1 to 5 in the figure represents sample of allogynogenetic silver crucian carp disposed by different concentrations of the heavy metal copper (0, 0.01, 0.05, 0.10 and 0.15 mg/L). |
| 图选项 |
2.3 异育银鲫肠道微生物群落丰度 本实验还对测序结果中肠道微生物功能多样性指数进行统计,由表 1可知,浓度为0、0.01、0.05、0.10和0.15 mg/L重金属铜胁迫处理的异育银鲫肠道样品获得的有效序列条数和OTUs数分别为42555、36566、38651、48494、38651和347、238、253、224、176,且各样品的测序覆盖率均在99.8%以上。得到的OTUs数为未进行铜胁迫处理鲫鱼肠道微生物样品的ACE指数和Chao指数(Chao1 richness estimator)最高,分别为350和353;经过重金属铜胁迫处理的异育银鲫肠道微生物样品的ACE指数(the ACE estimator)和Chao指数分别为253、265、232、272和253、271、233、249。在未进行重金属铜胁迫处理异育银鲫肠道微生物样品中Shannon指数(Shannon-wiener diversity index)最高、Simpson指数(Simpson diversity index)最低。以上多样性指数表明,经过重金属铜胁迫处理后异育银鲫肠道微生物多样性明显降低。
表 1. 不同处理肠道微生物功能多样性指数 Table 1. Functional diversity of gut microbial community with different treatments
| Sample ID | Reads | 0.97 | |||||
| OTU | ACE | Chao | Coverage | Shannon | Simpson | ||
| 1 | 42555 | 347 | 350 (348, 359) | 353 (348, 371) | 0.999765 | 4.49 (4.48, 4.51) | 0.0236 (0.0232, 0.0241) |
| 2 | 36566 | 238 | 253 (245, 269) | 253 (244, 274) | 0.999207 | 2.02 (2, 2.04) | 0.3997 (0.3938, 0.4057) |
| 3 | 38651 | 253 | 265 (258, 279) | 271 (260, 300) | 0.999353 | 1.85 (1.83, 1.88) | 0.5074 (0.501, 0.5137) |
| 4 | 48494 | 224 | 232 (227, 245) | 233 (227, 252) | 0.999629 | 2.10 (2.08, 2.11) | 0.3260 (0.322, 0.3299) |
| 5 | 43728 | 176 | 272 (241, 318) | 249 (212, 324) | 0.998788 | 1.28 (1.26, 1.3) | 0.5817 (0.5758, 0.5876) |
| The number 1 to 5 in the table represents sample of allogynogenetic silver crucian carp disposed by different concentrations of the heavy metal copper (0, 0.01, 0.05, 0.10 and 0.15 mg/L), the number 0.97 in the table represents the OTU reads similarity of this analysis is 97 percent. | |||||||
表选项
2.4 异育银鲫肠道微生物群落结构和组成 从图 3可以看出,5个样品主要由厚壁菌门、变形菌门、拟杆菌门、CK-1C4-19、梭杆菌门组成,各门类在样品中的比例存在差异。在不进行重金属铜胁迫处理的异育银鲫肠道样品(1) 中,主要由厚壁菌门、变形菌门和拟杆菌门组成,其占比例分别为62.90%、25.52%和6.45%。0.01 mg/L重金属铜胁迫处理的异育银鲫肠道样品(2) 中,主要由变形菌门、厚壁菌门、拟杆菌门和CK-1C4-19组成,所占比例分别为14.59%、10.81%、10.08%和63.95%。0.05 mg/L重金属铜胁迫处理的异育银鲫肠道样品(3) 中,主要由变形菌门和厚壁菌门组成,其含量分别为76.69%和18.55%。0.10 mg/L重金属铜胁迫处理的异育银鲫肠道样品(4) 中,其优势菌与不进行重金属铜胁迫处理的鲫鱼肠道样品中的相同,只是所占比例不同,分别为28.55%、13.81%和57.40%。0.15 mg/L重金属铜胁迫处理的异育银鲫肠道样品(5) 中,变形菌门、厚壁菌门、拟杆菌门和梭杆菌门是优势菌,所占比例分别为14.57%、32.74%、59.66%和75.93%。以上研究表明,重金属铜胁迫处理可改变样品中优势菌的含量。
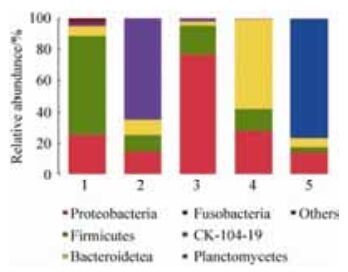 |
| 图 3 各门细菌相对丰度 Figure 3 Bacteria community structure of different samples in phylum. The number 1 to 5 in the figure represents sample of allogynogenetic silver crucian carp disposed by different concentrations of the heavy metal copper (0, 0.01, 0.05, 0.10 and 0.15 mg/L). |
| 图选项 |
由图 4可知,重金属铜胁迫处理会直接影响异育银鲫肠道样品中菌群的分布。鲸杆菌在0.15 mg/L重金属铜胁迫处理的异育银鲫肠道样品(5) 中的含量最高,占样品中总菌数的76%;Barnesiella 和柠檬酸杆菌是0.10 mg/L重金属铜胁迫处理的异育银鲫肠道样品(4) 中的优势菌,其所占比例分别为53%和22%;柠檬酸杆菌在0.05 mg/L重金属铜胁迫处理的异育银鲫肠道样品(3) 中的含量最高,占样品中总菌数的71%;CK-1C4-1_norank是0.01 mg/L重金属铜胁迫处理的异育银鲫肠道样品(2) 中的优势菌,其所占比例为64%,在不进行重金属铜胁迫处理的异育银鲫肠道样品(1) 中,各菌群分布比较均匀。以上研究结果表明,重金属铜可以扰乱异育银鲫肠道的微生态环境。
2.5 异育银鲫肠道微生物群落相对丰度 图 5为异育银鲫肠道微生物群落相对丰度图,从图中可以得出,微生物群落根据进化关系总共聚类为两支,说明经过重金属铜胁迫14 d后异育银鲫肠道微生物种类并未发生变化。由图 5可知,分支Ⅰ的核心门类主要包括变形菌门、厚壁菌门、拟杆菌门、CK-1C4-19和梭杆菌门。分支Ⅱ中的核心门类主要包括蓝藻细菌、绿弯菌门、浮霉菌和放线菌门且以上4种菌只出现在不进行铜胁迫处理的异育银鲫肠道样品(1) 中。结果表明,重金属铜抑制了蓝藻细菌、绿弯菌门、浮霉菌和放线菌门的出现。
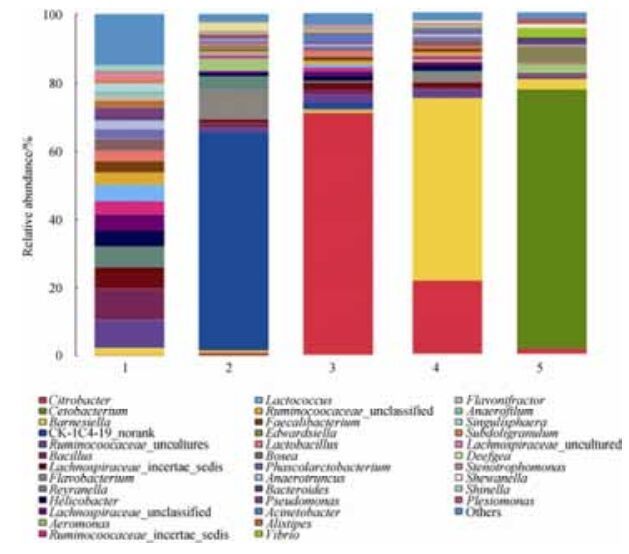 |
| 图 4 各属细菌相对丰度 Figure 4 Bacteria community structure of different samples in genus. The number 1 to 5 in the figure represents sample of allogynogenetic silver crucian carp disposed by different concentrations of the heavy metal copper (0, 0.01, 0.05, 0.10 and 0.15 mg/L). |
| 图选项 |
 |
| 图 5 各属细菌相对丰度 Figure 5 Microbial community heatmap analysis. The number 1 to 5 in the figure represents sample of allogynogenetic silver crucian carp disposed by different concentrations of the heavy metal copper (0, 0.01, 0.05, 0.10 and 0.15 mg/L). |
| 图选项 |
3 讨论 水环境中重金属对鱼类健康有很大的影响,肠道微生物的种类和数量反映出与宿主间相互依赖、相互制约的微生态关系,在鱼类的生长、发育、营养水平和免疫防疫等方面也发挥着重要的作用[12-13]。本研究采用高通量测序技术对5种不同重金属铜浓度胁迫处理的异育银鲫肠道微生物进行检测,研究胁迫处理前后异育银鲫肠道微生物的变化情况。研究发现,在经过重金属铜胁迫处理后,异育银鲫肠道微生物具有一个不受重金属铜影响的“核心菌群”。这与Zhang等[14]研究发现,经过不同脂肪源饲料饲喂凡纳滨对虾,其肠道微生物具有一个不受饲料组分影响的“核心菌群”的结果相类似。说明环境因素的变化并不能对水生生物的核心菌群产生影响。研究还发现,经过重金属铜胁迫处理后,不仅异育银鲫肠道微生物的多样性明显降低,其群落结构也存在着明显的差异。这与部分文献结果相似,Wang等[15]采用黑麦草作为饲料喂食草鱼后发现,草鱼肠道内出现了大量的降解纤维素的菌;翟少伟等[16]在饲料中添加抗菌肽Surfactin饲喂吉富罗非鱼,结果发现吉富罗非鱼肠道中的大肠杆菌数量显著降低、乳酸杆菌数量显著增加,细菌总数无明显变化;张国启[17]研究发现,长期投喂壳寡糖可促进黄河鲤肠道内乳酸杆菌和双歧杆菌的生长,对大肠杆菌也有较好的抑制作用。说明环境的变化对鱼类肠道微生物存在着一定的影响。
在未经重金属铜胁迫处理的异育银鲫肠道样品(1) 中,厚壁菌门、变形菌门和拟杆菌门为主要的细菌类群。Han[18]和Roeselers[19]等研究发现,厚壁菌门、变形菌门是在鱼类中普遍存在的,而拟杆菌门的含量仅次于前两者,本研究结果与其一致。在正常的鱼类肠道中,以上3种菌含量的大小顺序为厚壁菌门 > 变形菌门 > 拟杆菌门[19]。然而在经过不同浓度重金属铜胁迫处理后,异育银鲫肠道菌群样品中厚壁菌门的含量明显降低于未胁迫处理的异育银鲫肠道样品,可能是因为重金属铜抑制了厚壁菌门的生长。厚壁菌门是鱼类肠道微生物中营养吸收的主要类群[19]。本研究中,不进行重金属铜胁迫处理样品中该类群的相对丰度为62.90%,而不同处理条件下该类群的的相对丰度分别为10.81%、18.55%、13.81%和32.74%,远低于不进行重金属铜胁迫处理样品中该类群的相对丰度,其主要包括芽孢杆菌属、乳酸菌和乳球菌。异育银鲫肠道中厚壁菌门的减少,可能会影响其对食物中热量的吸收,从而影响异育银鲫的正常生长。本研究为养殖户如何正确、快速地养殖鲫鱼提供一定的理论基础。
变形菌门为鱼类肠道微生物中主要类群之一[20]。研究发现,经过重金属铜胁迫处理后,异育银鲫肠道中隶属于变形菌门中的气单胞菌属、弧菌和爱德华菌属与不进行铜胁迫处理的异育银鲫肠道微生物相比,其数量呈上升趋势。气单胞菌属中的嗜水气单胞菌分为致病性和非致病性两种。致病性气单胞菌是多种水产动物的主要致病菌[21]。弧菌中的副溶血性弧菌、鳗弧菌等是鱼贝类的主要致病菌。爱德华菌中的迟缓爱德华菌是一种重要的条件致病性人畜共患病原菌,宿主感染后可引发败血、肝脓疡、胃肠炎等疾病[22]。重金属铜胁迫处理后,气单胞菌属、弧菌和爱德华菌属的数量明显上升,说明经过重金属铜胁迫处理后,异育银鲫体内存在潜在的健康风险。以上研究为鲫鱼疾病的预防提供一定的数据支撑。核心微生物,特别是核心物种或核心OTU,以及由核心微生物组成的核心微生物菌群是某一微生物群落的特征微生物类群,对于群落的功能起着关键作用[23]。本研究发现,铜胁迫前后异育银鲫肠道核心微生物群(门水平)明显不同,分支Ⅰ中的核心微生物为不同处理组中的共有微生物,分别为变形菌门、厚壁菌门、拟杆菌门、CK-1C4-19和梭杆菌门。分支Ⅱ中的核心微生物只出现在不进行铜胁迫处理的异育银鲫肠道样品中,分别为蓝藻细菌、绿弯菌门、浮霉菌门和放线菌门。可能是因为重金属铜的添加不利于蓝藻细菌、绿弯菌门、浮霉菌门和放线菌门的生长。
References
| [1] | Bj?rkstén B. The gut microbiota:a complex ecosystem. Clinical & Experimental Allergy, 2006, 36(10): 1215-1217. |
| [2] | Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease. Nature Reviews Immunology, 2009, 9(5): 313-323. DOI:10.1038/nri2515 |
| [3] | Li YM, Xu ZW, Li F, Tao X, Lü JH. Effects of fermented liquid cereal grain feed on growth performance and intestinal microbial flora diversity of early-weaned piglets. Chinese Journal of Animal Nutrition, 2010, 22(6): 1650-1657. (in Chinese) 李永明, 徐子伟, 李芳, 陶新, 吕金辉. 发酵谷物液体饲料对超早期断奶仔猪生长性能和肠道微生物菌群多样性的影响. 动物营养学报, 2010, 22(6): 1650-1657. |
| [4] | Chen JH, Wang ZK, He M, Yin YP. Analysis of intestinal microecology of Apriona germara (Hope) larvae by DGGE and RFLP techniques. Biotechnology Bulletin, 2008(6): 115-119, 123. (in Chinese) 陈金华, 王中康, 贺闽, 殷幼平. DGGE和RFLP方法分析桑粒肩天牛幼虫肠道微生物多样性. 生物技术通报, 2008(6): 115-119, 123. |
| [5] | Wu SG, Wang GT, Angert ER, Wang WW, Li WX, Zou H. Composition, diversity, and origin of the bacterial community in grass carp intestine. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [6] | Ye L, Amberg J, Chapman D, Gaikowski M, Liu WT. Fish gut microbiota analysis differentiates physiology and behavior of invasive Asian carp and indigenous American fish. The ISME Journal, 2014, 8(3): 541-551. DOI:10.1038/ismej.2013.181 |
| [7] | Li XM, Yu YH, Xie SQ, Yan QY, Chen YH. Effect of chitosan on intestinal bacteria of Allogynogenetic crucian carp, Carassius auratus gibelio, as Depicted by polymerase chain reaction-denaturing Gradient Gel Electrophoresis. Journal of the World Aquaculture Society, 2011, 42(4): 539-548. DOI:10.1111/j.1749-7345.2011.00496.x |
| [8] | Wang C, Ni JJ, Yan QY, Li JJ, Li XH, Yu YH. Comparison of the intestinal bacterial communities between Grass Carp (Ctenopharyngodon idellus) and Bluntnose Black Bream (Megalobrama amblycephala). Acta Hydrobiologica Sinica, 2014, 38(5): 868-875. (in Chinese) 王纯, 倪加加, 颜庆云, 李金金, 李星浩, 余育和. 草鱼与团头鲂肠道菌群结构比较分析. 水生生物学报, 2014, 38(5): 868-875. DOI:10.7541/2014.130 |
| [9] | 邵仙萍. 碱式氯化铜对异育银鲫和团头鲂生长、组织铜水平、抗氧化活性及肠道菌群的影响. 南京农业大学博士论文, 2012. |
| [10] | Shao XP, Liu WB, Lu KL, Xu WN, Zhang WW, Wang Y, Zhu J. Effects of tribasic copper chloride on growth, copper status, antioxidant activities, immune responses and intestinal microflora of blunt snout bream (Megalobrama amblycephala) fed practical diets. Aquaculture, 2012, 338-341: 154-159. DOI:10.1016/j.aquaculture.2012.01.018 |
| [11] | 农业部渔业渔政管理局. 2015中国渔业统计年鉴. 北京: 中国农业出版社, 2015. |
| [12] | Zhong L, Xiang JG, Zeng D, Li NQ. Effects of different diets on intestinal microbiota of Elopichthys bambusa. Acta Hydrobiologica Sinica, 2016, 40(4): 830-835. (in Chinese) 钟蕾, 向建国, 曾丹, 李宁求. 饵料对鳡肠道微生物多样性的影响. 水生生物学报, 2016, 40(4): 830-835. DOI:10.7541/2016.107 |
| [13] | 祭仲石. 三种不同环境中鲢鳙肠道微生物研究. 上海海洋大学博士论文, 2014. |
| [14] | Zhang ML, Sun YH, Chen K, Yu N, Zhou ZG, Chen LQ, Du ZY, Li EC. Characterization of the intestinal microbiota in Pacific white shrimp, Litopenaeus vannamei, fed diets with different lipid sources. Aquaculture, 2014, 434: 449-455. DOI:10.1016/j.aquaculture.2014.09.008 |
| [15] | Wang Y, Sheng HF, He Y, Wu JY, Jiang YX, Tam NFY, Zhou HW. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags. Applied and Environmental Microbiology, 2012, 78(23): 8264-8271. DOI:10.1128/AEM.01821-12 |
| [16] | Zhai SW, Shi QC, Chen XH. Effect of dietary antimicrobial peptides-surfactin supplementation on parameters of intestinal health indices of genetically improved farmed tilapia (gift, Oreochromis niloticus). Acta Hydrobiologica Sinica, 2016, 40(4): 823-829. (in Chinese) 翟少伟, 史庆超, 陈学豪. 饲料中添加抗菌肽Surfactin对吉富罗非鱼肠道健康的影响. 水生生物学报, 2016, 40(4): 823-829. DOI:10.7541/2016.106 |
| [17] | 张国启. 壳寡糖对黄河鲤生产性能、免疫指标和肠道菌群影响的研究. 河南工业大学硕士论文, 2012. |
| [18] | Han SF, Liu YC, Zhou ZG, He SX, Cao YN, Shi PJ, Yao B, Ring? E. Analysis of bacterial diversity in the intestine of grass carp (Ctenopharyngodon idellus) based on 16S rDNA gene sequences. Aquaculture Research, 2010, 42(1): 47-56. DOI:10.1111/are.2010.42.issue-1 |
| [19] | Roeselers G, Mittge EK, Stephens WZ, Parichy DM, Cavanaugh CM, Guillemin K, Rawls JF. Evidence for a core gut microbiota in the zebrafish. The ISME Journal, 2011, 5(10): 1595-1608. DOI:10.1038/ismej.2011.38 |
| [20] | Cottrell MT, Kirchman DL. Natural Assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low-and high-molecular-weight dissolved organic matter. Applied and Environmental Microbiology, 2000, 66(4): 1692-1697. DOI:10.1128/AEM.66.4.1692-1697.2000 |
| [21] | Rao JJ, Li SS, Huang KH, Jiang SX, Pan QX. Development of multiplex polymerase chain reaction for detection of pathogenic aeromonas hydrophila and its preliminary application. Journal of Fishery Sciences of China, 2007, 14(5): 749-755. (in Chinese) 饶静静, 李寿崧, 黄克和, 江树勋, 潘群兴. 致病性嗜水气单胞菌多重PCR检测方法的建立. 中國水產科學, 2007, 14(5): 749-755. |
| [22] | Wang XP, Ding L, Zou LZ, Chen SB, Xie QL, Yan MC. Visualisation of zebrafish infection with GFP-labelled Edwardsiella tarda. Acta Laboratorium Animalis Scientia Sinica, 2011, 19(5): 433-436. (in Chinese) 王雪鹏, 丁雷, 邹兰柱, 陈少波, 谢起浪, 闫茂仓. 应用绿色荧光蛋白标记迟缓爱德华菌感染斑马鱼. 中国实验动物学报, 2011, 19(5): 433-436. |
| [23] | Shade A, Handelsman J. Beyond the Venn diagram:the hunt for a core microbiome. Environmental Microbiology, 2012, 14(1): 4-12. DOI:10.1111/j.1462-2920.2011.02585.x |
