靖宪月, 陈姗姗

 , 周顺桂
, 周顺桂 福建农林大学资源与环境学院, 福建省土壤环境健康与调控重点实验室, 福建 福州 350002
收稿日期:2017-04-12;修回日期:2017-05-23;网络出版日期:2017-07-11
基金项目:国家自然科学基金(41501248)
*通信作者:陈姗姗, Tel: +86-591-86398509; E-mail:chenss@fafu.edu.cn
摘要:可吸收胞外电子的电活性微生物(Electroactive microorganisms,EAMs)可利用胞外固态载体的电子将二氧化碳或其他氧化态物质还原成胞外有机物、还原态无机物或自身生命活动所需的有机物。该类EAMs的出现拓宽了人们对微生物多样性的认识,在生物质能合成、污染物治理与化学物质检测等方面具有重要的应用价值。本文介绍了代表性的可吸收胞外电子EAMs的物质转化与电能转化率等基本特性,重点阐述该类EAMs基于膜蛋白的直接吸收电子机制,及基于电子穿梭体的间接吸收电子机制,提出了其在微生物电合成系统与微生物传感器中的应用前景,并从EAMs机理研究、生物膜微观机制及工程应用的角度展望其今后的研究方向。
关键词: 电活性微生物 吸收电子机制 膜结合蛋白 电子穿梭体 电合成系统 微生物传感器
Advances in electroactive microorganisms with capability for extracellular electron uptake
Xianyue Jing, Shanshan Chen

 , Shungui Zhou
, Shungui Zhou Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China
Received 12 April 2017; Revised 23 May 2017; Published online 11 July 2017
*Corresponding author: Shanshan Chen, Tel: +86-591-86398509; E-mail:chenss@fafu.edu.cn
Supported by the National Natural Science Foundation of China (41501248)
Abstract: Electroactive microorganisms (EAMs) with capability for extracellular electron uptake are microorganisms that can use electrons from extracellular solid to reduce carbon dioxide or other oxidative substances into extracellular organics, reductive inorganics or intracellular life-supporting organics. The finding of these EAMs broadens our knowledge of microbial diversity. They have significant practical applications in biomass energy synthesis, contaminant treatment and chemical detection. In this review, the substance transformation and electron recovery efficiency of representative EAMs with capability for extracellular electron uptake were introduced. The direct electron uptake mechanism based on membrane-bound proteins and the indirect electron uptake mechanisms based on electron shuttles were summarized. Application potentials in the microbial electrosynthesis system and the microbial sensor were proposed. And future research directions of these EAMs were discussed from the perspectives of mechanism study, biofilm micromechanism and engineering application.
Key words: electroactive microorganism electron uptake mechanism membrane-bound protein electron shuttle electrosynthesis system microbial sensor
电活性微生物(Electroactive microorganisms,EAMs)是一类可与胞外固态载体——电极进行电子传递的微生物,部分EAMs可将电子传递给电极以产生电流,部分EAMs可吸收电极传来的电子得到目标产物,部分EAMs同时具备输出和吸收胞外电子的能力[1-4]。可吸收胞外电子的EAMs在合成化学产品和修复环境两个应用方向上具有清洁、低能耗及可持续等特点,近年来受到国内外研究者的重视[5-6]。除应用层面的研究,****们试图深入解析EAMs吸收电子的机制,旨在从机理理论的高度为提高目标产物产量和污染修复效率提供指导。本文将在总结具备吸收胞外电子能力的代表性EAMs的基础上,阐述其胞外吸收电子机制的研究进展,介绍其在微生物电合成系统与微生物传感器中的应用前景,并从EAMs机理研究、生物膜微观机制及工程应用的角度展望其今后的研究方向。
1 吸收胞外电子的代表性EAMs 大部分可吸收胞外电子EAMs的研究是在微生物电合成系统(Microbial electrosynthesis system,MES)中开展的。MES (图 1)由阳极室和阴极室组成,2个极室被质子或离子交换膜分隔开,阳极发生微生物催化氧化有机物或简单的水氧化产生电子的反应,关键的生物电合成反应发生在阴极,依靠外电路电能降低电子传递的壁垒,阴极室中的微生物接受阴极传来的电子,将二氧化碳或其他氧化态物质还原成胞外有机物、还原态无机物或自身生命活动所需的有机物[6-8]。
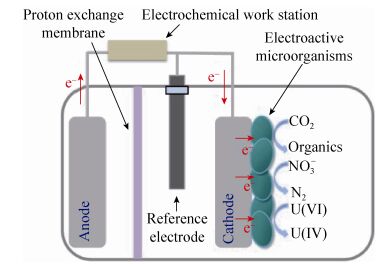 |
| 图 1 微生物电合成系统(据文献[10]绘制) Figure 1 Microbial electrosynthesis system (adapted from reference [10]). |
| 图选项 |
在合成化学制品方面研究较多的可吸收胞外电子EAMs为Clostridum属和Sporomusa属[5, 7],它们将CO2合成为乙酸、丁酸、乙醇等分泌到胞外,同时获得微生物自身所需的能量。Sporomusa ovata DSM-2662是目前已知的MES中以纯菌形式合成乙酸效果最好的微生物,合成速率可达282 mmol/(L·m2·d),电能转化为乙酸的效率超过80%,比光能或化能自养型微生物的能量转化效率高[9]。在环境修复方面研究最多的EAMs是Geobacter属及Shewanella属[9],它们可吸收胞外电子,将U(VI)、硝酸盐等污染物还原为U(IV)、亚硝酸盐、N2等生物毒性小的物质[1, 4, 9]。此外,EAMs还能吸收胞外电子合成自身生长所需的有机物,Acidithiobacillus ferrooxidans是首株被证明能利用阴极电子合成供自身生长所用的胞内有机物的EAMs[8]。
目前已报道的可吸收电子EAMs按首字母排序总结于表 1,从中可看出该类EAMs广泛分布于多个菌属,它们的电能利用率较高,例如Pseudomonas alcaliphila MBR在利用阴极电子将硝酸盐还原为亚硝酸盐时,电能转化率可达(93.50±3.04)%[11]。
表 1. 代表性吸收胞外电子的电活性微生物 Table 1. Representative EAMs with capability for extracellular electron uptake
| Microorganism | Substance transformation | Electron recovery efficiency | References |
| Acidithiobacillus ferrooxidans | CO2→Intracellular organic matter | Not given | [8] |
| Alcaligenes faecalis ATCC 8750 | Nitrate→Nitrite | Not given | [12] |
| Nitrite→NO/N2O/N2 | Not given | ||
| Anaeromyxobacter dehalogenans 2CP-1 | 2-Chlorophenol→Phenol | Not given | [13] |
| Azospira suillum | ClO4-→Cl- | Not given | [6] |
| Clostridium aceticum | CO2→Acetic acid, 2-Hydroxybutyric acid | Not given | [7] |
| Clostridium ljungdahlii | CO2→Acetic acid, formic acid, 2-Hydroxybutyric acid | 89% (acetic acid) | [5, 14] |
| CO2→Ethanol | |||
| Dechloromonas agitate VDY | ClO4-→Cl- | Not given | [6] |
| Geobacter metallireducens GS-15 | Nitrate→Nitrite | Not given | [9] |
| Geobacter soli GSS01 | Nitrate→Nitrite | Not given | [4] |
| Geobacter sulfurreducens PCA | Fumaric acid→Succinic acid U(VI)→U(IV) | Not given | [1, 2] |
| Mariprofundus ferrooxydans PV-1 | CO2→Intracellular organic matter | Not given | [15] |
| Methanobacterium-like archaeon IM1 | CO2→CH4 | 80% | [16] |
| Methanobacterium palustre | CO2→CH4 | Not given | [17] |
| Methanococcus maripaludis MM901 | CO2→CH4 | Not given | [18] |
| Moorella thermoacetica | CO2→Acetic acid | (79±15)% | [7] |
| Moorella thermoautotrophica DSM1974 | CO2→Acetic acid | (72±4)% | [19] |
| Nitrosomonas europaea ATCC 19718 | CO2→Intracellular organic matter | Not given | [20] |
| Pseudomonas alcaliphila MBR | Nitrate→Nitrite | (93.50±3.04)% | [11] |
| Ralstonia eutropha LH74D | CO2→Isobutanol, 3-methyl-1-butanol | Not given | [21] |
| Rhodopseudomonas palustris TIE-1 | CO2→Intracellular organic matter | Not given | [22] |
| Shewanella oneidensis MR-1 | Fumaric acid→Succinic acid | Not given | [3] |
| Sporomusa ovata | CO2→Acetic acid, 2-Hydroxybutyric acid | (89±12)% (acetic acid) | [5, 9, 23] |
| Sporomusa silvacetica | CO2→Acetic acid, 2-Hydroxybutyric acid | Not given | [7] |
| Sporomusa sphaeroides | CO2→Acetic acid, 2-Hydroxybutyric acid | Not given | [7] |
| Thiobacillus denitrificans DSM 12475 | Nitrate→Nitrite/N2O | 72% | [24] |
表选项
2 吸收胞外电子的EAMs电子传递机制 Geobacter属和Shewanella属的几株模式菌株G. metallireducens GS-15、G. sulfurreducens PCA、G. soli GSS01及S. oneidensis MR-1既可输出电子也可吸收胞外电子,具有双向电子传递的能力[1-4, 9]。2011年,Strycharz等[2]发现G. sulfurreducens在输出与吸收电子时,基因表达图谱有所不同。若敲除G. sulfurreducens的omcZ和pilA这两种在输出电子过程中至关重要的基因,对其吸收胞外电子过程没有影响,说明这两个方向的电子传递路径不是简单的原路反向移动[2, 25],也表明相较于EAMs输出电子的研究,吸收胞外电子机理研究是一个崭新的领域。目前已知的吸收胞外电子机制主要有两大类:一是基于膜结合蛋白的直接吸收电子机制,二是基于电子穿梭体的间接吸收电子机制。
2.1 基于膜结合蛋白的直接吸收电子机制 研究吸收胞外电子的机制大多以Geobacter属或Shewanella属为对象,原因是这2个属的微生物已完成全基因组测序,并且在输出电子方面有一定的机制研究基础。直接吸收电子机制指的是不需依赖任何电子穿梭体,由附着在电极上的EAMs依靠细胞外膜或周质上的蛋白直接吸收来自电极的电子[26]。
Strycharz等[2]研究证明,G. sulfurreducens PCA菌株在吸收电子的条件下,编码G. sulfurreducens PCA的PccH蛋白基因转录丰度大,删除该蛋白基因后严重抑制了其吸收胞外电子的功能。Santos等[27]通过薄膜热解石墨电极获得G. sulfurreducens的PccH蛋白,并采用循环伏安法研究PccH蛋白的热力学和动力学特性,进一步证明PccH蛋白在吸收胞外电子时起关键的作用。Ross等[3]用敲除相关蛋白基因的方式为S. oneidensis的吸收电子机制给出直接的证据,他们发现删除S. oneidensis MR-1中FccA、MtrA、MtrB和CymA蛋白的基因,从电极到微生物的电子传递过程受到抑制,表明Mtr路径在吸收电子时起关键作用,并推断MR-1吸收电子时的传递路径为:电极→MtrC→MtrB→MtrA→CymA→内膜中的甲萘醌循环→周质中的FccA (图 2-A)。
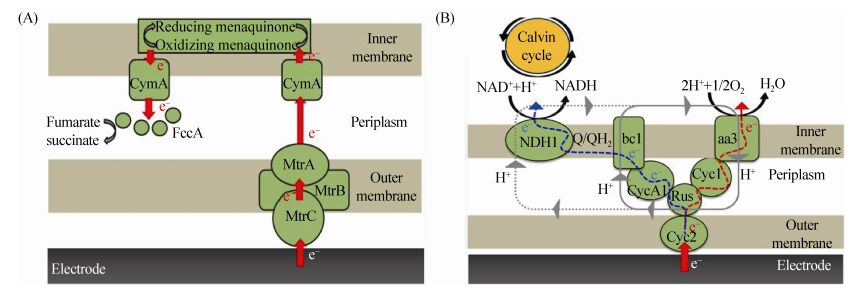 |
| 图 2 基于膜蛋白结合的直接电子传递机制(据文献[3, 8]绘制) Figure 2 The direct electron uptake mechanism based on membrane-bound proteins. A: Electron uptake pathway of Shewanella oneidensis MR-1. B: Mechanisms of electron transfer from electrodes to Acidithiobacillus ferrooxidans (adapted from references [3, 8]). |
| 图选项 |
Ishii等[8]结合电化学方法及化学标记法探明Acidithiobacillus ferrooxidans碳同化过程的电子传递路径(图 2-B)。以Fe2+为电子供体时电子从A. ferrooxidans外膜到内膜的传递分为“吸能”和“放能”两条路线。该研究首先对电流稳定的MES中电极上的微生物进行原位深紫外(254 nm)灭菌,结果电流受到抑制,表明电流主要以附着在电极上的A. ferrooxidans为电子受体。为确定A. ferrooxidans吸收电子时起关键作用的蛋白,用时间分辨暂态光谱法对A. ferrooxidans进行CO人工光化学反应处理,CO与铁络合使血红蛋白失活,此时电流受到抑制;当用配有单色仪(频带宽度为10 nm)的1000 W氙气灯照射时血红蛋白恢复原来的功能,此时电流得到恢复。随后对A. ferrooxidans进行扩散传输紫外可见光谱分析,得知其中的aa3复合蛋白是A. ferrooxidans产生电流的关键蛋白,位于“放能”路径的末端,是外源电子传递到胞内还原O2产生ATP及形成在“吸能”路线中质子力的关键蛋白。此外,在反应器中加入了bc1复合物的抑制子抗霉素A,结果表明在添加1% (V/V)的抗霉素A时电流受到抑制,不加抗霉素A则电流无明显变化,由此推测bc1复合蛋白将电子传递到NDH1蛋白进而将NAD+还原为NADH,而这一过程及还原O2产生的质子力最终启动卡尔文循环进行固碳。
已知的EAMs直接输出电子机制中,除了基于膜蛋白,还有基于被称为“纳米导线”的IV型菌毛的方式[25]。然而目前的EAMs吸收电子机制研究中尚未发现通过“纳米导线”吸收电子的方式。
2.2 基于电子穿梭体的间接吸收电子机制 间接吸收电子机制(图 3),即EAMs利用外源或内源电子穿梭体吸收来自电极的电子[18]。电子穿梭体是能可逆地进行氧化和还原从而介导电极与EAMs间电子传递的物质。人工合成的外源电子穿梭体,如甲基紫精、中性红等可介导电子从电极到EAMs的传递。它们的添加改变了电子流的方向,使更多的电子从铁氧化还原蛋白池流向辅酶NADH池,通过NAD+→NADH反应增加了合成产物所必需的辅酶NADH的量,同时增加还原力,从而促进EAMs对胞外电子的吸收[28]。
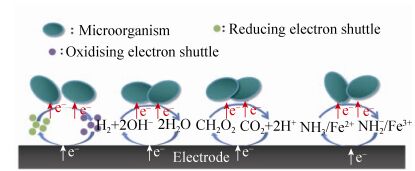 |
| 图 3 基于电子穿梭体的间接吸收电子机制(据文献[29]绘制) Figure 3 The indirect electron uptake mechanism based on electron shuttles (adapted from reference [29]). |
| 图选项 |
EAMs还能以H2、甲酸、氨气或Fe2+等可溶性小分子作为电子穿梭体[26]。根据吉布斯自由能,在阴极电势低于-0.41 V (vs. SHE)时,阴极有H2生成,Rabaey等[29]指出,H2可通过?反应介导电极与微生物间的电子传递。然而H2溶解度低,常压下不一定能与生物体和电极充分接触,不利于其作为电子穿梭体起作用。阴极电势低于-0.41 V (vs. SHE)时CO2和H+通过电化学反应还能生成甲酸[26],不同于溶解度低的H2,甲酸能与EAMs和电极充分接触,Ralstonia eutropha被证明在阴极合成多元醇类时以甲酸为电子穿梭体吸收电子[21]。Deutzmann等[30]也指出,当MES系统中的阴极电位在-0.5 V到-0.6 V (vs. SHE)时,产甲烷菌和产乙酸菌分别以H2和甲酸为电子穿梭体。
Bose等[22]研究表明,在EAMs (Rhodopseudomonas palustris TIE-1)催化下Fe2+失去电子被氧化为Fe3+,而Fe3+又通过电化学反应被还原为Fe2+,从而实现电极与EAMs间的电子传递。该反应发生所需的电位(0.1 V)比产甲烷菌或产乙酸菌MES系统中设置的电位(-0.4 V到-0.5 V)需要的电能更少。与该原理相同,氨氧化菌Nitrosomonas europaea在MES中吸收阴极电子时,NO2-首先通过电化学反应被还原为氨气,氨气又被微生物氧化为NO2-[20, 31]。另外,一些分子结构比较复杂的物质,例如MES中活细胞分泌或死细胞释放的核黄素及DNA也可作为EAMs吸收胞外电子的电子穿梭体[27]。
3 吸收胞外电子的EAMs应用前景 3.1 微生物电合成 部分具备吸收胞外电子能力的EAMs可在MES中将温室气体CO2转化为附加值更高的乙酸、乙醇等化学制品[21]。传统裂解产酸/醇的工业方法需在高温高压强酸条件下进行,与之相比,EAMs在MES中产酸/醇具有反应条件安全、温和的优点;而与传统的发酵产酸/醇法相比,MES法具有原料清洁、产物特异性高的优势,为产酸/醇工业向低能耗的绿色环保方向转型提供了契机。目前MES法产酸/醇仍停留在实验室阶段,如何提高目标产物的产量是其走向实际应用面临的最大挑战[32]。优化MES设计是提高产量的重要途径之一[33],研究者在改进电极材料、离子交换膜及MES反应器构型方面进行了广泛的研究。
可吸收胞外电子的EAMs在MES中一般是以生物膜形式附着于阴极,因此阴极性能在MES中占据重要地位。近年来,研究者通过改良MES阴极提高EAMs的有机物产量并取得了突破性的成果。Zhang等[23]在以Sporomusa ovata DSM 2662构建的纯菌MES中采用了几丁聚糖修饰碳布、金纳米粒子修饰碳布和碳纳米管-轻纺织布等12种不同材料来制作阴极,当恒电位仪的电位设为-0.4 V (vs. SHE)时,以几丁聚糖修饰碳布作为阴极的MES的乙酸产量高达2.748 g/(m2·d),电能转化率达(86±12)%。该研究指出,S. ovata外膜带负电荷,在电中性的碳布表面修饰几丁聚糖、三聚氰酰氯及聚苯胺等物质使其带正电荷,有利于S. ovata在电极表面附着,迅速形成生物膜。Alvarez-Gallego等[34]设计的气体扩散电极结合疏水微孔与亲水微孔创造出气相、液相与固相的三相界面,使气体与固体电极更易接触,确保在电极表面有丰富的气体参与反应。金属纳米粒子及碳纳米管具有生物相容性良好、比表面积大、导电性强等优点,有利于微生物与电极之间的电子传递。Jourdin等[33]在混合菌MES中,当阴极电位设置为-0.85 V (vs. SHE)时,将多碳纳米管用电泳沉积的方法附着在网状玻璃碳表面形成三维材料作为阴极,使乙酸产量达到685 g/(m2·d),电能转化率高达(100±4)%,之后他们在此基础上调整阴极电位值(-1.1 V),使产量达1330 g/(m2·d),这是目前已知的混合菌MES合成乙酸的最高速率[35]。用该法制备阴极,所需装备简单,制作过程危险性小,易在不规则的基底表面沉积形成薄层,适用于大规模生产。
除改进阴极材料外,Giddings等[5]移除MES的交换膜,简化MES系统以提高乙酸产量。Faraghiparapari等[19]对Moorella thermoautotrophica ATCC 39073和Thermoanaerobacter kivui DSM 2030的MES设置不同运行温度,结果表明在60℃下,当阴极电位设置为-0.3 V (vs. SHE)时,两菌产乙酸效果最佳,分别达到了(6.9±0.6) mmol/(L·m2·d)和(11.6±0.9) mmol/(L·m2·d)。Ammam等[36]对Sporomusa ovata DSM-2662进行基因表达分析,表明含钨的醛铁氧还蛋白氧化还原酶和含钨的甲酸脱氢酶在MES中可以提高Sporomusa ovata DSM-2662合成乙酸的速率,因此在阴极电位设置为-0.69 V(vs. SHE)的条件下,将培养基的钨浓度从0.01 μmol/L提高到0.10 μmol/L,使乙酸产量从(32.0±1.7) mmol/(m2·d)提高到(141.2±56.6) mmol/(m2·d)。
3.2 环境污染治理 除应用于微生物电合成外,可吸收电子的EAMs在污染物治理方面也有应用价值。高氯酸盐会影响甲状腺激素的产生从而导致新生儿神经系统缺陷,且在环境中较为稳定,对人类威胁严重。Thrash等[6]以Dechloromonas agitate VDY构建的MES对高氯酸盐去除速率达60 mg/(L·d)。地下水铀污染是全球性的环境问题,目前对其行之有效的污染修复方法是降低其溶解度。Gregory等[1]发现在MES中Geobacter sulfurreducens PCA可将可溶性U(VI)还原为不溶的U(IV)从而降低铀的生物毒性,去除率达到了87%。
3.3 生物传感器 此外,有****以利用EAMs可吸收胞外电子的特点构建微生物传感器。富马酸是一种食物霉变指示剂,当食物中的富马酸浓度超过25 μmol/L表示已发生霉变,因此,高效地检测富马酸浓度对食品安全检测具有重要意义。Si等[37]利用Shewanella oneidensis MR-1能吸收胞外电子将富马酸还原的特点构建微生物传感器用于食品霉变程度检测,传感器的输出电流与所测富马酸在2-10 mmol/L浓度范围内存在正相关线性关系(R2=0.9997),同时微生物对底物浓度的变化响应迅速(图 4)。与物理化学监测方法和其他生物传感方法相比,基于可吸收电子EAMs的微生物传感器具有更低的检出限和更高的灵敏度,在痕量监测方面具有应用潜力[37]。
 |
| 图 4 检测富马酸含量的微生物传感器(据文献[37]绘制) Figure 4 An electrochemical biosensing system for fumarate quantification (rearranged from reference [37]). |
| 图选项 |
4 展望 (1) EAMs机理研究:开展EAMs吸电机理、代谢特征与能量利用模式的研究,有助于解释自然环境中的一些宏观现象,也有利于构建服务于工程应用的高效基因改造菌。然而迄今为止,文献鲜有研究可吸收电子EAMs的代谢特征与能量利用模式,对其吸收电子的机制研究刚刚起步,特别是分布最广的Clostridum属和Sporomusa属的吸电机制未见报道。广泛应用蛋白质组分析、基因敲除等分子生物学手段,结合电化学分析方法和同位素示踪技术,是研究该类EAMs机理的关键点。
(2) 生物膜微观机制:可吸收电子的EAMs在MES中通常以生物膜的形式附着于阴极上进行反应,对生物膜的微观机制进行解析,有利于提高其电化学活性、改善电合成效率。微尺度的无扰动原位监测技术,如微电极系统,已日趋成为研究生物膜的重要手段,然而目前大部分微电极只能检测无机物,缺乏原位有机物微测专用设备是研究该类EAMs形成的生物膜的重要限制因素,亟需技术人员开发研制。
(3) 工程应用:在提高可吸收电子EAMs的电能利用率与合成速率上,根据微生物的特性,继续研发低成本高效率的催化剂,设计导电性好、生物相容性高的新型阴极材料,优化运行MES的参数与条件,提高合成产物的特异性,是MES走向大规模工业化生产应用的主要手段。此外,目前尚无可吸收电子EAMs原位修复实际水土污染的报道,鉴于野外环境的复杂性,有必要开展原位修复试验,考察实际水体和土壤环境对该类EAMs修复污染物效果的影响。
References
| [1] | Gregory KB, Lovley DR. Remediation and recovery of uranium from contaminated subsurface environments with electrodes. Environmental Science & Technology, 2005, 39(22): 8943-8947. |
| [2] | Strycharz SM, Glaven RH, Coppi MV, Gannon SM, Perpetua LA, Liu AN, Nevin KP, Lovley DR. Gene expression and deletion analysis of mechanisms for electron transfer from electrodes to Geobacter sulfurreducens. Bioelectrochemistry, 2011, 80(2): 142-150. DOI:10.1016/j.bioelechem.2010.07.005 |
| [3] | Ross DE, Flynn JM, Baron DB, Gralnick JA, Bond DR. Towards electrosynthesis in Shewanella:energetics of reversing the Mtr Pathway for reductive metabolism. PLoS One, 2011, 6(2): e16649. DOI:10.1371/journal.pone.0016649 |
| [4] | Yang GQ, Huang LY, You LX, Zhuang L, Zhou SG. Electrochemical and spectroscopic insights into the mechanisms of bidirectional microbe-electrode electron transfer in Geobacter soli biofilms. Electrochemistry Communications, 2017, 77: 93-97. DOI:10.1016/j.elecom.2017.03.004 |
| [5] | Giddings CGS, Nevin KP, Woodward T, Lovley DR, Butler CS. Simplifying microbial electrosynthesis reactor design. Frontiers in Microbiology, 2015, 6: 468. |
| [6] | Thrash JC, Van Trump JI, Weber KA, Miller E, Achenbach LA, Coates JD. Electrochemical stimulation of microbial perchlorate reduction. Environmental Science & Technology, 2007, 41(5): 1740-1746. |
| [7] | Nevin KP, Hensley SA, Franks AE, Summers ZM, Ou JH, Woodard TL, Snoeyenbos-West OL, Lovley DR. Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms. Applied and Environmental Microbiology, 2011, 77(9): 2882-2886. |
| [8] | Ishii T, Kawaichi S, Nakagawa H, Hashimoto K, Nakamura R. From chemolithoautotrophs to electrolithoautotrophs:CO2 fixation by Fe(Ⅱ)-oxidizing bacteria coupled with direct uptake of electrons from solid electron sources. Frontiers in Microbiology, 2015, 6: 994. |
| [9] | Gregory KB, Bond DR, Lovley DR. Graphite electrodes as electron donors for anaerobic respiration. Environmental Microbiology, 2004, 6(6): 596-604. |
| [10] | Lovley DR. Powering microbes with electricity:direct electron transfer from electrodes to microbes. Environmental Microbiology Reports, 2011, 3(1): 27-35. DOI:10.1111/emi4.2011.3.issue-1 |
| [11] | Su WT, Zhang LX, Li DP, Zhan GQ, Qian JW, Tao Y. Dissimilatory nitrate reduction by Pseudomonas alcaliphila with an electrode as the sole electron donor. Biotechnology and Bioengineering, 2012, 109(11): 2904-2910. DOI:10.1002/bit.v109.11 |
| [12] | Wang X, Yu P, Zeng CP, Ding HR, Li Y, Wang CQ, Lu AH. Enhanced Alcaligenes faecalis denitrification rate with electrodes as the electron donor. Applied and Environmental Microbiology, 2015, 81(16): 5387-5394. DOI:10.1128/AEM.00683-15 |
| [13] | Strycharz SM, Gannon SM, Boles AR, Franks AE, Nevin KP, Lovley DR. Reductive dechlorination of 2-chlorophenol by Anaeromyxobacter dehalogenans with an electrode serving as the electron donor. Environmental Microbiology Reports, 2010, 2(2): 289-294. DOI:10.1111/emi4.2010.2.issue-2 |
| [14] | Bajracharya S, Heijne A, Benetton XD, Vanbroekhoven K, Buisman CJN, Strik DPBTB, Pant D. Carbon dioxide reduction by mixed and pure cultures in microbial electrosynthesis using an assembly of graphite felt and stainless steel as a cathode. Bioresource Technology, 2015, 195: 14-24. DOI:10.1016/j.biortech.2015.05.081 |
| [15] | Summers ZM, Gralnick JA, Bond DR. Cultivation of an obligate Fe(Ⅱ)-oxidizing lithoautotrophic bacterium using electrodes. mBio, 2013, 4(1): e00420-12. |
| [16] | Beese-Vasbender PF, Grote JP, Garrelfs J, Stratmann M, Mayrhofer KJJ. Selective microbial electrosynthesis of methane by a pure culture of a marine lithoautotrophic archaeon. Bioelectrochemistry, 2015, 102: 50-55. DOI:10.1016/j.bioelechem.2014.11.004 |
| [17] | Cheng SA, Xing DF, Call DF, Logan BE. Direct biological conversion of electrical current into methane by electromethanogenesis. Environmental Science & Technology, 2009, 43(10): 3953-3958. |
| [18] | Lohner ST, Deutzmann JS, Logan BE, Leigh J, Spormann AM. Hydrogenase-independent uptake and metabolism of electrons by the archaeon Methanococcus maripaludis. The ISME Journal, 2014, 8(8): 1673-1681. DOI:10.1038/ismej.2014.82 |
| [19] | Faraghiparapari N, Zengler K. Production of organics from CO2 by microbial electrosynthesis (MES) at high temperature. Journal of Chemical Technology Biotechnology, 2017, 92(2): 375-381. DOI:10.1002/jctb.5015 |
| [20] | Khunjar WO, Sahin A, West AC, Chandran K, Banta S. Biomass production from electricity using ammonia as an electron carrier in a reverse microbial fuel cell. PLoS One, 2012, 7(9): e44846. DOI:10.1371/journal.pone.0044846 |
| [21] | Li H, Opgenorth PH, Wernick DG, Rogers S, Wu TY, Higashide W, Malati P, Huo YX, Cho KM, Liao JC. Integrated electromicrobial conversion of CO2 to higher alcohols. Science, 2012, 335(6076): 1596. DOI:10.1126/science.1217643 |
| [22] | Bose A, Gardel EJ, Vidoudez C, Parra EA, Girguis PR. Electron uptake by iron-oxidizing phototrophic bacteria. Nature Communications, 2014, 5: 3991. |
| [23] | Zhang T, Nie HR, Bain TS, Cui MM, Snoeyenbos-West OL, Franks AE, Nevin KP, Russell TP, Lovley DR. Improved cathode materials for microbial electrosynthesis. Energy & Environmental Science, 2013, 6(1): 217-224. |
| [24] | Yu LP, Yuan Y, Chen SS, Zhuang L, Zhou SG. Direct uptake of electrode electrons for autotrophic denitrification by Thiobacillus denitrificans. Electrochemistry Communications, 2015, 60: 126-130. |
| [25] | Richter H, Nevin KP, Jia HF, Lowy DA, Lovley DR, Tender LM. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type IV pili, and protons in extracellular electron transfer. Energy & Environmental Science, 2009, 2(5): 506-516. |
| [26] | Tremblay PL, Angenent LT, Zhang T. Extracellular electron uptake:among autotrophs and mediated by surfaces. Trends in Biotechnology, 2017, 35(4): 360-371. |
| [27] | Santos TC, de Oliveira AR, Dantas JM, Salgueiro CA, Cordas CM. Thermodynamic and kinetic characterization of PccH, a key protein in microbial electrosynthesis processes in Geobacter sulfurreducens. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2015, 1847(10): 1113-1118. DOI:10.1016/j.bbabio.2015.06.005 |
| [28] | Harrington TD, Mohamed A, Tran VN, Biria S, Gargouri M, Park JJ, Gang DR, Beyenal H. Neutral red-mediated microbial electrosynthesis by Escherichia coli, Klebsiella pneumoniae, and Zymomonas mobilis. Bioresource Technology, 2015, 195: 57-65. DOI:10.1016/j.biortech.2015.06.005 |
| [29] | Rabaey K, Rozendal RA. Microbial electrosynthesis-revisiting the electrical route for microbial production. Nature Reviews Microbiology, 2010, 8(10): 706-716. DOI:10.1038/nrmicro2422 |
| [30] | Deutzmann JS, Sahin M, Spormann AM. Extracellular enzymes facilitate electron uptake in biocorrosion and bioelectrosynthesis. mBio, 2015, 6(2): e00496-15. |
| [31] | Khunjar WO, Sahin A, West AC, Chandran K, Banta S. Biomass production from electricity using ammonia as an electron carrier in a reverse microbial fuel cell. PLoS One, 2012, 7(9): e44846. DOI:10.1371/journal.pone.0044846 |
| [32] | Andersen SJ, Hennebel T, Gildemyn S, Coma M, Desloover J, Berton J, Tsukamoto J, Stevens C, Rabaey K. Electrolytic membrane extraction enables production of fine chemicals from biorefinery sidestreams. Environmental Science & Technology, 2014, 48(12): 7135-7142. |
| [33] | Jourdin L, Grieger T, Monetti J, Flexer V, Freguia S, Lu Y, Chen J, Romano M, Wallace GG, Keller J. High acetic acid production rate obtained by microbial electrosynthesis from carbon dioxide. Environmental Science & Technology, 2015, 49(22): 13566-13574. |
| [34] | Alvarez-Gallego Y, Dominguez-Benetton X, Pant D, Diels L, Vanbroekhoven K, Genné I, Vermeiren P. Development of gas diffusion electrodes for cogeneration of chemicals and electricity. Electrochimica Acta, 2012, 82: 415-426. DOI:10.1016/j.electacta.2012.06.096 |
| [35] | Jourdin L, Freguia S, Flexer V, Keller J. Bringing high-rate, CO2-based microbial electrosynthesis closer to practical implementation through improved electrode design and operating conditions. Environmental Science & Technology, 2016, 50(4): 1982-1989. |
| [36] | Ammam F, Tremblay PL, Lizak DM, Zhang T. Effect of tungstate on acetate and ethanol production by the electrosynthetic bacterium Sporomusa ovata. Biotechnology for Biofuels, 2016, 9(1): 163. DOI:10.1186/s13068-016-0576-0 |
| [37] | Si RW, Zhai DD, Liao ZH, Gao L, Yong YC. A whole-cell electrochemical biosensing system based on bacterial inward electron flow for fumarate quantification. Biosensors and Bioelectronics, 2015, 68: 34-40. |
