李盼盼1,2, 袁晓龙1, 李金海3, 申国明1, 高林1, 李青诚3, 高加明3, 张鹏1


1.中国农业科学院烟草研究所, 山东 青岛 266101;
2.中国农业科学院研究生院, 北京 100081;
3.中国烟草总公司湖北省公司, 湖北 武汉 430000
收稿日期:2018-03-28;修回日期:2018-05-08;网络出版日期:2018-07-17
基金项目:国家自然科学基金(31700295);湖北省烟草公司科技项目(027Y2017-006)
*通信作者:张鹏, Tel:+86-532-66715079, E-mail:zhangpeng@caas.cn
摘要:[目的]研究传统药用植物烟草(Nicotiana tabacum L.)内生真菌的丰富度,揭示其种群多样性和群落结构,为烟草内生真菌资源的有效利用奠定基础。[方法]采用组织分离法进行烟草内生真菌的分离,通过形态学和分子生物学相结合的方法进行菌株分类鉴定,以香农多样性指数及相对分离频率反映内生真菌物种多样性及分布规律。[结果]从不同组织部位、不同生长时期、不同海拔样地的健康烟草中共分离获得539株内生真菌,根据rDNA-ITS系统发育分析鉴定为31属73种,香农多样性指数为2.78,曲霉属Aspergillus和镰孢属Fusarium为优势菌群,其相对分离频率分别为22.63%和12.99%。其分布规律表现为茎部内生真菌的多样性高于叶部和根部;随着生育期的延长,内生真菌多样性逐步增多;随着海拔高度升高,内生真菌的种类和数量呈现降低的趋势。[结论]烟草内生真菌具有丰富的生物多样性,其分布表现出组织、生长时期、海拔高度专化性。阐明内生真菌在烟草中的分布规律,可以为烟草内生真菌在农业生产领域的开发应用提供科学依据。
关键词: 烟草 内生真菌 多样性 种群结构
Biodiversity and community structure of endophytic fungi isolated from Nicotiana tabacum L.
Panpan Li1,2, Xiaolong Yuan1, Jinhai Li3, Guoming Shen1, Lin Gao1, Qingcheng Li3, Jiaming Gao3, Peng Zhang1


1.Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, Shandong Province, China;
2.Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3.Hubei Provincial Tobacco Company of China National Tobacco Corporation, Wuhan 430000, Hubei Province, China
Received 28 March 2018; Revised 8 May 2018; Published online 17 July 2018
*Corresponding author: Peng Zhang, Tel: +86-532-66715079; E-mail: zhangpeng@caas.cn
Supported by the National Natural Science Foundation of China (31700295) and by the Technology Project of Hubei Tobacco Company (027Y2017-006)
Abstract: [Objective]In order to systematically investigate the richness of endophytic fungi derived from the medicinal plant Nicotiana tabacum L., and to reveal their biodiversity and community structures, the resource library of the tobacco endophytic fungi has been established, to provide a foundation for the development and effective use of the fungal endophytes.[Methods]The tobacco endophytic fungi were isolated by tissue separation method and identified with morphology and molecular biology methods. The Shannon index (H') and relative frequency (RF) were used to reflect the biodiversity and distribution of the tobacco endophytic fungi.[Results]A total of 539 strains were isolated under different tissues, developmental periods, and altitudes. According to morphological characteristics and rDNA-ITS sequences, they were identified as 73 taxa in 31 genera, of which the genera Aspergillus sp. and Fusarium sp. were confirmed as the dominant flora, with the relative frequency values of 22.63% and 12.99%, respectively. Meanwhile, the Shannon diversity index was 2.78, indicating considerable richness of the fungal endophytes. The diversity of the endophytic fungi in stems was higher compared with those of in roots and leaves. With the extension of the developmental period, the diversity of the fungal endophytes increased gradually, whereas the trend of the species diversity index of the fungal endophytes was downward with altitude.[Conclusion]Tobacco endophytic fungi have abundant biodiversity, and their distribution shows the specialization of tissues, developmental periods, and altitudes, respectively. To illustrate the distribution of endophytic fungi in tobacco will provide scientific basis for the development and application of the fungal endophytes in agricultural industry.
Keywords: tobacco endophytic fungi biodiversity community structure
植物内生真菌(plant endophyte)是指与植物体共存但不引起植物产生病害的一类真菌,其分布广泛,种类多样[1]。从其发现至今的100余年,内生真菌由于其自身及其代谢产物对宿主及微生态系统的良性作用受到广泛的关注[2]。内生真菌由于长期生活在植物体内的特殊生态环境中,在演化过程中与宿主发生协同进化,通过建立植物体-菌互作体系形成了互惠共生关系。一方面植物体生长发育过程中产生的营养成分可以供给内生真菌的生长需要,另一方面内生真菌通过合成次生代谢产物形成化学防御机制,在宿主的生长发育、抵御病害及系统演化等过程中发挥了重要的作用[3-4]。已有研究证明,内生真菌在植物体生长发育及在植物抗生物和非生物胁迫中发挥着积极作用,在植物生长促进剂、植物抗病性诱导剂、提高植物体对重金属的耐受性、降低重金属对植物的不良影响等方面具有显著作用[5]。
烟草(Nicotiana tabacum L.)属茄科草本植物,具有悠久的种植历史,其作为模式植物在遗传学、细胞学、育种学、形态学、有机物代谢等植物学领域发挥着积极作用。烟草作为传统的药用植物,蕴含着丰富的内生真菌资源[6]。作为烟田微生物生态系统的重要组成部分,烟草内生真菌在促进烟草生长、提高烟叶品质和抗逆性(抗病、抗重金属和干旱胁迫)等方面具有重要的作用。目前关于烟草内生真菌的研究已有一定基础,但主要集中在云南、河南2个植烟区[7-8]。如韩伟从云南烟草中分离获得内生真菌186株,鉴定为7属10种。在种群结构上,发现柑橘链格孢Alternaria citri是优势菌株,存在于烟草的整个生育期。而黑痣菌属的Phyllachora nicotiae和P. nicoticola仅分离于叶中,茎点霉属的Phoma epiccocina和P. pomorum只分离于茎中,具有组织专化性。在种群分布上,发现烟草内生真菌种群分布与生育期的延长呈正相关,成熟期的内生真菌数量最多,种类最丰富[7]。裴洲洋以河南省9个烟草品种为材料,共从中分离了977株菌株,鉴定为15属,发现内生真菌的分布与烟草生育期、烟草组织部位、年际变动均有一定相关[8]。在农业生产方面,烟草内生真菌对烟草生长的促生作用、生物防治作用、抗重金属作用等也有相关报道[8-9]。
本研究以湖北恩施州烟草为研究对象,进行烟草内生真菌多样性的探究。恩施州位于湖北省西南部(108°23′12″?110°38′08″E,29°07′10″? 31°24′13″N),是湖北省最大的烟叶产区,具有“烟草王国”的称号[10]。本研究对恩施州烟草中的内生真菌资源进行发掘,对其多样性及种群结构进行探究。深入研究烟草内生真菌多样性具有重要的科学意义,可为烟草内生真菌在农业生产上的应用提供资源,为开发内生真菌的生物学功能提供依据,也可为内生真菌与宿主互作的研究提供基础。
1 材料和方法 1.1 试验材料 烟草样品为普通栽培种云烟87,于2017年5月至8月采集于湖北恩施州。采用随机取样法采集不同组织部位(根、茎、叶)、不同生长时期(苗期、团棵期、旺长期、成熟期)、不同海拔样地(600、1000、1300 m)的健康烟株。每个样品采集数目 > 10株,分离的组织块 > 50块。样品采集后立即装入无菌袋中带回实验室4℃保存,并在24 h内进行内生真菌的分离。
1.2 内生真菌的分离纯化 将采集的样品在自来水下充分冲洗,除去表面的泥土。然后将冲洗的烟草组织按“75%乙醇(1 min) -2.5%次氯酸钠(30 s) -75%乙醇(1 min)”三步消毒法进行表面灭菌,之后用无菌水冲洗3遍。将组织切成0.5 cm×0.5 cm的小块,将切口插入含有0.5%氯霉素的PDA培养基上,28℃恒温培养箱内培养3?30 d。待培养基中组织切口处有菌丝长出,用灭菌的接种环挑取菌丝至新的PDA培养基上纯化直至获得纯培养[6]。已纯化的菌株置于40%的甘油中保存。为保证内生真菌分离的准确性,实验设置2组对照:(1)设置未经表面消毒的组织作为对照1,然后通过组织印迹法来检验表面消毒效果[6];(2)采用漂洗液检验法,取最后一次表面消毒的无菌水涂布到PDA培养基上培养作为对照2,验证表面消毒效果[4]。
1.3 内生真菌的分类鉴定 采用形态学和分子生物学相结合的方法进行菌种鉴定。在培养过程中,观察菌株的生长速度、菌落大小、质地、边缘等形态特征,及其分生孢子或菌丝体的显微结构特征。同时,采用CTAB法提取纯化菌株的基因组DNA[11],DNA完整性利用1%琼脂糖凝胶电泳进行检测,电泳条件:电压120 V,时间15?20 min;Maker:λDNA/Hind Ⅲ marker,DNA浓度和纯度利用Nanodrop检测。利用通用引物ITS1 (5′-TCCGTAGGTGAACCTGCG G-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增菌株的ITS序列。PCR扩增体系为:0.3 μL Taq DNA聚合酶(5 U/μL),5.0 μL Taq缓冲液(10×PCR buffer),3.0 μL MgCl2 (25 mmol/L),1.0 μL dNTPs (每种碱基各10 mmol/L),1.5 μL ITS1引物,1.5 μL ITS4引物,3.0 μL模板DNA,34.7 μL超纯水(pH 8.0)。PCR反应程序:95℃ 15 min;95℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min;25℃ 10 min,4℃保存。扩增成功的PCR产物纯化后经上海生工生物工程技术服务有限公司进行测序。将测序成功的ITS序列在NCBI上进行NR比对,搜索与PCR产物序列相似的序列片段,初步确定物种的分类地位。结合NCBI上已有的近缘物种的序列,使用DNAMAN工具对序列进行比对分析,根据相似度来判断其与已知序列的同源性。
1.4 数据统计分析 用香农多样性指数(H′)来反映烟草内生真菌物种多样性,用相对分离频率衡量某种内生真菌的优势度。香农多样性指数公式和相对分离频率公式分别如公式(1)、(2)所示。
 | 公式(1) |
 | 公式(2) |
2 结果和分析 2.1 烟草内生真菌的多样性及菌群组成 从湖北省恩施州采集的烟草不同组织部位(根、茎、叶)、不同生长时期(苗期、团棵期、旺长期、成熟期)、不同海拔样地(600、1000、1300 m)共分离到内生真菌539株,共鉴定为31属73种(表 1),香农多样性指数为2.78。基于属水平来看,曲霉属Aspergillus和镰孢属Fusarium为优势菌群,其相对分离频率分别为22.63%和12.99% (图 1);常见内生真菌13属,分别为刺盘孢属Colletotrichum、茎点霉属Phoma、链格孢属Alternaria、青霉属Penicillium、弯孢属Curvularia、附球菌属Epicoccum、拟盘多毛孢属Pestalotiopsis、踝节菌属Talaromyces、黑孢属Nigrospora、亚隔孢壳属Didymella、毛壳属Chaetomium、球座菌属Guignardia和木霉属Trichoderma;稀有内生真菌16属,分别为派伦霉属Peyronellaea、皮司霉属Pithomyces、半内果菌属Hamigera、色二孢属Diplodia、双极霉属Bipolaris、灵芝属Ganoderma、耐碱酵母属Galactomyces、棒孢属Corynespora、端梗孢属Acrophialophora、Setophoma (未检索到中文名称)、叶点霉属Phyllosticta、并头状菌属Syncephalastrum、梭孢壳属Thielavia、旋孢腔属Cochliobolus、枝孢属Cladosporium和被孢霉属Mortierella (表 2)。
表 1. 湖北烟草内生真菌种群组成 Table 1. The composition of tobacco endophytic fungi from Hubei province
| Order | Family | Genus | Species |
| Pleosporales | Pleosporaceae | Alternaria | 6 |
| Bipolaris | 1 | ||
| Curvularia | 4 | ||
| Cochliobolus | 1 | ||
| Pithomyces | 1 | ||
| Didymellaceae | Didymella | 3 | |
| Epicoccum | 2 | ||
| Phoma | 3 | ||
| Peyronellaea | 1 | ||
| Phaeosphaeriaceae | Setophoma | 1 | |
| Corynesporascaceae | Corynespora | 1 | |
| Botryosphaeriales | Botryosphaeriaceae | Phyllosticta | 1 |
| Diplodia | 1 | ||
| Guignardia | 1 | ||
| Glomerellales | Glomerellaceae | Colletotrichum | 5 |
| Trichosphaeriales | Trichosphaeriaceae | Nigrospora | 3 |
| Xylariales | Sporocadaceae | Pestalotiopsis | 2 |
| Hypocreales | Hypocreaceae | Trichoderma | 2 |
| Nectriaceae | Fusarium | 6 | |
| Sordariales | Chaetomiaceae | Chaetomium | 1 |
| Thielavia | 1 | ||
| Eurotiales | Aspergillaceae | Aspergillus | 12 |
| Penicillium | 4 | ||
| Hamigera | 1 | ||
| Trichocomaceae | Talaromyces | 3 | |
| Saccharomycetales | Dipodascaceae | Galactomyces | 1 |
| Polyporales | Polyporaceae | Ganoderma | 1 |
| Mortierellales | Mortierellaceae | Mortierella | 1 |
| Mucorales | Syncephalastraceae | Syncephalastrum | 1 |
| Capnodiales | Cladosporiaceae | Cladosporium | 1 |
| incertae sedi* | incertae sedi* | Acrophialophora | 1 |
| Total | 18 | 31 | 73 |
| *: indicates the classification is unidentified. | |||
表选项
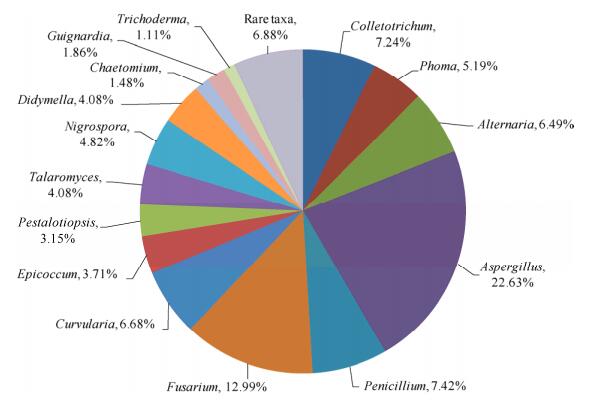 |
| 图 1 烟草内生真菌在属水平的优势度 Figure 1 Dominance of tobacco endophytic fungi in genus. |
| 图选项 |
表 2. 烟草常见内生真菌的相对分离频率 Table 2. Relative frequency (RF) of common endophytic fungi in Nicotiana tabacum (%, RF≥1%)
| Genera | 600 m | 1000 m | 1300 m | Total | ||||||||
| Root | Stem | Leaf | Root | Stem | Leaf | Root | Stem | Leaf | ||||
| Colletotrichum sp. | 0.93 | 0.74 | 2.23 | 0.19 | 0.37 | 1.86 | - | 0.37 | 0.56 | 7.24 | ||
| Phoma sp. | 0.19 | 1.30 | 1.67 | - | 0.56 | 0.56 | - | 0.56 | 0.37 | 5.19 | ||
| Alternaria sp. | 0.56 | 2.04 | 0.74 | - | 1.11 | 0.74 | - | - | 1.30 | 6.49 | ||
| Aspergillus sp. | 1.48 | 4.45 | 4.45 | 1.30 | 3.15 | 1.86 | 1.30 | 2.41 | 2.23 | 22.63 | ||
| Penicillium sp. | 0.74 | 1.48 | 0.37 | 0.74 | 0.93 | 0.56 | 1.11 | 1.11 | 0.37 | 7.42 | ||
| Fusarium sp. | 2.41 | 2.60 | - | 1.11 | 2.23 | 1.11 | 0.56 | 2.04 | 0.93 | 12.99 | ||
| Curvularia sp. | 1.48 | 0.93 | 0.37 | 0.74 | 1.30 | 1.11 | 0.19 | 0.37 | 0.19 | 6.68 | ||
| Epicoccum sp. | - | 0.93 | 0.74 | 0.19 | 1.30 | - | - | 0.56 | - | 3.71 | ||
| Pestalotiopsis sp. | - | 1.11 | 0.74 | - | 0.74 | 0.19 | - | 0.37 | - | 3.15 | ||
| Talaromyces sp. | - | 0.93 | 1.11 | - | 1.11 | 0.19 | 0.37 | 0.19 | 0.19 | 4.08 | ||
| Nigrospora sp. | 0.56 | 0.93 | 0.93 | 0.56 | 0.19 | 0.37 | 0.74 | 0.19 | 0.37 | 4.82 | ||
| Didymella sp. | 0.37 | 0.93 | 0.56 | 0.37 | 0.56 | 0.19 | - | 0.37 | 0.74 | 4.08 | ||
| Chaetomium sp. | - | 0.56 | 0.37 | - | - | 0.19 | - | 0.37 | - | 1.48 | ||
| Guignardia sp. | 0.19 | 0.37 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 0.19 | 1.86 | ||
| Trichoderma sp. | - | 0.37 | - | - | 0.56 | - | - | 0.19 | - | 1.11 | ||
| Rare taxa: Peyronellaea sp. (0.74%), Diplodia sp. (0.56%), Bipolaris sp. (0.56%), Corynespora sp. (0.56%), Acrophialophora sp. (0.56%), Mortierella sp. (0.56%), Pithomyces sp. (0.37%), Hamigera sp. (0.37%), Galactomyces sp. (0.37%), Setophoma sp. (0.37%), Phyllosticta sp. (0.37%), Syncephalastrum sp. (0.37%), Thielavia sp. (0.37%), Cladosporium sp. (0.37%), Ganoderma sp. (0.18%) and Cochliobolus sp. (0.18%). -: not detective. | ||||||||||||
表选项
2.2 不同组织部位烟草内生真菌的多样性 经分离纯化培养,从根中分离获得内生真菌118株,从茎中分离获得244株,叶中分离获得177株。在内生真菌的种类上,根部分离到内生真菌19个属,茎部分离到24个属,叶部分离到18个属(图 2)。在属水平的丰富度上,茎中内生真菌的丰富度最高。根的优势属为Aspergillus和Fusarium,茎和叶的优势属为Aspergillus。在常见属水平,根、茎、叶中内生真菌分别有12属、15属、14属,其中,Trichoderma仅存在于茎部。在稀有属方面,不同部位表现出一定的组织偏好性。其中,根部出现6个特有属,分别是Hamigera、Bipolaris、Ganoderma、Galactomyces、Setophoma、Mortierella;茎部出现5个特有属,分别是Pithomyces、Diplodia、Phyllosticta、Cochliobolus、Cladosporium;叶部仅出现1个特有属Thielavia。由烟草根、茎和叶组织的内生真菌种类分布表明,内生真菌的分布具有一定的组织偏好性,不同组织中内生真菌的种群结构具有一定的差异性。特别在稀有属方面,不同组织内的内生真菌均具有相应特有属。导致其出现的原因可能与不同组织所处生态位不同有关。根际土壤环境具有湿度高、光照低且有机质含量高的特点,而茎、叶所处环境具有紫外线强、营养物质匮乏的特点,因此导致其内生真菌种群结构存在显著差异[9]。
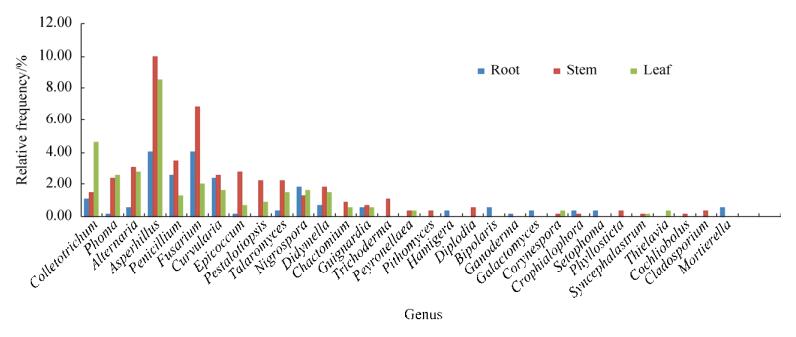 |
| 图 2 烟草不同组织内生真菌的多样性比较 Figure 2 The comparison of the diversity of the tobacco endophytic fungi in different tissues. |
| 图选项 |
2.3 不同生长时期烟草内生真菌的多样性 从分离获得的内生真菌数量上,苗期共分离得到72株内生真菌,团棵期分离到125株,旺长期分离到148株,成熟期分离到194株。从分离到的内生真菌的种属多样性上,苗期共分离到8个属,团棵期15个属,旺长期21个属,成熟期23个属(图 3)。其中,4个生育期的优势属均为Aspergillus。苗期分离到的8个属在团棵期、旺长期、成熟期均有出现。Curvularia、Pestalotiopsis、Talaromyces 3个属自团棵期至成熟期均有出现,而Nigrospora、Didymella、Guignardia 3个属仅出现在旺长期及成熟期,Trichoderma、Peyronellaea和Pithomyces 3个属仅出现在团棵期及旺长期。此外,除苗期外,团棵期、旺长期和成熟期均有特定属检出。Hamigera只存在于团棵期,Diplodia、Bipolaris、Ganoderma和Galactomyces 4个属只存在于旺长期,Corynespora等9个属只存在于成熟期(图 3)。以上研究表明,烟草内生真菌的分布随生育期的延长而发生变化,从烟草的苗期至成熟期,内生真菌的数量和菌群丰度均呈上升趋势。除苗期外,内生真菌在烟草不同生育期均存在特定属,表现出生长专化性。
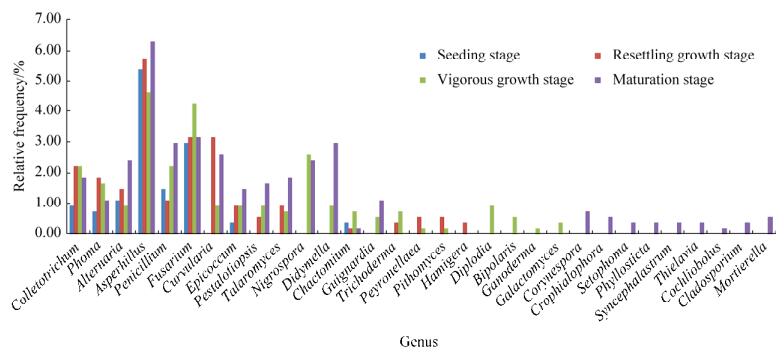 |
| 图 3 不同生长时期烟草内生真菌的多样性比较 Figure 3 The comparison of the diversity of tobacco endophytic fungi at different growth stages. |
| 图选项 |
2.4 不同海拔高度烟草内生真菌的多样性 如表 3所示,海拔高度600 m处分离得到252株内生真菌,1000 m处分离到165株内生真菌,而1300 m处仅分离到122株内生真菌。在属水平上,600 m海拔处共分离到内生真菌30个属,1000 m海拔处共分离到28个属,1300 m海拔处分离到22个属。3个海拔高度的优势菌群均为Aspergillus。600 m和1000 m海拔处均发现特定属,Syncephalastrum和Cochliobolus只在600 m海拔分离到,Ganoderm a只在1000 m海拔分离到。从香农多样性指数上看,内生真菌的丰富度随着海拔高度升高而呈降低趋势。
表 3. 不同海拔烟草内生真菌多样性比较 Table 3. The comparison of the diversity of the tobacco endophytic fungi under different altitudes
| Altitudes/m | Numbers | Genera | Common genera | Rare genera | Endemic genera | Shannon-Weiner |
| 600 | 252 | 30 | 15 | 15 | 2 | 1.63 |
| 1000 | 165 | 28 | 15 | 13 | 1 | 1.20 |
| 1300 | 122 | 22 | 15 | 7 | 0 | 0.95 |
| Total | 539 | 31 | 15 | 16 | 3 | 2.78 |
表选项
3 讨论 植物内生真菌种类丰富,数量庞大,并且与其宿主植物之间具有紧密、特别的生态关系,目前在已知的所有植物中均发现了内生真菌的存在,内生真菌的种属多样性和生存的普遍性为内生真菌的研究提供了基础。目前研究者已对多种药用植物中的内生真菌进行了多样性分析,如杨瑞先等对芍药(Paeonia lactiflora Pall.)内生真菌的种群多样性进行了分析,分离获得了52株内生真菌,隶属于7目、13科、15属,发现小球腔菌属Leptosphaeria、土赤壳属Ilyonectria和镰孢属Fusarium为优势种群[4];谢华蓉等对广藿香各部位内生真菌的类群结构及多样性进行了分析,共分离获得313株内生真菌,隶属于30个属,其中链格孢属、拟茎点霉属和炭疽菌属为优势类群[12];伍晓丽等从玄参不同组织部位中(根、主茎、侧枝、叶片)分离内生真菌,并进行了种群多样性分析,共分离得到内生真菌58株,其优势属为刺盘孢属Colletotrichum[13]。深入研究植物内生真菌多样性和种群结构具有重要的科学意义和应用价值,可以为植物内生真菌在农业生产上的应用提供资源,为开发内生真菌的生物学功能提供依据,也可为内生真菌与宿主互作及机制的研究提供基础。
烟草作为传统的药用植物,其内生真菌的研究相对较少且不系统,目前仅有云南、河南2个植烟区的研究。由于地理环境因素不同,云南、河南省烟草内生真菌的种类和分布特征完全不同,据此推测湖北省烟草内生真菌多样性可能会与其他省之间存在差异。因此,本研究选取湖北恩施州的烟草进行了内生真菌的分离,并选取不同组织、不同生长时期和不同海拔高度作为生理及生态因素,系统研究不同因素下烟草内生真菌的分布规律,发现其分布随着组织部位、生育期、海拔高度的不同均表现出一定的专化性。该分布规律与云南、河南产区烟草内生真菌的分布相似,但是在优势属方面存在特异性。在湖北产区,Aspergillus和Fusarium为优势菌群;在河南产区,Alternaria和Chaetomium为优势属;云南产区,Phoma、Alternaria和Fusarium 3个属为优势菌群。以上研究表明,内生真菌的分布同时具有地域专化性,其优势菌群随着地理环境的变化而改变。
目前关于烟草内生真菌的研究结果均表明,内生真菌在烟草组织中的分布存在组织专化性[8-9]。在同一海拔水平,烟草根、茎、叶的内生真菌多样性也存在差异。已有研究结果表明,在河南产区,烟草内生真菌分布规律表现为叶中种类和数量最多,其次为茎,根最少。本研究中,湖北产区烟草内生真菌在属水平的丰富度上,呈现出茎 > 叶 > 根,表现出一定的地域特性。并且综合不同的海拔高度,发现根、茎、叶中都不同程度地分离到特有属,也反映了内生真菌的分布具有组织偏好性。
烟草不同生育期的内生真菌多样性存在较大差异。有的菌群在整个生育期都存在,而有的菌群只出现在某一段生育期。有研究表明,内生菌群在植物体内的定殖、生长、繁殖、代谢等受到宿主的影响[14]。目前推测原因有三方面:一是当某一生育期的植株体内环境不能满足菌群的需要时,内生菌就无法实现在植株中的定殖;二可能是随着生育期的延长,烟株体内处于相对优势的菌群逐渐占据绝对优势,部分内生真菌处于竞争弱势而无法生存;三是在长期的进化过程中,烟草不同生育阶段与不同的菌株建立了互利共生关系,更利于自身的生长发育。而以上推测目前尚缺乏试验证明。本研究中,在烟草的团棵期、旺长期、成熟期均分离到了特有属,说明在生育期上,内生真菌也具有生长时期专化性。
植物内生真菌的一条重要来源途径是根际真菌通过植物侧根的裂缝进入植物中[14],经过长期的协同进化作用,与宿主植物建立了和谐的共生关系,即成为内生真菌。研究表明,随着海拔升高,土壤微生物群落香农多样性指数和丰富度指数呈下降趋势[15-16]。本实验中,3个海拔高度的内生真菌多样性存在差异,且随着海拔的上升,丰富度呈下降的趋势,可能与土壤中微生物群落的减少有关。并且,土壤的理化性质也会随着海拔的升高发生变化[17-18],从而影响到根际土壤中微生物菌群的种类[19],所以在不同海拔高度均有特有属的出现。
4 结论 烟草内生真菌具有丰富的生物多样性,从不同组织部位、不同生长时期、不同海拔样地的健康烟株中分离到539株内生真菌,鉴定为31属73种。其中,Aspergillus和Fusarium为优势菌群,其相对分离频率分别为22.63%和12.99%;常见内生真菌13属,稀有内生真菌16属。内生真菌的分布随着组织部位、生育期、海拔高度的不同均表现出专化性。不同组织中的内生真菌多样性表现为茎 > 叶 > 根,表现出组织偏好性;随着生育期的延长,内生真菌的丰富度呈增加的趋势,并且除苗期外,内生真菌在烟草不同生育期均存在特定属,表现出生长专化性;随着海拔的升高,分离到的内生真菌的丰富度降低。不同组织、不同生育期、不同海拔中内生真菌的多样性差异主要体现在稀有属上,表明特定的内生真菌在宿主的定殖上具有选择性。该选择性可能与特定内生真菌的生物学功能或者生理活性有关,其活性及与宿主的相关关系值得深入探究。
References
| [1] | Aly AH, Debbab A, Proksch P. Fungal endophytes:unique plant inhabitants with great promises. Applied Microbiology and Biotechnology, 2011, 90(6): 1829-1845. DOI:10.1007/s00253-011-3270-y |
| [2] | Song YL, Wu P, Li YF, Tong XX, Zheng YF, Chen ZH, Wang LL, Xiang TH. Effect of endophytic fungi on the host plant growth, expression of expansin gene and flavonoid content in Tetrastigma hemsleyanum Diels & Gilg ex Diels. Plant and Soil, 2017, 417(1/2): 393-402. |
| [3] | Guo LD. Advances of researches on endophytic fungi. Mycosystema, 2001, 20(1): 148-152. (in Chinese) 郭良栋. 内生真菌研究进展. 菌物系统, 2001, 20(1): 148-152. DOI:10.3969/j.issn.1672-6472.2001.01.029 |
| [4] | Yang RX, Zhang L, Peng BB, Meng CG. Fungal endophytes in Paeonia lactiflora and their secondary metabolites. Acta Microbiologica Sinica, 2017, 57(10): 1567-1582. (in Chinese) 杨瑞先, 张拦, 彭彪彪, 蒙城功. 芍药内生真菌的鉴定及产生活性次生代谢产物的评估. 微生物学报, 2017, 57(10): 1567-1582. |
| [5] | Rodriguez RJ, White Jr JF, Arnold AE, Redman RS. Fungal endophytes:diversity and functional roles. New Phytologist, 2009, 182(2): 314-330. DOI:10.1111/j.1469-8137.2009.02773.x |
| [6] | Li PP, Yuan XL, Zheng X, Gao L, Liu XM, Zhang ZF, Zhang P, Shen GM. The biodiversity of endophytic fungi in Nicotiana tabacum and their cytotoxicity. Chinese Tobacco Science, 2017, 38(3): 74-79. (in Chinese) 李盼盼, 袁晓龙, 郑璇, 高林, 刘新民, 张忠锋, 张鹏, 申国明. 烟草内生真菌多样性及其细胞毒活性初步研究. 中国烟草科学, 2017, 38(3): 74-79. |
| [7] | 韩伟. 云南烟草内生真菌生物多样性初步研究. 山东农业大学硕士学位论文, 2004. http://journals.im.ac.cn/html/actamicrocn/2018/10/%20//cdmd.%20cnki.%20com.%20cn/Article/CDMD-10434-2004121149.%20htm |
| [8] | 裴洲洋. 烟草内生真菌种群多样性及烟草赤星病生防内生菌的筛选. 河南农业大学硕士学位论文, 2009. http://journals.im.ac.cn/html/actamicrocn/2018/10/%20//cdmd.%20cnki.%20com.%20cn/Article/CDMD-10466-2009255466.%20htm |
| [9] | Jin HQ, Cheng CH, Xu QQ, Li XJ, Liu HY, Mao LJ, Liu N, Feng XX, Lin FC, Zhang CL. Effects of endophytic fungi on tobacco growth and heavy metal content in leaves. Mycosystema, 2017, 36(2): 186-192. (in Chinese) 金慧清, 程昌合, 徐清泉, 李信军, 刘宏玉, 毛黎娟, 刘凝, 冯晓晓, 林福呈, 章初龙. 烟草内生真菌对烟草生长和烟叶重金属含量的影响. 菌物学报, 2017, 36(2): 186-192. |
| [10] | Li YY, Liu HL, Wang L, Zhu B, Huang JB, Xu RB, Li XH. Pathogenicity of Ralstonia solanacearum infecting tobacco in Enshi of Hubei province. Chinese Tobacco Science, 2015, 36(5): 59-63. (in Chinese) 黎妍妍, 刘海龙, 王林, 朱宝, 黄俊斌, 许汝冰, 李锡宏. 湖北恩施烟区烟草青枯菌致病力分析. 中国烟草科学, 2015, 36(5): 59-63. |
| [11] | Huang J, Ge X, Sun M. Modified CTAB protocol using a silica matrix for isolation of plant genomic DNA. BioTechniques, 2000, 28(3): 432, 434. |
| [12] | Xie HR, Xu ZC, Liu J, Shi YN, Yuan BH, Deng ZJ. Diversity and the antagonistic activities of endophytic fungi from patchouli against Ralstonia solanacearum. Microbiology China, 2017, 44(5): 1171-1181. (in Chinese) 谢华蓉, 徐在超, 刘军, 史亚楠, 袁保红, 邓祖军. 广藿香内生真菌多样性及其对青枯菌的拮抗活性. 微生物学通报, 2017, 44(5): 1171-1181. |
| [13] | Wu XL, Song XH, Yang HG, Liu F, Zhang X, Liu JL, Chen DX, Li LY. Identification and phylogenetic analysis of endophytic fungi isolated from Scrophularia ningpoensis. China Journal of Chinese Materia Medica, 2017, 42(5): 902-911. (in Chinese) 伍晓丽, 宋旭红, 杨宏国, 刘飞, 张雪, 刘金亮, 陈大霞, 李隆云. 玄参内生真菌分离、鉴定及系统发育分析. 中国中药杂志, 2017, 42(5): 902-911. |
| [14] | Yao LA, Hu ZB, Wang LL, Zhou JY, Li WK. Research development of the relatioship between plant endophyte and host. Ecology and Environmental Sciences, 2010, 19(7): 1750-1754. (in Chinese) 姚领爱, 胡之璧, 王莉莉, 周吉燕, 黎万奎. 植物内生菌与宿主关系研究进展. 生态环境学报, 2010, 19(7): 1750-1754. DOI:10.3969/j.issn.1674-5906.2010.07.042 |
| [15] | Song XC, Guo LM, Tian HD, Deng XJ, Zhao LS, Cao JZ. Variation of soil microbial community diversity along an elevational gradient in the Mao'er Mountain forest. Acta Ecologica Sinica, 2017, 37(16): 5428-5435. (in Chinese) 宋贤冲, 郭丽梅, 田红灯, 邓小军, 赵连生, 曹继钊. 猫儿山不同海拔植被带土壤微生物群落功能多样性. 生态学报, 2017, 37(16): 5428-5435. |
| [16] | Han DX, Wang N, Wang NN, Sun X, Feng FJ. Soil microbial functional diversity of different altitude Pinus koraiensis forests. Chinese Journal of Applied Ecology, 2015, 26(12): 3649-3656. (in Chinese) 韩冬雪, 王宁, 王楠楠, 孙雪, 冯富娟. 不同海拔红松林土壤微生物功能多样性. 应用生态学报, 2015, 26(12): 3649-3656. |
| [17] | Gu XN, He HS, Tao Y, Jin YH, Zhang XY, Xu ZW, Wang YT, Song XX. Soil microbial community structure, enzyme activities, and their influencing factors along different altitudes of Changbai Mountain. Acta Ecologica Sinica, 2017, 37(24): 8374-8384. (in Chinese) 谷晓楠, 贺红士, 陶岩, 靳英华, 张心昱, 徐志伟, 王钰婷, 宋祥霞. 长白山土壤微生物群落结构及酶活性随海拔的分布特征与影响因子. 生态学报, 2017, 37(24): 8374-8384. |
| [18] | Bangroo SA, Najar GR, Rasool A. Effect of altitude and aspect on soil organic carbon and nitrogen stocks in the Himalayan Mawer Forest Range. CATENA, 2017, 158: 63-68. DOI:10.1016/j.catena.2017.06.017 |
| [19] | Zhang L, Wang A, Yang WQ, Xu ZF, Wu FZ, Tan B, Liu Y, Chen LH. Soil microbial abundance and community structure vary with altitude and season in the coniferous forests, China. Journal of Soils and Sediments, 2017, 17(9): 2318-2328. DOI:10.1007/s11368-016-1593-0 |
