张智猛1, 慈敦伟1, 张冠初1,2, 丁红1, 杨吉顺1, 戴良香1

 , 张岱3
, 张岱3

1.山东省花生研究所, 山东 青岛 266100;
2.沈阳农业大学农学院, 辽宁 沈阳 110866;
3.河北农业大学植物保护学院, 河北 保定 071001
收稿日期:2016-08-25;修回日期:2016-11-09;网络出版日期:2016-12-02
基金项目:“十三五”国家科技支撑计划(2014BAD11B04-03);山东省现代农业产业技术体系创新团队岗位专家(花生)(SDAIT-04-06);山东省农业重大应用技术创新课题(2014);山东省自主创新专项基金(2014ZZCX07401-12)
*通信作者:戴良香, Tel: +86-532-87632131; E-mail: liangxiangd@163.com
张岱, E-mail: adaiadai1987@163.com
摘要: [目的]以不同含盐量的滨海盐土、内陆盐碱土和中等肥力非盐碱土壤为实验对象,探讨花生种子在吸水膨胀与萌发过程中,不同类型盐碱土对种子际土壤微生物多样性变化的影响。[方法]采集不同含盐量的滨海盐土、内陆盐碱土和中等肥力非盐碱土壤,通过对各样品中细菌的16S rRNA基因的V3-V4区进行PCR扩增,利用Illumina Hiseq高通量测序技术对12份V3-V4高变区PCR产物进行测序,并对测序数据进行生物信息学分析。[结果](1)盐碱土壤的种子际细菌群落多样性高于非盐碱土壤,且以东营青坨滨海盐土种子际土壤细菌群落多样性较高。(2)不同类型土壤样本微生物群落结构在纲水平存在明显差异。4种土壤类型种子际土壤细菌共分属于6个菌纲,分别为Proteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes菌纲,并均以Proteobacteria和Actinobacteria菌纲为主要菌纲。全样本菌落结构分析结果表明,4种类型土壤中不同吸胀时间内种子际微生物菌落在门、属水平上的类型和丰度差异最为显著(P < 0.05)。(3)beta多样性分析和各样本遗传距离(phylogenetic distances)聚类树图分析表明,4个土壤类型的12个土壤样本种子际土壤中微生物群落均可聚为2大类。[结论]土壤含盐量越高其种子际土壤细菌群落多样性较高。不同类型土壤样本微生物群落结构在纲水平存在明显差异,以Proteobacteria和Actinobacteria菌纲为主要菌纲。种子吸胀萌发时间影响种子际微生物菌落在门、属水平上的类型和丰度,但对相同土壤类型样本间遗传距离无影响。
关键词: 花生 盐碱土 种子萌发 种子际 细菌多样性 lllumina Hiseq高通量测序
Diversity of microbial community structure in the spermosphere of saline-alkali soil in shandong area
Zhimeng Zhang1, Dunwei Ci1, Guanchu Zhang1,2, Hong Ding1, Jishun Yang1, Liangxiang Dai1

 , Dai Zhang3
, Dai Zhang3

1.Shandong Peanut Research Institute, Qingdao 266100, Shandong Province, China;
2.College of agriculture, Shenyang Agricultural University, Shenyang 110866, Liaoning Province, China;
3.College of plant protection, Agricultural University of Hebei, Baoding 071001, Hebei Province, China
Received 25 August 2016; Revised 09 November 2016; Published online 02 December 2016
*Corresponding author: Liangxiang Dai, Tel: +86-532-87632131; E-mail: liangxiangd@163.com
Dai Zhang, E-mail: adaiadai1987@163.com
Supported by the Subject of National Key Technology Research and Development Program of the Thirteenth Five-year Plan (2014BAD11B04-03), by the Shandong Province Modern Agricultural Technology System Innovation Team of Experts Jobs (peanuts) (SDAIT-04-06), by the Shandong Agricultural Technology Innovation Significant Application Issues (2014) and by the Shandong Province Innovation Special Fund (2014ZZCX07401-12)
Abstract: [Objective]Three soil types in different salt contents were taken as the experiment objectives. We evaluated the effect of various saline alkali soil types on diversity of bacterial community structure in spermosphere soil during water absorption and germination of peanut seeds.[Methods]The V3-V4 region of 16S ribosomal RNA genes was amplified using PCR, and the PCR products were then analyzed using Illumina high-throughput sequencing technology.[Results](1) The diversity of soil bacterial community in saline alkali soil was higher than that in non-saline alkali soil. Especially, the highest diversity was in spermosphere soil from Qingtuo. (2) The microflora structures in different soils were distinct at the class level. Soil bacteria in four samples were classified into six classes, including Proteobacteria, Actinobacteria, Actinobacteria, Bacteroidetes, Acidobacteria and Firmicutes. Proteobacteria and Actinobacteria groups were dominant in colonies. The analysis of whole samples colony structure showed that the difference of type and abundance at phylum and genus level during different adsorption time was most significant (P < 0.05). (3) The analysis of beta diversity and phylogenetic distances of constructed phylogenetic trees revealed that the sequenced clones fell into two major groups within the domain bacteria.[Conclusion]The diversity of bacteria community compositions in the high salt content soil was higher. There were obvious differences in microbial community structure of different soil types at class level, primarily in the Proteobacteria and Actinobacteria. The type and abundance of microbial colonies at both phylum and genus levels were affected by the seed germination time. However, there was no influence on the genetic distance between the samples from the same soil type.
Key words: peanut saline-alkali soil seed germination spermosphere bacterial diversity lllumina Hiseq high-throughput sequencing
种子萌发是一个复杂的多步骤过程,容易受到机械伤害、病害和环境胁迫的影响,也被认为是植物生活周期中最重要和最脆弱的阶段,对于一年生和二年生植物,种子的成功萌发更为重要。种子萌发起始于水分吸收 (吸胀),结束于胚轴的伸出,通常是胚根突破周围结构,为随后的幼苗生长做准备[1-2]。种子萌发过程中种子内部产生的吸胀作用、呼吸作用与能量产生、DNA和蛋白质的修复等重要生理变化、差异蛋白质组分析以及萌发过程中下胚轴-胚根细胞的伸长、代谢活性的迅速增加等关键事件的发生发展与种子外部土壤微域环境相辅相成,环境变更或管理分异对土壤微域结构的影响以及微域环境对土壤微生物多样性的调控都是非常重要的因素[3]。
“种子际”是指距离种子表面1–10 mm内受到种子萌发影响的区域[4],是种子萌发过程中形成的微生物活跃区域,富于微生物群落的形成和功能的瞬时演替特性,对根际微生物的定殖和植物的生长发育具有独特的生态学意义[5]。种子际固有微生物群落是种子微生物生态的重要组成部分,它们与种子萌发过程的分泌物和土壤微生物群落密切相关。种子萌发过程中有机物的分泌释放是植物与病原微生物以及土壤微生物之间相互作用主要的驱动力[6-7]。由于盐碱土壤的有机质含量、酸碱度、水分及土壤母质的不同,与此环境相适应的土壤微生物种类各异,加之盐碱胁迫危害,缺苗断垄是盐碱地作物生产中常见的现象,也是限制作物高产高效的重要制约因素。花生属中等耐盐作物,苗全、苗齐是盐碱地花生高产高效的重要环节。花生种子较大,单粒种子约是小麦、玉米种子的18–45倍和2–6倍,是耐盐碱作物谷子、高粱种子的256–466倍和30–50倍,其萌发出苗历时长、吸水量大、种子与种子际土壤环境密切,开展盐碱土花生种子吸水萌发过程中种子际土壤微生物多样性、菌群结构和功能的研究具有重要意义。以往关于土壤微生物与种子萌发的研究多集中在土壤灭菌、不同类型细菌、链霉菌等对种子萌发、幼苗生长和土壤微生物的影响,以及种子内生菌类群等方面[8-13],但有关盐碱地花生种子吸水萌发过程中种子际土壤微生物菌群变化的研究鲜见报道,为此,本试验以不同类型盐碱土壤和非盐碱土壤为对象,利用lllumina Hiseq高通量测序技术 (基于边合成边测序原理) 直接从土壤中提取总DNA,构建细菌16S rRNA基因克隆文库,对盐碱地花生种子吸水萌发过程中种子际土壤微生物的菌群结构比较分析,旨在为进一步了解盐碱土壤微生物多样性、结构和功能以及盐碱地花生保全苗、促早发和建立盐碱地高产优质栽培技术规程提供理论依据。
1 材料和方法 1.1 土样采集 盐碱地土壤样品分别采自山东省东营市利津县汀罗镇毛坨村、垦利县青坨村和聊城高唐,非盐碱土壤采自山东省花生研究所莱西试验站。其中山东省东营市利津县汀罗镇毛坨村、垦利县青坨村和聊城高唐的土壤类型均为潮土类盐化潮土亚类、青岛莱西土壤类型为褐土类潮褐土亚类,东营市利津县和垦利县均属黄河三角洲地区滨海盐碱土区,土壤盐渍化明显,而聊城高唐土壤为内陆盐碱土壤,次生盐渍化强烈,莱西土壤则为非盐碱土壤。利津县汀罗镇毛坨村和垦利县青坨村盐碱土壤前茬均为棉花,聊城高唐的土壤和莱西土壤前茬均为玉米。各土壤样本盐分含量、有机质含量和pH值如表 1。供试花生品种为大花生品种花育25号,百仁重102.5 g。
表 1. 供试土壤样品性状与处理 Table 1. Characteristics and treatment of soil samples for test
| Sampling sites | Water absorption and seed dilation time | Salt contents in soil/(g/kg) | Organic contents in soil/(g/kg) | pH | ||
| 24 h | 48 h | 72 h | ||||
| Maotuo, Dongying (东营毛坨) | HSS1 | HSS5 | HSS9 | 1.54 | 5.49 | 8.70 |
| Laixi, Qingdao (青岛莱西) | HSS2 | HSS6 | HSS10 | 0.68 | 12.39 | 7.65 |
| Gaotang, Liaocheng (聊城高唐) | HSS3 | HSS7 | HSS11 | 2.28 | 10.57 | 8.80 |
| Qingtuo, Dongying (东营青坨) | HSS4 | HSS8 | HSS12 | 3.54 | 8.03 | 8.55 |
表选项
将风干后的土壤过3 mm筛后分别装入高12 cm、内径10 cm同批次、同重量塑料盆,每盆装土量780 g,每种土壤装15盆,之后每盆中浇入同等体积的水,使土壤含水量刚好控制在田间持水量范围内,人工气候室内自然蒸发至土壤含水量为60%–70%时进行播种。每盆播种10粒花生种子,每粒种子间距控制在1 cm,播深一致控制在3 cm。于播种后2 h计为种子吸水膨胀开始并计时,东营毛坨、莱西青岛、聊城高唐和东营青坨各样品于吸水膨胀24 h时采集的种子际周围样品编号分别为HSS1、HSS2、HSS3、HSS4,48 h和72 h采集种子际周围土壤样品依次编号为HSS5、HSS6、HSS7–HSS12 (表 1)。每次采集5盆即5个重复,将采集的5个重复的样品混匀,装入无菌袋中,置于?20 ℃冰箱保存备用。低温保存土壤样品由北京诺赛基因公司进行测定。
1.2 土壤DNA提取 收集所得土壤样品利用OMEGA土壤总DNA提取试剂 (OMEGA soil DNA kit) 盒进行提取。所得DNA采用1.5%琼脂糖凝胶电泳和Nanodrop 2000分光光度计检测DNA的纯度和浓度。
1.3 16S rRNA文库构建及高通量测序 稀释后的基因组DNA利用引物340F:CCTACGGGNBGCASCAG以及805R:GACTAC NVGGGTATCTAATCC对16S rRNA基因的V3-V4区进行扩增。扩增程序如下:95 ℃预变性3 min;30个循环包括 (95 ℃ 30 s;50 ℃ 30 s;72 ℃ 60 s);72 ℃ 7 min。PCR产物使用1.5%浓度的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等浓度混样,充分混匀后使用0.5×TBE浓度1.5%的琼脂糖胶电泳纯化PCR产物,回收目标条带。产物纯化试剂盒使用的是QIAGEN公司的MinElute胶回收试剂盒。最后使用HiSeq2500进行250PE测序。
1.4 生物信息学分析 测序得到的原始数据 (Raw Data),存在一定比例的干扰数据 (Dirty Data),为了使信息分析的结果更加准确、可靠,使用SOAPdenovo对原始数据进行拼接、过滤,得到有效数据 (Clean Data)。
然后基于有效数据进行OTUs (Operational taxonomic units) 聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度、多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。最后在以上分析的基础上,可以进行一系列的基于OTUs、物种组成的聚类分析,PCoA和PCA统计比较分析,挖掘样品之间的物种组成差异,并结合环境因素进行关联分析。
2 结果和分析 2.1 样本的有效序列数据量 对所得原始测序序列进行过滤后发现,供试样本有效序列条数在86211–179138间,HSS6样品有效序列条数最小,HSS12样品最大,12个样本的有效序列条数总和为1592117 (表 2)。样品序列平均长度相近,在437.76–451.83 bp。
表 2. 土壤样本的有效序列统计 Table 2. Statistics results of effective sequences for twelve soil samples
| Item | Sampling sites | Water absorption and seed dilation time | ||
| 24 h | 48 h | 72 h | ||
| The original data log | Maotuo, Dongying (东营毛坨) | 189358 | 137057 | 155135 |
| Laixi, Qingdao (青岛莱西) | 159317 | 108222 | 168808 | |
| Gaotang, Liaocheng (聊城高唐) | 160090 | 160140 | 140259 | |
| Qingtuo, Dongying (东营青坨) | 222039 | 147991 | 216381 | |
| Data log after quality control | Maotuo, Dongying (东营毛坨) | 161242 | 116879 | 126806 |
| Laixi, Qingdao (青岛莱西) | 135999 | 91076 | 134179 | |
| Gaotang, Liaocheng (聊城高唐) | 136420 | 136035 | 114611 | |
| Qingtuo, Dongying (东营青坨) | 183924 | 127688 | 179138 | |
| Number of sequences | Maotuo, Dongying (东营毛坨) | 153999 | 111253 | 126806 |
| Laixi, Qingdao (青岛莱西) | 128685 | 86211 | 134179 | |
| Gaotang, Liaocheng (聊城高唐) | 129979 | 129327 | 114611 | |
| Qingtuo, Dongying (东营青坨) | 175789 | 122140 | 179138 | |
| Average length | Maotuo, Dongying (东营毛坨) | 450.37 | 451.02 | 450.96 |
| Laixi, Qingdao (青岛莱西) | 443.25 | 451.83 | 437.76 | |
| Gaotang, Liaocheng (聊城高唐) | 450.79 | 448.76 | 450.44 | |
| Qingtuo, Dongying (东营青坨) | 446.03 | 450.98 | 451.18 | |
表选项
2.2 Alpha多样性分析 Alpha多样性 (alpha diversity or α diversity) 是指单个样本的多样性。Alpha多样性指标包括丰富度指数 (Chao1、ACE)、多样性指数 (Shannon、Simpson)、覆盖率 (Goods_coverage) 和样品中OTU的个数 (Observed_species) 等,不同的多样性指数反映土壤微生物群落功能多样性的不同方面。
2.2.1 稀释曲线: 稀释曲线是利用已测得16S rRNA序列中已知的各种OTU的相对比例,来计算抽取n个读长 (reads) 时出现OTU数量的期望值,然后根据一组n值与其相对应的OTU数量的期望值 (此处采用Chao1算法估计),利用R软件做出曲线。当曲线趋于平缓或者达到平台期时也就可以认为测序深度已经基本覆盖到样品中所有的物种;反之,则表示样品中物种多样性较高,还存在较多未被测序检测到的物种。检测结果表明,12个土壤样本的稀释曲线均近乎同时趋于平缓,但样品HSS3、HSS7和HSS11到达平台期的chao1丰富度指数低于其他样本。表明再增加12个土壤样本的测序量 (横坐标),对OTU数 (纵坐标) 的增长贡献不大,说明测序量足够,已经基本覆盖到样品中所有的物种。各样品chao1值以样品HSS3、HSS7和HSS11较低,在13244.71以下,其样本中物种多样性相对较低;而以HSS4、HSS8、HSS9的chao1值较高,在15146.33和15453.63之间,其样本中物种多样性较丰富 (表 3)。毛坨种子际土壤Chao1值随种子吸水膨胀萌发时间延长增大,而青坨土壤Chao1值则减小,莱西和高唐土壤变化各异。: 表 3. 各种子际土壤样品Alpha多样性指标计算结果 Table 3. Alpha diversity index calculation results of different samples in spermosphere soil
| Soil samples | Good_coverage | Chaol | ACE | Shannon | Simpson | Observed_species |
| HSS1 | 0.9528 | 14636.77 | 15241.22 | 11.1535 | 0.9986 | 9765 |
| HSS2 | 0.9401 | 13971.60 | 15078.84 | 11.2691 | 0.9987 | 9404 |
| HSS3 | 0.9592 | 12893.65 | 13293.21 | 10.6262 | 0.9967 | 8690 |
| HSS4 | 0.9537 | 15453.63 | 15721.09 | 11.3426 | 0.9987 | 10208 |
| HSS5 | 0.9548 | 15037.81 | 15353.34 | 11.1200 | 0.9984 | 9890 |
| HSS6 | 0.9422 | 13962.05 | 14690.46 | 11.3368 | 0.9987 | 9532 |
| HSS7 | 0.9591 | 13244.71 | 13648.16 | 10.8339 | 0.9975 | 9001 |
| HSS8 | 0.9545 | 15156.22 | 15611.13 | 11.3614 | 0.9989 | 10355 |
| HSS9 | 0.9538 | 15146.33 | 15463.42 | 11.2314 | 0.9987 | 9978 |
| HSS10 | 0.9482 | 14076.41 | 14590.49 | 11.3918 | 0.9988 | 9733 |
| HSS11 | 0.9598 | 13217.67 | 13530.35 | 10.8156 | 0.9978 | 8833 |
| HSS12 | 0.9561 | 15087.89 | 15653.27 | 11.5014 | 0.9991 | 10526 |
表选项
2.2.2 Shannon-Wiener指数: 利用各样本在不同的测序量时微生物多样性指数构建曲线,以此来反映各样本的物种多样性随着测序量的变化情况。如果每一个体都属于不同的种,多样性指数就最大,反之最小。结果显示,各样品Shannon指数以样品HSS3、HSS7和HSS11较小,在10.63和10.83之间,其样本群落多样性较少;而以HSS4、HSS8、HSS10和HSS12的Shannon指数较高,在11.34和11.50之间,其样本群落多样性较丰富 (表 3)。聊城高唐内陆盐碱土花生种子际土壤细菌群落多样性较小,而东营青坨土壤种子际土壤细菌群落多样性较大,尤以种子吸胀72 h后种子际土壤细菌群落多样性最大。莱西土壤和青坨土壤种子际土壤细菌群落多样性随种子吸胀萌发时间延长表现增大趋势。:
2.2.3 Simpson指数: Simpson指数是用来估算样品中微生物多样性指数之一,其取值区间是0–1,当样品中只有一个物种时 (即所有序列都代表同一个物种),值为0;当样品中各物种均匀分布时,值为1,此时样本中物种多样性最大。Simpson指数值越大,越均匀,群落多样性越高。结果显示,各样品simpson指数均在0.996以上,接近于1,但样品HSS3、HSS7和HSS11的simpson指数相对较小,均在0.998以下,而HSS10、HSS8和HSS12的simpson指数相对较高,分别为0.9988、0.9989和0.9991。HSS10、HSS8和HSS12样品的群落多样性较高,除毛坨盐碱土外,青坨、高唐盐碱土和莱西非盐碱土种子际土壤simpson指数均随种子吸水膨胀萌发时间延长而增大。:
2.2.4 ACE、coverage和observed_species指标: 表 3看出,以HSS3、HSS7和HSS11样品文库覆盖率 (Goods_coverage) 较高,均在0.959以上,HSS2、HSS6和HSS10样品文库覆盖率在0.950以下,表明HSS3、HSS7和HSS11样品中序列绝大多数被测出,其中序列未被测出的概率较低。各样品菌落丰富度指数 (ACE) 和QTU个数 (Observed_species) 均以HSS3、HSS7和HSS11较低,其ACE在13648.16以下、QTU个数在8689和9001间,样本中物种种类相对较少;而HSS4、HSS8、HSS12的ACE和QTU个数较高,分别为15611.13–15721.09和10208–10526,其样本中物种种类较丰富。随种子吸水萌发时间延长,不同土壤类型种子际土壤样品菌落ACE、Goods_coverage和Observed_species变化不同,随花生种子吸水萌发时间延长,青坨和莱西土壤种子际样本序列被检测出的概率增加,其样本物种种类增加,而莱西土壤样本群落丰富度指数下降。: 2.3 物种分类及样本间差异比较
2.3.1 单样本物种分类: 根据OTU分类学注释结果对每个样品进行物种分类鉴定。选用第二分类层次即纲水平的分类结果,绘制不同土壤类型、花生种子吸水膨胀不同时间时种子际物种分类图 (图 1)。仅列出代表性的东营毛坨土壤HSS1样本24 h (图 1-A)、青岛莱西土壤HSS6样本48 h (图 1-B)、聊城高唐土壤HSS11样本72 h (图 1-C) 和东营青坨土壤HSS8样本48 h (图 1-D) 种子际物种分类图 4个,其余8个物种分类图略。图 1看出,各类型土壤各种子际样本菌落共发现14个菌纲,其中以Actinobacteria、Alphaproteobacteria、Deltaproteobacteria、Gammaproteobacteria和Acidobacteria-6五个菌纲为12个样本各吸水萌发时间共有,其占比平均值分别为14.02%、21.72%、5.43%、6.02%和4.95%,以Alphaproteobacteria、Actinobacteria和Gammaproteobacteria为主要菌纲,各种子际土壤中丰度极低的其他菌纲类所占比例平均值为28.23%。东营毛坨、聊城高唐和东营青坨3种盐碱土中花生种子萌发时不同时间种子际土壤中丰度极低的其他菌纲类所占比例平均值均在1/3左右,分别为29.83%、30.67%和28.67%,青岛莱西非盐碱土壤中的比例较小,仅为23.77%。莱西非盐碱土壤花生种子吸水萌发24 h时,Acidimicrobiia菌纲占比3.2%,低于其他土壤1.5–2.7倍,而后则未发现此菌纲;毛坨土壤中未发现Thermoleophilia菌纲,但莱西非盐碱土壤中此菌纲占比在10%以上,高于高唐和青坨盐碱土壤1倍左右。Gemmatimonadetes、Gemm-5和Methanobacteria菌纲仅分别在莱西土壤24 h、高唐土壤72 h和青坨土壤24 h种子际样本中检出,其占比分别为3.4%、4.0%和4.5%。菌纲则仅在毛坨土壤中检出其占比在3.4%–3.8%。Betaproteobacteria菌纲在毛坨和高唐土壤中不存在,而在莱西和青坨土壤中平均占比分别为4.97%和3.5%。高唐土壤种子际样本的unclassified菌纲在3.3%左右。可见,不同类型土壤上花生种子吸水萌发时间种子际土壤微生物菌落结构在纲水平存在明显差异,盐碱土壤中菌群结构在纲水平更为丰富。:
 |
| 图 1. 花生种子萌发时间与种子际土壤中微生物群落纲层次分类结果 Figure 1. Classification results of soil microbial colonies in the spermosphere seed germination. HSS1, HSS6, HSS11 and HSS8 show the characteristics of different samples in spermosphere soil of Dongying Mao tuo 24 h, Qingdao Laixi 48 h, Liaocheng Gaotang 72 h and Dongying Qing tuo 48 h under different seed germination times. |
| 图选项 |
2.3.2 目水平全样本菌落结构分析: 图 2表明,4种类型土壤种子际微生物菌落在目水平上共有13个,各土壤类型间各菌目丰度明显不同,其中未分类的菌属丰度均在10%以上,并以采自聊城高唐和东营毛坨的种子际土壤样本未分类菌目丰度较高,在15%–20%左右,其余2种土壤中的丰度在10%左右,而且未分类菌目的丰度在毛坨和莱西种子际土壤中均随花生种子吸胀萌发时间延长而降低,而在高唐和青坨种子际土壤中表现刚好相反。4种类型土壤种子际微生物其他类菌目所占比例有差异,除莱西土壤占比较小在20%–25%外,其余3中土壤种子际占比均在30%以上,且高唐土壤种子际占比最高,为30%–35%。:
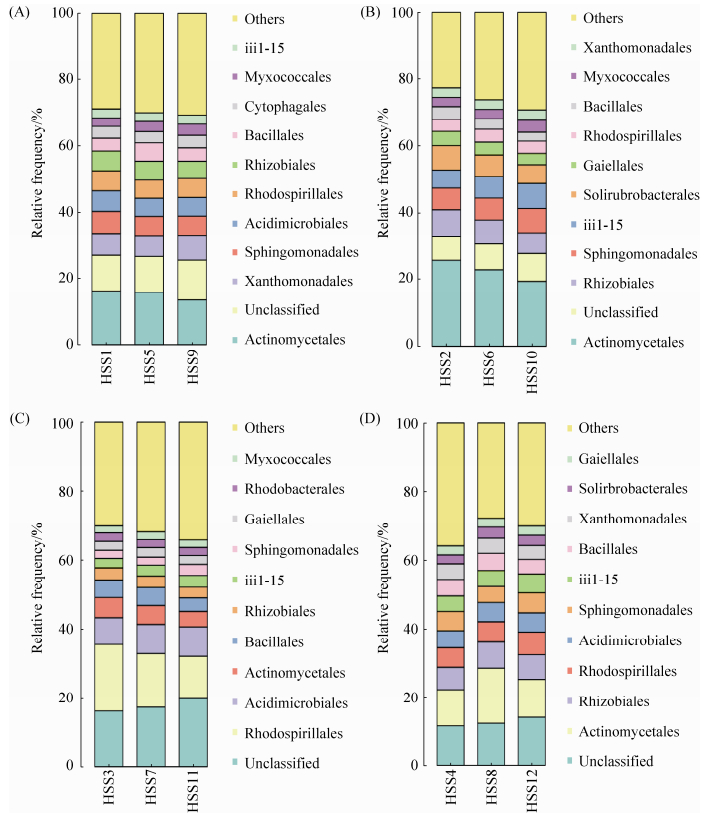 |
| 图 2. 各组全样本在目水平的菌落结构柱状图 Figure 2. Histogram of microflora structure from twelve samples at the level of order. A, B, C and D show the colonies were grouped into order level. Samples sequentially were collected from Dongying Maotuo, Qingdao Laixi, Liaocheng Gaotang and Dongying Qing tuo spermosphere soil under different seed germination times. |
| 图选项 |
各土壤类型种子际均以Actinomycetales、Rhodospirillales、Sphingomonadales、Xanthomonadales、Rhizobiales、Acidimicrobiales、Solirubrobacterales、iii1?15和Bacillales为主要菌目,但在不同土壤类型种子际样本中丰度各不相同,各土壤类型种子际主要菌目均存在Actinomycetales菌目,但其所占比例差异较大,莱西非盐碱土壤种子际占比最高,约在20%–25%,毛坨盐碱土种子际次之,占比15%左右,青坨土壤种子际占比10%左右,高唐土壤占比最低,仅为5%左右。Rhodospirillales菌目在高唐土壤中丰度为10%–20%,且随花生种子吸水萌发时间延长幅度降低;Rhizobiales菌目在莱西土壤、东营毛坨和东营青坨土壤种子际的丰度均在5%以上,而在高唐土壤种子际仅在3%左右。表现出花生种子际土壤微生物群落在目水平上的多样性和对土壤环境变更或管理分异对土壤微域结构的影响以及微域环境对土壤微生物多样性的调控。:
2.3.3 全样本科水平的菌落结构分析: 图 3表明,4种类型土壤种子际微生物菌落在科水平上共有33个菌科,各土壤类型间各菌科丰度明显不同,其中未分类的菌科和其他菌科丰度之和约在60%以上,其他菌科丰度在25%–35%,未分类的菌科丰度在25%–55%,高唐土壤种子际样品未分类的菌科丰度高达50%以上,东营毛坨other菌科丰度在35%左右。未分类菌科的丰度在毛坨和莱西种子际土壤中均随花生种子吸胀萌发时间延长而增大,而在高唐土壤种子际样本中表现刚好相反的趋势。4种类型土壤种子际微生物其丰度在前6位的主要菌科类型差别较大,共有19个菌科,其中又以Actinomycetales、Xanthomonadaceae、Sphingomonadaceae、Gaiellaceae、Rhodospirillales等菌科为主要菌科,其丰度均在5%左右,其余菌科丰度均低于5%。表现出花生种子际土壤微生物群落在目水平上的多样性和对土壤环境变更或管理差异对土壤微域结构的影响以及微域环境对土壤微生物多样性的调控。:
 |
| 图 3. 各组全样本在科水平的菌落结构柱状图 Figure 3. Histogram of microflora structure from twelve samples at the level of family. A, B, C and D show the colonies were grouped into family level. Samples sequentially were collected from Dongying Maotuo, Qingdao Laixi, Liaocheng Gaotang and Dongying Qing tuo spermosphere soil under different seed germination time. |
| 图选项 |
2.4 Beta多样性分析
2.4.1 OTU丰度heatmap图: 图 4可见,不同土壤类型相应OTU包含的序列数丰度值各不相同,不同来源土壤包含OTU序列表现明显差异,东营毛坨盐碱土种子际HSS1、HSS5和HSS9样本OTU丰度值较大,莱西非盐碱土种子际HSS2、HSS6和HSS10样本OTU丰度值较小。依据4个土壤类型的12个不同吸水时间种子际土壤样本top50个OTU丰度值,可将其聚为3大类,其中,ID368490和146917单独聚为1类,其余48个OTU聚为2大类。OTU丰度聚类仅与土壤类型有关,而与其种子萌发时间无关。:
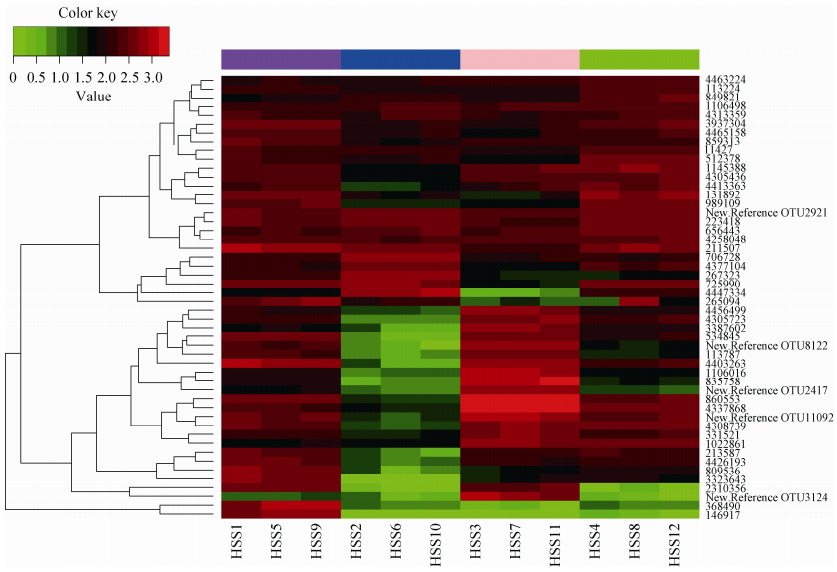 |
| 图 4. 样本间OTU丰度聚类结果 Figure 4. OTU abundance between samples clustering results. |
| 图选项 |
2.4.2 样本聚类树图: 图 5表明,4种土壤类型12个样本的遗传距离 (Phylogenetic distances) 亦聚为2大类4小类,非盐碱土壤的HSS10、HSS6和HSS2的3个样品的遗传距离相近而聚为一类,其余3个盐碱土壤花生根际样本聚为一类,且相同土壤类型的不同萌发时间样品遗传距离相近而聚为一类。:
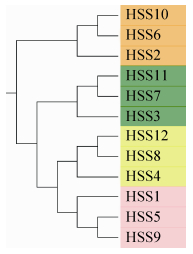 |
| 图 5. 各样本遗传距离聚类树图 Figure 5. Phylogenetic distances clutering tree based on the 16S rRNA sequences of the clones obtained from four types of soil. |
| 图选项 |
2.4.3 样本间相似度比较PCoA图: 由图 6可知,主成分1(PC1) 可以解释所有变量方差的34.83%,主成分2(PC2) 可以解释所有变量方差的20.02%,前两个主成分共解释了总变异的54.85%,第3主成分可以解释所有变量方差的16%左右,第4至第12主成分的方差贡献率较小,均在5.0%左右,尤其第12主成分的方差贡献率接近0(图 6-Ⅰ)。4组样本分布于不同象限,其相似度差异较大,聊城高唐C组土壤样品与第1、2主成分均为正相关关系,东营毛坨A组土壤样品与第1主成分为正相关关系而与第2主成分为负相关关系,B组与第2主成分为正相关关系而与第1主成分为负相关关系,D组则与第1、2主成分均为负相关关系 (图 6-Ⅱ)。可见,土壤类型对土壤微生物类菌群类型影响较大,12个土壤样本依据土壤含盐量高低和种子际微域环境聚为2大类4小类,即同一类型土壤聚为一类而不受花生种子吸胀萌发时间的影响。:
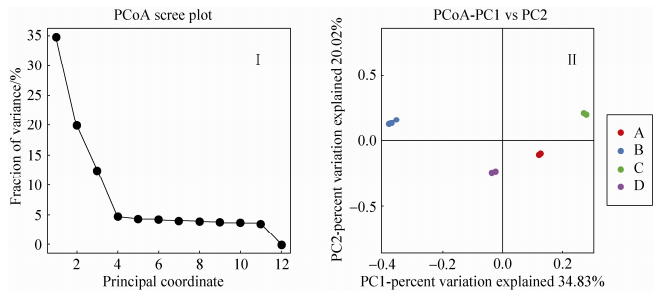 |
| 图 6. 基于unweighted unifrac距离的样本间相似度比较PCoA图 Figure 6. Similarity comparison based on unweighted unifrac distances of the clones obtained from four types of soil. Letter A, B, C, D represent as samples from spermosphere soil in Dongying Maotuo, Qingdao Laixi, Liaocheng Gaotang and Dongying Qing tuo respectively. |
| 图选项 |
3 讨论和结论 3.1 土壤类型对微生物多样性的影响 土壤微生物物种的多样性是指土壤生态系统中微生物的物种丰富度和均一度,是微生物多样性的最直接表现形式。根据原位的、不经培养的微生物系统发育学研究发现,自然界中95%–99%的微生物种群尚未被分离培养或描述过,从而推算地球上仅细菌就有10万–50万种[14-16]。对甘肃环县草地可培养细菌分离后发现,平均每1 g土壤有65个不同的细菌种群,细菌总量为4.51×109–1.74×1010CFU/g土壤,不同牧草根际细菌数量、种类和优势种群均存在差异[17]。美国威斯康星农田土壤的微生物约98%的物种属于细菌[18],多种土壤杆菌属 (Agrobacterium spp.) 明显集中在植物的根际,根际土壤中的土壤杆菌比非根际土壤高1000倍,且沙土有利于其生长[19]。北京地区和山东地区典型蔬菜地土壤细菌种群中优势种群均为变形细菌,但是土壤细菌多样性降低,这可能与典型菜田的多年连作,种植蔬菜种类单一直接相关。水稻旱育栽培下变形菌门α-变形菌纲和γ-变形菌纲、拟杆菌门、绿弯菌门、硝化螺旋菌门、酸杆菌门、芽单胞菌门、浮霉菌门和放线菌门比例上升,而厚壁菌门、变形菌门β-变形菌纲的比例下降。对土壤细菌优势群落的功能分析发现,旱育秧能够显著促进根际与土壤养分转化密切相关的硝化细菌、固氮菌、氨氧化菌、光合细菌、解磷菌和解钾菌的繁殖。同时,旱育秧根际土壤中与根系生长密切相关的根际促生菌的数量显著提高[20-21]。
在盐碱土的细菌、放线菌和真菌3大类群中,细菌占绝对优势,其次是放线菌,真菌数量最少;天津滨海盐碱土、河西走廊东端盐碱土壤中和新疆平原荒漠盐渍草地中微生物数量均以细菌占绝对优势,占总菌数的99%,真菌和放线菌占1%[22-24]。细菌数量与土壤全盐含量呈显著负相关,土壤盐害程度越高,微生物数量越少,土壤细菌的数量分布从大到小为轻度盐化土、中度盐化土、重度盐化土和盐土[6, 20, 22, 25],充分反映了以盐害为主导因子的土壤环境条件的综合影响。本研究结果表明,聊城高唐内陆盐碱土花生种子际土壤微生物群落多样性较小,而东营青坨土壤种子际土壤微生物群落多样性较大,尤以种子吸胀72 h后种子际土壤微生物群落多样性最大。盐碱土壤中菌群结构在纲水平更为丰富且不同类型土壤样本种子际微生物菌落结构在纲水平存在明显差异。在Proteobacteria、Actinobacteria、Actinobacteria、Bacteroidetes、Acidobacteria和Firmicutes 6个优势菌纲中,以Proteobacteria和Actinobacteria为主要菌纲,其所占比例分别在31.9%和16.8%以上,东营毛坨盐碱土壤中Bacteroidetes菌纲占比3.8%,其余3种土壤中未发现,Firmicutes菌纲在非盐碱土壤中占比为零。在门水平上丰度均以Proteobacteria和Actinobacteria菌门丰度较高,平均丰度分别为35%和25%左右,二者丰度差异主要表现在非盐碱土壤和东营青坨盐碱土壤种子际,非盐碱土壤种子际Proteobacteria丰度小于Actinobacteria。在属水平上,未分类的菌属丰度均在68%以上,除Sphingomonadaceae属在4种类型土壤中丰度均较大且在非盐碱土壤种子际最高、聊城高唐土壤种子际最低。可见,不同类型土壤花生种子际土壤含盐量、有机质含量、pH和电导率等是制约花生种子际微域环境的重要因子,通过调控种子际各相关因子,改善土壤微域生态环境,增强种子际土壤中与营养转化循环相关的优势菌群的数量比例,进而有利于花生种子吸胀萌发、早发全苗和健壮幼苗的形成。
3.2 种子际微域土壤环境变化 种子际 (Spermosphere) 是植物微生态系统的重要组成部分,在种子萌发的短暂时间内富于微生物群落的形成和功能的瞬时演替特性。萌发种子分泌物的瞬时演替释放对种子际固有和接种微生物的群落多样性、增殖和活性具有调控作用; 种子际微生物的趋化性对于微生物的定殖和对病原菌的拮抗能力以及生物防治效果有重要影响[26]。不同种类植物的种子萌发过程中分泌物的性质和数量会有所不同,这些分泌物一般在播种后一定时间内陆续瞬时演替释放,而且对种子际的性质有至关重要的影响[27]。在靠近萌发的胚根处的微生物活性高于邻近的种子表面,种子际对某些微生物的影响在一定程度上具有时间、品种和环境的特异性[11]。种子分泌物的瞬时释放在很大程度上控制着种子际微生物群落的动态变化,在播种后数十小时内,伴随着种子分泌物的迅速变化,微生物行为的相应变化往往也同样迅速,包括种子际固有微生物的瞬时演替、接种微生物的生长、增殖和活性发挥以及侵染种子和幼苗的病原菌的生长变化等[28-29]。巨大芽孢杆菌 (B. megaterium)、荧光假单胞菌 (P. fluorescens) 和恶臭假单胞菌 (P. putida) 的某些菌株仅对大豆和马铃薯种子分泌物的多种氨基酸和有机酸成分有趋化反应,但对蔗糖没有趋化反应,并发现这些细菌对大豆种子分泌物的趋化性对其在种子上的定殖和拮抗病原菌的能力有显著影响[30-31]。百脉根 (Lotuscorniculatus L.) 种子际细菌在24 h的短时间内可以游动2 cm到达种子[32]。本试验条件下,随种子吸胀萌发时间延长各类型土壤种子际微生物群落多样性有增大趋势,而非盐碱土壤和聊城高唐土壤种子际Actinobacteria和Proteobacteria菌门丰度呈降低趋势。不同类型土壤花生种子际微生物依据其群落丰度可聚为2大类,东营毛坨土壤和聊城高唐土壤聚为一类,东营青坨和青岛莱西土壤聚为一类。但依其遗传距离也聚为2大类4小类,非盐碱土壤的3个不同吸胀时间种子际样品的遗传距离相近而聚为一类,其余3个盐碱土壤花生种子际样本聚为一类,且相同土壤类型的不同萌发时间样品遗传距离相近而聚为一类。主成分分析表明,土壤类型对土壤微生物类菌群类型影响较大,12个土壤样本依据土壤含盐量、有机质含量和ph高低等土壤本身性质和种子际微域环境聚为2大类4小类,即同一类型土壤聚为一类而不受花生种子吸胀萌发时间的影响。
参考文献
| [1] | Rajjou L, Duval M, Gallardo K, Catusse J, Bally J, Job C, Job D. Seed germination and vigor.Annual Review of Plant Biology, 2012, 63(1): 507–533DOI:10.1146/annurev-arplant-042811-105550. |
| [2] | Bewley JD, Bradford K, Hilhorst H, Nonogaki H. Seeds: physiology of development, germination and dormancy. 3rd ed. New York: Springer, 2013. |
| [3] | Lin XG, Hu JL. Scientific connotation and ecological service function of soil microbial diversity.Acta Pedologica Sinica, 2008, 45(5): 892–900(in Chinese).林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能.土壤学报, 2008, 45(5): 892–900. |
| [4] | Nelson EB. Microbial dynamics and interactions in the spermosphere.Annual Review of Phytopathology, 2004, 42(1): 271–309DOI:10.1146/annurev.phyto.42.121603.131041. |
| [5] | Buyer JS, Roberts DP, Russek-Cohen E. Microbial community structure and function in the spermosphere as affected by soil and seed type.Canadian Journal of Microbiology, 1999, 45(2): 138–144DOI:10.1139/w98-227. |
| [6] | Liu L, Liu Y, Qiu FB, Zhang XX, Song W. Advances of studies on micro-ecology in the spermosphere.Microbiology, 2008, 35(11): 1811–1816(in Chinese).刘琳, 刘洋, 邱服斌, 张晓霞, 宋未. 植物种子际微生态学研究进展.微生物学通报, 2008, 35(11): 1811–1816. |
| [7] | Sun Y, Gao JY, Jin WY, Wen HY, Gao XL, Xu XL, Li YC, Lu YH. Effects of bacterial strains B and T on seeds germination of Capsicum frutescens and Brassica chinensis.Seed, 2014, 33(3): 43–46(in Chinese).孙怡, 高婕妤, 金玮玥, 温洪宇, 高霞莉, 徐秀丽, 李媛聪, 陆宇豪. 细菌B、T对青椒和上海鸡毛菜种子萌发的影响.种子, 2014, 33(3): 43–46. |
| [8] | An J, Wu N, Zhang YM. Effects of sand sterilization on seed germination, seedling growth and rhizosheath formation of Stipagrostis pennata.Journal of Desert Research, 2016, 36(2): 399–405(in Chinese).安晶, 吴楠, 张元明. 沙土灭菌对羽毛针禾 (Stipagrostis pennata)种子萌发、幼苗生长及根鞘形成的影响.中国沙漠, 2016, 36(2): 399–405. |
| [9] | Gao XK, Wei SZ. Effects of rhizospheric microorganism on seed germination of mung bean.Jiangsu Agricultural Sciences, 2010(1): 106–108(in Chinese).高小宽, 魏淑珍. 根际微生物对绿豆发芽率的影响.江苏农业科学, 2010(1): 106–108. |
| [10] | Gao XL, Zhou Y, Jin WY, Sun Y, Wen HY, Wang AM. Study of bacterial strains from paddy soil on seeds germination of Lycopersicon esculentum mill.Seed, 2013, 32(4): 25–28(in Chinese).高霞莉, 周玥, 金玮玥, 孙怡, 温洪宇, 王爱民. 稻田土壤细菌对圣女果种子促萌发研究.种子, 2013, 32(4): 25–28. |
| [11] | Ugoji EO, Laing MD, Hunter CH. Colonization of Bacillus spp. on seeds and in plant rhizoplane.Journal of Environmental Biology, 2005, 26(3): 459–466. |
| [12] | Niu SQ, Yang TT, Li JF, Da WY, Yang JW. Seasonal trends of microbial functional groups in saline-alkali soil and their relationship with soil physicochemical factors in the East Hexi corridor.Arid Zone Research, 2011, 28(2): 328–334(in Chinese).牛世全, 杨婷婷, 李君锋, 达文燕, 杨建文. 盐碱土微生物功能群季节动态与土壤理化因子的关系.干旱区研究, 2011, 28(2): 328–334. |
| [13] | Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in-situ detection of individual microbial cells without cultivation.Microbiological and Molecular Biology Reviews, 1995, 59(1): 143–169. |
| [14] | Wang GR, Chen XR, Zhang JZ, Han YZ, Hu YG, Yang CD, Xu CL. The temporal and spatial distribution of soil microorganism physiological floras in alpine shrubs of the eastern Qilian mountains.Acta Prataculturae Sinica, 2011, 20(2): 31–38(in Chinese).王国荣, 陈秀蓉, 张俊忠, 韩玉竹, 胡宜刚, 杨成德, 徐长林. 东祁连山高寒灌丛草地土壤微生物生理功能群的动态分布研究.草业学报, 2011, 20(2): 31–38. |
| [15] | Borneman J, Triplett E W. Molecular microbial diversity in soils from eastern amazonia: evidence for unusual microorganisms and microbial population shifts associated with deforestation.Applied and Environmental Microbiology, 1997, 63(7): 2647–2653. |
| [16] | Zhang W, Wei HL, Gao HW, Hu YG. Advances of studies on soil microbial diversity and environmental impact factors.Chinese Journal of Ecology, 2005, 24(1): 48–52(in Chinese).张薇, 魏海雷, 高洪文, 胡跃高. 土壤微生物多样性及其环境影响因子研究进展.生态学杂志, 2005, 24(1): 48–52. |
| [17] | Zhang ZX, Lin YQ, Dai PL, Li Z, Li Z, Lin WX. Ecological characteristics of rice rhizosphere of dry-raised seedlings.Chinese Journal of Eco-Agriculture, 2015, 23(12): 1552–1561(in Chinese).张志兴, 林芸青, 戴沛良, 李洲, 李忠, 林文雄. 水稻旱育壮秧的根际生态学特性分析.中国农业生态学报, 2015, 23(12): 1552–1561. |
| [18] | Sun JJ, Yin JD, Xie YH, Yang YL, Shu XW, Liu BD. Microbial ecological characteristics of saline-alkali soil in coastal area of Tianjin.Journal of Nanjing Forestry University (Natural Science Edition), 2010, 34(3): 57–61(in Chinese).孙佳杰, 尹建道, 解玉红, 杨永利, 舒晓武, 刘保东. 天津滨海盐碱土壤微生物生态特性研究.南京林业大学学报 (自然科学版), 2010, 34(3): 57–61. |
| [19] | Li FX, Wang XQ, Guo YZ, Xu X, Yang JG, Ji YQ. Microbial flora and diversity in different types of saline-alkali soil in Ningxia.Journal of Soil and Water Conservation, 2011, 25(5): 107–111(in Chinese).李凤霞, 王学琴, 郭永忠, 许兴, 杨建国, 季艳清. 宁夏不同类型盐渍化土壤微生物区系及多样性.水土保持学报, 2011, 25(5): 107–111. |
| [20] | Luo Q, Huang BL, Tang ZX, Lai LM, Wei W, Zheng YR. Carbon source utilization of microbes in saline soil of three vegetation types in Xinjiang, China.Chinese Journal of Applied and Environmental Biology, 2013, 19(1): 96–104(in Chinese).罗倩, 黄宝灵, 唐治喜, 来利明, 魏伟, 郑元润. 新疆盐渍土3种植被类型土壤微生物碳源利用.应用与环境生物学报, 2013, 19(1): 96–104.DOI:10.3724/SP.J.1145.2013.00096 |
| [21] | Niu SQ, Jing CH, Liao SQ, Zhu XT, Han JS. Bacterial population structure diversity in saline-alkali soil in Hexi corridor.Journal of Northwest Normal University (Natural Science), 2013, 49(2): 90–95(in Chinese).牛世全, 景彩虹, 廖世齐, 朱学泰, 韩建山. 河西走廊盐碱土细菌种群结构多样性的研究.西北师范大学学报 (自然科学版), 2013, 49(2): 90–95. |
| [22] | Kang YJ, Hu J, Dong BH, Lu XY. Microbial characters of a salina-alkali soil in coastal wetland.Journal of Agro-Environment Science, 2007, 26(增刊): 181–183(in Chinese).康贻军, 胡健, 董必慧, 陆小云. 滩涂盐碱土壤微生物生态特征的研究.农业环境科学学报, 2007, 26(增刊): 181–183. |
| [23] | Huang J, Hirji R, Adam L, Rozwadowski KL, Hammerlindl JK, Keller WA, Selvaraj G. Genetic engineering of glycinebetaine production toward enhancing stress tolerance in plants: metabolic limitations.Plant Physiology, 2000, 122(3): 747–756DOI:10.1104/pp.122.3.747. |
| [24] | Lozupone C, Knight R. UniFrac: a new phylogenetic method for comparing microbial communities.Applied and Environmental Microbiology, 2005, 71(12): 8228–8235DOI:10.1128/AEM.71.12.8228-8235.2005. |
| [25] | Chen WF, Shi YX. Distribution characteristics of microbes in new-born wetlands of the Yellow River Delta.Acta Agrestia Sinica, 2010, 18(6): 859–864(in Chinese).陈为峰, 史衍玺. 黄河三角洲新生湿地不同植被类型土壤的微生物分布特征.草地学报, 2010, 18(6): 859–864. |
| [26] | Spaeth SC. Pressure-driven extrusion of intracellular substances from bean and pea cotyledons during imbibition.Plant Physiology, 1987, 85(1): 217–223DOI:10.1104/pp.85.1.217. |
| [27] | Zheng SH, Watabe R. Relationship between sugar exudation from imbibing seeds and seedling emergence in soybean.Japanese Journal of Crop Science, 2000, 69(4): 520–524DOI:10.1626/jcs.69.520. |
| [28] | Nelson EB. Microbial dynamics and interactions in the spermosphere.Annual Review of Phytopathology, 2004, 42(1): 271–309DOI:10.1146/annurev.phyto.42.121603.131041. |
| [29] | Han XM, Wang RQ, Liu J, Wang MC, Zhou J, Guo WH. Effects of vegetation type on soil microbial community structure and catabolic diversity assessed by polyphasic methods in North China.Journal of Environmental Sciences, 2007, 19(10): 1228–1234DOI:10.1016/S1001-0742(07)60200-9. |
| [30] | Scher FM, Kloepper JW, Singleton CA. Chemotaxis of fluorescent Pseudomonas spp. to soybean seed exudates in vitro and in soil.Canadian Journal of Microbiology, 1985, 31(6): 570–574DOI:10.1139/m85-106. |
| [31] | Gamliel A, Katan J. Chemotaxis of fluorescent Pseudomonads towards seed exudates and germinating seeds in solarized soil.Phytopathology, 1992, 82(3): 328–332DOI:10.1094/Phyto-82-328. |
| [32] | Begonia MF, Kremer RJ. Chemotaxis of deleterious rhizobacteria to birdsfoot trefoil.Applied Soil Ecology, 1999, 11(1): 35–42DOI:10.1016/S0929-1393(98)00131-0. |
