刘艺端, 慕春龙, 朱伟云


江苏省消化道营养与动物健康重点实验室, 南京农业大学消化道微生物研究室, 江苏 南京 210095
收稿日期:2017-03-21;修回日期:2017-06-10;网络出版日期:2017-07-17
基金项目:国家重点基础研究发展计划(973计划)项目(2013CB127300)
*通信作者:朱伟云, E-mail:zhuweiyun@njau.edu.cn
摘要:[目的]采用体外发酵技术比较小肠微生物对不同蛋白源的发酵规律。[方法]以成年猪的十二指肠、空肠和回肠内容物为接种物,以豆粕、菜粕或鱼粉水解物上清液为氮源底物,于发酵的0、4、8、12 h分别测定发酵液pH、微生物蛋白、氨氮和挥发性脂肪酸含量,同时提取细菌DNA并进行定量分析。[结果]添加含氮底物的空肠组和回肠组氨氮浓度和菌体蛋白浓度均相对增加,尤其是酶解菜粕组菌体蛋白合成量较高;十二指肠组菌体蛋白浓度以及氨氮含量不断减少。各发酵组乳酸和挥发酸快速积累,4-8 h积累量最大;8 h后空肠组和回肠组乳酸和挥发酸含量相对稳定,而十二指肠组后期丙酸含量增加约2 mmol/L,并伴随着乳酸含量的相对减少。同时,各组中总细菌、拟杆菌门、厚壁菌门和乳酸杆菌数量相对增加,且略高于无氮组,但不同蛋白源组间无显著差异。[结论]在体外培养条件下,空肠和回肠微生物具有相似的发酵规律,均能快速利用培养液中的含氮物质合成菌体蛋白;十二指肠微生物具有较强的产挥发酸能力,能够转化乳酸并大量产生丁酸和丙酸,这有利于宿主营养功能和肠道健康。
关键词: 蛋白来源 小肠微生物 发酵特性 菌群组成
Effect of different nitrogen source on porcine small intestinal fermentation in vitro
Yiduan Liu, Chunlong Mu, Weiyun Zhu


Laboratory of Gastrointestinal Microbiology, Jiangsu Provincial Key Laboratory of Gastrointestinal Nutrition and Animal Health; College of Animal Science and Technology, Nanjing Agriculture University, Nanjing 210095, Jiangsu Province, China
Received 21 March 2017; Revised 10 June 2017; Published online 17 July 2017
*Corresponding author: ZhuWeiyun, E-mail:zhuweiyun@njau.edu.cn
Supported by the National Key Basic Research Program of China (2013CB127300)
Abstract: [Objective]We studied the effect of different nitrogen source on bacteria from porcine small intestine.[Methods]Digesta samples from different segments of the small intestine were inoculated into media containing enzyme-treated protein (soybean meal, rapeseed meal or fish meal) and incubated for 12 h.[Results]After incubation of jejunal and ileal microbes, the contents of ammonia and microbial crude protein increased in groups with nitrogen resources, especially the groups with rapeseed meal which had the highest increment of microbial crude protein. However, concentrations of microbial crude protein and ammonia decreased in duodenal groups. Besides, concentrations of volatile fatty acid and lactate increased in all groups, and acetate concentrations were more than 50% of the total volatile fatty acid concentration. The contents of propionate and butyrate increased in duodenal groups, whereas the contents of lactate decreased during the last four hours. However, propionate and butyrate were not changed in jejunal and ileal groups. The copy numbers of total bacteria, Firmicutes, Bacteroides and Lactobacillus increased during the experiment, but it was not significantly different between groups with different enzyme-treated protein.[Conclusion]Protein after digestion would be utilized by jejunal and ileal microbes, which mostly used to produce microbial crude protein. Duodenal microbes would utilize lactate and produce propionate and butyrate.
Key words: protein resources small intestinal microbes fermentation microbial structure
肠道微生物和宿主之间存在复杂的共生关系,肠道微生物在肠道氨基酸代谢中扮演着重要角色。宿主摄入的氨基酸并不能被全部吸收进入血液,有相当部分氨基酸将会被寄居于消化道中的微生物代谢[1-2]。一方面,肠道微生物依赖日粮和宿主来源的蛋白质和氨基酸生存、增殖,例如与无菌小鼠相比,常规小鼠小肠尤其是回肠肠腔中总氨基酸浓度相对较低[3];另一方面,微生物能够利用氨、氨基酸等含氮物质合成菌体蛋白,为宿主提供额外的蛋白质。
事实上,肠道微生物的组成是日粮等因素共同影响的结果,肠道细菌的组成和代谢均会受到蛋白质结构以及氨基酸组成的影响。豆粕和鱼粉是饲料行业使用最普遍的蛋白质原料。当前,随着饲料资源消耗的急剧增长,菜粕等资源的替代使用将逐渐成为一种趋势。相比饲喂豆粕日粮的仔猪,酪蛋白日粮饲喂后其回肠中拟杆菌属、肠杆菌科等细菌丰度较高[4]。在体外培养条件下,肠道微生物能够快速利用富含小肽的酪蛋白水解物[5],伴随着氨氮的快速累积,而对完整酪蛋白和游离氨基酸的利用相对缓慢。
与此同时,肠道微生物的代谢活动能够影响宿主的营养功能和健康,比如代谢产物丁酸为肠道上皮细胞提供能量,促进肠道发育和生长[6]。小肠是蛋白质消化和吸收的关键部位,而目前对饲喂常用蛋白质原料条件下猪小肠不同肠段微生物组成和代谢规律知之甚少。为此,本文首先利用消化酶预处理蛋白质原料以模拟蛋白质在猪体内的消化过程,以酶解预处理蛋白质作为氮源底物,通过细菌体外培养法研究小肠不同肠段微生物对不同蛋白质源的发酵规律,为小肠微生物研究以及猪蛋白质营养和健康调控的研究提供参考。
1 材料和方法 1.1 底物预处理 选用3种常用蛋白质原料,即豆粕(CP%=49.3%)、菜粕(CP%=40.9%)和鱼粉(CP%=67.2%)。为了模拟饲料在猪体内的消化过程,参照Huang等[7]体外两步酶解法对蛋白质原料进行消化处理。每瓶原料含氮量为100 mg,每种原料16瓶,各加入9 mL蒸馏水振荡混匀,依次添加α-淀粉酶(Sigma公司)、胃蛋白酶(Solarbio公司)、胰蛋白酶(Solarbio公司)和糜蛋白酶(Solarbio公司)模拟胃、小肠两阶段消化。将消化液转移到透析袋置于0.01 mol/L氯化钠溶液,37 ℃透析15 h;后更换透析液,继续透析2 h。最后用尼龙网过滤收集每种原料的全部酶解液,用于配制培养基。
1.2 培养基和接种物的制备 参照Dai等方法[1]配制厌氧培养基。加入过量葡萄糖(10 mg/L),氮源为唯一变量条件,含氮培养基添加1.1制备的全部消化滤液,调节培养基pH为6.8。厌氧条件下分装83 mL至血清瓶,含氮培养基每瓶含氮量为100 mg,115 ℃灭菌15 min。
收集4头(杜×长×大)商品猪(饲喂玉米-豆粕日粮)的新鲜十二指肠、空肠中段和回肠中段食糜,根据马梅蕾等[8]方法制备接种物,厌氧条件下用37 ℃无氮培养基稀释食糜,培养基与食糜的稀释比例分别为十二指肠3:1 (V/W)、空肠和回肠9:1 (V/W)。将混合液经4层无菌纱布过滤至血清瓶,静置培养4 h。然后分别取接种物5 mL,接种至上述培养基中,发酵体系为90 mL,静置培养12 h。
1.3 试验设计 试验包括S (Soybean meal,豆粕组)、R (Rapeseed meal,菜粕组)、F (Fish meal,鱼粉)和N (No nitrogen,无氮组) 4种培养基,分别接种由十二指肠、空肠或回肠食糜制备的接种物,共12组,每组4个重复。接种后将发酵瓶置于37℃条件下持续培养12 h。
1.4 测定指标及方法 分别于0、4、8、12 h采集培养液样品各5 mL,参照马艳艳等[9]方法用pH-HJ90B酸度计测定pH;参照Weatherburn等[10]方法测定氨氮浓度;参照Makkar等方法[11]测定菌体蛋白含量;参照Mao等[12]方法用气相色谱仪(Shimadzu,GC-14B,Japan)测定乙酸、丙酸和丁酸浓度;参照Yang等[2]方法用酚/氯仿/异戊醇抽提若干次获得发酵液总DNA,参照Yang等[13]方法测定总细菌、拟杆菌门、厚壁菌门和乳酸杆菌数量。
1.5 统计分析 试验数据经Excel 2013初步处理后,利用SPSS 17.0进行单因素方差分析,差异显著性采用LSD-Turkey法进行多重比较,P < 0.05时为差异显著。
2 结果和分析 2.1 接种不同消化道食糜后培养液pH随时间的变化 如图 1所示,培养过程中含氮底物各组pH持续下降,发酵4 h后pH约为6.5。各对照组pH也呈下降趋势,但是下降幅度较各含氮组小(P < 0.05),但接种空肠食糜后其无氮组pH略低于各含氮组(P < 0.05)。
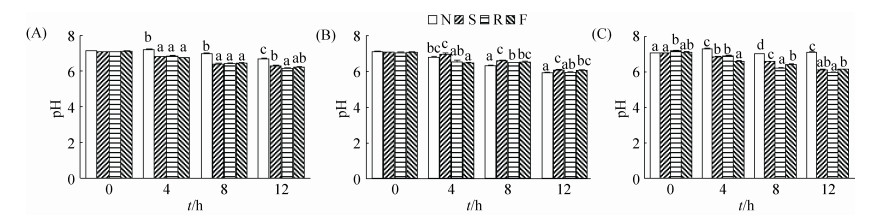 |
| 图 1 体外培养过程中pH随时间的变化 Figure 1 Changes of pH during in vitro cultivation. A: Duodenum; B: Jejunum; C: Ileum. Data are shown as mean±SEM. In the same time point, values of the columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with little letter superscripts mean significant difference between different nitrogenous substrates (P < 0.05). N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. |
| 图选项 |
2.2 不同肠段食糜接种后培养液中乳酸含量随时间的变化 如图 2所示,各组培养液中乳酸均有积累,各含氮底物组积累量高于无氮组(P < 0.05),且4-8 h乳酸积累量较大,同时,豆粕组乳酸积累量相对较高(P < 0.05)。发酵8 h后,十二指肠各含氮底物组乳酸含量相对减少,空肠各含氮组乳酸含量基本不变,回肠尤其是其中的菜粕组和鱼粉组乳酸含量则相对增加。
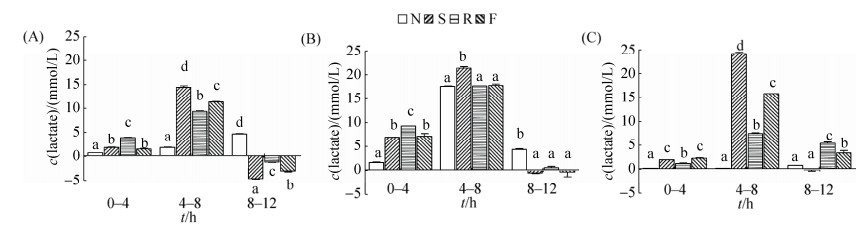 |
| 图 2 体外培养过程中乳酸浓度随时间的变化 Figure 2 Changes of lactate concentration during in vitro cultivation. A: Duodenum; B: Jejunum; C: Ileum. Data are shown as mean±SEM. In the same time point, values of the columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with little letter superscripts mean significant difference between different nitrogenous substrates (P < 0.05). N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. 0–4 h means the value analyzed at 4 h minus the value determined at 0 h, which is similar to 4–8 h and 8–12 h. |
| 图选项 |
2.3 接种不同肠段食糜后培养液中菌体蛋白含量随时间的变化 如图 3-A所示,接种十二指肠食糜后,豆粕组菌体蛋白持续减少,鱼粉组则先增加后减少,菜粕组发酵前4 h相对增加。空肠各组(图 3-B)以及回肠(图 3-C)豆粕组和菜粕组中,菌体蛋白含量发酵前8 h不断增加,后4 h则相对减少,其中菜粕组菌体蛋白含量增幅相对较高(P < 0.05),而空肠组菌体蛋白变化幅度较大。
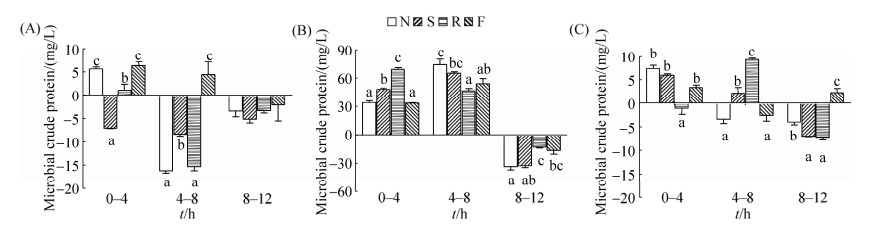 |
| 图 3 体外培养过程中菌体蛋白浓度随时间的变化 Figure 3 Changes of microbial crude protein concentration during in vitro cultivation. A: Duodenum; B: Jejunum; C: Ileum. Data are shown as mean±SEM. In the same time point, values of the columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with little letter superscripts mean significant difference between different nitrogenous substrates (P < 0.05). N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. 0–4 h means the value analyzed at 4 h minus the value determined at 0 h, which is similar to 4–8 h and 8–12 h. |
| 图选项 |
2.4 不同肠段食糜接种后培养液中挥发酸含量随时间的变化 如图 4所示,各组培养液中乙酸和总VFA含量的变化一致。培养前4 h内总VFA含量快速增加(图 4-A),各含氮组增量达10 mmol/L;十二指肠和回肠各氮源组总VFA含量显著高于对照组(P < 0.05),空肠组内无显著差异(P > 0.05)。发酵4 h后,十二指肠各氮源组丙酸和丁酸含量显著高于对照组(P < 0.05),丙酸总增量约2 mmol/L,而发酵4 h后空肠组和回肠组中丙酸和丁酸含量几乎没有变化(P > 0.05)。
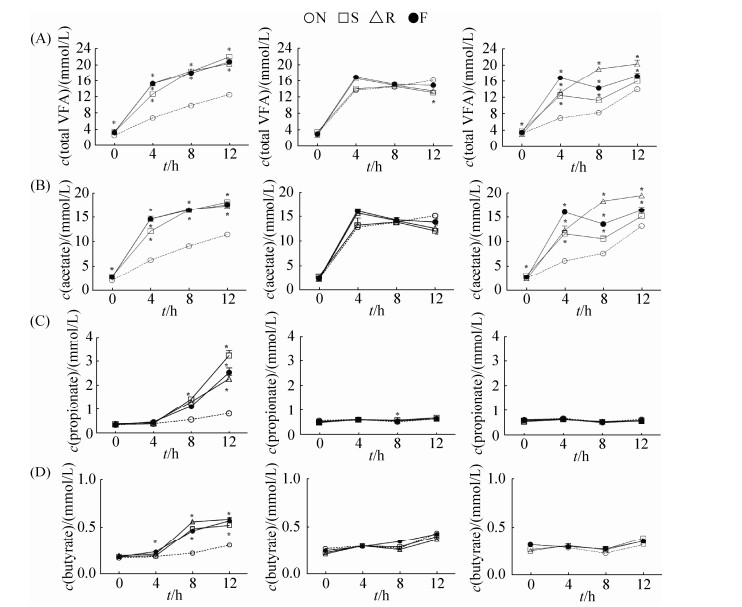 |
| 图 4 培养液中VFA浓度随时间的变化 Figure 4 Changes of VFA concentration at each time point during in vitro cultivation. A: Total VFA; B: Acetate; C: Propionate; D: Butyrate. Data are shown as mean±SEM. *means significant difference compared to the groups without nitrogenous substrates (P < 0.05). N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. |
| 图选项 |
2.5 接种小肠不同肠段食糜后氨氮含量随时间的变化 如图 5-A所示,接种十二指肠食糜后,在豆粕组、菜粕组和无氮组培养液中,发酵前8 h氨氮含量不断减少,后4 h相对增加;而鱼粉组中氨氮含量则是先增加后减少。如图 5-B、C所示,接种空肠或回肠食糜后,在0-4 h、4-8 h和8-12 h各含氮底物组培养液中氨氮含量先增加、后减少、再增加,豆粕组氨氮增量较高,且含氮组氨氮变化幅度显著高于无氮组(P < 0.05)。
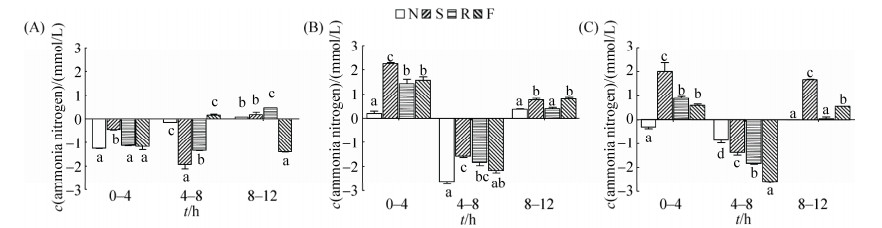 |
| 图 5 体外培养过程中氨氮浓度随时间的变化 Figure 5 Changes of nitrogenous ammonia concentration in the cultural media during in vitro cultivation. A: Duodenum; B: Jejunum; C: Ileum. Data are shown as mean±SEM. In the same time point, values of the columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with little letter superscripts mean significant difference between different nitrogenous substrates (P < 0.05). 0–4 h means the value analyzed at 4 h minus the value determined at 0 h, which is similar to 4–8 h and 8–12 h. N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. |
| 图选项 |
2.6 接种小肠不同肠段食糜后菌群组成随时间的变化 如图 6所示,接种十二指肠食糜后,培养液中总细菌数目增加,12 h豆粕组中总细菌数量显著高于对照组(P < 0.05)。接种空肠食糜的培养液中,总细菌、拟杆菌、厚壁菌、乳酸杆菌和大肠杆菌数量随发酵时间延长而不断增加;发酵4 h后,菜粕组总细菌、拟杆菌门和厚壁菌门数量相对高于无氮组(P < 0.05);发酵12 h后,豆粕组和鱼粉组培养液中总细菌和拟杆菌门细菌数量相对高于其他两组(P < 0.05)。接种回肠食糜的培养液中,总细菌和乳酸杆菌数量增加,但不同底物组间无显著差异(P > 0.05);发酵12 h,各含氮组中拟杆菌门数量高于无氮组(P < 0.05)。与回肠组相比,空肠组培养液中总细菌和拟杆菌门细菌数量增加较快。
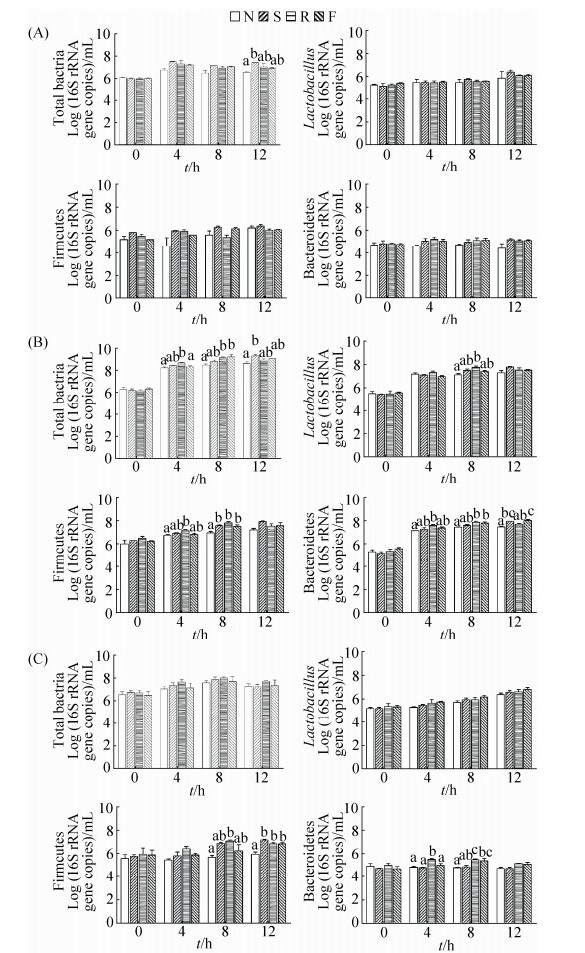 |
| 图 6 不同氮源底物对发酵液菌群数量的影响 Figure 6 Effects of different nitrogen on microbial quantity in the medium. A: Duodenum; B: Jejunum; C: Ileum. Data are shown as mean±SEM. In the same time point, values of the columns with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with little letter superscripts mean significant difference between different nitrogenous substrates (P < 0.05). N: No nitrogen; S: Soybean meal; R: Rapeseed meal; F: Fish meal. |
| 图选项 |
3 讨论 3.1 不同蛋白源对小肠微生物代谢的影响 肠道微生物可利用蛋白质、氨基酸等含氮物质,一方面合成细菌自身蛋白,另一方面代谢生成氨、VFA和生物胺等物质。本试验无氮组中氨氮含量相对初始时刻减少。Salter等[14]也曾指出,在缺少氨基酸、小肽等氮源物质的条件下,肠道微生物主要利用氨作为氮源。然而,添加酶解蛋白的培养液中氨氮含量快速增加,这与Yang等[2]以氨基酸为底物的体外试验结果一致。氨基酸等含氮物质脱氨产物氨氮的快速积累,暗示着微生物能够快速利用培养液中的含氮底物。与此同时,空肠和回肠各组中菌体蛋白含量快速增加,且添加酶解蛋白的培养液中拟杆菌门和厚壁菌门细菌数量相对高于无氮组。这提示空肠和回肠微生物能够快速利用酶解蛋白底物合成菌体蛋白,而无氮组中菌体蛋白的增加可能与食糜中的残留含氮物有关。在瘤胃微生物体外试验中,提供菜粕底物后,微生物利用非氨态氮合成菌体的比例增加,而豆粕组中主要利用氨氮形式的氮源底物[15]。在本试验中,接种空肠和回肠食糜的菜粕组中菌体蛋白合成量也相对较高,同时空回组接种初始4 h内培养液中氨氮快速增加,暗示着接种前期菜粕底物被快速利用,而接种十二指肠食糜后则是鱼粉组MCP增加,由此可见,不同肠段微生物对不同蛋白源的利用可能具有一定选择性。在本试验中,不同蛋白底物组间总细菌、拟杆菌门和厚壁菌门细菌数量没有显著区分,这可能是由体外培养条件和培养时间的限制造成的。然而,从另一个角度也就是蛋白水平角度出发,许多饲养试验已经发现日粮蛋白水平会影响菌群组成,因此,本试验中在蛋白含量充足条件下,蛋白源即氨基酸组成和比例的差异可能没有影响菌群组成,而当蛋白水平降低后,蛋白源对菌群的影响可能会更加突出。在下一步研究中,需要继续探究长期饲喂不同蛋白源日粮后猪肠道微生物的组成和代谢的变化规律。
3.2 不同部位微生物发酵规律的比较 微生物的氨基酸代谢产物VFA与肠道健康有着密切联系,VFA有利于维持肠道的酸性环境、预防病原菌在肠道的定植和增殖[16],不仅是肠道上皮细胞和肠道微生物的重要能源物质,还参与宿主的信号调节[17]。本试验各培养液中VFA相对积累,而乳酸杆菌不仅在数量上快速增长,且代谢旺盛大量产生乳酸。其中,空肠组和回肠组中乳酸和VFA积累到一定量后即保持相对稳定,伴随着pH值的相对降低,适宜的酸性环境有利于肠道对营养物质的消化和吸收[18]。
本试验中,接种十二指肠食糜的含氮组中丙酸和丁酸相对积累,伴随着培养后期乳酸含量相对减少。事实上,乳酸杆菌、双歧杆菌等大多数肠道微生物都能大量产生乳酸,但正常情况下肠道内的乳酸不会过度积累,曾有报道指出,霍氏真杆菌(Eubacterium hallii)、埃氏巨型球菌(Megasphaera elsdenii)等肠道微生物是挥发酸的主要产生菌[19],而且能够通过乳酸转化途径生成丁酸或丙酸[2]。然而,本试验对照组中乳酸含量没有减少,但对照组中乳酸含量低于含氮各组,推测当乳酸积累到一定量时小肠微生物才开始利用乳酸。另一方面,丙酸和丁酸的产生与氨基酸底物有关。Smith等[20]通过接种人粪样的单一氨基酸体外培养试验发现,丙酸主要由丙氨酸、苏氨酸和蛋氨酸等生成,而丁酸主要由谷氨酸、赖氨酸、组氨酸等生成。由此可见,培养液中存在氨基酸等氮源底物也是丙酸和丁酸生成的重要基础。在动物体内,乙酸和丙酸将由血液运送至不同器官代谢利用,如肝脏糖异生作用主要利用丙酸[21]。丁酸是肠道上皮细胞的重要能量来源,同时能够促进肠道黏蛋白的生成[6]。因此,十二指肠微生物的代谢活动对肠道稳态及功能有着积极作用,然而,目前尚不能确定参与丙酸和丁酸产生过程的关键细菌类型,需要后续筛选、鉴定等试验论证。
4 结论 在体外培养条件下,空肠和回肠微生物具有相似的发酵规律,均能快速利用培养液中的含氮物质合成菌体蛋白。十二指肠微生物具有较强的产VFA能力,能够转化乳酸并生成乙酸和丙酸,这有利于宿主营养功能和肠道健康。
References
| [1] | Dai ZL, Zhang J, Wu GY, Zhu WY. Utilization of amino acids by bacteria from the pig small intestine. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [2] | Yang YX, Dai ZL, Zhu WY. Important impacts of intestinal bacteria on utilization of dietary amino acids in pigs. Amino Acids, 2014, 46(11): 2489-2501. DOI:10.1007/s00726-014-1807-y |
| [3] | Torrallardona D, Harris CI, Coates ME, Fuller MF. Microbial amino acid synthesis and utilization in rats:incorporation of 15N from 15NH4Cl into lysine in the tissues of germ-free and conventional rats. British Journal of Nutrition, 1996, 76(5): 689-709. DOI:10.1079/BJN19960076 |
| [4] | Rist VTS, Weiss E, Sauer N, Mosenthin R, Eklund M. Effect of dietary protein supply originating from soybean meal or casein on the intestinal microbiota of piglets. Anaerobe, 2014, 25: 72-79. DOI:10.1016/j.anaerobe.2013.10.003 |
| [5] | Santos AS, Ferreira LMM, Martin-Rosset W, Cotovio M, Silva F, Bennett RN, Cone JW, Bessa RJB, Rodrigues MAM. The influence of casein and urea as nitrogen sources on in vitro equine caecal fermentation. Animal, 2012, 6(7): 1096-1102. DOI:10.1017/S1751731111002527 |
| [6] | Jung TH, Park JH, Jeon WM, Han KS. Butyrate modulates bacterial adherence on LS174T human colorectal cells by stimulating mucin secretion and MAPK signaling pathway. Nutrition Research and Practice, 2015, 9(4): 343-349. DOI:10.4162/nrp.2015.9.4.343 |
| [7] | Huang RL, Tan ZL, Xing TX, Pan YF, Li TJ. An in vitro method for the estimation of ileal crude protein and amino acids digestibility using the dialysis tubing for pig feedstuffs. Animal Feed Science and Technology, 2000, 88(1/2): 79-89. |
| [8] | Ma ML, He XY, Zhu WY. Metabolic pattern of pig hindgut bacteria on aromatic amino acids by an in vitro fermentation method. Acta Microbiologica Sinica, 2016, 56(11): 1786-1793. (in Chinese) 马梅蕾, 何香玉, 朱伟云. 体外法研究猪后肠道对芳香族氨基酸的发酵特性. 微生物学报, 2016, 56(11): 1786-1793. |
| [9] | Ma YY, Cheng YF, Zhu WY. Different origins and stubbles of alfalfa:Evaluation of hutritional value by an in vitro fermentation method. Chinese Journal of Animal Nutrition, 2014, 26(8): 2421-2432. (in Chinese) 马艳艳, 成艳芬, 朱伟云. 体外发酵法评价不同产地、不同茬次苜蓿的营养价值. 动物营养学报, 2014, 26(8): 2421-2432. |
| [10] | Weatherburn MW. Phenol-hypochlorite reaction for determination of ammonia. Analytical Chemistry, 1967, 39(8): 971-974. DOI:10.1021/ac60252a045 |
| [11] | Makkar HPS, Sharma OP, Dawra RK, Negi SS. Simple determination of microbial protein in rumen liquor. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [12] | Mao SY, Zhu WY, Wang QJ, Yao W. Effect of daidzein on in vitro fermentation by microorganisms from the goat rumen. Animal Feed Science and Technology, 2007, 136(1/2): 154-163. |
| [13] | Yang LN, Bian GR, Su Y, Zhu WY. Comparison of faecal microbial community of Lantang, Bama, Erhualian, Meishan, Xiaomeishan, Duroc, Landrace, and Yorkshire sows. Asian-Australasian Journal of Animal Sciences, 2014, 27(6): 898-906. DOI:10.5713/ajas.2013.13621 |
| [14] | Salter DN, Daneshvar K, Smith RH. The origin of nitrogen incorporated into compounds in the rumen bacteria of steers given protein-and urea-containing diets. British Journal of Nutrition, 1979, 41(1): 197-209. DOI:10.1079/BJN19790026 |
| [15] | Guadagnin M, Tagliapietra F, Cattani M, Schiavon S, Worgan HJ, Belanche A, Newbold CJ, Bailoni L. Rumen fermentation and microbial yield of high-or low-protein diets containing ground soybean seeds or homemade rapeseed expellers evaluated with RUSITEC. Canadian Journal of Animal Science, 2013, 93(3): 363-371. DOI:10.4141/cjas2013-007 |
| [16] | Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota:introducing the concept of prebiotics. Journal of Nutrition, 1995, 125(6): 1401-1412. |
| [17] | Hume ID. Fermentation in the hindgut of mammals//Mackie RI, White BA. Gastrointestinal Microbiology. Boston, MA: Springer, 1997: 84-115. |
| [18] | Macfarlane GT, Macfarlane S. Bacteria, colonic fermentation, and gastrointestinal health. Journal of AOAC International, 2012, 95(1): 50-60. DOI:10.5740/jaoacint.SGE_Macfarlane |
| [19] | Flint HJ, Duncan SH, Scott KP, Louis P. Interactions and competition within the microbial community of the human colon:links between diet and health. Environmental Microbiology, 2007, 9(5): 1101-1111. DOI:10.1111/emi.2007.9.issue-5 |
| [20] | Smith EA, Macfarlane GT. Dissimilatory amino acid metabolism in human colonic bacteria. Anaerobe, 1997, 3(5): 327-337. DOI:10.1006/anae.1997.0121 |
| [21] | Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, Pettersson S. Host-Gut Microbiota metabolic interactions. Science, 2012, 336(6086): 1262-1267. DOI:10.1126/science.1223813 |
