谷亚冰1,2, 刘征华1,2, 孟德龙1,2, 邹源3, 尹华群1,2


1.中南大学资源加工与生物工程学, 湖南 长沙 410083;
2.生物冶金教育部重点实验室, 湖南 长沙 410083;
3.广西山区综合技术开发中心, 广西 南宁 530022
收稿日期:2018-02-04;修回日期:2018-03-23;网络出版日期:2018-03-27
基金项目:国家自然科学基金(31570113,41573072);中南大学研究生自主探索创新项目(1053320171104)
作者简介:尹华群, 博士, 中南大学资源加工与生物工程学院教授, 博士生导师, "湖南省环境微生物组学与应用国际合作基地"负责人, 中国大百科全书编委, Frontiers in microbiology等国际学术期刊客座主编, 先后主持(参与)973、863、国家支撑计划、国家自然科学基金等项目20多项, 在冶金微生物群落结构与功能分析的基因组学技术、冶金微生物种群的适应机制以及冶金微生物协同促进硫化矿物氧化溶解机理等方面取得了系统性的成果, 相关研究成果在Applied and Environmental Microbiology、Environmental Pollution和Applied microbiology and Biotechnology等专业学术期刊上发表SCI论文60多篇, 获湖南省科技进步一等奖1项, 授权发明专利10余项
*通信作者:尹华群, Tel/Fax:+86-731-88830546;E-mail:yinhuaqun_cs@sina.com
摘要:[目的]深入研究极端酸性环境中微生物的碳循环过程。[方法]应用16S rRNA高通量测序和功能基因芯片技术对德兴铜矿中浸矿堆(LH)和积液池(LS)两个子系统中的微生物群落结构组成和功能基因组成进行分析;并运用PICRUSt功能基因预测的方法对群落功能进行预测。[结果]功能基因芯片和功能预测分析都表明碳循环基因在子系统间存在显著差异(P<0.05),且碳固定相关的卡尔文循环、还原性三羧酸循环等基因以及碳降解相关的己聚糖和纤维素等基因在LS系统中都要明显高于LH系统。碳循环功能基因在子系统之间的差异与环境条件相关,其中TON、Ca、ES、Fe3+和P作用显著。[结论]在极端酸性环境中,环境条件的差异会对微生物群落碳循环功能基因产生筛选作用,参与碳循环的微生物的种类和相对丰度都发生变化,最终改变了群落碳循环模式。
关键词: 生物冶金 极端环境 碳循环 功能基因芯片 功能基因预测
Study on the key microbes and mtabolic pathways of carbon cycling in bioleaching system
Yabing Gu1,2, Zhenghua Liu1,2, Delong Meng1,2, Yuan Zou3, Huaqun Yin1,2


1.School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, Hunan Province, China;
2.Education Ministry Key Laboratory of Biometallurgy, Central South University, Changsha 410083, Hunan Province, China;
3.Guangxi Mountainous Comprehensive Technological Development Center, Nanning 530022, Guangxi Zhuang Autonomous Region, China
Received 4 February 2018; Revised 23 March 2018; Published online 27 March 2018
*Corresponding author: Huaqun Yin, Tel/Fax: +86-731-88830546; Email: yinhuaqun_cs@sina.com
Supported by the National Natural Science Foundation of China (31570113, 41573072) and by the Research Innovation Program for College Graduates of Central South University (1053320171104)
Abstract: [Objective]To understande the role of microbes for carbon cycling in acid mine drainage (AMD) system.[Methods]The 16S rRNA high-throughput sequencing, PICRUSt functional prediction method and functional gene chip technology were used to analyze the microbial community composition and functional gene composition in the two systems of leaching heap (LH) and leaching solution (LS) in Dexing Copper Mine.[Results]Both functional gene array and functional prediction analysis show that there were significant differences in the carbon cycle genes between LH and LS (P < 0.05). Besides, the carbon fixation genes related to Calvin cycle and reductive tricarboxylic acid cycle, and carbon degradation genes related to hemicellulose and cellulose degradation were both higher in LS than LH. The differences were caused by environmental condition, especially for contents of TON, Ca, ES, Fe3+ and P.[Conclusion]In the extremely acid environment, differences in environmental condition can screen for different carbon cycling genes. Then, the categories of microbies participating in the main carbon cycling process would decrease in leaching solution, while the relative abundance would increase, and eventually change the carbon cycling pattern.
Key words: bioleaching extreme environment carbon cycling GeoChip functional prediction
碳循环是生物地球化学循环中最重要的一环[1-2],微生物因其种类复杂、代谢功能多样等特点,在这个过程中发挥了重要的作用。碳循环过程[3]主要包括碳固定、碳降解以及甲烷循环3个基本过程。目前已知的微生物固定CO2的途径有卡尔文循环(Calvin cycle)、还原性乙酰辅酶A途径(reductive acetyl-CoA pathway)、还原性柠檬酸循环途径、3-羟基丙酸双循环途径、3-羟基丙酸/4-羟基丁酸循环和2-羧酸/4-羟基丁酸循环。这几种固碳途径在微生物中的分布有显著差异,但是卡尔文循环始终是光能自养型微生物和化能自养型微生物的主要固碳途径[4]。微生物能够分解生态系统中的淀粉、纤维素、几丁质和木质素等有机多聚物,转化其中储存的碳元素,加速系统中的碳循环。不同功能的微生物群落参与到碳循环的各个过程,在维持生态系统稳定方面起到了不容忽视的作用。研究微生物对碳循环过程的调控,碳循环基因与环境因子的关联机制,以及功能微生物群落的种间和种内关系都具有重要的生态学意义[5-6],对解决全球资源紧张、资源短缺以及环境恶化问题都是一股不能忽视的力量。
生物冶金系统[7-10]是一种极端酸性环境,研究表明系统内富含Acidiphilium、Acidocella、Acidithiobacillus、Leptospirillum、Acidomonas、Sulfobacillus等化能自养型微生物。PICRUSt功能基因预测是研究微生物群落结构功能的一种有效方法。Staley等[11]使用PICRUSt功能基因预测研究了密西西比河微生物的功能多样性;Koo等[12]通过PICRUSt研究了常年被冰雪覆盖的温特塞湖不同冰层微生物群落的功能差异。谢建平等[13]通过GeoChip 2.0研究了生物冶金系统中微生物群落的代谢功能,检测到了碳固定、碳降解、甲烷代谢以及铁硫代谢等代谢过程的相关基因,揭示了系统内丰富的功能基因多样性。生物冶金系统包括浸矿堆(LH)和积液池(LS) 2个体系[14-16],2个系统中的环境条件,如pH、铁硫含量等,具有显著差异,环境因子的差异进一步导致了微生物群落结构和功能基因的差异。作为冶金微生物系统的主要能源物质,研究表明在浸矿堆和积液池2个体系中铁、硫元素循环存在显著差异,其中浸矿堆中的微生物体系检测到更多的铁硫氧化基因,研究也证实了浸矿堆系统氧化S0和Fe2+能力更强。对于生物浸出系统中的碳循环过程,目前的研究还很少。但是,因为生物冶金系统中的碳元素极为有限,碳元素的循环过程发挥着极其重要的作用。已知的研究表明该系统中存在着地球生态系统中发现过的大多数碳循环过程[13, 17],但是不同碳循环过程在该系统中的分布情况却知之不详。在冶金微生物介导的碳元素固定过程需要铁硫氧化产生的能量和还原力驱动,生物冶金两个系统中铁硫循环的差异是否与碳循环过程有所关联还需要进一步研究。为此,本文针对德兴铜矿的浸矿堆(LH)和积液池(LS)两个体系进行16S rRNA高通量测序和功能基因芯片研究,分析不同体系中碳循环的差异,探索极端酸性环境下的碳循环途径与环境因子的关系,进一步加深对地球生物化学循环的了解。
1 材料和方法 1.1 样品的采集 测试样品取自江西省的德兴铜矿。作为生物冶金测试点,德兴铜矿已有30多年历史,浸出体系稳定,微生物环境研究完善。为了研究生物冶金系统中的碳循环以及过程中微生物的作用,从浸矿堆(20-30 cm的深度)和集液池(1.5 m深)中分别取8个样品,标记为LH1-LH8,LS1-LS8。样品经过处理后收菌存放在冰箱的-80 ℃,用于DNA提取。后续样品理化参数的测定以及16S rRNA基因高通量测序分析同文献[18]。
1.2 功能基因芯片 本研究使用功能基因芯片揭示微生物群落之间的功能差异。使用随机引物法[19]用荧光染料Cy-5 (GE Healthcare,CA,USA)标记DNA样品。然后,用试剂盒QIAquick Purification kit (Qiagen,CA,USA)进行纯化,在45 ℃烘箱中将样品烘干成粉末。然后把标记的样品与杂交溶液(最终浓度为1×Acgh blocking,1×HI-RPM缓冲液,10 pmol/L通用标准DNA,0.05 μg/μL Cot-1 DNA和10%甲酰胺)完全混匀。随后,95 ℃变性3 min,37 ℃退火30 min,然后与基因芯片在67 ℃杂交箱中杂交处理24 h。在室温条件下,用清洗缓冲液(Agilent)洗涤。然后用扫描仪NimbleGen MS200 Microarray Scanner (Roche NimbleGen,Inc.,Madison,WI,USA)成像。把图像用Agilent特征提取软件进行处理。最后,在IEG网站(http://ieg.ou.edu/microarray/)按照文献所述在线处理数据。主要流程如下:(1)去除信号比率低于2.0的低质量点;(2)计算每个样品的相对丰度;(3)统计分析各个功能基因的分布情况。
1.3 数据分析 将测序得到的fasta文件上传到Galaxy网站上进行PICRUSt功能基因预测[20],得到的功能基因信息与KEGG Orthology进行比对归类,划分为一级、二级和三级的功能基因。将功能基因芯片数据和功能基因预测结果导入到STAMP软件中,可以分析不同系统间的功能基因差异。DCA (detrended correspondence analysis)用于数据的降维和聚类分析,可以用R软件vegan函数包执行。Pearson correlation analysis用于计算功能基因与环境参数或细菌之间的相关性,在Minitab上执行该分析。
2 结果和分析 2.1 生物冶金系统微生物群落基因预测 研究采取的16个样品经过16S rRNA基因测序得到1308个OTU,每个样品的序列数Resample到20000条。经过对KEGG数据库进行比对,获得包括代谢、细胞过程和环境信息过程在内的6种生物代谢通路功能。DCA分析表明微生物群落的代谢功能组成在2个子系统LH和LS之间存在显著差异性(图 1-A)。
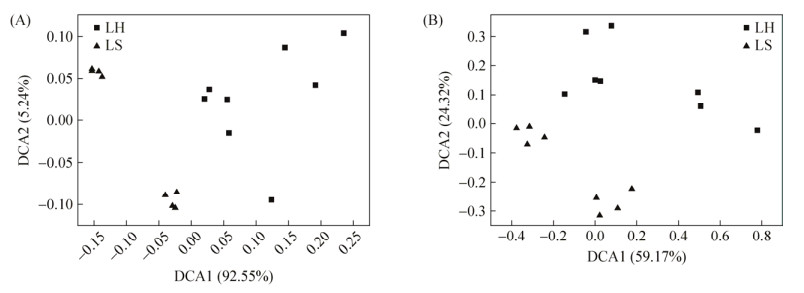 |
| 图 1 细菌功能基因结构在生物冶金子系统间差异的DCA分析 Figure 1 DCA analysis of bacterial functional gene structure between LH and LS. A: Metalism functional genes from PICRUSt; B: Carbon cycling genes from Geochip. |
| 图选项 |
在12个二级预测代谢功能中有9个子功能的相对丰度在2个子系统中具有明显差异(图 2)。其中多糖合成和代谢、能量代谢、辅因子和维生素代谢和核苷酸代谢的功能基因相对丰度在LS系统中明显偏高(P<0.05)。而脂类代谢、异生素生物降解和代谢、氨基酸代谢、萜类化合物和聚酮化合物的代谢以及其他次生代谢产物的生物合成的功能基因在LH系统中明显偏高。其他3种功能基因,碳水化合物代谢、酵素家族和其他氨基酸代谢在2个子系统中的相对丰度则没有显著性差异。
 |
| 图 2 预测功能基因在生物冶金子系统之间的差异(二级功能层) Figure 2 The variation of predicted functional profiles between subsystems LH and LS (hierarchy level 2). |
| 图选项 |
2.2 生物浸出子系统中碳循环相关预测基因分析 冶金微生物系统中多糖合成和碳水化合物代谢都是重要的碳循环过程,其下的三级预测功能中分别包括15和11个子功能(表 1)。其中相对丰度较高的细菌Acidithiobacillus主要与糖基磷脂酰肌醇的合成以及维生素C、丁酸、半乳糖、丙酸酯、淀粉和蔗糖的代谢功能显著相关;Acidiphilium与碳代谢途径脂多糖生物合成和脂多糖生物合成蛋白以及淀粉和蔗糖代谢显著相关;Leptospirillum与糖基转移酶和N-聚糖生物合成以及多种碳水化合物(氨基糖、核苷糖、维生素C、丁酸、柠檬酸、半乳糖和丙酸酯等)代谢途径显著相关;Thiomonas则与多种多糖的合成(鞘糖脂、糖基磷脂酰肌醇、脂多糖和脂多糖生物合成蛋白)和代谢(糖胺聚糖和其他聚糖)途径显著相关。其他细菌Dyella、Acidisoma、Curtobacterium和Rhodanobacter等13个属分别与多种碳循环途径显著相关。
表 1. 三级预测基因与冶金微生物系统中优势属的相关性分析 Table 1. Pearson correlation analysis between functional genes and dominant genera in bioleaching system
| Functional gene | Acidithiobacillus | Acidiphilium | Leptospirillum | Thiomonas | Dyella | Acidisoma | Rhodanobacter | Legionella | Sulfobacillus | Thiobacillus | Hydrotalea |
| Glycosaminoglycan degradation | 0.095 | 0.687 | 0.584 | 0.001 | 0.005 | 0.565 | 0.008 | 0.153 | 0.397 | 0.000 | 0.000 |
| Glycosphingolipid biosynthesis-ganglio series | 0.107 | 0.725 | 0.535 | 0.001 | 0.003 | 0.580 | 0.005 | 0.150 | 0.353 | 0.000 | 0.000 |
| Glycosphingolipid biosynthesis-globo series | 0.068 | 0.956 | 0.506 | 0.000 | 0.005 | 0.711 | 0.013 | 0.053 | 0.325 | 0.002 | 0.000 |
| Glycosylphosphatidylinositol (GPI)-anchor biosynthesis | 0.032 | 0.166 | 0.557 | 0.048 | 0.498 | 0.606 | 0.851 | 0.007 | 0.968 | 0.605 | 0.943 |
| Glycosyltransferases | 0.590 | 0.068 | 0.025 | 0.013 | 0.059 | 0.023 | 0.036 | 0.017 | 0.485 | 0.124 | 0.084 |
| Lipopolysaccharide biosynthesis | 0.304 | 0.043 | 0.152 | 0.017 | 0.051 | 0.029 | 0.028 | 0.029 | 0.846 | 0.097 | 0.075 |
| Lipopolysaccharide biosynthesis proteins | 0.250 | 0.040 | 0.183 | 0.021 | 0.062 | 0.022 | 0.033 | 0.024 | 0.909 | 0.113 | 0.089 |
| N-Glycan biosynthesis | 0.101 | 0.370 | 0.000 | 0.138 | 0.231 | 0.105 | 0.163 | 0.201 | 0.072 | 0.352 | 0.364 |
| Other glycan degradation | 0.053 | 0.879 | 0.542 | 0.000 | 0.013 | 0.725 | 0.027 | 0.050 | 0.395 | 0.003 | 0.000 |
| Peptidoglycan biosynthesis | 0.393 | 0.202 | 0.666 | 0.362 | 0.466 | 0.126 | 0.371 | 0.193 | 0.497 | 0.649 | 0.756 |
| Various types of N-glycan biosynthesis | 0.380 | 0.155 | 0.331 | 0.975 | 0.863 | 0.190 | 0.502 | 0.849 | 0.568 | 0.755 | 0.656 |
| Amino sugar and nucleotide sugar metabolism | 0.701 | 0.066 | 0.009 | 0.123 | 0.159 | 0.016 | 0.076 | 0.119 | 0.515 | 0.264 | 0.352 |
| Ascorbate and aldarate metabolism | 0.000 | 0.352 | 0.005 | 0.736 | 0.598 | 0.522 | 0.610 | 0.475 | 0.027 | 0.608 | 0.666 |
| Butanoate metabolism | 0.000 | 0.831 | 0.007 | 0.486 | 0.833 | 0.693 | 0.894 | 0.236 | 0.439 | 0.989 | 0.665 |
| C5-Branched dibasic acid metabolism | 0.183 | 0.076 | 0.878 | 0.142 | 0.196 | 0.138 | 0.130 | 0.258 | 0.443 | 0.234 | 0.214 |
| Citrate cycle (TCA cycle) | 0.057 | 0.325 | 0.000 | 0.464 | 0.375 | 0.093 | 0.200 | 0.605 | 0.287 | 0.416 | 0.632 |
| Fructose and mannose metabolism | 0.191 | 0.094 | 0.493 | 0.106 | 0.100 | 0.047 | 0.062 | 0.091 | 0.678 | 0.141 | 0.182 |
| Galactose metabolism | 0.018 | 0.210 | 0.040 | 0.338 | 0.800 | 0.050 | 0.786 | 0.643 | 0.897 | 0.671 | 0.164 |
| Glycolysis/Gluconeogenesis | 0.417 | 0.055 | 0.228 | 0.071 | 0.082 | 0.030 | 0.041 | 0.082 | 0.984 | 0.132 | 0.171 |
| Glyoxylate and dicarboxylate metabolism | 0.300 | 0.422 | 0.355 | 0.724 | 0.408 | 0.545 | 0.304 | 0.927 | 0.152 | 0.299 | 0.457 |
| Inositol phosphate metabolism | 0.546 | 0.505 | 0.537 | 0.456 | 0.257 | 0.209 | 0.193 | 0.520 | 0.453 | 0.205 | 0.314 |
| Pentose and glucuronate interconversions | 0.640 | 0.559 | 0.049 | 0.011 | 0.365 | 0.399 | 0.619 | 0.213 | 0.018 | 0.428 | 0.031 |
| Pentose phosphate pathway | 0.073 | 0.063 | 0.670 | 0.340 | 0.259 | 0.059 | 0.162 | 0.215 | 0.252 | 0.324 | 0.469 |
| Propanoate metabolism | 0.042 | 0.616 | 0.037 | 0.890 | 0.598 | 0.392 | 0.373 | 0.627 | 0.697 | 0.494 | 0.764 |
| Pyruvate metabolism | 0.588 | 0.088 | 0.126 | 0.051 | 0.080 | 0.046 | 0.043 | 0.095 | 0.871 | 0.118 | 0.118 |
| Starch and sucrose metabolism | 0.028 | 0.049 | 0.727 | 0.170 | 0.180 | 0.048 | 0.132 | 0.086 | 0.318 | 0.280 | 0.338 |
| Blode number indicated the significant correlation (P<0.05). | |||||||||||
表选项
2.3 环境因子对微生物群落C循环基因的影响 在冶金微生物系统中,用功能基因芯片检测了群落碳循环相关基因,包括碳降解、碳固定、甲烷氧化和甲烷生成过程,共有24977个相关的探针。DCA分析显示2个系统的样品会分开聚类(图 1-B),表现出了明显的差异性。在大类水平上,LS系统中检测到的碳循环基因的相对丰度,包括碳降解、碳固定和甲烷代谢,都要多于LH系统,但是,只有碳降解和甲烷代谢相关基因的差异性是显著的(P<0.05)。在亚类水平上(图 3),芯片数据显示浸矿堆和积液池中微生物群落在碳代谢细节上也有显著性差异。冶金系统微生物群落能够分解淀粉、几丁质、果胶和纤维素等天然多聚物,其中LH系统分解荚醛/木质素、角质素、萜烯和莰酮的功能基因的相对丰度明显多于LS (P<0.05),而分解纤维素、木质素和磷脂的功能基因的相对丰度则明显少于LS (P<0.05)。冶金微生物系统固碳功能主要是通过卡尔文循环和还原性辅酶A等途径完成的。其中在基因芯片数据中相对丰度最高的卡尔文循环在LH系统中的分布明显多于LS,而还原性辅酶A途径的基因在LS系统中出现的更多。LH和LS系统之间环境因子都有显著差异,RDA分析可以解释环境因子对冶金微生物群落碳循环基因的影响(图 4)。其中TON (总有机氮)、Ca (钙元素)、ES (单质硫)、Fe3+ (三价铁离子)和P (磷元素)都会对冶金微生物系统中的碳循环功能基因显著相关。
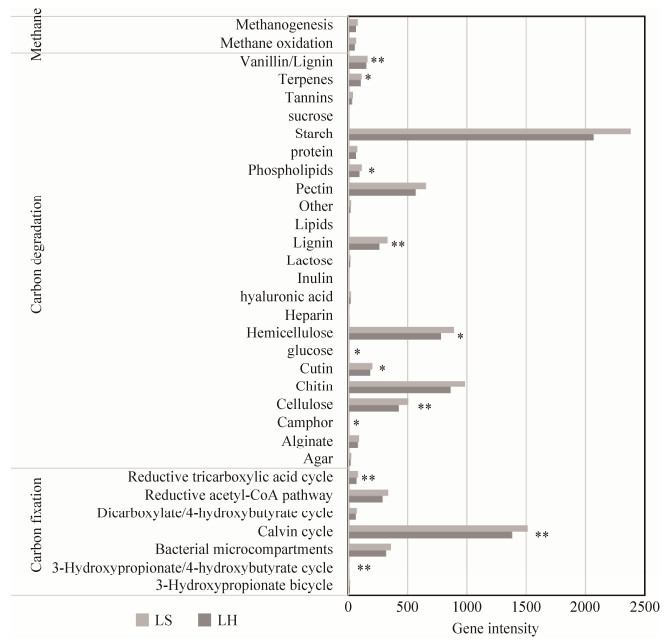 |
| 图 3 碳循环功能基因在生物冶金子系统LH和LS之间的差异(亚类水平) Figure 3 The differences of carbon cycling genes between subsystems LH and LS (Subcategory 2). Signifcant differences among groups are indicated by *. *P < 0.1, **P < 0.05. |
| 图选项 |
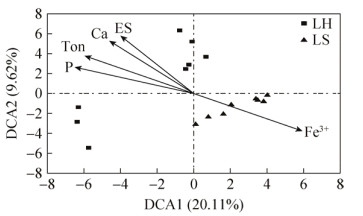 |
| 图 4 碳循环功能基因与环境参数之间的RDA分析 Figure 4 RDA analyses of carbon cycling genes and environmental factors. Vectors represent statistically signifcant variables explaining the observed patterns (P < 0.05). |
| 图选项 |
2.4 生物冶金系统中关键微生物的碳循环基因分布 在冶金微生物系统中,Acidithiobacillus、Acidiphilium、Leptospirillum、Thiomonas、Thermogymnomonas、Ferroplasma、Dyella、Acidisoma、Rhodanobacter、Legionella、Sulfobacillus、Thiobacillus和Hydrotalea是微生物群落中的优势分类属。参考本研究功能基因芯片数据,发现在包括Acidithiobacillus、Acidiphilium和Leptospirillum在内的9个属的细菌中检测到了与碳循环相关的基因(表 2)。其中在Acidithiobacillus、Acidiphilium、Leptospirillum、Sulfobacillu和Thiobacillus中全都检测到了碳固定和碳降解基因;在Thiomonas、Ferroplasma和Legionella中只检测到了碳固定基因;在Rhodanobacter中只检测到了碳降解基因。而关于甲烷代谢基因,只在Acidiphilium和Sulfobacillus中检测到了甲烷氧化基因。
表 2. 亚类碳循环功能基因在冶金微生物系统优势属中的分布 Table 2. The distribution of carbon cycling genes in bioleaching systems
| Subcategory 1 | Subcategory 2 | Acidithiobacillus | Acidiphilium | Leptospirillum | Thiomonas | Ferroplasma | Rhodanobacter | Legionella | Sulfobacillus | Thiobacillus |
| Carbon fixation | Bacterial Microcompartments | √ | × | × | √ | × | × | √ | × | √ |
| Calvin cycle | √ | √ | × | √ | × | × | × | √ | √ | |
| Reductive acetyl-CoA pathway | × | × | √ | × | √ | × | × | √ | × | |
| Reductive tricarboxylic acid cycle | × | × | √ | × | × | × | × | × | × | |
| Carbon degration | Cellulose | √ | × | × | × | × | √ | × | × | × |
| Chitin | × | × | × | × | × | √ | √ | √ | × | |
| Hemicellulose | × | × | × | × | × | √ | × | √ | √ | |
| Starch | √ | √ | √ | × | × | √ | × | × | √ | |
| Methane | Methane oxidation | × | √ | × | × | × | × | × | √ | × |
| The symbol √ in table indicated the related gene was detected, while × not. | ||||||||||
表选项
3 讨论 生物冶金体系是一种极端酸性环境,其相应的嗜酸微生物种类也极其丰富[21]。德兴铜矿的生物浸出系统已经有将近30年的研究,是一个典型的生物浸出系统[22]。通过多年的研究,我们对该体系微生物的群落结构以及代谢潜能都有了充分的认识。先前的研究[14, 23]发现生物冶金2个子系统LH和LS的群落结构和多样性之间都表现出了显著差异性。微生物群落的功能是与群落组成紧密相关的,同时2个子系统的功能基因结构和多样性之间也存在显著差异性。其中LS的群落和功能基因多样性都明显低于LH系统。本研究使用功能基因预测和功能基因芯片两种方法分析冶金微生物两个子系统中的碳循环功能基因,发现两者在功能基因组成之间存在显著差异,与群落结构变化吻合。
DCA分析显示,PICRUSt功能预测的代谢基因组成以及功能基因芯片检测到的碳循环基因组成在LH和LS系统中均有差异。对于生物来说,碳元素的固定是一个消耗能量的过程,而碳降解过程则伴随着能量的产生,即整个碳循环过程是一个物质和能量循环的过程[24]。而在冶金微生物系统中,常见的属水平上的细菌,如Acidithiobacillus、Leptospirillum和Acidiphilium等都是自养型微生物,可以进行铁氧化和硫氧化作用,产生供细菌生存的能量[13]。先前的研究表明德兴铜矿冶金微生物系统中占优势地位的细菌[18]包括Acidithiobacillus、Acidiphilium、Leptospirillum、Thiomonas、Thermogymnomonas、Ferroplasma、Dyella、Acidisoma、Rhodanobacter、Legionella、Sulfobacillus、Thiobacillus和Hydrotalea,其总的相对丰度在LS系统中要明显高于LS系统[18]。其中,PICRUSt功能基因预测的结果显示冶金子系统的碳循环代谢功能基因组成在大类水平和亚类水平上都有明显变化,相关性分析表明这种变化可能是与群落中的微生物紧密相关的。结果表明,德兴铜矿中的优势微生物,除去Thermogymnomonas和Ferroplasma外都与一些含碳化合物的合成与代谢过程紧密相关,比如N-聚糖生物合成、脂多糖生物合成以及淀粉和蔗糖代谢等。这些代谢过程都是系统中的微生物参与碳循环过程的方式[25-26]。由于上述结论都是基于16S rRNA测序结果的一种推论[27],而功能基因芯片的结果则能够充分证明这些结论。结果发现在上面提到的13种冶金微生物系统的优势属中,分别检测到了与碳循环功能相关的基因。比如,相对丰度最高的属Acidithiobacillus不仅拥有卡尔文循环相关酶和羧酶体中固碳酶的相关基因,同时还有碳代谢中分解维生素和淀粉的基因,这些结果与基因预测结果是一致的。因为在LS系统中,具有铁/硫氧化功能的微生物相对丰度更高,在铁/硫氧化过程中产生的能量就更多[14];同时该系统具有碳降解功能的微生物丰度也要明显高于LH系统,因此在LS系统中微生物可以获得更多的能量用于碳固定途径。即LS系统中群落微生物进行碳循环的能力可能是强于LH系统的。
在冶金微生物系统中,微生物碳循环的途径主要包括碳固定、碳代谢以及甲烷循环[2]。其中在德兴铜矿中(图 5)检测到的碳固定途径主要包括卡尔文循环、还原性乙酰-CoA途径以及还原性三羧酸循环途径;而碳代谢途径主要是淀粉、纤维素、几丁质和半纤维素的代谢途径。不同系统的不同途径中,参与的微生物种类和丰度都有显著性差异,其中LS系统中参与上述碳循环途径的微生物种类要显著少于LH系统,而相对丰度明显高于LH系统。在冶金微生物系统中,环境中的pH值、铁、硫和磷的含量都对微生物群落有显著的影响[28-31],对微生物起到了筛选作用,能够有助于微生物适应所处环境的功能基因得到富集,从而影响了微生物的功能组成,直至最后改变了微生物的群落结构和多样性。在本研究中,Fe3+、TON、Ca、P和ES都对2个子系统中碳循环功能基因组成产生了显著影响。一方面,子系统中铁和硫作为能源物质,对微生物的生存有着显著影响[32-33];另一方面,因为2个系统中有机氮和钙都与微生物代谢活动紧密相关,其中钙离子是微生物生长和代谢过程中必需的微量元素,对某些酶的活性有显著影响[34],而碳循环和氮/磷循环之间通过广泛的物质和能量交流紧密联系在一起[35-37]。在农田土壤微生物群落中观测到了相似的结果[38],当增加化学肥料的施用后,土壤中微生物进行氮/碳/硫/磷循环的功能基因多样性明显降低,而丰度却明显增加,相应的微生物群落多样性也明显地减少。而甲烷循环主要包括甲烷氧化和甲烷合成2个途径,其中参与甲烷氧化途径的微生物在2个系统中也存在显著差异,与碳固定和碳代谢途径相似;但是甲烷合成途径却没有匹配到相应的微生物。这主要是因为,自然界中能够生成甲烷的微生物主要是严格厌氧的产甲烷古菌,比如广古门,而在冶金微生物系统中广古门的微生物在属的水平上相对丰度较低,且有许多物种在属的水平上无法分类。
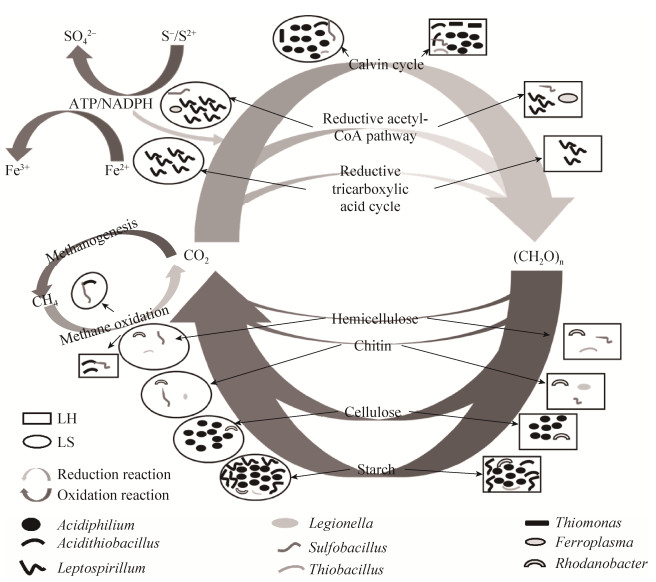 |
| 图 5 生物冶金系统中在微生物作用下的碳循环模型示意图 Figure 5 Concept model of carbon cycling and microorganisms involved in them in bioleaching system. The larger arrow indicated the stronger function. |
| 图选项 |
4 结论 在本项研究中,功能基因预测到的代谢基因在生物冶金浸矿堆系统和浸出液系统中表现出了显著差异性,功能基因芯片实验也证明了这项结论,揭示了环境因子对微生物群落碳循环功能基因的作用机制,以及微生物群落成员在碳循环过程中发挥的作用。但是,对于冶金微生物碳循环功能的研究还很少,本研究的结论也还需要进一步的实验验证。在将来的研究中,应该进一步关注冶金微生物群落的功能结构和多样性,加强对于微生物功能结构机制的研究。
References
| [1] | Falkowski P, Scholes RJ, Boyle E, Canadell J, Canfield D, Elser J, Gruber N, Hibbard K, H?gberg P, Linder S. The global carbon cycle:a test of our knowledge of earth as a system. Science, 2000, 290(5490): 291-296. DOI:10.1126/science.290.5490.291 |
| [2] | Liu YY, Wang S, Li SZ, Deng Y. Advances in molecular ecology on microbial functional genes of carbon cycle. Microbiology China,, 2017, 44(7): 1676-1689. (in Chinese) 刘洋荧, 王尚, 厉舒祯, 邓晔. 基于功能基因的微生物碳循环分子生态学研究进展. 微生物学通报, 2017, 44(7): 1676-1689. |
| [3] | Zhou GS. Global carbon cycling. Beijing: China Meteorogical Press, 2003. (in Chinese) 周广胜. 全球碳循环. 北京: 气象出版社, 2003. |
| [4] | Yuan HZ, Qin HL, Liu SL, Nie SA, Wei WX, Wu JS. Advances in research of molecular ecology of carbon fixation microorganism. Scientia Agricultura Sinica, 2011, 44(14): 2951-2958. (in Chinese) 袁红朝, 秦红灵, 刘守龙, 聂三安, 魏文学, 吴金水. 固碳微生物分子生态学研究. 中国农业科学, 2011, 44(14): 2951-2958. |
| [5] | Ainsworth EA, Rogers A. The response of photosynthesis and stomatal conductance to rising[CO2]:mechanisms and environmental interactions. Plant, Cell & Environment, 2007, 30(3): 258. |
| [6] | Zhao RY, Lü XF, Jiang JJ, Duan YF. Factors affecting soil CO2 and karst carbon cycle. Acta Eeologica Sinica, 2015, 35(13): 4257-4264. (in Chinese) 赵瑞一, 吕现福, 蒋建建, 段逸凡. 土壤CO2及岩溶碳循环影响因素综述. 生态学报, 2015, 35(13): 4257-4264. |
| [7] | Funari V, M?kinen J, Salminen J, Braga R, Dinelli E, Revitzer H. Metal removal from Municipal Solid Waste Incineration fly ash:A comparison between chemical leaching and bioleaching. Waste Management, 2017, 60: 397. DOI:10.1016/j.wasman.2016.07.025 |
| [8] | Bosecker K. Bioleaching:metal solubilization by microorganisms. FEMS Microbiology Reviews, 1997, 20(3/4): 591-604. |
| [9] | Xiao Y, Liu X, Dong W, Liang Y, Niu J, Gu Y, Ma L, Hao X, Xian Z, Zhen X. Effects of pyrite and sphalerite on population compositions, dynamics and copper extraction efficiency in chalcopyrite bioleaching process. Archives of Microbiology, 2017, 199(5): 1-10. |
| [10] | Ma L, Wang X, Tao J, Feng X, Zou K, Xiao Y, Liang Y, Yin H, Liu X. Bioleaching of the mixed oxide-sulfide copper ore by artificial indigenous and exogenous microbial community. Hydrometallurgy, 2017, 169: 41-46. DOI:10.1016/j.hydromet.2016.12.007 |
| [11] | Staley C, Gould TJ, Wang P, Phillips J, Cotner JB, Sadowsky MJ. Core functional traits of bacterial communities in the Upper Mississippi River show limited variation in response to land cover. Frontiers in Microbiology, 2014, 5(414): 414. |
| [12] | Koo H, Mojib N, Hakim JA, Hawes I, Tanabe Y, Andersen DT, Bej AK. Microbial communities and their predicted metabolic functions in growth laminae of a unique large conical mat from Lake Untersee, East Antarctica. Frontiers in Microbiology, 2017, 8: 1347. DOI:10.3389/fmicb.2017.01347 |
| [13] | Xie J, He Z, Liu X, Liu X, van Nostrand JD, Deng Y, Wu L, Zhou J, Qiu G. GeoChip-based analysis of the functional gene diversity and metabolic potential of microbial communities in acid mine drainage. Applied and Environmental Microbiology, 2011, 77(3): 991-999. DOI:10.1128/AEM.01798-10 |
| [14] | Niu J, Deng J, Xiao Y, He Z, Zhang X, van Nostrand JD, Liang Y, Deng Y, Liu X, Yin H. The shift of microbial communities and their roles in sulfur and iron cycling in a copper ore bioleaching system. Scientific Reports, 2016, 6: 34744. DOI:10.1038/srep34744 |
| [15] | Zhang X, Liu X, Liang Y, Xiao Y, Ma L, Guo X, Miao B, Liu H, Peng D, Huang W. Comparative genomics unravels the functional roles of co-occurring acidophilic bacteria in bioleaching heaps. Frontiers in Microbiology, 2017, 8: 790. DOI:10.3389/fmicb.2017.00790 |
| [16] | Xiao D, Yi L, Liang HQ, Hong W, Wei MZ, Zeng XD. Thin-layer heap bioleaching of copper flotation tailings containing high levels of fine grains and microbial community succession analysis. International Journal of Minerals, Metallurgy and Materials, 2017, 24(4): 360-368. DOI:10.1007/s12613-017-1415-4 |
| [17] | Goltsman DS, Denef VJ, Singer SW, VerBerkmoes NC, Lefsrud M, Mueller RS, Dick GJ, Sun CL, Wheeler KE, Zemla A, Baker BJ, Hauser L, Land M, Shah MB, Thelen MP, Hettich RL, Banfield JF. Community genomic and proteomic analyses of chemoautotrophic iron-oxidizing "Leptospirillum rubarum" (Group Ⅱ) and "Leptospirillum ferrodiazotrophum" (Group Ⅲ) bacteria in acid mine drainage biofilms. Applied and Environmental Microbiology, 2009, 75(13): 4599-4615. DOI:10.1128/AEM.02943-08 |
| [18] | Xiao Y, Liu X, Liang Y, Niu J, Zhang X, Ma L, Hao X, Gu Y, Yin H. Insights into functional genes and taxonomical/phylogenetic diversity of microbial communities in biological heap leaching system and their correlation with functions. Applied Microbiology and Biotechnology, 2016, 100(22): 9745-9756. DOI:10.1007/s00253-016-7819-7 |
| [19] | Gao Y, Wang S, Xu D, Yu H, Wu L, Lin Q, Hu Y, Li X, He Z, Deng Y, Zhou J, Yang Y. GeoChip as a metagenomics tool to analyze the microbial gene diversity along an elevation gradient. Genomics Data, 2014, 2: 132-134. DOI:10.1016/j.gdata.2014.06.003 |
| [20] | Langille MGI, Zaneveld J, Caporaso JG, Mcdonald D, Dan K, Reyes JA, Clemente JC, Burkepile DE, Thurber RLV, Knight R. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences. Nature Biotechnology, 2013, 31(9): 814. DOI:10.1038/nbt.2676 |
| [21] | Watling HR. The bioleaching of sulphide minerals with emphasis on copper sulphides-A review. Hydrometallurgy, 2006, 84(1/2): 81-108. |
| [22] | Gui BW, Liu QJ, Li ZK. Application of copper biohydrometallurgy in Dexing Copper Mine. Hydrometallurgy of China, 2001, 20(2): 72-75. (in Chinese) 桂斌旺, 刘全军, 李壮阔. 铜的生物湿法冶金在德兴铜矿的应用. 湿法冶金, 2001, 20(2): 72-75. |
| [23] | Xiao Y, Liu X, Ma L, Liang Y, Niu J, Gu Y, Zhang X, Hao X, Dong W, She S, Yin H. Microbial communities from different subsystems in biological heap leaching system play different roles in iron and sulfur metabolisms. Applied Microbiology and Biotechnology, 2016, 100(15): 6871-6880. DOI:10.1007/s00253-016-7537-1 |
| [24] | Parton WJ, Stewart JWB, Cole CV. Dynamics of C, N, P and S in grassland soils:a model. Biogeochemistry, 1988, 5(1): 109-131. DOI:10.1007/BF02180320 |
| [25] | Zhou JT, Wang J. A review of carbon dioxide fixation by microorganisms. Advances in Environmental Science, 1999(1): 1-9. (in Chinese) 周集体, 王竞. 微生物固定CO2的研究进展. 环境工程学报, 1999(1): 1-9. |
| [26] | Liu Q, Wei XM, Wu XH, Yuan HZ, Wang JR, Li YY, Ge TD, Wu JS. Characteristic of abundances and diversity of carbon dioxide fixation microbes in paddy soils. Environmental Science, 2017, 38(2): 760-768. (in Chinese) 刘琼, 魏晓梦, 吴小红, 袁红朝, 王久荣, 李裕元, 葛体达, 吴金水. 稻田土壤固碳功能微生物群落结构和数量特征. 环境科学, 2017, 38(2): 760-768. |
| [27] | Li GX. PICRUSt-based predicted metagenomic analysis of treeline soil bacteria on Mount Dongling, Beijing. Acta Eeologica Sinica, 2018, 38(6). (in Chinese) 厉桂香. 北京东灵山土壤细菌在树线处的PICRUSt基因预测分析. 生态学报, 2018, 38(6). DOI:http://journals.im.ac.cn/html/actamicrocn/2018/4/10.5846/stxb201703130423 |
| [28] | Yang Y, Shi W, Wan M, Zhang Y, Zou L, Huang J, Qiu G, Liu X. Diversity of bacterial communities in acid mine drainage from the Shen-bu copper mine, Gansu province, China. Electronic Journal of Biotechnology, 2008, 11(1): 299-301. |
| [29] | Fabisch M, Beulig F, Akob DM, Kusel K. Surprising abundance of Gallionella-related iron oxidizers in creek sediments at pH 4.4 or at high heavy metal concentrations. Frontiers in Microbiology, 2013, 4: 390-390. |
| [30] | Li X, Meng D, Li J, Yin H, Liu H, Liu X, Cheng C, Xiao Y, Liu Z, Yan M. Response of soil microbial communities and microbial interactions to long-term heavy metal contamination. Environmental Pollution, 2017, 231(Pt 1): 905-917. |
| [31] | Xian Z, Liu X, Liang Y, Xue G, Xiao Y, Ma L, Bo M, Liu H, Peng D, Huang W. Adaptive evolution of extreme acidophile sulfobacillus thermosulfidooxidans potentially driven by horizontal gene transfer and gene loss. Applied and Environmental Microbiology, 2017, 83(7): 03098-03016. |
| [32] | Zhou HB, Mao F, Wang YG. Acidophilic microorganisms and bioleaching technology. Bulletin of Mineralogy, Petrology and Geochemistry, 2015, 34(2): 269-276. (in Chinese) 周洪波, 毛峰, 王玉光. 嗜酸微生物与生物冶金技术. 矿物岩石地球化学通报, 2015, 34(2): 269-276. |
| [33] | Gu W, Bai J, Dong B, Zhuang X, Zhao J, Zhang C, Wang J, Shih K. Enhanced bioleaching efficiency of copper from waste printed circuit board driven by nitrogen-doped carbon nanotubes modified electrode 1. Chemical Engineering Journal, 2017, 324: 122-129. DOI:10.1016/j.cej.2017.05.024 |
| [34] | Guo YP, Ren YX, Liu GH, Cao CM, Yan LJ. Effects of calcium (CaCl), GA and complex liquid on the physiological characteristics of alfalfa seedlings under drought stress. Acta Pratacultuae Sinica, 2015. |
| [35] | Baker BJ, Lazar CS, Teske AP, Dick GJ. Genomic resolution of linkages in carbon, nitrogen, and sulfur cycling among widespread estuary sediment bacteria. Microbiome, 2015, 3(1): 14. DOI:10.1186/s40168-015-0077-6 |
| [36] | Goll DS, Brovkin V, Parida BR, Reick CH. Nutrient limitation reduces land carbon uptake in simulations with a model of combined carbon, nitrogen and phosphorus cycling. Biogeosciences Discussions, 2012, 9(3): 3547-3569. |
| [37] | Mooshammer M, Hofhansl F, Frank AH, Wanek W, H?mmerle I, Leitner S, Schnecker J, Wild B, Watzka M, Keiblinger KM. Decoupling of microbial carbon, nitrogen, and phosphorus cycling in response to extreme temperature events. Science Advances, 2017, 3(5): e1602781. DOI:10.1126/sciadv.1602781 |
| [38] | Xue K, Wu L, Deng Y, He Z, Van NJ, Robertson PG, Schmidt TM, Zhou J. Functional gene differences in soil microbial communities from conventional, low-input, and organic farmlands. Applied and Environmental Microbiology, 2013, 79(4): 1284. DOI:10.1128/AEM.03393-12 |
