吴玉珍1, 洪亚天1,3, 刘全力1, 徐海津1, 白艳玲1, 张秀明1, 乔明强1,2


1.南开大学生命科学学院, 天津 300071;
2.南开大学分子微生物学与技术教育部重点实验室, 天津 300071;
3.济南市中心医院, 山东 济南 250013
收稿日期:2017-04-23;修回日期:2017-06-10;网络出版日期:2017-08-04
基金项目:天津市应用基础与前沿技术重点项目(17JCZDJC32200)
*通信作者:乔明强, Tel:+86-22-23503340;E-mail:qiaomq@nankai.edu.cn
摘要:[目的]在酿酒酵母中异源表达双孢蘑菇来源的酪氨酸酶基因PPO2,并研究酪氨酸酶在酿酒酵母胞内及胞外的酶学特性。[方法]提取双孢蘑菇总RNA,通过RT-PCR克隆酪氨酸酶基因PPO2,构建表达载体pSP-G1-PPO2,并转化至酿酒酵母进行表达,采用镍亲和层析纯化蛋白并研究其酶学性质。[结果]在酿酒酵母中正确表达了大小为65 kDa的酪氨酸酶蛋白。重组酶能催化底物酪氨酸产生黑色素。体外活性测定表明,酪氨酸酶催化最适温度为45,以酪氨酸和多巴为底物时最适pH分别为7.0和8.0。在酿酒酵母中测得底物酪氨酸浓度低于2.5 mg/mL时,黑色素的产量与底物浓度呈现正相关性。[结论]来源于双孢蘑菇的酪氨酸酶基因PPO2在酿酒酵母中成功表达,重组酶具有良好的酶学特性。利用酪氨酸酶产物黑色素的产量与底物浓度呈现正相关性这一特性,可将其作为细胞酪氨酸产量的传感器,为高通量筛选酪氨酸高产菌株提供了思路。
关键词: 酪氨酸酶 异源表达 双孢蘑菇 酿酒酵母 酶学特性
Expression and characterization of tyrosinase from Agaricus bisporus in Saccharomyces cerevisiae
Yuzhen Wu1, Yatian Hong1,3, Quanli Liu1, Haijin Xu1, Yanling Bai1, Xiuming Zhang1, Mingqiang Qiao1,2


1.College of Life Sciences, Nankai University, Tianjin 300071, China;
2.Key Laboratory of Molecular Microbiology and Technology, Ministry of Education, Nankai University, Tianjin 300071, China;
3.Jinan Central Hospital, Jinan 250013, Shandong Province, China
Received 23 April 2017; Revised 10 June 2017; Published online 4 August 2017
*Corresponding author: Mingqiang Qiao, Tel:+86-22-23503340;E-mail:qiaomq@nankai.edu.cn
Supported by the Tianjin Key Research Program of Application Foundation and Advanced Technology, China (17JCZDJC32200)
Abstract: [Objective]The aim of this research was to express the tyrosinase-coding PPO2 gene from Agaricus bisporus in Saccharomyces cerevisiae and to investigate the characteristics of tyrosinase in vitro and in vivo.[Methods]We cloned PPO2 gene by RT-PCR using the total RNA extracted from Agaricus bisporus. The expression vector pSP-G1-PPO2 was constructed and transformed into yeast. The recombinant protein was purified with Ni-NTA and the tyrosinase enzyme properties were evaluated.[Results]The optimum temperature of tyrosinase in vitro was 45℃. And the optimum pH was 7.0 and 8.0 using tyrosine and L-3, 4-dihydroxyphenylalanine (L-DOPA) as substrate, respectively. In Saccharomyces cerevisiae, the yield of melanin increased with the rise in substrate concentration within 2.5 mg/mL.[Conclusion]We achieved heterologous expression of tyrosinase-coding gene PPO2 from Agaricus bisporus in Saccharomyces cerevisiae and characterized the enzyme properties. The melanin production positively correlates with the concentration of substrate tyrosine which indicates that tyrosinase could be a biosensor to report the content of tyrosine in yeast and could be used for the high throughput screening of high-yield tyrosine strains.
Key words: tyrosinase heterologous expression Agaricus bisporus Saccharomyces cerevisiae enzyme properties
酪氨酸酶是普遍存在于微生物、植物、无脊椎动物及哺乳动物中的一种多酚氧化酶[1]。在氧气的参与下,酪氨酸酶能将单酚类化合物(如酪氨酸)氧化为多酚类化合物(如L-多巴)及醌类化合物进而形成肉眼可见的黑色素[2]。酪氨酸酶属于三型铜蛋白,其酶活性中心含有一个双核的铜原子位点[3-4],铜原子与分子氧形成侧面桥连,从而发挥催化活性。因此酪氨酸酶发挥催化活性需要铜离子的参与。
目前来源于假单胞菌[5]、曲霉菌[6]、木霉菌[7]、漏斗棱孔菌[8]等微生物的酪氨酸酶基因均已被分离鉴定。其中双孢蘑菇来源的酪氨酸酶是真菌中最早被研究的[9]。酪氨酸酶在食品药品生产、医学、美容、生物传感器[10]及废水处理等多个领域中都发挥着重要作用。来源于双孢蘑菇的酪氨酸酶是目前唯一商品化的酪氨酸酶,但由于提取纯化的技术限制,商品化酪氨酸酶的价格昂贵且纯度不高。已有文献报道,商品酪氨酸酶中含有杂蛋白、碳水化合物、酚类化合物及漆酶等可能会干扰酪氨酸酶活性鉴定的杂质[11],因此对于获得低成本、高纯度、相对安全的异源酪氨酸酶的研究具有重要的意义。
酿酒酵母作为真核模式生物,且为非致病菌,用于表达双孢蘑菇来源的酪氨酸酶具有天然的优势,是进行微生物发酵生产黑色素的合适宿主。除此之外,针对酿酒酵母中酪氨酸产量测定方法的缺陷,酪氨酸酶在酿酒酵母中的表达亦可作为酪氨酸产量的生物传感器,为高通量筛选高产酪氨酸菌株提供了可能[12-13]。
本文在酿酒酵母中异源表达了双孢蘑菇来源的酪氨酸酶基因PPO2,对酪氨酸酶蛋白进行了分离纯化和鉴定,并对其在体外的催化条件进行了探索,特别对酪氨酸酶在酿酒酵母胞内的酶学特性进行了探究,为其在酿酒酵母中作为酪氨酸产量的生物传感器提供了实验依据。
1 材料和方法 1.1 材料
1.1.1 菌株和质粒: 本研究中用到的菌株和质粒如表 1所示。
表 1. 本研究中使用菌株和质粒 Table 1. Strains and plasmids used in this study
| Strains or plasmids | Characteristics | Source |
| BY4741 | MATa, his3Δ1, leu2Δ0, ura3Δ0, met15Δ0 | EUROSCARF |
| SC-pSP-G1 | BY4741 containing pSP-G1 plasmid | This study |
| SC-PPO2 | BY4741 containing pSP-G1-PPO2 | This study |
| pSP-G1 | Shuttle vector, Ampr, URA3 | EUROSCARF |
| pSP-G1-PPO2 | PPO2 expression vector | This study |
| DH5α | Host strain to amplify plasmid DNA and the mazF source | Laboratory stock |
| pGEM-T Easy | Cloning vector for the PCR products, Ampr | Promega |
表选项
1.1.2 培养基和生长条件: YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10。营养缺陷培养基SC-ura (g/L):葡萄糖20,硫酸铵5,无氨基酵母氮源1.7,无尿嘧啶氨基酸混合物1.3。LB培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10。氨苄青霉素的使用浓度为100 μg/mL。固体培养基加入20 g/L琼脂粉。BY4741的培养条件为30 ℃、200 r/min;大肠杆菌培养条件为37 ℃、200 r/min。
1.1.3 主要试剂: 实验所用PCR相关试剂、限制性内切酶、RNAiso Plus试剂盒、PrimeScript 1st Strand cDNA Synthesis Kit试剂盒购于大连宝生物工程有限公司;Super-Bradford Protein Assay Kit试剂盒、大肠杆菌感受态DH5α购自康为世纪生物科技有限公司;质粒快速小提试剂盒购于天根生物科技公司。
1.1.4 主要仪器设备: PCR热循环仪、DNA凝胶电泳仪、冷冻离心机、蛋白质半干转膜仪、752紫外可见分光光度计、凝胶成像仪、915型Accument pH计。
1.2 酪氨酸酶基因表达载体的构建 按照TaKaRa公司的RNAiso Plus及PrimeScript 1st Strand cDNA Synthesis Kit试剂盒说明书提取双孢蘑菇的总RNA并合成第一链cDNA,利用引物对PPO2-F (ATAACTAGTATGTCGCTGATTGC TACTGT)和PPO2-R (ATAAGATCTTCAATGGTG ATGGTGATGATGACCACCGTTAATAACATGCACCGCGA)进行PCR扩增克隆得到PPO2基因,并连接至pGEM-T Easy载体,转化大肠杆菌DH5α。测序验证序列正确的质粒与表达载体pSP-G1均通过Bgl Ⅱ、Spe Ⅰ双酶切后回收并连接,转化大肠杆菌,通过酶切验证后命名为pSP-G1-PPO2并保存菌种。
1.3 酪氨酸酶在酿酒酵母中的表达及纯化 将质粒pSP-G1-PPO2转化至酿酒酵母BY4741中,利用营养缺陷标记URA3进行筛选,涂布至SC-ura培养基平板。通过菌落PCR验证正确的转化子命名为SC-PPO2。分别接种SC-PPO2与对照SC-pSP-G1菌株至5 mL SC-ura液体培养基中,培养至OD600为1.5–1.7时收集菌体,加入100 μL裂解液和50 mg玻璃珠振荡破碎10 min,4 ℃离心收集上清。取100 μL上清液,加入25 μL上样缓冲液,加热变性10 min后,进行SDS-PAGE凝胶电泳,银染显色及Western blot蛋白杂交。当凝胶电泳蛋白条带与预期一致后进行扩大培养,按照上述方法,同样进行细胞破碎,收集上清液,进行Ni-NTA柱纯化蛋白并脱盐处理。根据康为世纪Super-Bradford Protein Assay Kit试剂盒说明绘制BSA标准曲线,计算纯化样品中的蛋白浓度,纯化后的蛋白于–80 ℃保存。
1.4 酪氨酸酶活力的测定 酪氨酸酶活力的测定参照文献[14]中的方法,以L-酪氨酸和L-多巴为底物,在酶促作用下生成产物黑色素,利用黑色素最大光吸收波长为475 nm,通过分光光度计测定黑色素光吸收值来测定酪氨酸酶的活力。
1.5 酪氨酸酶的体外酶学特性
1.5.1 底物浓度与酪氨酸酶活力的关系: L-酪氨酸浓度设置为0.1、0.2、0.5、1.0、2.0 mmol/L;L-多巴浓度设置为1、2、5、10、15、30 mmol/L。取100 μL酶液与2.9 mL分别含有底物L-酪氨酸或L-多巴的磷酸盐缓冲液(pH 7.0)充分混匀后测定反应体系的起始OD475,分别于常温条件下反应60 min与15 min,反应结束后测定终止OD475。
1.5.2 温度与酪氨酸酶活力的关系: L-酪氨酸浓度2 mmol/L,L-多巴浓度15 mmol/L,同样取100 μL酶液与2.9 mL含有底物的磷酸盐缓冲液(pH 7.0)混匀后测定初始OD475,分别置于20、30、37、45、55、65、75 ℃充分反应,L-酪氨酸与L-多巴反应体系分别于60 min和15 min后测定终止OD475。
1.5.3 pH与酪氨酸酶活力的关系: 分别配置含2 mmol/L L-酪氨酸,15 mmol/L L-多巴的磷酸盐缓冲液,分别将pH调节至4.0、5.0、6.0、7.0、8.0、9.0、10.0。同样取100 μL酶液与2.9 mL含有底物的磷酸盐缓冲液混匀后测定初始OD475,分别于常温条件下反应60 min与15 min,反应结束后测定终止OD475。
1.6 酪氨酸酶在酿酒酵母中的酶学特性测定
1.6.1 pH与酪氨酸酶活力的关系: 挑取酿酒酵母SC-PPO2单菌落于5 mL SC-ura液体培养基,30 ℃、220 r/min过夜培养,取250 μL培养物转接至5 mL SC-ura培养基,培养至OD600为3.5–4.0,补加酪氨酸至其终浓度为5 mg/mL,加入CuSO4至终浓度为1 mmol/L。加入NaOH分别调节pH至5.0、6.0、7.0、8.0、9.0、10.0。30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。
1.6.2 底物浓度与酪氨酸酶活力的关系: 同1.6.1所述培养菌体至OD600 3.5–4.0,加入NaOH调节pH至9.0,加入CuSO4至终浓度为1 mmol/L。补加L-酪氨酸至终浓度分别为0、0.1、0.5、1.0、2.5、5.0 mg/mL,30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。
1.6.3 铜离子浓度与酪氨酸酶活力的关系: 同1.6.1所述培养菌体至OD600为3.5–4.0,补加酪氨酸至其终浓度为2.5 mg/mL,加入NaOH调节pH至9.0,分别加入CuSO4至终浓度为0、0.1、0.2、0.5、1.0 mmol/L。30 ℃继续培养24 h后,观察颜色变化,取出1 mL培养物,离心取上清测定OD475。
2 结果和分析 2.1 酪氨酸酶基因表达载体的构建 处理新鲜双孢蘑菇提取总RNA,结果如图 1-A所示。利用引物对PPO2-F/R克隆基因PPO2,其中下游引物引入his-TAG。反转录克隆到的基因PPO2如图 1-B所示。条带大小为1.7 kb,符合预期。连接pGEM-T Easy载体后验证正确的质粒与表达载体pSP-G1双酶切后纯化并连接。质粒通过Bgl Ⅱ、Spe Ⅰ双酶切,如图 1-C所示,得到7.3 kb与1.7 kb两条条带,符合预期,并进行测序将序列正确的转化子用于下一步实验。
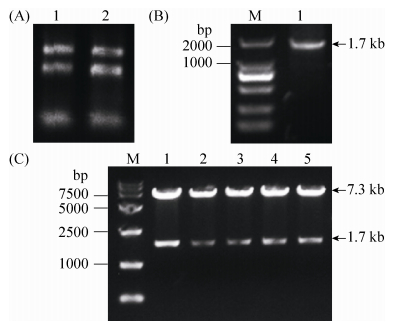 |
| 图 1 酪氨酸酶基因表达载体的构建 Figure 1 Construction of expression vector of tyrosinase-coding gene PPO2. A: total RNA of Agaricus bisporus. B: clone of tyrosinase-coding gene PPO2 by RT-PCR. C: enzyme digestion analysis using Spe Ⅰ and Bgl Ⅱ. M: marker. |
| 图选项 |
2.2 酪氨酸酶在酿酒酵母中的表达及纯化 菌株SC-PPO2与对照SC-pSP-G1过夜培养,添加外源酪氨酸继续培养24 h,肉眼可见菌株SC-PPO2培养物变黑,如图 2-A中2号试管所示。1号试管为空白对照,无黑色素产生。表明PPO2基因在酿酒酵母中正确表达且具生物活性,能够将底物酪氨酸催化为黑色素。蛋白杂交检测结果如图 2-B所示,SC-PPO2菌株正确表达65 kDa大小的酪氨酸酶,泳道1空白对照中无此条带。
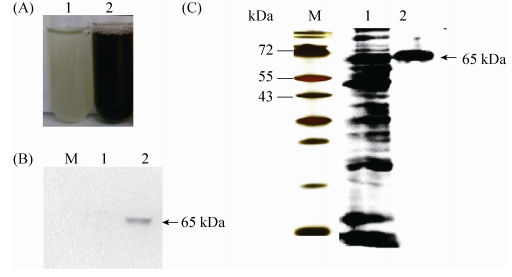 |
| 图 2 酪氨酸酶蛋白的表达、Western blot检测及纯化分析 Figure 2 The enzyme activity analysis, Western blot analysis and purification of recombinant tyrosinase. A: enzyme activity analysis of tyrosinase in Saccharomyces cerevisiae. Lane 1: control SC-pSP-G1; lane 2: recombinant SC-PPO2. B: Western blot analysis of recombinant tyrosinase. M: protein marker; lane 1: control SC-pSP-G1; lane 2: recombinant SC-PPO2. C: SDS-PAGE analysis of purified tyrosinase. M: protein marker; lane 1: recombinant strain SC-PPO2; lane 2: purified protein tyrosinase. |
| 图选项 |
酶液经过镍柱纯化且进行脱盐处理后,通过SDS-PAGE检测蛋白纯化结果。如图 2-C所示,纯化后条带单一,大小正确,表明纯化结果较好,可用于酪氨酸酶的活性检测。蛋白质定量采用牛血清蛋白BSA作为标准品,由标准曲线计算蛋白含量约为0.604 mg/mL。
2.3 重组酪氨酸酶的体外酶学特性
2.3.1 底物浓度与酪氨酸酶活力的关系: 酪氨酸酶同时具有单酚氧化酶与多酚氧化酶的活性[15],因此我们选用L-酪氨酸与L-多巴分别作为底物表征酪氨酸酶的两种酶活性。酪氨酸酶活力与L-酪氨酸浓度的关系如图 3-A所示,可见当酪氨酸浓度低于2 mmol/L时,酶催化速率随底物浓度增加而升高,高于2 mmol/L时反应速率没有明显变化,表明此时底物已饱和;酪氨酸酶活力与L-多巴浓度的关系如图 3-B所示,当L-多巴浓度低于10 mmol/L时,酶催化速率也随底物浓度增加而升高,高于10 mmol/L后酶催化速率保持不变。根据Linewear-Burk方程1/V=(Km/Vmax)×1/[S]+1/Vmax,计算可得以酪氨酸为底物时Km=0.12 mmol/L,Vmax=97 U/min;以L-多巴为底物时,Km=1.86 mmol/L,Vmax=132 U/min。其中Km是酶催化反应的重要常数,表征酶与底物的亲和力,Km越小,酶与底物之间的亲和力越高。
 |
| 图 3 底物浓度对酪氨酸酶活性的影响 Figure 3 Effect of substrate concentration on tyrosinase activity. Values represent results of three independent operations. The average and standard error were calculated. |
| 图选项 |
2.3.2 温度与酪氨酸酶活力的关系: 图 4显示的是酪氨酸酶活性受温度的影响,可见在45 ℃时酶活力达到最高,30–65 ℃酪氨酸酶均表现出较高的酶活力。
 |
| 图 4 温度对酪氨酸酶活性的影响 Figure 4 Effect of temperature on tyrosinase activity. A: L-tyrosine as substrate; B: L-DOPA as substrate. Values represent results of three independent operations. The average and standard error were calculated. |
| 图选项 |
2.3.3 pH与酪氨酸酶活力的关系: 酪氨酸酶活力与pH关系如图 5所示,以L-酪氨酸为底物时最适pH约为7.0,以L-多巴为底物时最适pH约为8.0,表明酪氨酸酶发挥单酚氧化酶与多酚氧化酶的最适pH有所差别,但总体相近。
 |
| 图 5 pH对酪氨酸酶活性的影响 Figure 5 Effect of pH on tyrosinase activity. A: L-tyrosine as substrate; B: L-DOPA as substrate. Values represent results of three independent operations. The average and standard error were calculated. |
| 图选项 |
2.4 酪氨酸酶在酿酒酵母中的酶学特性
2.4.1 pH与酪氨酸酶活力的关系: 将生长至稳定期的SC-PPO2培养体系分别调节pH至5.0–10.0,继续培养24 h后,培养体系的颜色变化如图 6所示。测得上清OD475的结果见表 2,与肉眼观察结果较为一致。将生长至稳定期的培养体系pH调为9.0时,培养24 h后,培养液中的pH值降为7.7,黑色素积累量最高。
 |
| 图 6 pH对酿酒酵母胞内酪氨酸酶活性的影响 Figure 6 Effect of pH on tyrosinase activity in Saccharomyces cerevisiae. 1–6: pH: 5.0, 6.0, 7.0, 8.0, 9.0 and 10.0. |
| 图选项 |
表 2. 不同pH下的紫外吸收测定结果 Table 2. Effect of pH on intracellular tyrosinase activity
| pH | OD475 |
| 5.0 | 0.443 |
| 6.0 | 0.596 |
| 7.0 | 1.395 |
| 8.0 | 2.081 |
| 9.0 | 3.249 |
| 10.0 | 2.794 |
表选项
2.4.2 底物浓度与酪氨酸酶活力的关系: 通过在培养体系中外源添加不同浓度的酪氨酸,颜色变化如图 7所示,上清OD475结果如表 3,可见酪氨酸浓度低于2.5 mg/mL时,黑色素随底物浓度增加而积累,高于2.5 mg/mL时,黑色素积累量保持稳定,底物达到饱和。
 |
| 图 7 底物浓度对酿酒酵母胞内酪氨酸酶活性的影响 Figure 7 Effect of substrate concentration on tyrosinase activity in Saccharomyces cerevisiae. 1–6: tyrosine concentration: 0, 0.1, 0.5, 1.0, 2.5, 5.0 mg/mL. |
| 图选项 |
表 3. 不同酪氨酸浓度下的紫外吸收测定结果 Table 3. Effect of substrate concentration on tyrosinase activity
| c (Tyrosine)/(mg/mL) | OD475 |
| 0 | 0.147 |
| 0.1 | 0.415 |
| 0.5 | 1.296 |
| 1.0 | 2.285 |
| 2.5 | 3.445 |
| 5.0 | 3.549 |
表选项
2.4.3 铜离子浓度与酪氨酸酶活力的关系: Cu2+对酪氨酸酶发挥酶活性起着重要作用,添加不同浓度的CuSO4对酪氨酸酶活性的影响如图 8所示,上清OD475结果如表 4,可见Cu2+浓度不低于0.2 mmol/L时,酪氨酸酶可以发挥较高的催化活性。
 |
| 图 8 Cu2+浓度对酿酒酵母胞内酪氨酸酶活性的影响 Figure 8 Effect of CuSO4 concentration on tyrosinase activity in Saccharomyces cerevisiae. 1–5: CuSO4 concentration: 0, 0.1, 0.2, 0.5, 1.0 mmol/L. |
| 图选项 |
表 4. 不同Cu2+下的紫外吸收测定结果 Table 4. Effect of CuSO4 concentration on tyrosinase activity
| c (CuSO4)/(mmol/L) | OD475 |
| 0 | 0.003 |
| 0.1 | 0.576 |
| 0.2 | 2.879 |
| 0.5 | 2.993 |
| 1.0 | 3.012 |
表选项
3 讨论 酪氨酸酶在微生物及动植物中普遍存在,并发挥着重要的生理功能。近年来,由于酪氨酸酶在食品、药品及环境领域有潜在用途,酪氨酸酶受到广泛的关注。但是从生物体中直接分离纯化酪氨酸酶的工艺复杂、产量较低[16],致使商品化酪氨酸酶的价格昂贵且纯度不高,制约了酪氨酸酶在各领域的应用,因此酪氨酸酶的异源表达成为了研究热点。Wichers等在大肠杆菌中成功克隆了酪氨酸酶基因PPO2的cDNA[17],但是表达出的蛋白并没有表现出酪氨酸酶活性。酿酒酵母作为真核模式生物,在表达双孢蘑菇来源的酪氨酸酶上具有天然的优势。
本研究在酿酒酵母中异源表达了双孢蘑菇的酪氨酸酶,并鉴定了其相关酶学特性。在体外实验中发现,酪氨酸酶发挥催化作用的最适温度为45 ℃,以酪氨酸为底物时酪氨酸酶Km=0.12 mmol/L,最适pH为7.0;L-多巴作为底物时,Km=1.86 mmol/L,最适pH为8.0,表明相较于L-多巴,酪氨酸酶对酪氨酸的亲和力更高。当酪氨酸浓度低于2 mmol/L时,酶催化速率随底物浓度增加而升高,高于2 mmol/L时底物饱和;底物L-多巴浓度高于10 mmol/L后酶催化速率保持不变,底物达到饱和。同时,在酿酒酵母中测定了酪氨酸酶在胞内的相关特性,在适合酿酒酵母生长的30 ℃条件下,酪氨酸酶发挥催化活性需要不低于0.2 mmol/L的Cu2+。培养物生长至稳定期后将pH调节为9.0时,24 h后黑色素积累量最高。该培养条件偏碱性,推测与酿酒酵母胞内产酸相关。在底物酪氨酸浓度低于2.5 mg/mL时,黑色素的产量与底物酪氨酸的浓度呈正相关性。
酪氨酸酶通过催化酪氨酸生成肉眼可见的黑色素,且在一定范围内黑色素的产量与酪氨酸浓度呈正相关性,可将酪氨酸酶作为酿酒酵母细胞酪氨酸产量的传感器,为高通量筛选酪氨酸高产菌株提供了思路。但是酿酒酵母的培养条件偏酸性,需要人工调节培养体系的pH,这可能成为影响最终结果的因素,是下一步工作需要解决的问题。
References
| [1] | Cabrera-Valladares N, Martínez A, Pi?ero S, Lagunas-Mu?oz VH, Tinoco R, de Anda R, Vázquez-Duhalt R, Bolívar F, Gosset G. Expression of the melA gene from Rhizobium etli CFN42 in Escherichia coli and characterization of the encoded tyrosinase. Enzyme and Microbial Technology, 2006, 38(6): 772-779. DOI:10.1016/j.enzmictec.2005.08.004 |
| [2] | Jang JH, Moon KD. Inhibition of polyphenol oxidase and peroxidase activities on fresh-cut apple by simultaneous treatment of ultrasound and ascorbic acid. Food Chemistry, 2011, 124(2): 444-449. DOI:10.1016/j.foodchem.2010.06.052 |
| [3] | Gerdemann C, Eicken C, Krebs B. The crystal structure of catechol oxidase:new insight into the function of type-3 copper proteins. Accounts of Chemical Research, 2002, 35(3): 183-191. DOI:10.1021/ar990019a |
| [4] | Inlow JK. Homology models of four Agaricus bisporus tyrosinases. International Journal of Biological Macromolecules, 2012, 50(1): 283-293. DOI:10.1016/j.ijbiomac.2011.11.010 |
| [5] | McMahon AM, Doyle EM, Brooks S, O'Connor KE. Biochemical characterisation of the coexisting tyrosinase and laccase in the soil bacterium Pseudomonas putida F6. Enzyme and Microbial Technology, 2007, 40(5): 1435-1441. DOI:10.1016/j.enzmictec.2006.10.020 |
| [6] | Abdel-Raheem A, Shearer CA. Extracellular enzyme production by freshwater ascomycetes. Fungal Diversity, 2002, 11: 1-19. |
| [7] | Selinheimo E, Saloheimo M, Ahola E, Westerholm-Parvinen A, Kalkkinen N, Buchert J, Kruus K. Production and characterization of a secreted, C-terminally processed tyrosinase from the filamentous fungus Trichoderma reesei. The FEBS Journal, 2006, 273(18): 4322-4335. DOI:10.1111/ejb.2006.273.issue-18 |
| [8] | Marková E, Kotik M, K?enková A, Man P, Haudecoeur R, Boumendjel A, Hardré R, Mekmouche Y, Courvoisier-Dezord E, Réglier M, Martínková L. Recombinant tyrosinase from Polyporus arcularius:overproduction in Escherichia coli, characterization, and use in a study of aurones as tyrosinase effectors. Journal of Agricultural and Food Chemistry, 2016, 64(14): 2925-2931. DOI:10.1021/acs.jafc.6b00286 |
| [9] | Lezzi C, Bleve G, Spagnolo S, Perrotta C, Grieco F. Production of recombinant Agaricus bisporus tyrosinase in Saccharomyces cerevisiae cells. Journal of Industrial Microbiology & Biotechnology, 2012, 39(12): 1875-1880. |
| [10] | DeLoache WC, Russ ZN, Narcross L, Gonzales AM, Martin VJJ, Dueber JE. An enzyme-coupled biosensor enables (S)-reticuline production in yeast from glucose. Nature Chemical Biology, 2015, 11(7): 465-471. DOI:10.1038/nchembio.1816 |
| [11] | Flurkey A, Cooksey J, Reddy A, Spoonmore K, Rescigno A, Inlow J, Flurkey HW. Enzyme, protein, carbohydrate, and phenolic contaminants in commercial tyrosinase preparations:potential problems affecting tyrosinase activity and inhibition studies. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4760-4768. DOI:10.1021/jf800109a |
| [12] | Mustafi N, Grünberger A, Kohlheyer D, Bott M, Frunzke J. The development and application of a single-cell biosensor for the detection of L-methionine and branched-chain amino acids. Metabolic Engineering, 2012, 14(4): 449-457. DOI:10.1016/j.ymben.2012.02.002 |
| [13] | Santos CNS, Stephanopoulos G. Melanin-based high-throughput screen for L-tyrosine production in Escherichia coli. Applied and Environmental Microbiology, 2008, 74(4): 1190-1197. DOI:10.1128/AEM.02448-07 |
| [14] | Jiang MM, Tian CR, Wang XJ. Characteristics of Agaricus bisporus tyrosinase. Jiangsu Journal of Agricultural Sciences, 2008, 24(2): 194-198. (in Chinese) 蒋萌蒙, 田呈瑞, 王向军. 双孢蘑菇中酪氨酸酶的特性. 江苏农业学报, 2008, 24(2): 194-198. |
| [15] | Faccio G, Kruus K, Saloheimo M, Th?ny-Meyer L. Bacterial tyrosinases and their applications. Process Biochemistry, 2012, 47(12): 1749-1760. DOI:10.1016/j.procbio.2012.08.018 |
| [16] | Liao HJ, Li RJ, Tao M, Bai YJ, Tang J, Tang YM. Isolation, purification and partial characterization of tyrosinase from Yunnan-grown lettuce tip. Food Science, 2017, 38(8): 30-36. (in Chinese) 廖海君, 李蕊伽, 陶敏, 白亚娟, 唐菁, 唐云明. 云南莴笋尖酪氨酸酶分离纯化及酶学性质. 食品科学, 2017, 38(8): 30-36. DOI:10.7506/spkx1002-6630-201708006 |
| [17] | Wichers HJ, Recourt K, Hendriks M, Ebbelaar CEM, Biancone G, Hoeberichts FA, Mooibroek H, Soler-Rivas C. Cloning, expression and characterisation of two tyrosinase cdnas from Agaricus bisporus. Applied Microbiology and Biotechnology, 2003, 61(4): 336-341. DOI:10.1007/s00253-002-1194-2 |
