白思宇, 杨倩, 仇华吉


中国农业科学院哈尔滨兽医研究所, 黑龙江 哈尔滨 150069
收稿日期:2017-04-16;修回日期:2017-06-04;网络出版日期:2017-07-27
基金项目:国家自然科学基金(31572540,31672537)
*通信作者:仇华吉, Tel/Fax:+86-451-51051708;E-mail:huajiqiu@hvri.ac.cn
摘要:干扰素刺激基因(Interferon-stimulated genes,ISGs)作为由干扰素(Interferons,IFNs)诱导表达的基因,在宿主抵抗病毒感染的过程中发挥着至关重要的作用。越来越多的研究表明,ISGs能够靶向病毒复制的不同阶段进而抵抗病毒感染。由于ISGs成员众多,且各自的结构及其在细胞中的定位也各不相同,这决定了ISGs在宿主体内以不同机制来发挥抗病毒作用。本文将简要介绍IFNs如何通过JAK-STAT通路调控ISGs的表达,并归纳和讨论不同ISGs家族蛋白较为典型的抗病毒机制。
关键词: 干扰素刺激基因 干扰素 天然免疫 抗病毒机制
Antiviral mechanisms of interferon-stimulated genes
Siyu Bai, Qian Yang, Huaji Qiu


Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, Heilongjiang Province, China
Received 16 April 2017; Revised 4 June 2017; Published online 27 July 2017
*Corresponding author: Huaji Qiu, Tel/Fax:+86-451-51051708;E-mail:huajiqiu@hvri.ac.cn
Supported by the National Natural Science Foundation of China (31572540, 31672537)
Abstract: Interferons (IFNs) can induce the expression of a series of interferon-stimulated genes (ISGs). As direct-acting antiviral factors, ISGs play important roles in host antiviral defense. More and more studies reveal that ISGs directly or indirectly target multiple steps of the virus life cycle. Since diverse ISGs have different structures and locations in the cell, they exert various antiviral actions through different pathways. This review aimed to give a brief introduction to ISGs expression induced by IFNs through the JAK-STAT pathway, and provide an overview of typical antiviral mechanisms of representative ISGs.
Key words: interferon-stimulated genes interferons innate immunity antiviral mechanism
固有免疫是生命进化选择的必然结果,它是机体抵抗病原体入侵后产生的第一道屏障,而干扰素(Interferons,IFNs)介导的抗病毒作用是其中极为重要的环节。1957年,Isaacs与Lindenmann最先定义了IFNs,意为由细胞产生的、能够干扰流感病毒感染的物质[1]。IFNs是一种分泌型蛋白,由细胞识别病原相关分子模式(Pathogen-associated molecule patterns,PAMPs)诱导产生[2]。IFNs产生后与细胞表面的IFNs受体相结合,进而启动下游JAK-STAT信号通路,并诱导大量干扰素刺激基因(Interferon-stimulated genes,ISGs)的转录。随着IFNs研究的不断深入,研究者最终解析了IFNs是如何通过JAK-STAT通路调控ISGs的表达。但是各种ISGs的抗病毒机理还有待深入研究[3]。
不同病毒感染后会导致宿主体内各种基因表达发生改变,使宿主呈现不同的生理状态。病毒侵入机体后,通过诱导Ⅰ和Ⅲ型IFNs刺激机体细胞产生成百上千种ISGs,进而发挥抗病毒作用。ISGs所表达的蛋白不仅能够直接抑制病毒的复制,而且能够反馈调节IFNs的表达量间接发挥抗病毒作用[3]。现有大量研究报道了多种ISGs蛋白以及多个ISGs家族蛋白的抗病毒作用及相关机制,结果表明,不同的ISGs能够对病毒从入侵到释放的多个阶段产生抑制作用。本文将简述ISGs的诱生机制,并着重叙述ISGs的各种抗病毒机制。
1 ISGs的诱导产生 IFNs能够通过细胞表面受体非常快速地将信号传递至细胞内部,诱导ISGs的表达,发挥抗病毒作用。根据IFNs的受体可将其分为3类,即Ⅰ、Ⅱ及Ⅲ型IFNs。不同种类的细胞因其具体功能不同,可分泌不同类型的IFNs,并通过不同的信号转换途径激活各自的ISGs体系[4-5]。因而,IFNs对ISGs表达的调控及其产物的生物学功能和抗病毒活性是研究IFNs抗病毒机制的核心内容。
IFNs通过JAK-STAT通路将胞外信号传递至胞内后诱导ISGs转录。在没有IFNs刺激的情况下,酪氨酸激酶(Janus kinases,JAKs)以无活性的状态围绕在IFNs受体周围,一旦IFNs与其受体结合后,JAKs被激活。激活的JAKs使转录因子STAT (Signal transducer and activator of transcription)的酪氨酸发生磷酸化,活化的STAT从IFN受体周围离开并进入细胞核调控ISGs的表达。例如Ⅰ型和Ⅲ型IFNs的信号能够使STAT1与STAT2发生磷酸化形成异源二聚体,再与IRF9 (Interferon-regulatory factor 9)结合形成复合物ISGF3 (Interferon-stimulated gene factor 3)。ISGF3能够入核并结合到ISGs的上游序列干扰素刺激应答元件(Interferon-stimulated response elements,ISRE)上,诱导ISGs大量转录(图 1)。IFN-γ与细胞表面的受体结合后,激活JAKs,引起STAT1发生磷酸化并形成同源二聚体,进入细胞核后激活GAS (Gamma-activated sequence)元件,诱导ISGs的表达[6]。而STAT2还可以与IRF9形成复合物,直接入核并调控ISGs的转录[7]。
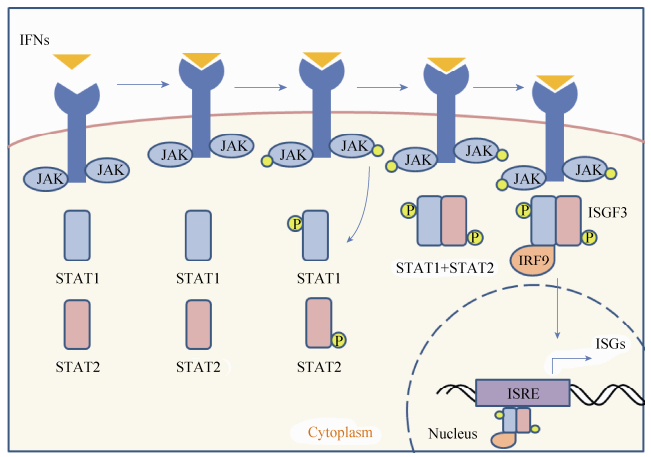 |
| 图 1 Ⅰ型与Ⅲ型干扰素激活胞内的JAK-STAT通路示意图(改编自参考文献[6]) Figure 1 Activation of the JAK-STAT pathway by types Ⅰ and Ⅲ IFNs (adapted from reference [6]). When IFNs bind to their receptors, the JAKs are activated and phosphorylated. And the phosphorylation of JAKs leads to the recruitment and phosphorylation of STAT1 and STAT2, which induce them to dimerize. The heterodimer in turn recruits IRF9 to form ISGF3. And ISGF3 translocates to the nucleus, where it can regulate the genes expression. IFNs: Interferons; JAKs: Janus kinases; STAT: Signal transducer and activator of transcription; IRF9: Interferon-regulatory factor 9; ISGF3: Interferon-stimulated gene factor 3. |
| 图选项 |
2 ISGs的抗病毒作用 IFNs现已被用于治疗病毒性疾病。ISGs作为IFNs抗病毒的主要执行者,其研究价值不言而喻。ISGs表达的蛋白涵盖极广,种类繁杂,且具有多种生物学活性,难以简单地通过结构或功能对其进行全面地分类。病毒的复制周期主要包括入侵、脱壳、复制、装配以及释放阶段,而目前的研究显示,ISGs能够有效靶向病毒复制周期的各个阶段,抑制其复制,从而实现抗病毒作用。因此,本文将以ISGs所针对的病毒复制的不同阶段对ISGs进行分类整理,并以其中几个主要的ISGs家族为例对ISGs的抗病毒功能及相关机制进行阐述。
2.1 针对病毒的入侵阶段
2.1.1 抗黏病毒蛋白(Mx): Mx是第一个被发现具有抑制病毒入侵功能的ISG蛋白,在人体内该家族编码Mx1和Mx2两种蛋白。最初证实,Mx1能够在病毒侵入机体后,阻碍其核酸进入细胞后的早期转录[8]。随着研究手段的丰富,发现该家族蛋白与动力蛋白(Dynamin)家族的蛋白结构上高度相似[9],而Mx1的抗病毒能力高度依赖其保守的结构域,其GTP酶活性能够使高度聚合化的Mx1复合物解离为二聚体以及四聚体,只有以低聚化复合物的形式存在时,Mx1才能够阻碍病毒核酸的进入来发挥抗病毒的功能[9-11]。此外,Mx1不仅能够通过抑制病毒核酸进入胞内来拮抗病毒,还能够通过调节IRF3的磷酸化来反向调节胞内IFNs的产生[12]。该家族另一成员Mx2蛋白,存在于细胞核内与胞浆两个区域,该蛋白末端有核定位信号(NLS),能够被IFN-α上调。研究证实,Mx2具有抗逆转录病毒的活性,上调该蛋白后能够抑制人免疫缺陷病毒(HIV)的增殖[13]。
2.1.2 干扰素诱导跨膜蛋白(IFITM proteins): 人体内存在4种该家族的蛋白,IFITM1、IFITM2、IFITM3和IFITM5,该家族蛋白均能抑制流感病毒的感染。随后研究者们通过基因组学筛选进一步确认,该家族蛋白能够影响流感等多种病毒的侵入以及释放[14]。不同的IFITM家族蛋白针对不同种类的病毒表现出不同的抑制能力[15],IFITM1比IFITM3更显著地抑制冠状病毒与线状病毒的复制,而IFITM3能更有效地拮抗流感病毒[16]。该家族蛋白之所以能够抑制多种病毒增殖,主要是因其能通过降低膜的流动性以及稳定性,来阻碍病毒囊膜与细胞膜相融合从而发挥抗病毒作用[17]。此外,IFITM家族蛋白对流感病毒膜融合的抑制会受到胞外pH调控[18]。
2.1.3 胆固醇25-羟基氧化酶(CH25H): 作为一种能够同时被Ⅰ型和Ⅱ型IFNs上调的蛋白,它能够将胆固醇氧化为25羟基胆固醇(25-Hydroxycholesterol,25HC),CH25H也主要是通过25HC这种可溶性物质来抵抗病毒的入侵。近期研究显示,CH25H的产物25HC具有广泛的抗病毒活性。过表达CH25H或用25HC处理细胞后,发现囊膜病毒的感染被显著地抑制[19]。25HC能够阻碍细胞与多种病毒间的膜融合,这说明脂膜的羟固醇化可能与CH25H的抗病毒作用相关[19]。25HC能够通过影响黄病毒科的寨卡病毒(ZIKV)的膜融合来抑制病毒感染,从而阻止该病毒诱发的小头畸形症状,这进一步说明了CH25H是一种重要的抗病毒蛋白[20]。此外,CH25H能够通过影响拉沙热病毒(LASV) GP1蛋白的糖基化来阻碍病毒与宿主受体的吸附,从而抑制病毒的入侵[21]。
2.2 针对病毒的复制与转录阶段
2.2.1 2′-5′寡腺苷酸合成酶(OAS): OAS (2′-5′-Oligoadenylate synthetase)与PKR (Protein kinase R)是最早被发现的由双链RNA (dsRNA)诱导产生的有活性的蛋白激酶,这两种酶依赖各自的功能抑制病毒蛋白合成及病毒感染。由IFNs诱导产生的OAS起初并无活性,只有在dsRNA激活后才能够发挥抗病毒功能[22],激活后OAS能够诱导ATP水解产生2′-5′寡腺苷酸,从而激活内源性的内切核糖核酸酶L (RNase L);活化的RNase L可降解病毒和宿主的RNA,抑制蛋白合成,进而发挥抗病毒功能[23]。生物体内不同的OAS蛋白具有不同的结构,本团队在近期研究中发现,猪源OASL蛋白并不依赖其活化RNase L通路来拮抗猪瘟病毒(CSFV),而是通过与MDA5互作从而增强其拮抗CSFV的能力[24]。
2.2.2 双链RNA依赖性蛋白激酶R(PKR): PKR能够被病毒入侵细胞后复制过程产生的dsRNA激活。在PKR的氨基端有一个能够识别dsRNA的结构域,其羧基端有一个激酶功能域。该蛋白在胞浆中原本处于无活性的状态,当病毒的双链RNA被其识别后该蛋白发生磷酸化,并形成二聚体进而激活翻译起始因子eIF2α (Eukaryotic initiation factor 2α,eIF2α)[25]。该翻译起始因子的激活不仅能够抑制病毒mRNA的翻译阻碍病毒元件的合成,还能够调控细胞自身以及病毒所诱导的自噬来拮抗病毒[26-28]。PKR可通过磷酸化激活NF-κB从而上调IFNs,使局部组织迅速对病毒入侵产生应激。此外,PKR可引起细胞凋亡进而阻碍病毒的传播[29],由于该蛋白的激酶活性,使其抗病毒机制相对来说比较复杂。
2.2.3 锌指抗病毒蛋白(ZAP): ZAP是哺乳动物体内的一种抗病毒蛋白,该蛋白能够有效地抑制多种RNA病毒(如反转录病毒、甲病毒以及线状病毒等)复制[30]。人源ZAP蛋白的mRNA经过不同的剪切方式能够得到大小不同的两种蛋白,分子量较大的为hZAP-L,较小的为hZAP-S。IFNs或IPS-1处理能上调ZAP蛋白的表达,而ZAP蛋白能够识别并结合病毒RNA上的ZAP应答元件(ZAP-responsive elements,ZRE),随后募集多种外切酶降解病毒RNA。已有研究证实ZAP蛋白能利用其自身的锌指结构域识别病毒的ZRE,从而降解乙型肝炎病毒(HBV)的前体RNA来抑制HBV的复制[31]。最近发现,ZAP蛋白还能靶向病毒的5'-UTR并抑制与心脏相关的炎症因子的表达,从而抑制柯萨奇病毒的感染[32]。
2.2.4 IFIT蛋白家族: IFIT蛋白是指由IFNs诱导的、含肽重复结构域的蛋白(Interferon-induced protein with tetratricopeptide repeats,IFIT)[33]。该家族蛋白在人体内包含有4个家族成员IFIT1、IFIT2、IFIT3及IFIT5,主要由大量的肽重复序列结构域(Tetratricopeptide repeats,TPRs)构成[34]。IFIT家族蛋白能够调节转录起始、细胞增殖与细胞迁移等多种生命活动。该家族的TPRs结构域可介导蛋白与蛋白间的互作,该家族中的IFIT1与IFIT2能够通过与真核起始因子3 (Eukaryotic initiation factor 3,eIF3)的e亚基与c亚基互作来抑制翻译复合物的形成,从而抑制翻译的起始[35]。此外,在病毒感染或是IFNs诱导后,IFIT家族蛋白能够与其他家族蛋白以及数种RNA结合蛋白形成复合体,从而清除病毒[33]。近期随着IFIT家族蛋白结构的解析,发现IFIT1与IFIT5含有一个带有正电的结构能够特异性地结合单链RNA的5'三磷酸,这表明IFIT家族蛋白不仅能够通过影响翻译复合体的形成来影响RNA翻译,还可能直接与RNA相结合从而发挥抗病毒作用[34]。
2.2.5 干扰素刺激基因15 (ISG15): 人源ISG15的mRNA编码一个分子量为17 kDa的前体蛋白后,该蛋白的羧基端被切去8个氨基酸形成分子量为15 kDa的成熟蛋白质[36]。ISG15是泛素样蛋白(Ubiquitin-like modifiers,UBLs)家族中的一员,该家族蛋白能够与靶蛋白结合将靶蛋白ISG化(ISGylation),从而发挥其活性。UBLs蛋白的氨基酸序列与泛素蛋白的相似性有限,但是在三维结构上却较为相近[37]。ISG15作为一种分泌型细胞因子,可以通过其自身的LRLRGG结构域结合靶蛋白,从而使靶蛋白ISG化。ISG化具有广泛的生物学活性,如IRF3的ISG化能够通过阻碍其泛素化而增加IRF3的稳定性[38]。宿主蛋白4EHP的ISG化能够增加自身对mRNA 5'端的亲和力,从而促进4EHP对mRNA翻译起始的抑制[39]。ISG15能够通过与MVB蛋白互作使其ISG化,并引起该蛋白的降解,从而减少外泌体的分泌[40]。同时ISG15能够使T淋巴细胞与NK细胞释放IFN-γ,ISG15缺陷型小鼠与人更易遭受严重的分枝杆菌感染[41]。
2.2.6 鸟苷酸结合蛋白(GBPs): GBPs与Mx同属于GTP酶家族,存在于大部分脊椎动物体内[42]。在大部分细胞中,GBPs蛋白由多种细胞因子诱导产生,如白介素(IL-1β)、Ⅰ型IFNs及肿瘤坏死因子,而IFN-γ能够更为有效地诱导GBPs的表达[43-44]。GBPs不仅能够通过其GTP酶活性发挥多种生物学功能,还能够以不依赖GTP酶活性的方式通过促炎性因子来调节血管生成[43, 45]。近期,我们发现,GBP1能够通过其GTP酶活性来抑制猪瘟病毒(CSFV)的复制[46]。也有研究发现,GBP5蛋白能够通过影响HIV囊膜蛋白的合成与修饰来抑制HIV的感染,而该过程并不依赖于GBP5的GTP酶活性[47]。
2.2.7 硫氧还蛋白(Trxs): 硫氧还蛋白是广泛存在于细菌以及动植物体内的一种氧化还原蛋白,该蛋白在动植物体内具有包括氧化还原功能在内的多种生物学活性。Trxs具有CGPC活性位点,是生物细胞中重要的二硫化物还原酶[48]。研究者通过免疫电镜确定,Trxs蛋白位于大肠杆菌细胞周至间隙以及大肠杆菌的拟核区两个区域[49]。Trxs蛋白在抗病毒方面的报道较少,最近本团队发现,Trx2能够通过加强转录因子p65的核转位来增强NF-κB的转录,从而实现其抗病毒功能[50]。
2.3 针对病毒的释放阶段
2.3.1 Viperin蛋白: Viperin是一种能够有效抑制病毒释放的抗病毒蛋白,在病毒感染的整个过程中发挥了重要的抗病毒作用。多种因子可诱导产生该蛋白,如Ⅰ型和Ⅲ型IFNs、DNA和RNA病毒衣壳蛋白等。Viperin可通过两种途径诱生,其一是JAK-STAT通路,其二是由IRF3直接刺激[2]。Viperin能够抑制多种DNA和RNA病毒,如丙型肝炎病毒(HCV)、流感病毒(Influenza virus)及HIV等[51]。在感染HCMV的细胞中,随着Viperin在细胞内的迁移,HCMV的结构蛋白合成以及HCMV的装配和成熟都受到抑制[52]。目前研究表明,Viperin可通过破坏细胞膜上的脂筏来抑制流感病毒的出芽及释放[53]。
2.3.2 骨髓基质细胞抗原2 (Tetherin): Tetherin是由BST2基因编码的一种脂筏相关跨膜蛋白[54]。Ⅰ型IFNs能够诱导Tetherin蛋白的表达,起初在Perez-Caballero等的研究中发现,该蛋白是一种能够与病毒囊膜相结合的跨膜蛋白,使病毒锚定在细胞膜上,从而抑制病毒的释放[55]。随后进一步确定了Tetherin蛋白能够通过形成二聚体,一端存在于HIV囊膜上另一端存在于宿主的细胞膜上,从而将新形成的HIV粒子锚定在宿主细胞表面[56]。此外Tetherin蛋白还能够与SIV的囊膜蛋白相互作用,从而抑制SIV颗粒从宿主细胞表面释放[57]。Tetherin蛋白之所以能够拮抗多种有囊膜病毒,也可能是因为该蛋白与病毒囊膜蛋白均能够靶向宿主细胞的磷脂双分子层,从而通过蛋白互作等方式来抑制病毒出芽、释放的过程。
2.4 针对病毒复制的多个阶段 TRIM家族蛋白:TRIM家族是一个成员众多的蛋白家族,该家族至少包含有60余种蛋白。该家族蛋白因为大多具有RING结构域、B-box结构域以及卷曲螺旋结构域3个极为保守的结构域而得名。根据蛋白结构、基因组结构以及进化的方式TRIM家族蛋白可被分为两类。第一类TRIM家族蛋白的C端具有多样性,而且保守地存在于脊椎动物和无脊椎生物体内。第二类TRIM家族蛋白不存在于无脊椎生物体内,且该类TRIM蛋白的C端具有一个独特的SPRY结构域[58]。TRIM蛋白在宿主免疫防御系统中起到重要作用,能够诱导细胞因子和促炎性因子的产生,还参与调节宿主的自噬和适应性免疫等[59-60]。TRIM家族蛋白不仅能够由IFNs诱导产生,还能够反过来调节IFNs。有研究证实,信号因子Ⅰ (SOCS1)能够通过负调控JAK-STAT通路来下调ISGs的表达。而TRIM8能与SOCS1结合,从而促进SOCS1的降解,抑制SOCS1对IFN-γ信号的下调[61]。TRIM家族的抗病毒功能和机制是多样化的。TRIM52能够与日本脑炎病毒(JEV)的非结构蛋白NS2A互作,发挥其E3泛素连接酶的活性并诱导NS2A泛素化以及降解[62]。TRIM5α能够通过识别成熟病毒衣壳蛋白的特定结构域来阻碍HIV的脱壳[63];TRIM11与TRIM32能够抑制HIV基因的表达[64];TRIM22与TRIM15能够抑制HIV的装配[65]。这说明TRIM蛋白的抗病毒作用能够靶向病毒感染生命周期的多个阶段。
总之,ISGs作为宿主发挥抗病毒作用的一类效应分子,几乎可以靶向病毒侵入、脱壳、基因组复制、病毒粒子装配以及释放等环节,从而抑制病毒的增殖,如图 2。因此,研究ISGs有助于深入了解宿主抗病毒机理,揭示病毒逃避宿主抗病毒机制。
 |
| 图 2 ISGs抑制病毒周期各阶段示意图 Figure 2 ISG proteins target specific steps of the virus life cycle. IFNs can induce the expression of a series of ISGs, which target different steps of the virus life cycle. Mx: Myxovirus resistance; IFITM: Interferon-induced transmembrane family; CH25H: Cholesterol-25-hydroxylase; OAS: 2'-5'-Oligoadenylate synthetase; PKR: Protein kinase R; ZAP: Zinc-finger antiviral protein; IFIT: IFN-induced protein with tetratricopeptide repeats family; ISG15: Interferon-stimulated gene 15; GBPs: Guanylate-binding proteins; Trxs: Thioredoxins; TRIM: Tripartite motif family. |
| 图选项 |
3 问题和展望 IFNs激活ISGs是固有免疫中发挥抗病毒效应极为关键的一环。除上述抗病毒相关的效应蛋白外,IFNs还可以诱导很多抗病毒ISGs。例如DDX60、IFI44L、IFI6、MAP3K4、MOV10、NAMPT、RTP4、TREX1和UNC84B等ISGs表达的蛋白也具有抗病毒的作用[66],且某些ISGs表达的效应蛋白的抗病毒活性具有病毒特异性。而某些ISGs效应蛋白在对一些病毒产生抑制的同时也可能刺激其他病毒的复制,如ISG15促进HCV的复制,并抑制干扰素抗HCV活性[67]。IFNs能诱导的ISGs数量极为庞大,尽管多年来已经鉴定出许多ISGs,但只有部分ISGs的抗病毒活性和相关机制得以阐明,绝大多数ISGs的相关生物学和抗病毒作用机制还有待于深入探索。
研究ISGs不仅有助于深入了解宿主抗病毒机制,也为开辟新的抗病毒策略及开发新型预防和治疗病毒性疾病的方法提供理论依据和参考。目前IFNs干预仍是治疗很多病毒性疾病的主要方法,但很多病毒性疾病的患者对IFNs治疗的应答效率在逐步降低。寻找新型的抗病毒靶点以及研发价格便宜、持续时间长的抗病毒药物迫在眉睫。许多干扰素诱导蛋白可以直接作用于病毒,或通过影响宿主直接抑制病毒基因转录、降解病毒RNA、抑制病毒蛋白的翻译和修饰功能等来拮抗病毒。因而对ISGs功能更深层次的研究将有助于开发新型的更有效抗病毒的靶标药物,为小分子抑制剂的研发开拓了新的领域。研究抗病毒ISGs和相关机制,既具有突出的科学意义又具有潜在的应用价值,其前景极为诱人,为控制病毒感染提供了新的方向。
然而,对于ISGs的抗病毒机理及临床应用的研究还存在很多问题。不同病毒感染的细胞中诱导的ISGs种类和表达量与IFNs处理后的细胞存在明显差异。IFNs处理后的细胞ISGs表达更加趋近于整体上调,而病毒感染细胞后,ISGs则主要表现为部分ISGs明显上调,而这些明显上调的ISGs往往发挥着重要的抗病毒作用,其机制尚未得到解析。此外,虽然ISGs作为药物靶点前景宽广,但是困难重重。首先,ISGs在体内往往有多种功能,盲目地作为靶标药物有很大的风险。其次,ISGs在机体内大多以一种组合的方式对抗不同病毒,很难通过调控单一ISG达到清除病毒的目的,且改变某一种ISG的表达量很可能会破坏这一组合,对机体其他抗病毒效应产生影响。因此,ISGs抗病毒作用机制及其相关应用的研究仍然任重而道远。
References
| [1] | Isaacs A, Lindenmann J. Pillars article:virus interference. Ⅰ. the interferon. Proc R Soc Lond B Biol Sci, 1957, 147: 258-267. DOI:10.1098/rspb.1957.0048 |
| [2] | Pestka S. The interferons:50 years after their discovery, there is much more to learn. Journal of Biological Chemistry, 2007, 282(28): 20047-20051. DOI:10.1074/jbc.R700004200 |
| [3] | Schneider WM, Chevillotte MD, Rice CM. Interferon-stimulated genes:a complex web of host defenses. Annual Review of Immunology, 2014, 32: 513-545. DOI:10.1146/annurev-immunol-032713-120231 |
| [4] | Secombes CJ, Zou J. Evolution of interferons and interferon receptors. Frontiers in Immunology, 2017, 8: 209. |
| [5] | Moraga I, Harari D, Schreiber G, Uzé G, Pellegrini S. Receptor density is key to the alpha2/beta interferon differential activities. Molecular and Cellular Biology, 2009, 29(17): 4778-4787. DOI:10.1128/MCB.01808-08 |
| [6] | O'Shea JJ, Schwartz DM, Villarino AV, Gadina M, McInnes IB, Laurence A. The JAK-STAT pathway:impact on human disease and therapeutic intervention. Annual Review of Medicine, 2015, 66: 311-328. DOI:10.1146/annurev-med-051113-024537 |
| [7] | Fink K, Grandvaux N. STAT2 and IRF9:beyond ISGF3. JAK-STAT, 2013, 2(4): e27521. DOI:10.4161/jkst.27521 |
| [8] | Zürcher T, Pavlovic J, Staeheli P. Mechanism of human MxA protein action:variants with changed antiviral properties. The EMBO Journal, 1992, 11(4): 1657-1661. |
| [9] | Nigg PE, Pavlovic J. Oligomerization and GTP-binding requirements of MxA for viral target recognition and antiviral activity against influenza A virus. The Journal of Biological Chemistry, 2015, 290(50): 29893-29906. DOI:10.1074/jbc.M115.681494 |
| [10] | Kochs G, Haller O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(5): 2082-2086. DOI:10.1073/pnas.96.5.2082 |
| [11] | Verhelst J, van Hoecke L, Spitaels J, de Vlieger D, Kolpe A, Saelens X. Chemical-controlled activation of antiviral myxovirus resistance protein 1. The Journal of Biological Chemistry, 2017, 292(6): 2226-2236. DOI:10.1074/jbc.M116.748806 |
| [12] | Schattgen SA, Oguin TH, Thomas PG. The antiviral molecule Mx1 positively regulates the induction of type Ⅰ IFN in response to influenza infection. The Journal of Immunology, 2016, 196(S1): 202.7. |
| [13] | Goujon C, Moncorgé O, Bauby H, Doyle T, Ward CC, Schaller T, Hué S, Barclay WS, Schulz R, Malim MH. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature, 2013, 502(7472): 559-562. DOI:10.1038/nature12542 |
| [14] | Brass AL, Huang IC, Benita Y, John SP, Krishnan MN, Feeley EM, Ryan BJ, Weyer JL, van der Weyden L, Fikrig E, Adams DJ, Xavier RJ, Farzan M, Elledge SJ. The IFITM proteins mediate cellular resistance to influenza A H1N1 virus, West Nile virus, and dengue virus. Cell, 2009, 139(7): 1243-1254. DOI:10.1016/j.cell.2009.12.017 |
| [15] | Lewin AR, Reid LE, McMahon M, Stark GR, Kerr IM. Molecular analysis of a human interferon-inducible gene family. European Journal of Biochemistry, 1991, 199(2): 417-423. DOI:10.1111/ejb.1991.199.issue-2 |
| [16] | Huang IC, Bailey CC, Weyer JL, Radoshitzky SR, Becker MM, Chiang JJ, Brass AL, Ahmed AA, Chi XL, Dong L, Longobardi LE, Boltz D, Kuhn JH, Elledge SJ, Bavari S, Denison MR, Choe H, Farzan M. Distinct patterns of IFITM-mediated restriction of filoviruses, SARS coronavirus, and influenza A virus. PLoS Pathogens, 2011, 7(1): e1001258. DOI:10.1371/journal.ppat.1001258 |
| [17] | Li K, Markosyan RM, Zheng YM, Golfetto O, Bungart B, Li MH, Ding SL, He YX, Liang C, Lee JC, Gratton E, Cohen FS, Liu SL. IFITM proteins restrict viral membrane hemifusion. PLoS Pathogens, 2013, 9(1): e1003124. DOI:10.1371/journal.ppat.1003124 |
| [18] | Gerlach T, Hensen L, Matrosovich T, Bergmann J, Winkler M, Peteranderl C, Klenk HD, Weber F, Herold S, P?hlmann S, Matrosovich M. pH optimum of hemagglutinin-mediated membrane fusion determines sensitivity of influenza A viruses to the interferon-induced antiviral state and IFITMs. Journal of Virology, 2017, 91(11): e00246-17. |
| [19] | Liu SY, Aliyari R, Chikere K, Li GM, Marsden MD, Smith JK, Pernet O, Guo HT, Nusbaum R, Zack JA, Freiberg AN, Su LS, Lee B, Cheng GH. Interferon-inducible cholesterol-25-hydroxylase broadly inhibits viral entry by production of 25-hydroxycholesterol. Immunity, 2013, 38(1): 92-105. DOI:10.1016/j.immuni.2012.11.005 |
| [20] | Li CF, Deng YQ, Wang S, Ma F, Aliyari R, Huang XY, Zhang NN, Watanabe M, Dong HL, Liu P, Li XF, Ye Q, Tian M, Hong S, Fan JW, Zhao H, Li LL, Vishlaghi N, Buth JE, Au C, Liu Y, Lu N, Du PS, Qin FXF, Zhang B, Gong DY, Dai XH, Sun R, Novitch BG, Xu ZH, Qin CF, Cheng GH. 25-Hydroxycholesterol protects host against Zika virus infection and its associated microcephaly in a mouse model. Immunity, 2017, 46(3): 446-456. DOI:10.1016/j.immuni.2017.02.012 |
| [21] | Shrivastava-Ranjan P, Bergeron , Chakrabarti AK, Albari o CG, Flint M, Nichol ST, Spiropoulou CF. 25-hydroxycholesterol inhibition of Lassa virus infection through aberrant GP1 glycosylation. mBio, 2016, 7(6): e01808-16. |
| [22] | Hovanessian AG. Interferon-induced and double-stranded RNA-activated enzymes:a specific protein kinase and 2',5'-oligoadenylate synthetases. Journal of Interferon Research, 1991, 11(4): 199-205. DOI:10.1089/jir.1991.11.199 |
| [23] | Floyd-Smith G, Slattery E, Lengyel P. Interferon action:RNA cleavage pattern of a (2'-5' )oligoadenylate——dependent endonuclease. Science, 1981, 212(4498): 1030-1032. DOI:10.1126/science.6165080 |
| [24] | Li LF, Yu J, Zhang Y, Yang Q, Li YF, Zhang L, Wang J, Li S, Luo Y, Sun Y, Qiu HJ. Interferon-inducible oligoadenylate synthetase-like protein acts as an antiviral effector against classical swine fever virus via the MDA5-mediated type Ⅰ interferon-signaling pathway. Journal of Virology, 2017, 91(11): e01514-16. |
| [25] | Sudhakar A, Ramachandran A, Ghosh S, Hasnain SE, Kaufman RJ, Ramaiah KVA. Phosphorylation of serine 51 in initiation factor 2α(eIF2α) promotes complex formation between eIF2α(P) and eIF2B and causes inhibition in the guanine nucleotide exchange activity of eIF2B. Biochemistry, 2000, 39(42): 12929-12938. DOI:10.1021/bi0008682 |
| [26] | Feng GS, Chong K, Kumar A, Williams BR. Identification of double-stranded RNA-binding domains in the interferon-induced double-stranded RNA-activated p68 kinase. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(12): 5447-5451. DOI:10.1073/pnas.89.12.5447 |
| [27] | Amici C, La Frazia S, Brunelli C, Balsamo M, Angelini M, Santoro MG. Inhibition of viral protein translation by indomethacin in vesicular stomatitis virus infection:role of eIF2α kinase PKR. Cellular Microbiology, 2015, 17(9): 1391-1404. DOI:10.1111/cmi.v17.9 |
| [28] | Tallóczy Z, Jiang WX, Virgin IV HW, Leib DA, Scheuner D, Kaufman RJ, Eskelinen EL, Levine B. Regulation of starvation-and virus-induced autophagy by the eIF2α kinase signaling pathway. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(1): 190-195. DOI:10.1073/pnas.012485299 |
| [29] | Wang YY, Men M, Xie B, Shan JG, Wang CX, Liu JD, Zheng H, Yang WG, Xue S, Guo CF. Inhibition of PKR protects against H2O2-induced injury on neonatal cardiac myocytes by attenuating apoptosis and inflammation. Scientific Reports, 2016, 6: 38753. DOI:10.1038/srep38753 |
| [30] | Müller S, M?ller P, Bick MJ, Wurr S, Becker S, Günther S, Kümmerer BM. Inhibition of filovirus replication by the zinc finger antiviral protein. Journal of Virology, 2007, 81(5): 2391-2400. DOI:10.1128/JVI.01601-06 |
| [31] | Mao RC, Nie H, Cai DW, Zhang JM, Liu HY, Yan R, Cuconati A, Block TM, Guo JT, Guo HT. Inhibition of hepatitis B virus replication by the host zinc finger antiviral protein. PLoS Pathogens, 2013, 9(7): e1003494. DOI:10.1371/journal.ppat.1003494 |
| [32] | Li M, Yan KP, Wei L, Yang J, Lu CY, Xiong F, Zheng CF, Xu W. Zinc finger antiviral protein inhibits coxsackievirus B3 virus replication and protects against viral myocarditis. Antiviral Research, 2015, 123: 50-61. DOI:10.1016/j.antiviral.2015.09.001 |
| [33] | Pichlmair A, Lassnig C, Eberle CA, Górna MW, Baumann CL, Burkard TR, Bürckstümmer T, Stefanovic A, Krieger S, Bennett KL, Rülicke T, Weber F, Colinge J, Müller M, Superti-Furga G. IFIT1 is an antiviral protein that recognizes 5'-triphosphate RNA. Nature Immunology, 2011, 12(7): 624-630. DOI:10.1038/ni.2048 |
| [34] | Abbas YM, Pichlmair A, Górna MW, Superti-Furga G, Nagar B. Structural basis for viral 5'-PPP-RNA recognition by human IFIT proteins. Nature, 2013, 494(7435): 60-64. DOI:10.1038/nature11783 |
| [35] | Terenzi F, Hui DJ, Merrick WC, Sen GC. Distinct induction patterns and functions of two closely related interferon-inducible human genes, ISG54 and ISG56. Journal of Biological Chemistry, 2006, 281(45): 34064-34071. DOI:10.1074/jbc.M605771200 |
| [36] | Reich N, Evans B, Levy D, Fahey D, Knight E Jr, Darnell JE Jr. Interferon-induced transcription of a gene encoding a 15-kDa protein depends on an upstream enhancer element. Proceedings of the National Academy of Sciences of the United States of America, 1987, 84(18): 6394-6398. DOI:10.1073/pnas.84.18.6394 |
| [37] | Andersen JB, Hassel BA. The interferon regulated ubiquitin-like protein, ISG15, in tumorigenesis:friend or foe?. Cytokine & Growth Factor Reviews, 2006, 17(6): 411-421. |
| [38] | Shi HX, Yang K, Liu X, Liu XY, Wei B, Shan YF, Zhu LH, Wang C. Positive regulation of interferon regulatory factor 3 activation by Herc5 via ISG15 modification. Molecular and Cellular Biology, 2010, 30(10): 2424-2436. DOI:10.1128/MCB.01466-09 |
| [39] | Okumura F, Zou WG, Zhang DE. ISG15 modification of the eIF4E cognate 4EHP enhances cap structure-binding activity of 4EHP. Genes & Development, 2007, 21(3): 255-260. |
| [40] | Villarroya-Beltri C, Baixauli F, Mittelbrunn M, Fernández-Delgado I, Torralba D, Moreno-Gonzalo O, Baldanta S, Enrich C, Guerra S, Sánchez-Madrid F. ISGylation controls exosome secretion by promoting lysosomal degradation of MVB proteins. Nature Communications, 2016, 7: 13588. DOI:10.1038/ncomms13588 |
| [41] | Bogunovic D, Boisson-Dupuis S, Casanova JL. ISG15:leading a double life as a secreted molecule. Experimental and Molecular Medicine, 2013, 45: e18. DOI:10.1038/emm.2013.36 |
| [42] | Vestal DJ, Jeyaratnam JA. The guanylate-binding proteins:emerging insights into the biochemical properties and functions of this family of large interferon-induced guanosine triphosphatase. Journal of Interferon & Cytokine Research, 2011, 31(1): 89-97. |
| [43] | Guenzi E, T?polt K, Cornali E, Lubeseder-Martellato C, J?rg A, Matzen K, Zietz C, Kremmer E, Nappi F, Schwemmle M, Hohenadl C, Barillari G, Tschachler E, Monini P, Ensoli B, Stürzl M. The helical domain of GBP-1 mediates the inhibition of endothelial cell proliferation by inflammatory cytokines. The EMBO Journal, 2001, 20(20): 5543-5811. DOI:10.1093/emboj/20.20.5543 |
| [44] | Man SM, Place DE, Kuriakose T, Kanneganti TD. Interferon-inducible guanylate-binding proteins at the interface of cell-autonomous immunity and inflammasome activation. Journal of Leukocyte Biology, 2017, 101(1): 143-150. DOI:10.1189/jlb.4MR0516-223R |
| [45] | Guenzi E, T?polt K, Lubeseder-Martellato C, J?rg A, Naschberger E, Benelli R, Albini A, Stürzl M. The guanylate binding protein-1 GTPase controls the invasive and angiogenic capability of endothelial cells through inhibition of MMP-1 expression. The EMBO Journal, 2003, 22(15): 3772-3782. DOI:10.1093/emboj/cdg382 |
| [46] | Li LF, Yu JH, Li YF, Wang JH, Li S, Zhang LK, Xia SL, Yang Q, Wang X, Yu SX, Luo YZ, Sun Y, Zhu Y, Munir M, Qiu HJ. Guanylate-binding protein 1, an interferon-induced GTPase, exerts an antiviral activity against classical swine fever virus depending on its GTPase activity. Journal of Virology, 2016, 90(9): 4412-4426. DOI:10.1128/JVI.02718-15 |
| [47] | Krapp C, Hotter D, Gawanbacht A, McLaren PJ, Kluge SF, Stürzel CM, Mack K, Reith E, Engelhart S, Ciuffi A, Hornung V, Sauter D, Telenti A, Kirchhoff F. Guanylate binding protein (GBP) 5 is an interferon-inducible inhibitor of HIV-1 infectivity. Cell Host & Microbe, 2016, 19(4): 504-514. |
| [48] | Guevara-Flores A, De Jesús Martínez-González J, Rendón JL, Del Arenal IP. The architecture of thiol antioxidant systems among invertebrate parasites. Molecules, 2017, 22(2): 259. |
| [49] | Nygren H, Rozell B, Holmgren A, Hansson HA. Immunoelectron microscopic localization of glutaredoxin and thioredoxin in Escherichia coli cells. FEBS Letters, 1981, 133(1): 145-150. DOI:10.1016/0014-5793(81)80492-9 |
| [50] | Li S, Wang JH, He WR, Feng S, Li YF, Wang X, Liao YJ, Qin HY, Li LF, Dong H, Sun Y, Luo YZ, Qiu HJ. Thioredoxin 2 is a novel E2-interacting protein that inhibits the replication of classical swine fever virus. Journal of Virology, 2015, 89(16): 8510-8524. DOI:10.1128/JVI.00429-15 |
| [51] | Mattijssen S, Pruijn GJM. Viperin, a key player in the antiviral response. Microbes and Infection, 2012, 14(5): 419-426. DOI:10.1016/j.micinf.2011.11.015 |
| [52] | Chin KC, Cresswell P. Viperin (cig5), an IFN-inducible antiviral protein directly induced by human cytomegalovirus. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(26): 15125-15130. DOI:10.1073/pnas.011593298 |
| [53] | Wang XY, Hinson ER, Cresswell P. The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts. Cell Host & Microbe, 2007, 2(2): 96-105. |
| [54] | Simon V, Bloch N, Landau NR. Intrinsic host restrictions to HIV-1 and mechanisms of viral escape. Nature Immunology, 2015, 16(6): 546-553. DOI:10.1038/ni.3156 |
| [55] | Perez-Caballero D, Zang T, Ebrahimi A, McNatt MW, Gregory DA, Johnson MC, Bieniasz PD. Tetherin inhibits HIV-1 release by directly tethering virions to cells. Cell, 2009, 139(3): 499-511. DOI:10.1016/j.cell.2009.08.039 |
| [56] | Venkatesh S, Bieniasz PD. Mechanism of HIV-1 virion entrapment by tetherin. PLoS Pathogens, 2013, 9(7): e1003483. DOI:10.1371/journal.ppat.1003483 |
| [57] | Serra-Moreno R, Zimmermann K, Stern LJ, Evans DT. Tetherin/BST-2 Antagonism by Nef depends on a direct physical interaction between Nef and tetherin, and on clathrin-mediated endocytosis. PLoS Pathogens, 2013, 9(7): e1003487. DOI:10.1371/journal.ppat.1003487 |
| [58] | Sardiello M, Cairo S, Fontanella B, Ballabio A, Meroni G. Genomic analysis of the TRIM family reveals two groups of genes with distinct evolutionary properties. BMC Evolutionary Biology, 2008, 8: 225. DOI:10.1186/1471-2148-8-225 |
| [59] | Uchil PD, Hinz A, Siegel S, Coenen-Stass A, Pertel T, Luban J, Mothes W. TRIM protein-mediated regulation of inflammatory and innate immune signaling and its association with antiretroviral activity. Journal of Virology, 2013, 87(1): 257-272. DOI:10.1128/JVI.01804-12 |
| [60] | Mandell MA, Jain A, Arko-Mensah J, Chauhan S, Kimura T, Dinkins C, Silvestri G, Münch J, Kirchhoff F, Simonsen A, Wei YJ, Levine B, Johansen T, Deretic V. TRIM proteins regulate autophagy and can target autophagic substrates by direct recognition. Developmental Cell, 2014, 30(4): 394-409. DOI:10.1016/j.devcel.2014.06.013 |
| [61] | Toniato E, Chen XP, Losman J, Flati V, Donahue L, Rothman P. TRIM8/GERP RING finger protein interacts with SOCS-1. The Journal of Biological Chemistry, 2002, 277(40): 37315-37322. DOI:10.1074/jbc.M205900200 |
| [62] | Fan WC, Wu MG, Qian SH, Zhou Y, Chen HC, Li XM, Qian P. TRIM52 inhibits Japanese encephalitis virus replication by degrading the viral NS2A. Scientific Reports, 2016, 6: 33698. DOI:10.1038/srep33698 |
| [63] | Wu XL, Anderson JL, Campbell EM, Joseph AM, Hope TJ. Proteasome inhibitors uncouple rhesus TRIM5α restriction of HIV-1 reverse transcription and infection. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(19): 7465-7470. DOI:10.1073/pnas.0510483103 |
| [64] | Uchil PD, Quinlan BD, Chan WT, Luna JM, Mothes W. TRIM E3 ligases interfere with early and late stages of the retroviral life cycle. PLoS Pathogens, 2008, 4(2): e16. DOI:10.1371/journal.ppat.0040016 |
| [65] | Barr SD, Smiley JR, Bushman FD. The interferon response inhibits HIV particle production by induction of TRIM22. PLoS Pathogens, 2008, 4(2): e1000007. DOI:10.1371/journal.ppat.1000007 |
| [66] | Schoggins JW, Wilson SJ, Panis M, Murphy MY, Jones CT, Bieniasz P, Rice CM. A diverse range of gene products are effectors of the type Ⅰ interferon antiviral response. Nature, 2011, 472(7344): 481-485. DOI:10.1038/nature09907 |
| [67] | Chen LM, Sun J, Meng L, Heathcote J, Edwards AM, McGilvray ID. ISG15, a ubiquitin-like interferon-stimulated gene, promotes hepatitis C virus production in vitro:implications for chronic infection and response to treatment. Journal of General Virology, 2010, 91(2): 382-388. DOI:10.1099/vir.0.015388-0 |
