杨秀清

 , 商慧慧
, 商慧慧 山西大学生物技术研究所, 化学生物学与分子工程教育部重点实验室, 山西 太原 030006
收稿日期:2017-10-18;修回日期:2017-12-19;网络出版日期:2017-12-28
基金项目:山西省自然科学基金(2014011030-3);山西省煤层气联合研究基金(2015012002);山西省煤基重点科技攻关项目(MQ2014-03)
*通信作者:杨秀清, Tel/Fax:+86-351-7010215;E-mail:xiuqyang@sxu.edu.cn
摘要:[目的]研究红球菌R04细胞的分裂方式及联苯对其形态和细胞分裂的影响。[方法]以一株多氯联苯降解菌株(Rhodococcus sp.R04)为研究对象,利用荧光显微镜、扫描电子显微镜及透射电子显微镜分析红球菌R04在不同培养条件下的细胞分裂。[结果]红球菌R04细胞表现出对称分裂(约占30%)和不对称分裂(约占70%)两种分裂方式,且培养条件不影响不对称分裂细胞所占的比例。细胞分裂过程中,隔膜主要分布于细胞长度的30%-50%。在联苯的分解代谢过程中,红球菌R04细胞的生长分裂会受到联苯的抑制,但不影响红球菌R04细胞的分裂方式,在联苯胁迫下,细胞形成丝状化,表现出异常分裂,随着培养时间的延长,在细胞生长指数后期至转换期,细胞能够进行正常分裂。[结论]环境异生型化合物联苯/多氯联苯对其降解菌株——红球菌R04细胞的生长和分裂有较强影响,但是并不影响其分裂方式。
关键词: 不对称分裂 细菌细胞分裂 联苯/多氯联苯 红球菌R04
Asymmetric cell division of Rhodococcus sp.R04 and its division inhibition under biphenyl stress
Xiuqing Yang

 , Huihui Shang
, Huihui Shang Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, Shanxi Province, China
Received 18 October 2017; Revised 19 December 2017; Published online 28 December 2017
*Corresponding author: Xiuqing Yang, Tel/Fax: +86-351-7010215; E-mail: xiuqyang@sxu.edu.cn
Supported by the Natural Science Foundation of Shanxi Province (2014011030-3), by the Natural Science and CBM Joint Foundation of Shanxi (2015012002) and by the Key Scientific and Technological Project of Shanxi (MQ2014-03)
Abstract: [Objective]To study the division of Rhodococcus sp. R04 cells and the effect of biphenyl on cellular morphology and cell division.[Methods]Using fluorescence microscopy, scanning electron microscopy and transmission electron microscopy, we analyzed the division of R. R04 cells cultured under different conditions.[Results]Rhodococcus sp. R04 exhibited asymmetric and symmetric division, and the proportion of the two types of division was about 7:3. The culture conditions did not affect the proportion of asymmetric division cells. The septum was located on the center to the poles, with some clustering at 30% and 50% of the cell length. Rhodococcus sp. R04 degraded biphenyl, but its division would be inhibited by biphenyl. Microscopic observation showed that Rhodococcus sp. R04 cells formed filaments and exhibited abnormal division in early exponential phase under biphenyl culture conditions. As the culture time was prolonged, the cells finally restored normal division.[Conclusion]Biphenyl/polychlorinated biphenyl has a strong effect on the reproduction and growth of Rhodococcus sp. R04 cell, but it does not affect the mode of cell division.
Key words: asymmetric division bacterial cell division biphenyl/PCB Rhodococcus sp. R04
分裂是细菌生长、繁殖的基础。细菌主要以二分裂方式进行繁殖,即母细胞一分为二产生两个子细胞。在这个过程中,一个母细胞通常会分裂成两个形态相同的子细胞,称为对称分裂,如大肠杆菌、枯草芽孢杆菌[1]和金黄色葡萄球菌等的分裂。目前对细菌细胞分裂的研究也主要集中于这些进行对称分裂的少数模式生物。除了对称分裂方式外,部分细菌的细胞分裂还存在不对称分裂(非均等分裂)方式,即一个母细胞分裂成两个类型不同的子细胞,如新月柄杆菌、结核分枝杆菌等的分裂。新月柄杆菌是一种研究不对称分裂的重要模式生物,它进行不对称分裂产生两种具有不同形态和细胞命运的子细胞[2]。另一种不对称分裂的细菌——结核分枝杆菌,其分裂过程中,会产生一个长的子细胞和一个短的子细胞,这两种细胞可以以不同速率生长,导致对抗生素的敏感性不同,这种现象增加了一些细胞继续存活的机会[3]。细胞的不对称分裂是细胞多样性形成的基础。
红球菌是需氧的革兰氏阳性细菌,和分枝杆菌同属放线菌,在工业和环境保护中应用较为广泛,目前已经从不同的污染环境中分离出几种红球菌菌株[4-6]。红球菌可以降解多种芳香族化合物,如苯酚、萘、联苯、多氯联苯(PCB)等[7-8],其降解过程对环境破坏小,经济有效且不会造成二次污染,被认为是一种很有前景的芳香族化合物降解途径[9]。多氯联苯(PCB)是一种环境异生型化合物[10],由于其具有良好的稳定性,绝缘性能和耐燃烧性而广泛用于工业目的[11],许多研究已经讨论了PCB对人类疾病的影响程度,例如癌症、神经行为障碍、甲状腺异常和免疫功能异常[12]等,此外,一些PCB同源物在土壤和水生动物中的毒性已经被证明是严重的环境问题[13]。
目前国内对于红球菌的研究主要集中于其代谢芳香化合物的途径以及代谢途径中的多种酶,很少有人研究这些芳香化合物对红球菌产生了怎样的影响。我们课题组对红球菌R04降解联苯/多氯联苯已经研究多年,之前的研究发现红球菌R04的分裂方式不同于大肠杆菌的对称分裂,而且在联苯/多氯联苯胁迫下,红球菌R04的细胞形态和分裂隔膜均发生了改变[14]。在联苯胁迫下,红球菌R04细胞的分裂方式是否改变也未可知。另外,根据之前的报道发现联苯胁迫下影响了红球菌R04分裂隔膜的形成[14],那么,随着红球菌R04对联苯的降解,这种影响能否被消除同样不清楚。因此,在本研究中,我们将通过显微观察和超显微观察分析红球菌R04细胞的分裂方式;同时,以联苯为唯一碳源培养红球菌R04,研究联苯对其分裂方式和细胞形态的影响,并观察联苯对其整个生长发育过程的抑制作用。这一研究可为下一步探究红球菌R04的生长和分裂机制提供理论基础,也有利于进一步对该菌降解芳香族化合物途径的理解。
1 材料和方法 1.1 菌株、培养基和生长条件 实验所用的红球菌R04菌株由本实验室保存。所用培养基为LB液体培养基和基础培养基[15],培养基配方具体如下。LB液体培养基(g/L):胰蛋白胨10,酵母膏5,氯化钠5。基础培养基(g/L):(NH4)2SO4 5.00,KH2PO4 2.93,K2HPO4·3H2O 5.87,MgSO4·7H2O 0.30,FeSO4·7H2O 0.01,NaCl 0.20,CaCl2 0.03,NiSO4·7H2O 0.006,微量元素盐溶液200 μL。微量元素盐溶液(g/L):Na3-Citrate·2H2O 0.180,FeSO4·7H2O 0.034,CoCl2·6H2O 0.005,Na2MoO4·2H2O 0.005,CuSO4·5H2O 0.004,MnCl2·4H2O 0.002,ZnCl2 0.003,H3BO3 0.002。分别在以上的基础培养基中加入11 mmol/L葡萄糖或不同浓度的联苯作为唯一碳源,红球菌R04接种于培养基后,30 ℃、200 r/min恒温振荡培养。
1.2 主要试剂和仪器 细胞膜染料FM1-43购于北京海德生物技术有限公司,DNA染料DAPI购于北京Solarbio公司,联苯购于军事医学科学院试剂站,戊二醛购于生工生物工程(上海)股份有限公司,锇酸购于上海恒远生物科技有限公司,其他化学试剂购于太原市津海有限公司;日立UV-2010分光光度计(Hitachi Instruments公司),超薄切片机(瑞典LKB-V型),H-600A透射电子显微镜(Hitachi Instruments公司),日立扫描电子显微镜SU1510 (Hitachi Instruments公司),恒温振荡培养箱2HWY-200D (上海智城分析仪器制造有限公司),Delta Vision Deconvolution microscope (美国Delta Vision公司)。
1.3 荧光显微镜观察 将制备的红球菌R04静息细胞[15]分别接种于LB培养基和以11 mmol/L葡萄糖或不同浓度联苯为碳源的基础培养基中,收集培养至指数期的细胞,磷酸缓冲液(20 mmol/L, pH 8.0)洗涤2次,膜染料FM1-43 (终浓度为0.1 μg/mL)避光染色5 min,磷酸缓冲液洗涤2次,DAPI (终浓度为0.1 μg/mL)避光染色5 min,磷酸缓冲液洗涤2次,重悬于1 mL磷酸缓冲液中,取20 μL处理好的菌液滴于载玻片上,盖玻片直接压片,用玻璃纤维密封脂将盖玻片边缘密封。Delta Vision去卷积荧光显微镜下100倍物镜观察。
1.4 扫描电子显微镜观察 将制备的红球菌R04静息细胞[15]分别接种于以11 mmol/L葡萄糖或不同浓度联苯为碳源的基础培养基中,收集培养至指数期的红球菌R04细胞,2.5%戊二醛前固定,1%锇酸后固定,乙醇逐级脱水,制片后置于60 ℃恒温箱干燥,镀膜,扫描电子显微镜下观察[16]。
1.5 透射电子显微镜观察 将制备的红球菌R04静息细胞[15]分别接种于以11 mmol/L葡萄糖为碳源的基础培养基中,收集培养至指数期的红球菌R04细胞,2%戊二醛前固定,1%锇酸后固定,丙酮逐级脱水,丙酮与包埋剂混合液室温浸透,包埋剂(环氧树脂618)包埋,恒温箱中40 ℃浸透24 h后,60 ℃聚合48 h,超薄切片,醋酸铀、柠檬酸铅双染色,透射电子显微镜下观察。
1.6 活细胞成像 滴加含有1.5%低熔点琼脂糖的LB培养基60 μL于单凹面载玻片上形成琼脂糖垫[17-18],将5-10 μL稀释至OD600为0.03的指数前期的红球菌R04细胞滴加于固化的琼脂糖垫顶部,将琼脂糖垫/细胞通过倾斜均匀地铺展,盖玻片直接压片,用玻璃纤维密封脂将盖玻片边缘密封,具有细胞的琼脂糖垫在30 ℃温育0.5-1.0 h以使细胞粘附,Delta Vision去卷积荧光显微镜下观察,每隔15 min成像1次。
1.7 数据分析 使用Delta Vision去卷积荧光显微镜随机拍摄大量的细胞图片,然后随机选取一定数量的图片利用softworx explorer中长度测量工具测量选定图片中的所有分裂的红球菌R04母细胞形成的两个子细胞的长度,每一个样统计细胞数为100个,分别做3个平行,将所得数据导入excel工作表中,统计不同分裂方式各占的细胞数。在本研究中,不考虑分裂母细胞的细胞长度范围,隔膜定位在距细胞中部大于10%偏差的细胞分裂都被认为是不对称细胞分裂,具有距离细胞中部异常偏离的隔膜,形成一个长的子细胞和一个短的子细胞[19],这个定义以区分在红球菌R04细胞中具有距离细胞中部微小偏差(5%-10%)的隔膜的对称分裂和具有距离细胞中部较大偏差(大于10%)的隔膜的不对称分裂。将100个分裂的红球菌R04细胞形成2个子细胞的长度数据导入Origin 9中得到分裂位点分布散点图。所得数据均为平均数±标准偏差。
2 结果和分析 2.1 红球菌R04细胞的不对称分裂
2.1.1 荧光显微镜观察红球菌R04细胞的不对称分裂: 分别于LB培养基和以11 mmol/L葡萄糖为碳源的基础培养基中培养红球菌R04至指数中期,经FM1-43膜染色和DAPI核染色后,Delta Vision荧光显微镜下观察红球菌R04细胞的分裂(图 1)。当以LB培养基培养时,红球菌R04表现出对称分裂(图 1-A)和不对称分裂(图 1-B)两种分裂方式,两种分裂方式的子细胞中都含有拟核。以11 mmol/L葡萄糖为碳源的基础培养基培养的红球菌R04同样表现出了对称分裂(图 1-C)和不对称分裂(图 1-D),且分裂形成的子细胞也均含有拟核,初步说明改变培养基成分(无论是LB培养基还是11 mmol/L葡萄糖为碳源的基础培养基)培养红球菌R04并不影响红球菌R04细胞的分裂方式。图 1中,处于指数期的红球菌R04细胞为杆状形态,而培养至稳定期的细胞形态为球形(图 1-E),说明红球菌R04细胞表现出杆状-球形的生命周期[20]。
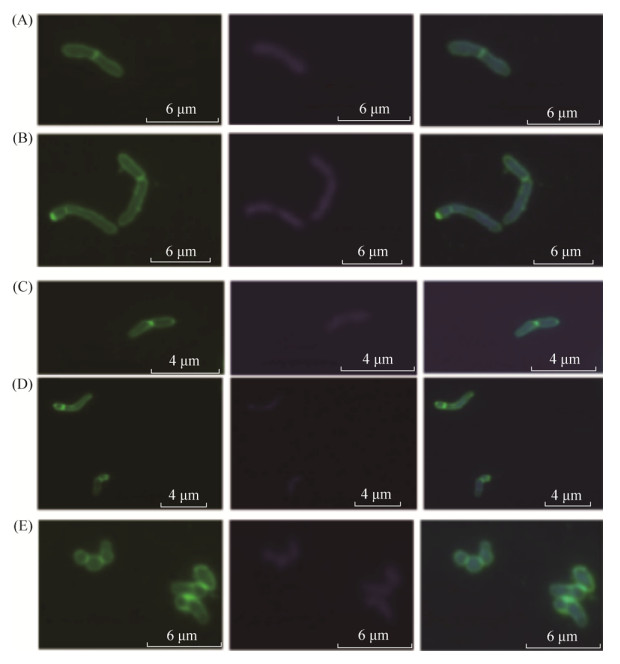 |
| 图 1 红球菌R04细胞的荧光显微镜图 Figure 1 Fluorescence micrograph of mid-log phase Rhodococcus sp. R04 cells stained with DNA- and membrane-specific dyes DAPI (blue) and FM1-43 (green), respectively, with asymmetrically or symmetrically placed septa. A: R. R04 cells with symmetric septa in LB broth; B: R. R04 cells with asymmetric septa in LB broth; C: R. R04 cells with symmetric septa in MS broth containing glucose; D: R. R04 cells with asymmetric septa in MS broth containing glucose; E: Cocci of R. R04 cells. Scale bars represent 4 μm, 6 μm, respectively. |
| 图选项 |
2.1.2 红球菌R04细胞分裂位点的分布: 分别用LB培养基和11 mmol/L葡萄糖为碳源的基础培养基培养红球菌R04,显微镜下观察了大量分裂的指数中期红球菌R04细胞(n=100),统计对称分裂和不对称分裂各占的比例,结果如表 1所示。在LB培养基中,红球菌R04细胞的不对称分裂大约占72.67%,而对称分裂仅占约27.33%;在以11 mmol/L葡萄糖为碳源培养时,红球菌R04细胞的不对称分裂大约占71.33%,而对称分裂约占28.67%,结果表明红球菌R04细胞的不对称分裂为其主要的分裂方式,且在这两种培养基条件下不影响红球菌R04细胞对称分裂和不对称分裂细胞所占的比例。为了研究红球菌R04细胞分裂位点的分布,本实验统计了以11 mmol/L葡萄糖为碳源的基础培养基培养的100个分裂的红球菌R04细胞,结果如图 2所示。纵坐标为细胞的实际长度,横坐标是将整个细胞长度看作单位1,用以表示隔膜所处位置占细胞长度的百分比,由图中可以看出,红球菌R04细胞隔膜的定位主要分布于细胞长度的30%-50%。研究表明,耻垢分枝杆菌分裂时,细胞隔膜的定位主要分布于细胞长度的20%-50%[21],结核分枝杆菌分裂时,细胞隔膜的定位主要分布于细胞长度的25%-50%[19],由此可见,红球菌R04与这两种典型的分枝杆菌具有相似的不对称分裂方式,且子代细胞长度比例相似。
表 1. 红球菌R04细胞不对称分裂的百分比 Table 1. Percentage of R. R04 cells with asymmetrically or symmetrically placed septum
| Cell type | Percentage of cells in LB broth (n=100) | Percentage of cells in MS broth containing glucose (n=100) |
| Asymmetrically dividing R. R04 cell with major deviation in daughter cell lengths | 72.67%±1.53% | 71.33%±2.08% |
| Symmetrically dividing R. R04 cell with minor deviation in daughter cell lengths | 27.33%±1.53% | 28.67%±2.08% |
表选项
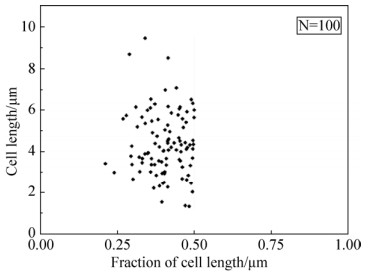 |
| 图 2 红球菌R04细胞分裂位点的分布 Figure 2 Distribution of septum positions in 100 R. R04 cells plotted along their axial length. The distance of the septum was measured from the nearest pole in fractions of cell length normalized to 1.0; the y-axis shows the size of individual cells in microns (μm). |
| 图选项 |
2.1.3 扫描电子显微镜和透射电子显微镜观察红球菌R04细胞的不对称分裂: 以11 mmol/L葡萄糖为碳源的基础培养基培养红球菌R04,取指数中期的细胞使用扫描电子显微镜(SEM)观察(图 3)。从图中可以直观地看到,红球菌R04细胞表现出对称分裂(图 3-C,3-D)和不对称分裂(图 3-A,3-B)两种分裂方式;指数期的红球菌R04细胞为杆状,培养至稳定期的红球菌R04细胞为球形(图 3-E),说明在红球菌R04细胞的生长周期中存在杆状-球形的形态变化[20]。通过透射电子显微镜(TEM)来观察细胞隔膜的定位,结果如图 4所示。从图中可清晰地看到红球菌R04细胞含有不对称隔膜(图 4-A-4-D)和对称隔膜(图 4-E-4-H),由超微结构图可以看出,不论是对称分裂还是不对称分裂,母细胞分裂形成的2个子细胞均具有拟核。超微结构显示完整的隔膜(图 4-A-4-D和4-F)和隔膜形成的初始阶段(图 4-E,4-G和4-H)。
 |
| 图 3 红球菌R04细胞扫描电子显微镜图 Figure 3 Scanning electron micrograph of dividing R. R04 cells of mid-log phase cells with asymmetric and symmetric septa. A, B: R. R04 cells with asymmetric septa; C, D: R. R04 cells with symmetric septa; E: Cocci of R. R04 cells. Scale bars represent 1 μm. |
| 图选项 |
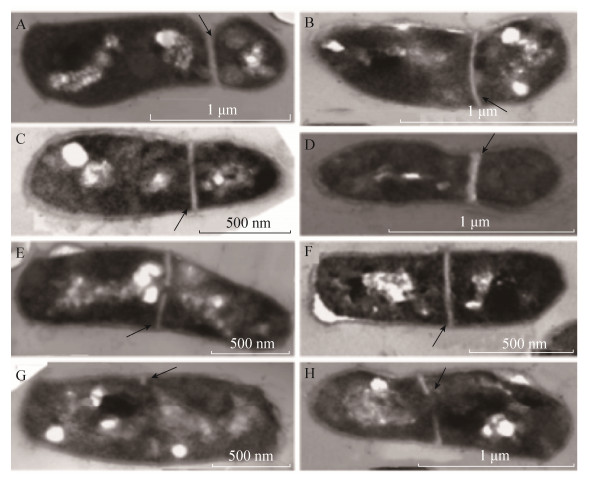 |
| 图 4 红球菌R04细胞透射电子显微镜图 Figure 4 Transmission electron micrograph of mid-log phase R. R04 cells with asymmetric and symmetric septa. A-D: R. R04 cells with asymmetric septa. E-H: R. R04 cells with symmetric septa. E, G, H: R. R04 cells at the initial stages of symmetric septation. The arrow indicates the position of the septum. Scale bars represent 0.5 μm, 1.0 μm, respectively. |
| 图选项 |
2.1.4 红球菌R04的活细胞成像: 在琼脂糖垫上的红球菌R04活细胞的time-lapse成像同样显示了细胞的不对称分裂,产生长细胞和短细胞。本实验选择了具有不同分裂过程的2个细胞(图 5)。以四角星符号标记的红球菌R04细胞在琼脂糖垫上生长1 h左右时首先经历不对称分裂产生1个长的子细胞和1个短的子细胞,长细胞在继续生长45 min后,再次经历了不对称分裂,产生新一代的长细胞和短细胞,短细胞(三角形符号)继续生长1.5 h后同样进行了不对称分裂,产生新一代的长细胞和短细胞;另一个以五角星符号标记的红球菌R04细胞生长100 min左右时首先进行对称分裂,得到2个大小近似相等的细胞,其中1个子细胞生长1 h后经历了不对称分裂,产生新一代的长细胞和短细胞。通过活细胞成像观察红球菌R04细胞生长分裂的过程证实了在细胞分裂过程中不对称分裂的发生,并确认了SEM、TEM和膜/核染色荧光成像实验的观察结果。
 |
| 图 5 红球菌R04活细胞成像图 Figure 5 Live cell time-lapse imaging of two R. R04 cells undergoing asymmetric and symmetric divisions. The daughter cells underwent further divisions. Growth and asymmetric division of an R. R04 cell (calatrava cross) to generate a short daughter cell (triangle symbol) and a long daughter cell (square symbol). The long daughter cell (square symbol) showed further growth and asymmetric division to generate a short daughter cell (circle symbol) and a long daughter cell (pentagon symbol). The short daughter cell (triangle symbol) also underwent further growth and asymmetric division to generate a short daughter cell (crescent symbol) and a long daughter cell (diamond symbol). Growth and symmetric division of another R. R04 cell (pentastar symbol) to generate two more or less equal-sized cells (right angle triangle symbol). One of the daughter cells showed further growth and asymmetric division to generate a short daughter cell (heart-shaped symbol) and a long daughter cell (trapezoid symbol). The cells were observed for three generations. The arrow indicates the position of the septum. Scale bars represent 6 μm. |
| 图选项 |
2.2 联苯胁迫下红球菌R04的细胞分裂
2.2.1 联苯胁迫下红球菌R04细胞的不对称分裂: 以21 mmol/L联苯为唯一碳源的基础培养基培养红球菌R04,荧光显微镜观察处于指数中期的红球菌R04细胞,结果表明,红球菌R04细胞同样表现出对称分裂(图 6白色三角形)和不对称分裂(图 6白色箭头)。接着我们统计了100个可以明显看出分裂情况的红球菌R04细胞,统计结果显示约75.86%的细胞表现为不对称分裂,而仅约24.14%的细胞表现出对称分裂(表 2),与表 1中的结果基本一致,说明在联苯培养条件下,并不影响红球菌R04细胞不对称分裂细胞所占的比例。
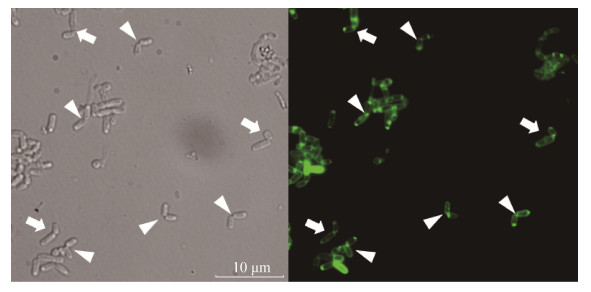 |
| 图 6 联苯培养条件下红球菌R04细胞的荧光显微镜图 Figure 6 Fluorescence micrograph of R. R04 cells cultured with biphenyl as carbon source stained with membrane-specific dyes FM1-43 (green) with symmetric and asymmetric septa. White triangles indicate symmetric division, and white arrowheads indicate asymmetric division. The biphenyl concentration is 21 mmol/L. Scale bars represent 10 μm. |
| 图选项 |
表 2. 联苯培养条件下红球菌R04细胞不对称分裂的百分比 Table 2. Percentage of R. R04 cells cultured with biphenyl with asymmetrically or symmetrically placed septum
| Cell type | Percentage of cells (n=100) |
| Asymmetrically dividing R. R04 cell with major deviation in daughter cell lengths | 75.86%±1.04% |
| Symmetrically dividing R. R04 cell with minor deviation in daughter cell lengths | 24.14%±1.04% |
表选项
2.2.2 联苯胁迫下红球菌R04细胞的形态改变: 以21 mmol/L联苯为唯一碳源培养红球菌R04,取指数前期细胞使用扫描电子显微镜观察,以11 mmol/L葡萄糖为碳源培养的红球菌R04细胞作为对照,结果如图 7所示。与对照(图 7-A)相比,在21 mmol/L联苯培养条件下,红球菌R04细胞出现丝状化,细胞的长度增大,不能进行正常的分裂,而丝状化细胞的直径并没有发生变化(图 7-B,7-C)。为了了解不同浓度联苯对红球菌R04丝状化程度的影响,本研究分别以3、6、21、42 mmol/L联苯为唯一碳源培养红球菌R04,将指数前期的细胞进行染色后于Delta Vision荧光显微镜下观察,结果如图 8所示。与对照(图 8-A,11 mmol/L葡萄糖为碳源培养)相比,不同浓度联苯培养条件下,红球菌R04细胞长度均有不同程度增大,形成丝状化细胞,且丝状化细胞的长度随联苯浓度的增大而增加(图 8-B,8-E细胞长度分别约为6 μm、6.4 μm、7.2 μm、13.1 μm),而且当21 mmol/L和42 mmol/L联苯为唯一碳源培养红球菌R04时,可以明显观察到有荧光堆积现象(图 8-D,8-E)。
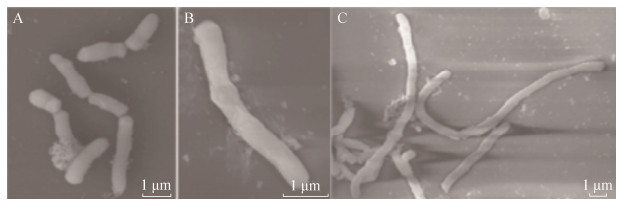 |
| 图 7 联苯培养条件下红球菌R04细胞的扫描电子显微镜图 Figure 7 Scanning electron micrograph of mid-log phase R. R04 cells cultured with biphenyl as carbon source. A: R. R04 cells with normal division cultured with glucose as carbon source; B, C: R. R04 cells with abnormal division cultured with biphenyl as carbon source; the biphenyl concentration is 21 mmol/L. Scale bars represent 1 μm. |
| 图选项 |
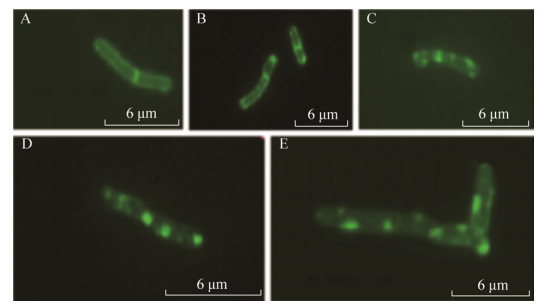 |
| 图 8 不同浓度联苯培养条件下红球菌R04细胞的荧光显微镜图 Figure 8 Fluorescence micrograph of mid-log phase R. R04 cells cultured with biphenyl as carbon source stained with membrane-specific dyes FM1-43 (green) with abnormal septa. A: R. R04 cells with normal septa cultured with glucose as carbon source; B-E: R. R04 cells with abnormal septa cultured with biphenyl as carbon source at concentrations of 3, 6, 21, 42 mmol/L, respectively. Scale bars represent 6 μm. |
| 图选项 |
2.2.3 联苯胁迫下红球菌R04细胞的分裂抑制: 以21 mmol/L和42 mmol/L联苯为碳源培养红球菌R04,分别选取培养了13、20、34、45、60 h后5个时期的细胞进行观察统计其生长[14]和分裂情况,每个时期统计100个细胞(表 3)。当联苯浓度为21 mmol/L时,红球菌R04培养13 h后,OD600值为0.576,荧光显微镜观察结果显示所有细胞均为异常分裂;继续培养至20 h后,OD600值为1.104,此时期细胞依然表现为异常分裂;在培养34 h后,OD600值为2.373,此时期大约94.33%的细胞恢复正常分裂,仅有约5.67%的细胞仍然处于异常分裂状态;培养45 h后,OD600值为3.78,几乎所有的细胞均恢复为正常分裂,只有个别1-2个细胞为异常分裂状态;培养60 h后,OD600值为6.394,此时期所有的细胞均恢复为正常分裂。当联苯浓度为42 mmol/L时,红球菌R04培养13 h后,OD600值为0.378,荧光显微镜观察结果显示所有细胞均为异常分裂;继续培养至20 h后,OD600值为0.694,此时期细胞依然表现为异常分裂;在培养34 h后,OD600值为1.103,此时期约38.67%的细胞恢复正常分裂,剩余约61.33%的细胞仍然处于异常分裂状态;培养45 h后,OD600值为1.162,仅约4.67%的细胞为异常分裂状态;培养60 h后,OD600值为1.193,此时期所有的细胞均恢复为正常分裂。以11 mmol/L葡萄糖为碳源培养红球菌R04细胞作为对照,显微观察显示,所有时期的细胞均表现为正常分裂(图 1)。说明红球菌R04细胞的分裂会受到联苯的抑制,同时红球菌R04细胞可以代谢联苯恢复正常分裂,最终完全表现为正常分裂。随着联苯浓度的增大,红球菌R04代谢联苯恢复正常分裂所需的时间延长。在本研究中,细胞膜着色均一、能形成正常隔膜的细胞被认为是正常分裂(图 8-A),而细胞膜局部有荧光斑点堆积粘附、不能形成完整隔膜的细胞被认为是异常分裂(图 8-D,8-E)。
表 3. 联苯胁迫下红球菌R04异常分裂的比例 Table 3. Percentage of R. R04 cells with abnormal division under biphenyl stress.
| Time/h | 21 mmol/L biphenyl | 42 mmol/L biphenyl | |||
| OD600[14] | Percentage of R. R04 cells with abnormal division/% | OD600[14] | Percentage of R. R04 cells with abnormal division/% | ||
| 13 | 0.576 | 99.95±0.05 | 0.378 | 99.72±0.28 | |
| 20 | 1.104 | 99.52±0.48 | 0.694 | 99.61±0.39 | |
| 34 | 2.373 | 5.67±0.12 | 1.103 | 61.33±1.31 | |
| 45 | 3.780 | 0.67±0.03 | 1.162 | 4.67±0.08 | |
| 60 | 6.394 | 0.33±0.01 | 1.193 | 0.67±0.03 | |
表选项
3 讨论 我们通过显微观察和超显微观察发现红球菌R04细胞在其生长和分裂过程中存在对称分裂和不对称分裂两种分裂方式,其中不对称分裂约占70%是其主要的分裂方式。细胞的生长和分裂是基本的生命过程。各种细菌的细胞分裂常见的是对称分裂,即形成形态相同的2个子细胞,如大肠杆菌、枯草芽孢杆菌[1]等的分裂。但是也有不对称分裂的例子,研究表明耻垢分枝杆菌、海分枝杆菌和结核分枝杆菌细胞分裂时均存在对称分裂和不对称分裂两种分裂方式[21-23]。细胞对称分裂和不对称分裂产生的其中一种原因是最终分裂位点选择的不同,分裂位点位于细胞中部则产生形态相同的2个子细胞,如果分裂位点偏离细胞中部一定位置则产生形态不同的2个子细胞[21]。具有代表性的大肠杆菌和枯草芽孢杆菌选择细胞中部作为分裂位点是通过Min系统和类核闭塞系统调控的,MinCDE系统避免了在细胞极处进行错误的分裂,类核闭塞系统阻止细胞分裂发生在类核附近[24]。细胞不对称分裂产生的另一种途径是隔膜虽然定位在细胞中部,但是细胞两极的生长速率不同最终导致形成的2个子细胞形态不同[19]。红球菌R04细胞的不对称分裂形成机制尚不清楚,其具体的分裂位点调控机制也将是我们课题组进一步研究的方向。
红球菌R04是一株可以有效降解联苯的菌株,其可以在以联苯为唯一碳源的培养基中正常生长。在红球菌R04降解联苯的过程中,联苯也对其生长和分裂产生了影响。我们以联苯为唯一碳源的基础培养基培养红球菌R04,研究表明联苯胁迫下,并不会影响红球菌R04不对称分裂细胞所占的比例,因此我们推测联苯并不能影响最终分裂位点的选择。但是联苯对红球菌R04细胞的生长和分裂有明显的抑制作用。我们课题组前文就已经报道了红球菌R04细胞在不同碳源培养条件下的生长情况,由生长曲线图[14]可知,与11 mmol/L葡萄糖和21 mmol/L联苯为碳源培养相比,在42 mmol/L联苯培养条件下,红球菌R04细胞调整期延长,生物量下降,生长缓慢,说明在42 mmol/L联苯胁迫下红球菌R04细胞的生长受到了很大的影响,但是其并未死亡。在本研究中,我们以21 mmol/L联苯为唯一碳源培养红球菌R04,扫描电子显微镜观察发现红球菌R04细胞出现丝状化,而且在细胞的某些部位会形成肿胀结构(图 7-B),我们推测在联苯胁迫下,红球菌R04细胞的隔膜形成材料虽然能定位到正确的分裂位点,但是不能形成可以行使正常功能的隔膜,造成隔膜形成材料的堆积,最终表现为细胞局部肿大,与荧光显微图中表现出绿色荧光斑点(图 8D,8-E)而不是形成正常的隔膜这一现象相吻合。另外,我们以21 mmol/L和42 mmol/L联苯为碳源培养红球菌R04,分别选取培养了13、20、34、45、60 h后5个时期的细胞进行观察统计其分裂情况,结果表明联苯抑制了红球菌R04细胞的分裂,在其生长前期异常分裂细胞所占比例高达99%,在如此高压胁迫环境下,红球菌R04细胞仍然可以生长,且随着培养时间的延长,到达细胞生长指数后期,红球菌R04细胞几乎全部恢复正常分裂,但是细胞恢复正常分裂的机制尚不清楚。
环境污染物的微生物降解方法被认为是很有前景的方法,然而在微生物降解环境污染物的同时,微生物本身也会受到环境污染物的影响,环境污染物可能通过在细菌的细胞质膜中积累并破坏其功能而发挥毒性作用。Donato报道杀虫剂2, 2-双(对氯苯基)-1, 1, 1-三氯乙烷通过诱导细胞膜紊乱从而干扰嗜热脂肪芽孢杆菌的生长[25];Parnell等发现PCBs会影响伯克霍尔德杆菌LB400的生物表面积,并导致膜分离[26];几种环境污染物对生长的抑制及其对呼吸和其他生命功能的相应影响已经在体外被证实[27-28];Bourquin和Cassidy表明,向液体培养基中加入PCBs会抑制细菌培养物的生长[29]。在本研究中,使用联苯为唯一碳源的基础培养基培养红球菌R04细胞,红球菌R04细胞能够利用联苯生长,但联苯也影响了红球菌R04细胞的生长分裂,这表明红球菌R04与环境化合物联苯之间是相互影响的。然而,联苯影响红球菌R04细胞生长分裂的具体机制还有待进一步的研究。
References
| [1] | Young KD. Bacterial shape: two-dimensional questions and possibilities. Annual Review of Microbiology, 2010, 64(1): 223-240. DOI:10.1146/annurev.micro.112408.134102 |
| [2] | Gitai Z, Dye N, Shapiro L. An actin-like gene can determine cell polarity in bacteria. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(23): 8643-8648. DOI:10.1073/pnas.0402638101 |
| [3] | Aldridge BB, Fernandez-Suarez M, Heller D, Ambravaneswaran V, Irimia D, Toner M, Fortune SM. Asymmetry and aging of mycobacterial cells lead to variable growth and antibiotic susceptibility. Science, 2012, 335(6064): 100-104. DOI:10.1126/science.1216166 |
| [4] | Morii S, Fujii C, Miyoshi T, Iwami M, Itagaki E. 3-Ketosteroid-Δ1-dehydrogenase of Rhodococcus rhodochrous: sequencing of the genomic DNA and hyperexpression, purification, and characterization of the recombinant enzyme. The Journal of Biochemistry, 1998, 124(5): 1026-1032. DOI:10.1093/oxfordjournals.jbchem.a022195 |
| [5] | Prince RC, Grossman MJ. Substrate preferences in biodesulfurization of diesel range fuels by Rhodococcus sp. strain ECRD-1. Applied and Environmental Microbiology, 2003, 69(10): 5833-5838. DOI:10.1128/AEM.69.10.5833-5838.2003 |
| [6] | Haroune N, Combourieu B, Besse P, Sancelme M, Kloepfer A, Reemtsma T, De Wever H, Delort AM. Metabolism of 2-mercaptobenzothiazole by Rhodococcus rhodochrous. Applied and Environmental Microbiology, 2004, 70(10): 6315-6319. DOI:10.1128/AEM.70.10.6315-6319.2004 |
| [7] | Boyle AW, Silvin CJ, Hassett JP, Nakas JP, Tanenbaum SW. Bacterial PCB biodegradation. Biodegradation, 1992, 3(2/3): 285-298. |
| [8] | Yang XQ, Xue R, Shen C, Li SR, Gao C, Wang Q, Zhao XX. Genome sequence of Rhodococcus sp. strain R04, a polychlorinated-biphenyl biodegrader. Journal of Bacteriolog, 2011, 193(18): 5032-5033. DOI:10.1128/JB.05635-11 |
| [9] | Sun LB, Zhang LY, Zhao Z, Ren HJ, Li S, Zhou JX. Identification and phylogenetic analyses of a PCBs degrading strain. Journal of Jilin University (Science Edition), 2007, 45(4): 691-695. (in Chinese) 孙立波, 张兰英, 赵喆, 任何军, 李爽, 周佳欣. 一株多氯联苯降解菌的分离鉴定及基因分型. 吉林大学学报(理学版), 2007, 45(4): 691-695. |
| [10] | Pi WQ, Qu YY, Zhang Q, Zhou JT. Advance on regulation and metabolic pathway in bacterial degradation of xenobiotics. Environmental Science & Technology, 2010, 33(4): 72-76. (in Chinese) 皮文清, 曲媛媛, 张强, 周集体. 异生型化合物生物降解及调控机理研究进展. 环境科学与技术, 2010, 33(4): 72-76. |
| [11] | Takeda H, Shimodaira J, Yukawa K, Hara N, Kasai D, Miyauchi K, Masai E, Fukuda M. Dual two-component regulatory systems are involved in aromatic compound degradation in a polychlorinated-biphenyl degrader, Rhodococcus jostii RHA1. Journal of Bacteriology, 2010, 192(18): 4741-4751. DOI:10.1128/JB.00429-10 |
| [12] | Kimbrough RD, Krouskas CA. Human exposure to polychlorinated biphenyls and health effects. Toxicological Reviews, 2003, 22(4): 217-233. DOI:10.2165/00139709-200322040-00004 |
| [13] | Seegal RF. Epidemiological and laboratory evidence of PCB-induced neurotoxicity. Critical Reviews in Toxicology, 1996, 26(6): 709-737. DOI:10.3109/10408449609037481 |
| [14] | Cao XX, Yang XQ. The effect of biphenyl/polychlorinated biphenyl on cell morphology and septum of Rhodococcus sp. R04. Journal of Shanxi University (Natural Science Edition), 2016, 39(2): 287-294. (in Chinese) 曹星星, 杨秀清. 联苯/多氯联苯对红球菌R04细胞形态及隔膜的影响. 山西大学学报(自然科学版), 2016, 39(2): 287-294. |
| [15] | Yang XQ, Xi JW. Transcriptomic and benzoate metabolic pathways of Rhodococcus sp. R04 cultured in biphenyl. Acta Microbiologica Sinica, 2015, 55(7): 851-862. (in Chinese) 杨秀清, 席婧雯. 联苯培养条件下红球菌R04转录表达和苯甲酸代谢途径解析. 微生物学报, 2015, 55(7): 851-862. |
| [16] | Lackner P, Beer R, Helbok R, Broessner G, Engelhardt K, Brenneis C, Schmutzhard E, Pfaller K. Scanning electron microscopy of the neuropathology of murine cerebral malaria. Malaria Journal, 2006, 5(1): 116. DOI:10.1186/1475-2875-5-116 |
| [17] | Young JW, Locke JCW, Altinok A, Rosenfeld N, Bacarian T, Swain PS, Mjolsness E, Elowitz MB. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nature Protocols, 2012, 7(1): 80-88. |
| [18] | Joyce G, Robertson BD, Williams KJ. A modified agar pad method for mycobacterial live-cell imaging. BMC Research Notes, 2011, 4(1): 73. DOI:10.1186/1756-0500-4-73 |
| [19] | Vijay S, Nagaraja M, Sebastian J, Ajitkumar P. Asymmetric cell division in Mycobacterium tuberculosis and its unique features. Archives of Microbiology, 2014, 196(3): 157-168. DOI:10.1007/s00203-014-0953-7 |
| [20] | Goodfellow M, Jones AL, Maldonado LA, Salanitro J. Rhodococcus aetherivorans sp. nov., a new species that contains methyl t-butyl ether-degrading actinomycetes. Systematic and Applied Microbiology, 2014, 27(1): 61-65. |
| [21] | Singh B, Nitharwal RG, Ramesh M, Pettersson BMF, Kirsebom LA, Dasgupta S. Asymmetric growth and division in Mycobacterium spp.: compensatory mechanisms for non-medial septa. Molecular Microbiology, 2013, 88(1): 64-76. DOI:10.1111/mmi.2013.88.issue-1 |
| [22] | Joyce G, Williams KJ, Robb M, Noens E, Tizzano B, Shahrezaei V, Robertson BD. Cell division site placement and asymmetric growth in mycobacteria. PLoS One, 2012, 7(9): e44582. DOI:10.1371/journal.pone.0044582 |
| [23] | Santi I, Dhar N, Bousbaine D, Wakamoto Y, McKinney JD. Erratum: Single-cell dynamics of the chromosome replication and cell division cycles in mycobacteria. Nature Communications, 2013, 4: 2913. |
| [24] | Sang Y, Tao J, Yao YF. Regulation of the Z ring positioning in bacterial cell division--a review. Acta Microbiologica Sinica, 2013, 53(4): 321-327. (in Chinese) 桑昱, 陶晶, 姚玉峰. 细菌分裂Z环定位的调控方式. 微生物学报, 2013, 53(4): 321-327. |
| [25] | Donato MM, Jurado AS, Antunes-Madeira MC, Madeira VMC. Bacillus stearothermophilus as a model to evaluate membrane toxicity of a lipophilic environmental pollutant (DDT). Archives of Environmental Contamination and Toxicology, 1997, 33(2): 109-116. DOI:10.1007/s002449900231 |
| [26] | Parnell JJ, Park J, Denef V, Tsoi T, Hashsham S, Quensen J, Tiedje JM. Coping with polychlorinated biphenyl (PCB) toxicity: physiological and genome-wide responses of Burkholderia xenovorans LB400 to PCB-mediated stress. Applied and Environmental Microbiology, 2006, 72(10): 6607-6614. DOI:10.1128/AEM.01129-06 |
| [27] | Calder JA, Lader JH. Effect of dissolved aromatic hydrocarbons on the growth of marine bacteria in batch culture. Applied and Environmental Microbiology, 1976, 32(1): 95-101. |
| [28] | Sikkema JA, de Bont JA, Poolman B. Mechanisms of membrane toxicity of hydrocarbons. Microbiological Reviews, 1995, 59(2): 201-222. |
| [29] | Bourquin AW, Cassidy S. Effect of polychlorinated biphenyl formulations on the growth of estuarine bacteria. Applied Microbiology, 1975, 29(1): 125-127. |
