王永霞1, 霍晴晴1, 李亚平1, 肖炜1, 赖泳红1, 和树庒2, 崔晓龙1,3


1.云南大学生命科学学院云南省微生物研究所, 云南 昆明 650091;
2.云南大学生态学与环境学院, 云南 昆明 650091;
3.云南大学省部共建云南生物资源保护与利用国家重点实验室, 云南 昆明 650091
收稿日期:2017-11-29;修回日期:2017-12-28;网络出版日期:2018-01-26
基金项目:国家重点科技计划项目水专项(2012ZX07102-003);国家自然科学基金(31660001,31660089,31660042);国家微生物资源平台专项-面向微生物教学实验的专题服务项目(NIMR-2016-8)
*通信作者:崔晓龙, Tel/Fax:+86-871-65034621, E-mail:xlcui@ynu.edu.cn
摘要:[目的]氮污染已成为当今水体污染的一个重要因素,为了解滇池可培养好氧反硝化细菌的多样性,获得高效好氧反硝化细菌资源,为污染水体或浅层地下水的生物修复提供材料。[方法]采用富集培养方法从滇池沉积物和水体样品中分离好氧反硝化细菌,对好氧反硝化细菌的16S rRNA基因序列进行系统发育分析,并筛选其中的高效好氧反硝化细菌。[结果]分离出260株好氧反硝化菌,经16S rRNA基因序列分析,260株菌分属于2门13科14属的59个种。假单胞菌属(Pseudomonas)为优势细菌属,其次是不动杆菌属(Acinetobacter)、气单胞菌属(Aeromonas)和代尔夫特菌属(Delftia)。筛选到12株高效好氧反硝化细菌菌株,其中8株属于假单胞菌(Pseudomonas spp.),4株为不动杆菌(Acinetobacter spp.)。定量分析发现菌株N15-6-1的反硝化效果较好。对菌株N15-6-1的脱氮条件优化结果显示,在以蔗糖为碳源,温度为30–35℃、C/N=12、静止培养时,反硝化能力较强,其在48 h内硝态氮的去除率达到98.81%,总氮的去除率达96.27%。[结论]滇池存在着较丰富的可培养好氧反硝化细菌,好氧反硝化细菌的分离丰富了好氧反硝化菌的种类,其中的高效脱氮菌株为污染水体或浅层地下水的生物修复提供了初步的候选菌株。
关键词: 滇池 富集培养 好氧反硝化细菌 系统发育分析 脱氮特性
Diversity and nitrogen removal efficiency of culturable aerobic denitrifying bacteria in the sediment and water in Dianchi Lake
Yongxia Wang1, Qingqing Huo1, Yaping Li1, Wei Xiao1, Yonghong Lai1, Shuzhuang He2, Xiaolong Cui1,3


1.Yunnan Institute of Microbiology, School of Life Sciences, Yunnan University, Kunming 650091, Yunnan Province, China;
2.School of Ecology and Environmental Science, Yunnan University, Kunming 650091, Yunnan Province, China;
3.State Key Laboratory for Conservation and Utilization of Bio-Resources in Yunnan, Yunnan University, Kunming 650091, Yunnan Province, China
Received 29 November 2017; Revised 28 December 2017; Published online 26 January 2018
*Corresponding author: Cui Xiaolong, Tel/Fax:+86-871-65034621, E-mail:xlcui@ynu.edu.cn
Supported by the National Key Sciences and Technology Program for Water Solutions (2012ZX07102-003), by the National Natural Science Foundation of China (31660001, 31660089, 31660042) and by the National Infrastructure of Natural Resources for Science and Technology Program of China (NIMR-2016-8)
Abstract: [Objective]At present, nitrogen pollution has been becoming an important factor in water pollution. In order to unveil the diversity of culturable aerobic denitrifying bacteria in Dianchi Lake and obtain efficient aerobic denitrifying bacteria for providing evidence to bioremediate the polluted water or shallow groundwater.[Methods]Aerobic denitrifying bacteria were obtained through enrichment method and screening processes. The taxonomic positions of these aerobic denitrifying bacteria were analyzed based on 16S rRNA gene sequence comparisons. The efficient aerobic denitrifying bacteria were screened out by detecting nitrogen removal efficiency.[Results]In this study, 260 strains of aerobic denitrifying bacteria were isolated from the sediment and water samples of Dianchi Lake. These bacteria were classified into 59 species, belonging to 14 genera of 13 families of in 2 phyla of bacteria. Pseudomonas composed the major culturable aerobic denitrifying bacteria of Dianchi Lake, followed by Acinetobacter, Aeromonas and Delftia. Twelve strains with perfect nitrogen removal characteristics were screened out. Therein, 8 strains were identified as Pseudomonas spp. and 4 strains were identified as Acinetobacter spp. One efficient denitrifying strain N15-6-1 was screened out by using the quantitative analysis. Its nitrate and total nitrogen removal rates reached 98.81% and 96.27% in 48 h at 30-35℃, C/N=12, repectively.[Conclusion]From all the results, the higher diversity of culturable aerobic denitrifying bacteria inhabited in Dianchi Lake, which enriched the species resources of aerobic denitrifying bacteria, and furthermore, the efficient aerobic denitrifying bacteria provided a significant candidate strains to bioremediate the polluted water or shallow groundwater.
Keywords: Dianchi lake enrichment aerobic denitrifying bacteria phylogenetic analysis nitrogen removal characteristic
湖泊是参与自然界水分循环和物质循环的重要生态系统。因此,湖泊不仅具有调洪抗旱、调节气候、渔业、旅游等功能,在维持区域生态系统平衡和保护生物多样性方面也发挥着重要的作用,是支撑当地经济和社会发展重要的资源之一[1]。微生物是驱动湖泊等水体地球化学循环和生态系统运行的关键,但迄今人们对其结构和功能的研究知之甚少[2]。反硝化作用是湖泊区域氮素的生物地球化学循环中重要的生态过程,是去除富营养化水体中氮素尤其是硝态氮的主要途径。传统理论认为反硝化是严格厌氧过程,自20世纪80年代,Robertson和Kuenen[3]首次分离出好氧反硝化细菌以来,研究者认识到好氧反硝化现象的存在并陆续从不同的生境中分离到了许多好氧反硝化菌株,如粪产碱菌(Alcaligenes faecalis)[4]、好氧反硝化微枝杆菌(Microvirgula aerodenitrificans)[5-6]、假单胞菌(Pseudomonas spp.)[7-13]、红球菌(Rhodococcus sp.)[14]、芽孢杆菌(Bacillus spp.)[15-18]、不动杆菌(Acinetobacter spp.)[19-22]、丛毛单胞菌(Comamonas spp.)[23-24]、副球菌(Paracoccus sp.)[25]和动胶杆菌(Zoogloea spp.)[20, 22, 26]。好氧反硝化细菌的发现为现有的生物脱氮工艺提供了新的研究方向,由于其可以在有氧条件下进行反硝化作用并在此过程中使pH升高等特点,使硝化和反硝化过程可以在同一反应器中进行并可中和硝化过程中产生的酸,从而简化运行工艺、节约运行成本。因此,分离和筛选高效好氧反硝化菌株不仅对反硝化理论研究具有重要意义,同时也为生物脱氮工艺研究和污水处理提供菌株材料。
1 材料和方法 1.1 样点 2014年10月,从云南滇池外海选取14个位点,用采样器采集表层(0–10 cm)沉积物和表层水样(深5 m),每个位点设置3个重复,分别装入无菌采样袋和三角瓶中,放置于装有冰袋的泡沫箱内,12 h内运回实验室,放入4℃冰库,待用。
1.2 培养基
1.2.1 富集培养基(SM)[11](g/L): NaNO3 0.85,琥珀酸钠2.84,KH2PO4 1.36,MgSO4·7H2O 0.19,(NH4)2SO4 0.27,酵母提取物1;微量元素1 mL,pH 7.2。微量元素(g/L):FeSO4·7H2O 0.2,CoCl2·7H2O 1,Na2MoO4·7H2O 0.38,CaCl2 0.2。
1.2.2 分离培养基(BTB培养基)[11](g/L): KNO3 1,KH2PO4 1,FeCl2·6H2O 0.5,CaCl2·7H2O 0.2,MgSO4·7H2O 1;琥珀酸钠8.5,溴百里香酚蓝1%,乙醇溶液1 mL,琼脂15 g,pH 7.0–7.3。
1.2.3 反硝化培养基(g/L): KNO3 0.6,KH2PO4 1,K2HPO4 1,MgSO4·7H2O 0.2,柠檬酸钠5,用NaOH(1 mol/L)溶液调节至pH 7.0。
1.2.4 模拟水质培养基(g/L): KNO3 1.08,KH2PO4 0.045,Na2HPO4·12H2O 0.242,NaHCO3 0.68,MgSO4·7H2O 0.1,微量盐溶液0.2 mL,pH 7.0。微量盐溶液为(g/L):EDTA 50,ZnSO4·7H2O 22,CaCl2 5.54,MnCl2·4H2O 5.06,FeSO4·7H2O 4.99,(NH4)6Mo7O24·4H2O 1.10,CuSO4·5H2O 1.57,CoCl2·6H2O 1.61。
上述分离培养基中加入制霉菌素50 mg/L,抑制真菌生长。制霉菌素过滤灭菌后,待灭菌后培养基冷至50 ℃时,再加入无菌制霉菌素,摇匀后倒平皿。
1.3 好氧反硝化细菌的富集、分离和筛选 2 g沉积物或50 mL湖水过滤后的滤膜分别放入含有100 mL富集培养基的三角瓶中,30 ℃、160 r/min培养24 h。将富集液进行梯度稀释至10–7,选取梯度为10–4、10–5、10–6、10–7,分别取各个梯度的稀释液0.2 mL,涂布于分离培养基上,放入恒温培养箱30 ℃培养1–2 d,挑取使周围培养基变为蓝色的单菌落,并在Luria-Bertani medium (LB)培养基上纯化、保藏。
将分离到的菌株接于反硝化液体培养基中,30 ℃、160 r/min条件下培养48 h进行定性复筛,吸取培养液滴于干净白瓷板上,加入Griess溶液Ⅰ、溶液Ⅱ各1滴,如果溶液显红色则显示培养液中有亚硝态氮存在;无色,加入二苯胺-硫酸试剂,生成蓝色沉淀,则说明有硝态氮存在,无色则说明无亚硝态氮和硝态氮。
Griess试剂和二苯胺-硫酸试剂的配制按照《常见细菌系统鉴定手册》[27]所述配方配制。
1.4 菌株的鉴定 从形态学、生理生化和分子系统学等几个方面对菌株进行鉴定。参照[28]的方法提取菌株基因组DNA并扩增其16S rRNA基因片段。扩增产物送生工生物工程(上海)股份有限公司测序。使用EzBioCloud (http://eztaxon-e.ezbiocloud.net)在线比对序列,确定各菌株的近缘种。在LPSN(List of Prokaryotic names with Standing in Nomenclature,http://www.bacterio.net)在线分析各菌株的属以上分类地位。
1.5 好氧反硝化细菌反硝化特性研究 按体积比3%接种量将处于对数生长期的菌液(OD600=1.0)接到反硝化培养基(总体积为100 mL)中,通过调节温度(15、20、25、30、35、40、45 ℃)、pH值(5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0)、C/N比(5:1、8:1、10:1、12:1、15:1、18:1)和碳源(甲醇,琥珀酸钠,柠檬酸钠,酒石酸钠,乙酸钠,蔗糖,葡萄糖),160 r/min恒温摇床培养48 h后测定培养液中菌体生长量、硝氮(NO3–-N)、亚硝氮(NO2–-N)和总氮(TN)含量。考察不同的因子对反硝化效果的影响。除温度实验外,其余均在30 ℃下培养,实验设3个重复。
1.6 好氧反硝化菌的反硝化活性定量测定 根据反硝化定性检测的结果筛选反硝化能力较强的菌株,将菌株斜面接种到5 mL的反硝化培养基中30 C、160 r/min培养24–48 h。10000 r/min离心10 min收集菌体,用PBS缓冲液冲洗3遍,配制成悬浮液,按1%的接种量接种到含有50 mL培养基的250 mL三角瓶中,30 C、160 r/min培养48 h。培养液10000 r/min离心10 min取上清液进行测定。
1.7 分析方法 菌体生长吸收度(OD600)的测定采用吸光光度法:用721型可见分光光度计测定菌液在600 nm下的光密度值。硝氮、亚硝氮和总氮的检测方法参照中华人民共和国环境保护行业标准:NO3–-N采用紫外分光光度法(HJ/T 346-2007)[29];NO2–-N采用N-(1-萘基)-乙二胺分光光度法(GB 7493- 87)[30];TN采用碱性过硫酸钾消解紫外分光光度法(HJ 636-2012)[31]。
2 结果和分析 2.1 好氧反硝化菌的多样性 经富集培养基培养后的培养液梯度稀释,BTB培养基分离、纯化,反硝化培养基定性复筛,从滇池14个样点中共得到260株反硝化细菌菌株。分别对260株反硝化细菌菌株进行DNA提取、16S rRNA基因测序、序列分析。结果显示,260株细菌分属于2门(Proteobacteria和Firmicutes) 13科14属的59个种(59种的16S rRNA基因序列已经上传到GenBank数据库,序列号:MG561155-MG561213)。所属的14属分别是:属于γ-Proteobacteria的Pseudomonas (24种,122株)、Acinetobacter (11种,55株)、Aeromonas (6种,22株)、Shewanella (1种,2株)和Enterobacter (1种,1株);属于β-Proteobacteria的Delftia (2种,21株)和Comamonas (3种,13株);属于α-Proteobacteria的Ochrobactrum (2种,8株)、Rhizobium (1种,6株),Paracoccus (2种,2株)、Ensifer (2种,2株)和Shinella (1种,1株);属于Firmicutes的Exiguobacterium (2种,3株)和Bacillus (1种,2株)。其中Pseudomonas最多,占所有菌株的46.9%,其次是Acinetobacter、Aeromonas和Delftia分别占所有菌株的21.2%、8.5%和8.1%。
从每个种中选择1株代表菌株与同源性相近种的典型菌株的信息进行比较,结果见表 1。其中22个种与已知菌的16S rRNA基因序列相似性达到100%,37个种与已知菌的16S rRNA基因序列相似性在97.34%–99.88%之间。这些近缘类群分布环境广泛:19个种分离自土壤或植物,16个种分离自水体或活性污泥,12个种分离自人体或动物体,其他来源的有12种。有21个种反硝化反应为阳性,16个种为阴性,8个种能进行第一步反硝化作用,13个种未见报道其反硝化能力。
表 1. 滇池中好氧反硝化细菌的16S rRNA基因序列的BLAST结果 Table 1. The BLAST results and aerobic denitrifying bacteria isolated from Dianchi Lake
| Strains | Nearest phylogenetic neighbor in GenBank | Similarity/% | GenBank accession number | Denitrification | Isolated place |
| W3-5-1 | Acinetobacter johnsonii CIP64.6 | 98.12 | Z93440 | - | Human duodenum |
| W3-5-4 | Acinetobacter beijerinckii CIP110307 | 97.86 | AJ626712 | - | Human wound |
| W6-5-3 | Acinetobacter tjernbergiae DSM14971 | 98.42 | AF509825 | N | Wastewater treatment plant |
| W16-5-2 | Acinetobacter tandoii DSM 14970 | 99.44 | AF509830 | N | Wastewater treatment plant |
| W16-7-5 | Acinetobacter bouvetii DSM 14964 | 97.34 | AF509827 | N | Wastewater treatment plant |
| N3-7-2 | Acinetobacter calcoacetius DSM 30006 | 100 | AIEC01000170 | - | Quinate enrichment from soil |
| L3-8-2 | Acinetobacter schindleri CIP 107287 | 98.00 | APPQ01000011 | N | Vagina |
| L15-8-1 | Acinetobacter towneri DSM 14962 | 99.72 | APPY01000064 | N | Activated sludge |
| L12-8-1 | Acinetobacter lwoffii NCTC 5866 | 99.73 | X81665 | - | N |
| W3-6-4 | Acinetobacter oryzae B23 | 99.60 | GU954428 | - | Wild rice leaf |
| W9-5-3 | Acinetobacter vivianii NIPH2168 | 98.29 | KT997477 | - | Human clinical specimens |
| L3-7-2 | Aeromonas hydrophila subsp. hydrophila ATCC 7966 | 100 | CP000462 | nitrate-nitrite | Tin of milk with a fishy odour |
| L7-6-2 | Aeromonas allosaccharophila CECT 4199 | 100 | S39232 | N | Diseased elver (Anguilla anguilla) |
| N6-8-1 | Aeromonas veronii ATCC 35624 | 100 | X60414 | + | Sputum of drowning victim |
| N6-6-2 | Aeromonas media ATCC 33907 | 99.87 | X60410 | + | Fish farm effluent |
| N3-8-2 | Aeromonas caviae ATCC 15468 | 100 | X74674 | N | Epizootic of young guinea pigs |
| N13-8-2 | Aeromonas dhakensis CIP 107500 | 99.26 | AJ508765 | nitrate-nitrite | Faeces of child with diarrhoea |
| N15-6-2 | Comamonas testosteroni ATCC 11996 | 100 | M11224 | N | Soil, enrichment with testosterone |
| W8-7-4 | Comamonas aquatica LMG2370 | 100 | AJ430344 | nitrate-nitrite | Freshwater |
| L14-6-3 | Comamonas jiangduensis YW1 | 99.87 | JQ941713 | - | Agricultural soil |
| W10-4-3 | Delftia lacustris DSM21246 | 100 | EU888308 | nitrate-nitrite | Mesotrophic lake water |
| W9-4-1 | Delftia acidovorans 2167 | 100 | AB021417 | nitrate-nitrite | Soil enriched with acetamide |
| W9-6-1 | Ensifer sesbaniae CCBAU 65729 | 99.86 | JF834143 | + | Root nodules of Psoralea corylifolia |
| W11-7-1 | Ensifer adhaerens LMG 20216 | 100 | AM181733 | + | Soil |
| W7-5-3 | Ochrobactrum pseudogrignonense CCUG 30717 | 100 | AM422371 | N | Human clinical specimens |
| W12-7-4 | Ochrobactrum anthropi ATCC 49188 | 100 | NR114979 | + | Human clinical specimens |
| W3-7-2 | Paracoccus pantotrophus ATCC 35512 | 100 | Y16933 | + | Denitrifying, sulfide-oxidizing effluent-treatment plant |
| W3-5-2 | Paracoccus bengalensis JJJ | 100 | AJ864469 | + | Rhizospheric soil |
| W12-5-3 | Rhizobium radiobacter ATCC 19358 | 100 | AB247615 | + | Saprobic soil |
| L8-6-3 | Shewanella xiamenensis S4 | 100 | FJ589031 | + | Coastal sea sediment |
| W9-5-2 | Shinella granuli Ch06 | 99.32 | AB187585 | + | Wastewater-treating UASB reactor |
| N8-7-1 | Pseudomonas hunanensis LV | 99.88 | JX545210 | - | Manganese contaminated soil sample |
| W5-7-4 | Pseudomonas putida NBRC 14164 | 99.74 | Z76667 | N | N |
| N16-7-1 | Pseudomonas plecoglossicida NBRC 103162 | 99.88 | AB009457 | nitrate-nitrite | Diseased ayu |
| N6-6-3 | Pseudomonas monteilii NBRC 103158 | 99.75 | AF064458 | - | Human bronchial aspirate |
| W8-4-3 | Pseudomonas fuscovaginae ICMP 5940 | 98.72 | FJ483519 | - | Soil |
| W3-4-4 | Pseudomonas balearica DSM 6083 | 97.40 | U26418 | + | Sewage water |
| L9-6-2 | Pseudomonas baetica a390 | 99.73 | FM201274 | + | Liver of a diseased wedge sole |
| W11-5-1 | Pseudomonas stutzeri ATCC 17588 | 99.86 | CP002881 | + | Spinal fluid |
| N3-8-3 | Pseudomonas alcaligenes NBRC 14159 | 100 | D84006 | + | Swimming-pool water |
| W12-7-3 | Pseudomonas indoloxydans IPL-1 | 98.50 | DQ916277 | nitrate-nitrite | Pesticide-contaiminated site |
| N14-7-2 | Pseudomonas veronii DSM 11331 | 99.86 | AF064460 | + | Mineral water |
| N9-7-6 | Pseudomonas vranovensis CCM 7279 | 98.73 | AY970951 | + | Soil besides highway |
| N6-8-3 | Pseudomonas kunmingensis HL22-2 | 99.36 | JQ246444 | + | Phosphate mine |
| N8-6-2 | Pseudomonas japonica NBRC 103040 | 99.45 | AB126621 | - | Activated sludge from sewage treatment plant |
| N13-6-2 | Pseudomonas koreensis Ps 9-14 | 100 | AF468452 | - | Agricultural soils |
| N15-6-1 | Pseudomonas brassicacearum subsp. neoaurantiaca ATCC 49054 | 99.45 | EU391388 | + | Rhizoplane of Brassica napus |
| N11-6-4 | Pseudomonas brassicacearum subsp. Brassicacearum DBK11 | 99.87 | AF10032 | - | Rhizophere of plant |
| N12-8-3 | Pseudomonas azotoformans IAM1603 | 98.26 | D84009 | + | Paddies |
| N13-8-5 | Pseudomonas thivervalensis DSM 13194 | 99.53 | AF100323 | + | Rhizoplane of Brassica napus |
| N9-6-4 | Pseudomonas rhodesiae CIP 104664 | 100 | AF064459 | - | Natural mineral water |
| N15-6-3 | Pseudomonas composti C2 | 100 | FN429930 | - | Compost samples |
| N3-7-4 | Pseudomonas taiwanensis BCRC 17751 | 98.96 | EU103629 | - | Soil |
| L3-6-1 | Pseudomonas entomophila L48 | 99.86 | AY907566 | - | Drosophila melanogaster |
| N3-7-1 | Pseudomonas chlororaphis subsp. aureofaciens NBRC 3521 | 100 | AY509898 | variable | N |
| W3-4-2 | Enterobacter xiangfangensis 10-17 | 99.87 | HF679035 | N | Rraditional sourdough |
| L4-8-2 | Bacillus cereus ATCC 14579 | 100 | AE016877 | N | N |
| L12-7-2 | Exiguobacterium acetylicum DSM 20416 | 99.74 | DQ019167 | N | Creamery waste |
| W7-4-2 | Exiguobacterium indicum HHS31 | 99.72 | AJ846291 | nitrate-nitrite | Hamta glacier |
| +: denitrification is positive; –: denitrification is negative; N: no description or no found. | |||||
表选项
2.2 菌株N15-6-1的反硝化效率定量测定 参照环境保护部发布的测定硝氮和亚硝氮行业测定标准,对59种好氧反硝化细菌代表菌株(表 1)的反硝化效率定量测定,得到12株高效好氧反硝化菌(W3-5-1、W3-5-4、W6-5-3、W16-5-2、N8-7-1、W5-7-4、N16-7-1、N6-8-3、N8-6-2、N15-6-1、N3-7-4、L3-6-1),其硝态氮的去除率均达到50%以上(图 1)。经形态学和16S rRNA基因序列分析,菌株W3-5-1、W3-5-4、W6-5-3和W16-5-2为不动杆菌属(Acinetobacter),与A. johnsonii、A. beijerinckii、A. tjernbergiae和A. tandoii的相似性分别为98.1%、97.9%、98.4%和99.4%,这4株近缘种均未见有反硝化性能的报道。菌株N8-7-1、W5-7-4、N16-7-1、N6-8-3、N8-6-2、N15-6-1、N3-7-4和L3-6-1为假单胞菌属(Pseudomonas),分别与近缘种P. hunanensis、P. putida、P. plecoglossicida、P. kunmingensis、P.japonica、P. brassicacearum subsp. neoaurantiaca、P. taiwanensis和P. entomophila的相似性为99.9%、99.7%、99.9%、99.4%、99.4%、99.5%、98.9%和99.9%。从定量实验结果上看,菌株W5-7-4、N3-7-4、N8-6-2和N8-7-1的硝氮去除率较高,均在60%以上,然而其在亚硝氮(NO2–-N)的积累量也较高(图 1)。以硝氮的去除率和亚硝氮的积累浓度两个指标为标准,筛选出菌株W6-5-3和菌株N15-6-1,并对其反硝化特性进一步研究,菌株W6-5-3研究结果已经申请专利,这里就不在赘述。菌株N15-6-1与典型菌株P. brassicacearum subsp. neoaurantiaca CIP 109457T的16S rRNA基因序列相似性为99.4%。后者有反硝化作用的能力,但未进行定量研究[32]。因此本研究选择菌株N15-6-1作为出发菌株,进而对其好氧反硝化特性进行研究。
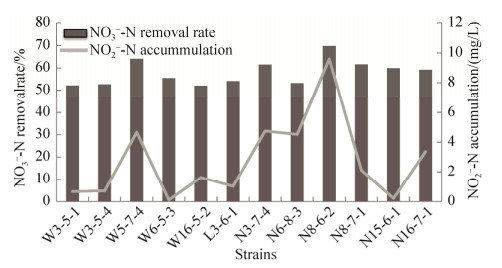 |
| 图 1 12株反硝化细菌菌株的反硝化效率 Figure 1 Denitrifying efficiency of twelve denitrifying bacteria. |
| 图选项 |
2.3 菌株N15-6-1初步鉴定 菌株N15-6-1革兰氏染色反应呈阴性,接触酶和氧化酶阳性;在LB培养基上的菌落形态特征为表面光滑,半透明,玉米黄;细胞呈杆状,有鞭毛,端生(图 2);硝酸盐还原和精氨酸水解阳性;硝基-D-甲基半乳糖水解、吲哚反应、VP实验、H2S产生、色氨酸脱氨酶、赖氨酸脱酸酶、鸟氨酸脱羧酶、发酵葡萄糖产酸、脲素水解、七叶灵水解和明胶液化均为阴性。菌株能利用葡萄糖、蔗糖、阿拉伯糖、甘露糖、甘露醇、N-乙酰葡糖胺、葡萄糖酸盐、癸酸、苹果酸、琥珀酸钠和柠檬酸钠作为碳源;不能利用麦芽糖、己二酸、苯乙酸、乙酸钠、酒石酸钠和甲醇作为碳源。
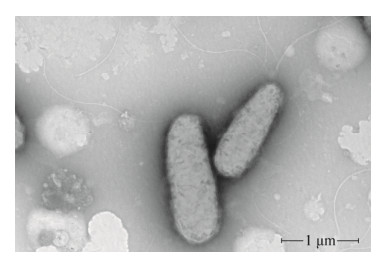 |
| 图 2 菌株N15-6-1透射电镜下的细胞形态 Figure 2 Transmission electron micrograph of cells of strain N15-6-1. |
| 图选项 |
经16S rRNA基因测序及其同源性分析,菌株N15-6-1与P. brassicacearum subsp. neoaurantiaca的相似性最高(99.4%),且在系统发育树上聚为一支(图 3)。结合形态特征、生理生化特性和16S rDNA的同源性分析,初步鉴定N15-6-1为假单胞菌的一个种。
 |
| 图 3 采用邻接法构建的菌株16S rRNA基因序列的系统发育树 Figure 3 Neighbour-joining phylogenetic tree based on 16S rRNA gene sequences showing the position of strain N15-6-1 and the type strains of related species from the genus Pseudomonas. Numbers at nodes are bootstrap values (percentages of 1000 replications); only values > 50% are shown. Bar, 0.005 substitutions per nucleotide position. |
| 图选项 |
2.4 代表性菌株N15-6-1的反硝化特性 以菌株N15-6-1为出发菌株,以反硝化培养基为基础培养基优化菌株N15-6-1的反硝化条件。
通过考察温度、pH、C/N、碳源和溶氧量等环境因子对菌株N15-6-1的反硝化能力的影响,结果表明,菌株N15-6-1在以体积比3%接种量接种到以蔗糖为碳源、KNO3为唯一氮源的液体培养基中,培养条件为30 ℃、静止、初始pH 7.0、C/N=12时,脱氮效率最优。
在脱氮最优的条件下,研究菌株N15-6-1反硝化过程。将菌株N15-6-1以体积比为3%(V/V)接种量接入不含微量元素的反硝化培养基内,每隔2 h取样一次研究氮的转化过程。从图 4可以看出,培养36 h后,硝氮(NO3–-N)的含量由91.71 mg/L降到1.09 mg/L,硝氮(NO3–-N)的去除率达到98.81%,且仅有微量的(0.008 mg/L)亚硝氮(NO2–-N)的积累,总氮(TN)的含量也从97.31 mg/L降到3.63 mg/L,总氮(TN)的去除率达96.27%。由图 4可知,菌株在12–18 h内的脱氮效率最高,这与该菌株对数生长期相吻合。同时OD600值最高仅有0.2左右,生物量较低,说明只有少量的NO3–-N转化为细胞体氮,大部分氮被转化为气体去除。
 |
| 图 4 菌株N15-6-1的脱氮效率 Figure 4 The nitrogen removal efficiency of strain N15-6-1. Data points are the average of triplicate measurements, error bars represent standard deviation. |
| 图选项 |
以模拟水质培养基为基础培养基,评价菌株N15-6-1在废水处理中的反硝化效能。从图 5可以看出,菌株N15-6-1对模拟高硝氮废水有较好的NO3–-N降解效果,且在此过程中有很少的NO2–-N积累。48 h内对NO3–-N的含量由161.51 mg/L降到0.09 mg/L,去除率达到99.94%;TN的含量由162.35 mg/L可以降到4.77 mg/L,去除率达97.06%。菌株N15-6-1的反硝化作用主要发生在对数期后期,在前24 h,TN和NO3–-N的含量变化较小,之后10 h,TN和NO3–-N含量迅速下降,在第33 h时两个指标分别从约160 mg/L降到2.88 mg/L和0.23 mg/L。NO2–-N含量呈现先上升后下降的趋势,说明菌株能以NO3–-N为底物进行反硝化作用。菌株N15-6-1对废水中的NO3–-N具有较好的降解能力,有望用于高硝氮废水的治理。
 |
| 图 5 菌株N15-6-1对模拟高氮水的脱氮效率 Figure 5 The nitrogen removal efficiency of strain N15-6-1 in simulated high nitrate wastewater. Data points are the average of triplicate measurements, error bars represent standard deviation. |
| 图选项 |
3 讨论 好氧反硝化细菌广泛分布于各种自然或人工环境中,尤其是氮素含量高的水体和土壤中。本研究采用富集培养、BTB培养基分离和Griess试剂显色方法进行好氧反硝化细菌的筛选,从滇池14个样点中共分离到260株反硝化细菌菌株,分属于2门13科14属的59个种。其中Pseudomonas、Acinetobacter、Aeromonas和Delftia为主要的细菌属,分别分离到24、11、6和3个种。这一研究结果与已知的纯培养好氧反硝化细菌类群相一致。Ji等[33]总结了近30年文献报道的好氧反硝化菌,归属14属的37个种,其中14个种为Pseudomonas,3个种为Acinetobacter,3个种为Delftia。Lv等[13]研究北京凉水河好氧反硝化细菌时发现,Pseudomonas也是主要的好氧反硝化细菌。
定量分析筛选出12株高效能的反硝化细菌,根据环境保护部发布的硝氮和亚硝氮行业标准,以菌株N15-6-1为出发菌株。结合形态特征、生理生化特性以及16S rDNA的同源性分析,菌株N15-6-1为假单胞菌的一个种。研究了不同环境因子对菌株N15-6-1反硝化特性的影响,并对其在模拟高硝氮废水中脱氮效果进行了初步探讨。在最适的培养条件下,培养36 h后,硝氮的去除率可以达到98.81%,总氮的去除率也达到96.27%。周石磊等[22]从水库底泥中分离到两株贫营养好氧反硝化菌不动杆菌(Acinetobacter sp.),72 h内硝氮的去除率分别达到98.88%和99.44%。Guo等[11]从富营养湖泊太湖分离到Pseudomonas stuteri T1,在最适的培养条件下,硝氮的去除率达到75%。本研究中菌株Pseudomonas sp. N15-6-1在转速100–200 r/min之间时菌株对NO3–-N和TN的降解率差异不大,而在低于50 r/min时,TN的去除率迅速增加。这一研究结果与文献报道的好氧反硝化溶氧阈值理论相符合[33-34]:反硝化作用首先随着DO浓度的增加而增强,随后超过某个点时,反硝化作用下降,即存在最适反硝化溶氧量,一般反硝化作用氧的阈值范围在0.08–7.7 mg/L。已有的研究报道,Paracoccus denitrification和Pseudomonas stutzeri的DO阈值分别是2.2 mg/L和2.5 mg/L[26, 34]。Huang和Tseng[35]对Citrobacter diversus的研究结果表明其最适反硝化的DO值为5 mg/L。
对菌株的模拟高硝氮废水的脱氮效果研究,发现菌株Pseudomonas sp. N15-6-1可以在低C/N(C/N=3)的条件下有较高反硝化能力,这与之前在反硝化培养基(C/N=12)中差异较大。分析原因是由于在模拟高硝氮废水中添加了微量元素从而提高了其反硝化酶的作用。研究报道,有些微量元素是酶的激活剂或者酶的辅助因子,对酶的活性有很大的影响[36]。如钼是微生物生长限制因子,对微生物的代谢乃至生命活动起着极其重要的作用[37]。铜是细菌酶的激活剂[38],如在NirK编码的亚硝酸还原酶中,铜是此酶的辅基;一氧化二氮还原酶是由含铜的亚基所组成,因此铜离子对反硝化酶是非常重要的。孟雪征[39]的研究表明,当Mo6+的浓度在小于5 mg/L时对反硝化具有促进作用,1 mg/L时促进效果最佳。荣宏伟[40]的研究表明当Cu2+的浓度低于0.5 mg/L时对反硝化过程具有一定的促进作用。
4 结论和展望 本文从滇池中分离得到260株好氧反硝化细菌菌株,并对其多样性进行了分析,筛选到12株高效的反硝化菌株,对其中的代表性菌株N15-6-1的反硝化特性进行优化,菌株可以在低C/N条件下实现高效的反硝化能力。讨论影响因子如何对菌株反硝化能力的影响,丰富了反硝化理论。本研究仅是在实验室条件下的模拟试验,对原位污水的处理效果还未知,下一步将会开展研究反硝化菌株的实际应用价值。基于本文仅通过纯培养的方法研究滇池反硝化细菌,并未涉及到对反消化细菌结构、功能及其动态变化等科学问题开展全面、系统的生态学研究。因此,对滇池反硝化菌的生态、功能及与环境因子的关系等方面的认识还有待深入,可以借助高通量测序技术和微生物组学技术研究滇池环境中的微生物的群落结构、功能。以期在全面认识微生物的多样性和功能的基础上,揭示特性微生物类群在湖泊元素地球化学循环的驱动机制。
References
| [1] | Wetzel RG. Limnology:Lake and river ecosystems. 3rd ed. London: Academic Press, 2001. |
| [2] | Wu QL, Jiang HL. China lake microbiome project. Bulletin of Chinese Academy of Sciences, 2017, 32(3): 273-279. (in Chinese) 吴庆龙, 江和龙. 中国湖泊微生物组研究. 中国科学院院刊, 2017, 32(3): 273-279. |
| [3] | Robertson LA, Kuenen JG. Aerobic denitrification-old wine in new bottles?. Antonie van Leeuwenhoek, 1984, 50(5/6): 525-544. |
| [4] | Joo HS, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4. Journal of Bioscience and Bioengineering, 2005, 100(2): 184-191. DOI:10.1263/jbb.100.184 |
| [5] | Patureau D, Zumstein E, Delgenes JP, Moletta R. Aerobic denitrifiers isolated from diverse natural and managed ecosystems. Microbial Ecology, 2000, 39(2): 145-152. DOI:10.1007/s002480000009 |
| [6] | Patureau D, Godon JJ, Dabert P, Bouchez T, Bernet N, Delgenes JP, Moletta R. Microvirgula aerodenitrificans gen. nov., sp. nov., a new Gram-negative bacterium exhibiting co-respiration of oxygen and nitrogen oxides up to oxygen-saturated conditions. International Journal of Systematic and Evolutionary Microbiology, 1998, 48: 775-782. |
| [7] | Kim M, Jeong SY, Yoon SJ, Cho SJ, Kim YH, Kim MJ, Ryu EY, Lee SJ. Aerobic denitrification of Pseudomonas putida AD-21 at different C/N ratios. Journal of Bioscience and Bioengineering, 2008, 106(5): 498-502. DOI:10.1263/jbb.106.498 |
| [8] | Zhu XY, Wang SM, Liang JR, Zhou LX. Isolation and identification of two aerobic denitrifiers with high efficiency in the removal of N from simulated wastewater. Acta Scientiae Circumstantiae, 2009, 29(1): 111-117. (in Chinese) 朱晓宇, 王世梅, 梁剑茹, 周立祥. 两株高效好氧反硝化细菌的分离鉴定及其脱氮效率. 环境科学学报, 2009, 29(1): 111-117. DOI:10.3321/j.issn:0253-2468.2009.01.017 |
| [9] | Miyahara M, Kim SW, Fushinobu S, Takaki K, Yamada T, Watanabe A, Miyauchi K, Endo G, Wakagi T, Shoun H. Potential of aerobic denitrification by Pseudomonas stutzeri TR2 to reduce nitrous oxide emissions from wastewater treatment plants. Applied and Environmental Microbiology, 2010, 76(14): 4619-4625. DOI:10.1128/AEM.01983-09 |
| [10] | Zhang JB, Wu PX, Hao B, Yu ZN. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001. Bioresource Technology, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
| [11] | Guo LY, Chen QK, Fang F, Hu ZX, Wu J, Miao AJ, Xiao L, Chen XF, Yang LY. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water. Bioresource technology, 2013, 142: 45-51. DOI:10.1016/j.biortech.2013.05.021 |
| [12] | Ji B, Wang HY, Yang K. Tolerance of an aerobic denitrifier (Pseudomonas stutzeri) to high O2 concentrations. Biotechnology Letters, 2014, 36(4): 719-722. DOI:10.1007/s10529-013-1417-x |
| [13] | Lv PY, Luo JX, Zhuang XL, Zhang DQ, Huang ZB, Bai ZH. Diversity of culturable aerobic denitrifying bacteria in the sediment, water and biofilms in Liangshui River of Beijing, China. Scientific Reports, 2017, 7(1): 10032. DOI:10.1038/s41598-017-09556-9 |
| [14] | Chen PZ, Li J, Li QX, Wang YC, Li SP, Ren TZ, Wang LG. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24. Bioresource Technology, 2012, 116: 266-270. DOI:10.1016/j.biortech.2012.02.050 |
| [15] | Zhang QL, Liu Y, Ai GM, Miao LL, Zhang HY, Liu ZP. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7. Bioresource Technology, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139 |
| [16] | Wang P, Yuan YZ, Li Q, Yang JZ, Zheng YL, He MQ, Geng H, Xiong L, Liu DL. Isolation and immobilization of new aerobic denitrifying bacteria. International Biodeterioration & Biodegradation, 2013, 76: 12-17. |
| [17] | Zhang XL, Zhang X. Denitrification characteristics of an aerobic denitrifying bacterium Bacillus sp. H2. Environmental Science & Technology, 2011, 34(10): 53-57. (in Chinese) 张小玲, 张霞. 好氧反硝化菌Bacillus sp. H2脱氮特性研究. 环境科学与技术, 2011, 34(10): 53-57. DOI:10.3969/j.issn.1003-6504.2011.10.012 |
| [18] | Song ZF, An J, Fu GH, Yang XL. Isolation and characterization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds. Aquaculture, 2011, 319(1/2): 188-193. |
| [19] | Yao S, Ni JR, Ma T, Li C. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2. Bioresource Technology, 2013, 139: 80-86. DOI:10.1016/j.biortech.2013.03.189 |
| [20] | Huang TL, Zhou SL, Zhang HH, Zhou N, Guo L, Di SY, Zhou ZZ. Nitrogen removal from micro-polluted reservoir water by indigenous aerobic denitrifiers. International Journal of Molecular Sciences, 2015, 16(4): 8008-8026. |
| [21] | Guo DQ, Liu HL, Wan YT, Li XW, Chen YY, Guan LB, Shan LN. Isolation and identification of an aerobic denitrifier and its denitrifying characteristic. Biotechnology Bulletin, 2012(10): 205-209. (in Chinese) 郭端强, 刘海龙, 万亚涛, 李小卫, 陈艳艳, 管丽冰, 单林娜. 一株好氧反硝化细菌的分离鉴定及反硝化特性研究. 生物技术通报, 2012(10): 205-209. |
| [22] | Zhou SL, Huang TL, Bai SY, He XX. Isolation, identification, and nitrogen removal characteristics of oligotrophic aerobic denitrifiers. China Environmental Science, 2016, 36(1): 238-248. (in Chinese) 周石磊, 黄廷林, 白士远, 何秀秀. 贫营养好氧反硝化菌的分离鉴定及其脱氮特性. 中国环境科学, 2016, 36(1): 238-248. DOI:10.3969/j.issn.1000-6923.2016.01.040 |
| [23] | Chen Q, Ni JR. Heterotrophic nitrification-aerobic denitrification by novel isolated bacteria. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1305-1310. |
| [24] | Wang P, Li XT, Xiang MF, Zhai Q. Characterization of efficient aerobic denitrifiers isolated from two different sequencing batch reactors by 16S-rRNA analysis. Journal of Bioscience and Bioengineering, 2007, 103(6): 563-567. DOI:10.1263/jbb.103.563 |
| [25] | Shi Z, Zhang Y, Zhou JT, Chen MX, Wang XJ. Biological removal of nitrate and ammonium under aerobic atmosphere by Paracoccus versutus LYM. Bioresource Technology, 2013, 148: 144-148. DOI:10.1016/j.biortech.2013.08.052 |
| [26] | Lukow T, Diekmann H. Aerobic denitrification by a newly isolated heterotrophic bacterium strain TL1. Biotechnology Letters, 1997, 19(11): 1157-1159. DOI:10.1023/A:1018465232392 |
| [27] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001. |
| [28] | Cui XL, Mao PH, Zeng M, Li WJ, Zhang LP, Xu LH, Jiang CL. Streptimonospora salina gen. nov., sp. nov., a new member of the family Nocardiopsaceae. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(2): 357-363. DOI:10.1099/00207713-51-2-357 |
| [29] | 国家环境保护总局. HJ/T 346-2007水质硝酸盐氮的测定紫外分光光度法(试行), 中华人民共和国环境保护行业标准, 2007. |
| [30] | 国家环境保护总局. GB 7493-1987水质亚硝酸盐氮的测定分光光度法, 中华人民共和国环境保护行业标准, 1987. |
| [31] | 国家环境保护总局. HJ 636-2012水质总氮的测定碱性过硫酸钾消解紫外分光光度法, 中华人民共和国环境保护行业标准, 2012. |
| [32] | Ivanova EP, Christen R, Bizet C, Clermont D, Motreff L, Bouchier C, Zhukova NV, Crawford RJ, Kiprianova EA. Pseudomonas brassicacearum subsp. nov., orange-pigmented bacteria isolated from soil and the rhizosphere of agricultural plants. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(10): 2476-2481. DOI:10.1099/ijs.0.009654-0 |
| [33] | Ji B, Yang K, Zhu L, Jiang Y, Wang HY, Zhou J, Zhang HN. Aerobic denitrification:A review of important advances of the last 30 years. Biotechnology and Bioprocess Engineering, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
| [34] | Wilson LP, Bouwer EJ. Biodegradation of aromatic compounds under mixed oxygen/denitrifying conditions:a review. Journal of Industrial Microbiology and Biotechnology, 1997, 18(2/3): 116-130. |
| [35] | Huang HK, Tseng SK. Nitrate reduction by Citrobacter diversus under aerobic environment. Applied Microbiology and Biotechnology, 2001, 55(1): 90-94. DOI:10.1007/s002530000363 |
| [36] | Burgess JE, Quarmby J, Stephenson T. Role of micronutrients in activated sludge-based biotreatment of industrial effluents. Biotechnology Advances, 1999, 17(1): 49-70. DOI:10.1016/S0734-9750(98)00016-0 |
| [37] | Jefferson B, Burgess JE, Pichon A, Harkness J, Judd SJ. Nutrient addition to enhance biological treatment of greywater. Water Research, 2001, 35(11): 2702-2710. DOI:10.1016/S0043-1354(00)00553-4 |
| [38] | Grau P. Criteria for nutrient-balanced operation of activated sludge process. Water Science and Technology, 1991, 24(3/4): 251-258. |
| [39] | Meng XZ, Cao XS, Cao L. Effects of molybdenum (Ⅵ) on denitrification performance of the activated sludge process. Ecology and Environment, 2006, 15(2): 216-218. (in Chinese) 孟雪征, 曹相生, 曹磊. Mo6+对活性污泥系统反硝化性能的影响. 生态环境, 2006, 15(2): 216-218. DOI:10.3969/j.issn.1674-5906.2006.02.003 |
| [40] | Rong HW, Wang Q, Zhang CS, Zhang KF. Effects of Cu2+ and Zn2+ on the biological nitrogen removal system. Chinese Journal of Environmental Engineering, 2009, 3(4): 617-620. (in Chinese) 荣宏伟, 王勤, 张朝升, 张可方. Cu2+、Zn2+对生物脱氮系统的影响. 环境工程学报, 2009, 3(4): 617-620. |
