陈丽莹1,2,3, 张玉满1,2, 陈晓英1,2, 方荣祥1,2, 张莉莉1,2


1.中国科学院微生物研究所, 植物基因组学国家重点实验室, 北京 100101;
2.国家植物基因研究中心, 北京 100101;
3.中国科学院大学, 北京 100049
收稿日期:2017-12-07;修回日期:2017-12-15;网络出版日期:2018-08-27
基金项目:三峡库区农业面源污染控制纳米碳添加肥与生物组合技术应用研究(2015HXKY2-4-1)
*通信作者:张莉莉, Tel:+86-10-64861838, Fax:+86-10-64858245, E-mail:zhangll@im.ac.cn
摘要:[目的]茶树(Camellia sinensis)为多年生常绿木本植物,其叶片用于生产茶叶。本论文通过测定茶树叶际内生细菌的菌群组成,比较叶际内生菌与土壤菌群的异同,以鉴定选择性富集于茶树叶际的内生细菌。[方法]本研究采集湖北宜昌邓村茶树,对茶叶表面进行除菌处理,提取茶叶及其内生细菌的总基因组DNA,通过细菌16S核糖体RNA基因(16S rDNA)保守区引物799F和1193R扩增16S rDNA的V5–V7可变区序列,并通过Illumina二代测序平台对扩增子进行建库测序。[结果]茶叶内生菌群由变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和极少量的梭杆菌门(Fusobacteria)5个门,共百余属组成,其中,甲基杆菌属(Methylobacterium)、代尔夫特菌属(Delftia)、微杆菌属(Microbacterium)、红球菌属(Rhodococcus)、Aureimonas和鞘氨醇单胞菌属(Sphingomonas)等以较高丰度富集于叶片组织内部。约40%的茶叶叶际内生细菌也在相应的土壤中存在,表明其可能的土壤来源;非土壤来源的茶叶内生细菌达60%,如Aureimonas和Delftia等。[结论]本研究解析了茶树叶际内生细菌的群落组成与结构,分析了内生细菌的可能来源,为以叶际内生菌为靶标,改善茶叶品质、降解农药残留、防御茶叶病虫害的研究提供基础。
关键词: 茶树 茶叶 叶际内生细菌菌群 土壤微生物群落 16S rDNA测序
Identification of endophytic bacteria selectively enriched in Camellia sinensis leaf
Liying Chen1,2,3, Yuman Zhang1,2, Xiaoying Chen1,2, Rongxiang Fang1,2, Lili Zhang1,2


1.State Key Laboratory of Plant Genomics, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2.National Plant Gene Research Center, Beijing 100101, China;
3.University of Chinese Academy of Sciences, Beijing 100049, China
Received 7 December 2017; Revised 15 December 2017; Published online 27 August 2018
*Corresponding author: Lili Zhang, Tel: +86-10-64861838; Fax: +86-10-64858245; E-mail: zhangll@im.ac.cn
Supported by the Follow-up Research Project of the Three Gorges Project (2015HXKY2-4-1)
Abstract: [Objective]Endophytic bacteria of tea leaves may play important roles in tea quality and disease defense. Here we clarify the bacterial communities inside tea leaves, compare the endophytic microbiota with the soil microbial flora, and identify the bacteria that have been selectively enriched in leaves.[Methods]Tea plants and the corresponding soil were sampled from Dengcun, Yichang, Hubei. Genomic DNA was extracted from both leaves and the endophytic bacteria, and the bacterial community was analyzed using Illumina MiSeq sequencing of 16S rRNA gene amplicon (V5-V7).[Results]Camellia sinensis leaf-colonizing endophytic microbiota were mainly composed of five phyla. At the genus level, more than 100 genera were identified among which the genera Methylobacterium, Delftia, Microbacteria, Rhodococcus, Aureimonas and Sphingomonas existed in high abundance. About 40% of the endophytic bacteria were also identified in the soil sample. The endophytic bacteria that did not exist in soil, such as Aureimonas and Delftia, accounted for the rest 60%.[Conclusion]Our findings would provide basis for the bacterium-based strategies in disease control and tea quality.
Keywords: Camellia sinensis tea phyllosphere endophytic bacteria soil microbiota 16S rDNA sequencing
自然状态下,植物并不是孤立地生长,而是与其体表和体内的多种微生物共栖[1-2],这些共栖微生物可以在营养、抗胁迫等方面来影响宿主植物的生长[3-4]。细菌是植物共栖微生物的主要组成成分[2],按照分布位置,植物细菌菌群被分为两类,一类是生活在植物表面的表面菌群(epiphytic bacteria),另一类是定殖在植物体组织内部的内生菌群(endophytic bacteria)[2]。植物内生细菌是指栖居在植物组织内部而且对宿主植物没有危害的细菌。按照植物体的结构组成,植物细菌菌群也可以被分为叶际菌群和根际菌群两大类。研究表明,植物叶际微生物中的有益细菌不仅可以促进植物的营养生长[5],而且可以阻止病原菌的侵染[6]。
茶树(Camellia sinensis)的多个变种用于生产茶叶,是我国重要的经济作物。先前的研究仅对茶树根际和叶表细菌进行解析[7-8],然而对于多年生常绿木本植物,叶际内生益生菌将更有可能作为遗传操作的靶标,为茶树叶片提供稳定的生物学性状,因此解析叶际内生菌群、鉴定选择性富集于茶叶组织内部的细菌具有重要的生物学意义。
由于自然界中绝大部分细菌不可培养[9-10],因此传统的培养法研究会导致对菌群的解析不全面。非培养法在DNA水平解析微生物群落,并对每种微生物的相对丰度进行分析,能更真实地反映微生物群落的结构组成,逐渐成为菌群解析的重要手段。基于16S rDNA扩增子的二代测序是常用的细菌非培养法研究手段,已被广泛应用于多种环境微生物群落以及动植物共生菌群的解析[11-13]。由于植物细胞器DNA与细菌16S rDNA的高度同源性造成的高比例宿主DNA污染[14-15],目前植物内生菌群的结构解析进展较为缓慢。
本研究采用16S rDNA扩增子测序的方法对茶叶内生菌群进行结构解析,我们选择植物共生菌测序常用引物对799F/1193R扩增细菌16S rDNA的V5-V7区[12, 16-17],并通过Illumina二代测序平台对扩增子进行测序。内生菌群通过与茶田土壤细菌群落进行比较,分析各内生细菌的可能来源,为以内生菌为靶标,促进茶叶生长、提升茶叶品质、防御茶叶病害的研究提供基础。
1 材料和方法 1.1 材料、试剂 本论文所用的茶树叶片和茶田土壤样品采自湖北省宜昌市邓村,3组叶片和土壤样品分别来自3个不同的茶田。
MO BIO PowerLyzer PowerSoil DNA isolation kit,乙醇,Tween20,TE缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA;pH 8.0),10% SDS,蛋白酶K (100 μg/mL,AMRESCO,Solon,USA),5 mol/L NaCl,CTAB/NaCl溶液(0.7 mol/L NaCl,10% (10 g/100 mL) CTAB),酚:氯仿:异戊醇(25:24:1,体积比),氯仿/异戊醇(1:1,体积比),KOD Plus (东洋纺,日本)。
1.2 土壤DNA提取 按照MO BIO PowerLyzer PowerSoil DNA isolation kit的说明书操作步骤提取茶田土壤样品的DNA。3组土壤样品各提取3份DNA。
1.3 茶树叶片表面除菌 取3-5片茶叶于50 mL无菌离心管(Thermo Fisher Scientific,USA)中,先用75%乙醇浸泡并振荡清洗5 min,再用ddH2O加表面活性剂Tween20 (1000:1)混匀后充分振荡清洗5 min,最后用ddH2O清洗4遍。
1.4 茶树叶片及其内生细菌总DNA提取 表面除菌后的茶叶用液氮研磨至细小粉末状,取适量(约100 mg)于1.5 mL离心管中;加567 μL TE缓冲液,涡旋振荡,充分混匀;加入30 μL 10% SDS和20 μL的蛋白酶K,振荡混匀,加2 μL RNase (100 mg/mL),37 ℃温育1 h;加入100 μL 5 mol/L NaCl,混匀,再加入80 μL CTAB/NaCl溶液,混匀后再65 ℃温育10 min;加入等体积的酚:氯仿:异戊醇(25:24:1),混匀,10000×g离心5 min,取上清;加入等体积的氯仿/异戊醇,混匀,10000×g离心5 min,取上清;加入0.6-0.8倍体积的异丙醇,轻轻混匀,10000×g离心5 min,弃上清;加1 mL 70%乙醇反复吹吸几次,10000×g离心5 min,弃乙醇;晾干后加ddH2O溶解DNA,-20 ℃保存。3组叶片样品各提取3份DNA。
1.5 PCR扩增 扩增引物对为799F(5′-AACMGGATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC-3′),5′端添加barcode序列的引物由美吉桑格生物医药科技股份有限公司提供。反应体系:10× KOD Buffer 5 μL;2 mmol/L dNTPs 5 μL;MgSO4 2 μL;KOD Plus 1 μL;引物799F和1193R各1.5 μL;DNA模板(茶树叶片及其内生菌总DNA 50 ng,茶田土壤DNA 10 ng);ddH2O补足至50 μL。扩增程序:94 ℃ 2 min;94 ℃ 30 s,63 ℃ 30 s,68 ℃ 30 s,30个循环;68 ℃ 5 min。
每个DNA样品设置3个PCR重复反应,每个样品的扩增总产物为3份重复PCR产物的总和。
1.6 16S rDNA扩增子测序 本次实验共18个测序样品,扩增产物交由美吉桑格生物医药科技股份有限公司进行建库测序,采用Illumina Miseq PE300平台,对菌群的V5-V7区进行测序。
2 结果和分析 2.1 测序样品的细菌群落alpha多样性分析 本次测序所得序列按照≥97%的相似度完成OTU (operational taxonomic unit,可操作分类单元)聚类,并在数据库SILVA (Release128 http://www.arb-silva.de)中按照0.7的分类置信度对OTU进行物种注释。如图 1所示,所有样品的稀释曲线均趋于平缓,且alpha多样性的coverage指数均大于0.97 (表 1),说明本次测序的测序数据量足够,可以进行后续的多样性分析。样品稀释曲线图和alpha多样性指数表均显示,茶叶内生细菌的sobs (表示物种数目)指数远小于茶土细菌菌群(图 1和表 1);另外,茶叶内生细菌的Shannon指数(表示群落多样性,其数值与多样性成正比)明显低于茶田土壤细菌菌群(表 1)。该结果表明,茶叶内生细菌菌群在物种数目和群落结构多样性上远低于茶土细菌菌群。
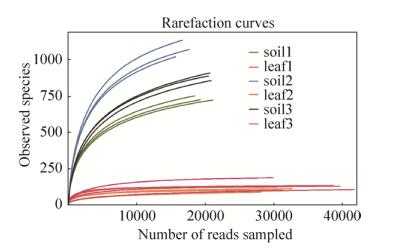 |
| 图 1 样品稀释曲线图 Figure 1 Rarefaction curves of samples. Horizontal axis indicates the number of effective sequences, vertical axis indicates observed species(sobs) number. |
| 图选项 |
表 1. 测序样品的alpha多样性指数表 Table 1. Alpha diversity index of samples
| Sample | Sobs | Ace | Chao | Shannon | Simpson | Coverage |
| soil1_1 | 720 | 843 | 836 | 5.02 | 0.02 | 0.99 |
| soil1_2 | 722 | 848 | 866 | 5.19 | 0.01 | 0.99 |
| soil1_3 | 749 | 896 | 902 | 5.18 | 0.01 | 0.99 |
| soil2_1 | 1069 | 1211 | 1221 | 5.75 | 0.01 | 0.99 |
| soil2_2 | 1131 | 1289 | 1312 | 5.89 | 0.01 | 0.99 |
| soil2_3 | 1018 | 1178 | 1186 | 5.73 | 0.01 | 0.99 |
| soil3_1 | 906 | 1101 | 1119 | 5.31 | 0.01 | 0.99 |
| soil3_2 | 885 | 1035 | 994 | 5.32 | 0.01 | 0.99 |
| soil3_3 | 854 | 1006 | 1024 | 5.16 | 0.01 | 0.99 |
| leaf1_1 | 133 | 137 | 139 | 2.95 | 0.10 | 1.00 |
| leaf1_2 | 127 | 129 | 129 | 3.26 | 0.07 | 1.00 |
| leaf1_3 | 121 | 122 | 122 | 3.25 | 0.07 | 1.00 |
| leaf2_1 | 101 | 104 | 104 | 2.83 | 0.09 | 1.00 |
| leaf2_2 | 111 | 117 | 119 | 2.27 | 0.21 | 1.00 |
| leaf2_3 | 86 | 103 | 97 | 1.96 | 0.20 | 1.00 |
| leaf3_1 | 185 | 192 | 192 | 2.90 | 0.10 | 1.00 |
| leaf3_2 | 104 | 125 | 129 | 2.23 | 0.15 | 1.00 |
| leaf3_3 | 125 | 129 | 129 | 2.91 | 0.09 | 1.00 |
| Alpha diversity indexes are used to reflect the richness and diversity of microbial community. Sobs (the observed richness), Ace (the ACE estimator) and Chao (the Chao1 estimator) indicate the community richness. Shannon and Simpson suggest the community diversity. Coverage index reflects the community coverage of sequencing sample. | ||||||
表选项
2.2 茶叶内生细菌菌群的组成结构 茶叶内生细菌菌群在门水平上主要由变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes) 4个门组成,此外还有极少量的梭杆菌门(Fusobacteria) (图 2)。茶叶叶际内生菌群的组成与目前已测定的多数植物相一致[2],进一步支持了不同植物的内生细菌菌群在门水平上基本一致的结论。属水平上,茶叶内生细菌菌群的组成种类繁多,超过100个属(前100个属见图 2)。我们进而分析了三组茶叶样品共有的,即在茶叶组织内较稳定存在的内生细菌,发现OTUs水平上有102种(图 3),属水平上相对丰度超过1%的有13个属(图 4)。其中,甲基杆菌属(Methylobacterium)、代尔夫特菌属(Delftia)、微杆菌属(Microbacterium)、红球菌属(Rhodococcus)、Aureimonas和鞘氨醇单胞菌属(Sphingomonas)相对丰度较高,超过5%(图 4),是茶叶内生细菌菌群的优势组分。
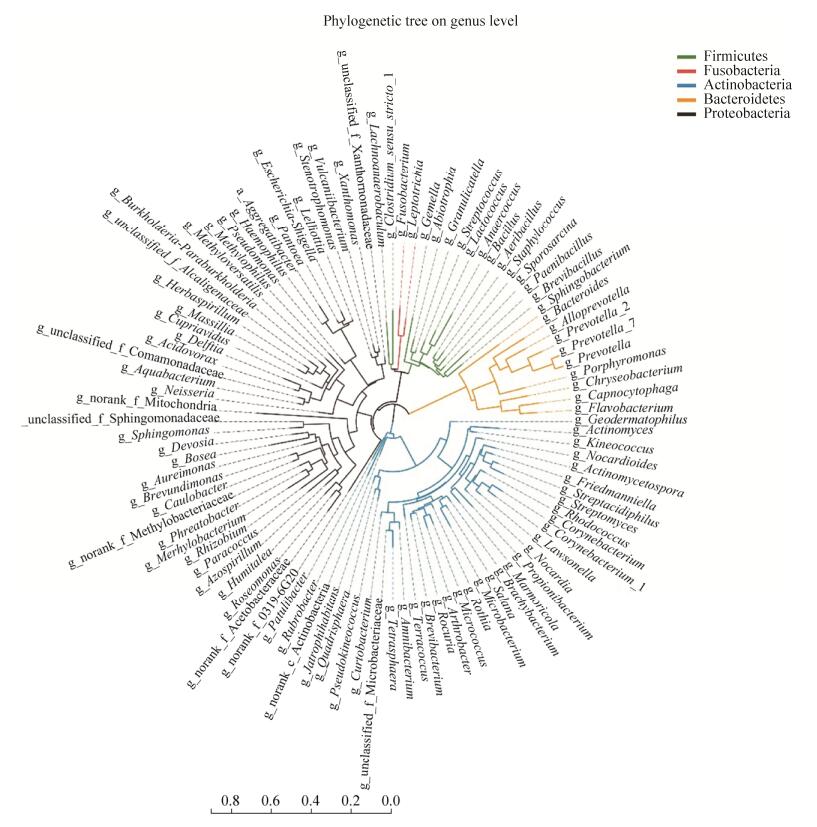 |
| 图 2 茶叶内生细菌菌群属水平系统进化树 Figure 2 Phylogenetic tree on genus level of tea leaf (Top100 genera). Different colors of the tree branch suggest different phyla. |
| 图选项 |
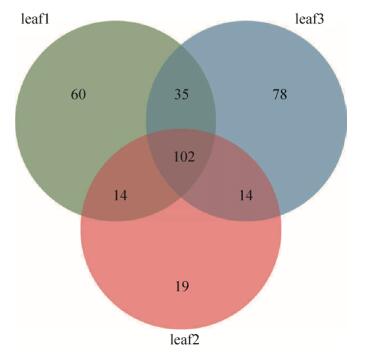 |
| 图 3 三组茶叶样品的OTUs维恩图 Figure 3 Venn diagrams of bacterial OTUs in three groups of tea leaf samples. It shows the number of shared and unique OTUs in those samples. The intersections of the circles shows the coexisted bacterial OTUs in those samples. |
| 图选项 |
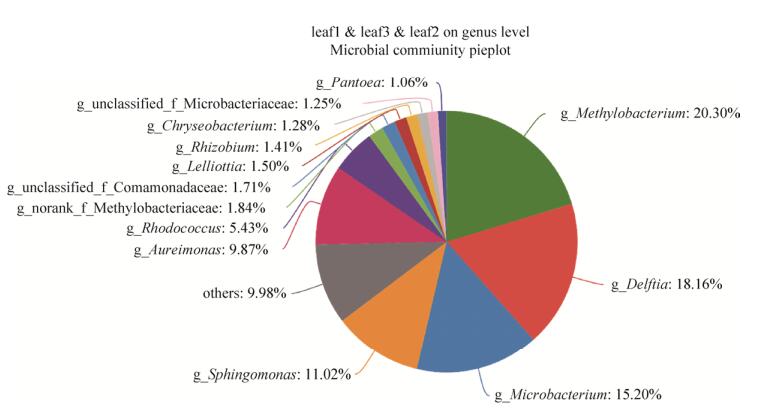 |
| 图 4 三组茶叶样品共有菌属 Figure 4 Common bacteria in three groups of tea leaf samples on genus level. This figure shows the genus whose relative abundance is over 1%, the others was classified as "others". |
| 图选项 |
2.3 不足40%茶叶内生细菌可能来源于土壤 植物叶际内生细菌的来源包括植物生活的土壤环境、空气环境、取食昆虫或上一代植物等,明确内生菌的来源将有助于探索如何使用不同来源内生菌发挥其特定的生物学功能。由于土壤微生物的可测性,以及其作为植物根内细菌主要来源的前期研究结果[1, 13],本文中我们进一步测定了茶树生长的土壤中的菌群组成,通过茶叶内生菌与土壤中各细菌丰度的比较,鉴定来源于土壤并选择性富集于茶叶内部的细菌。如图 5所示,茶田土壤细菌菌群由25个门组成,其中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)是相对丰度最高的3个门。茶田土壤菌群中有较高丰度的酸杆菌门(Acidobacteria)细菌,推测为适应南方茶园土壤偏酸性的结果。
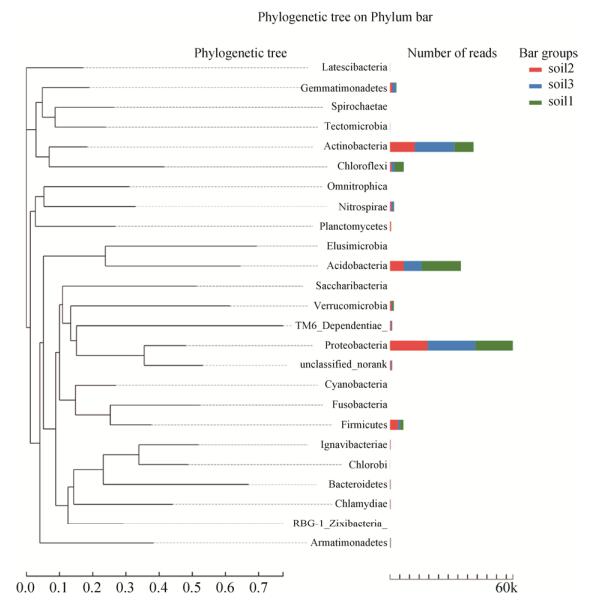 |
| 图 5 茶田土壤内生细菌菌群门水平系统进化树 Figure 5 Phylogenetic tree on phylum level of tea soil. The color bar shows abundance of the phylum in different samples. |
| 图选项 |
图 6显示,3组茶叶内生细菌和茶田土壤细菌菌群共有的OTUs分别仅占茶叶内生细菌菌群OTUs总数的37.4%、34.2%、38.4%,说明茶叶内生细菌菌群中土壤来源的细菌占比比较稳定但不足40%,超过60%的茶叶内生细菌都是茶田土壤中没有的,即这部分细菌都是非土壤来源的。茶树与土壤是多年相互共生的环境体系,茶叶和土壤共有的细菌大多为叶内细菌来源于土壤,但也不能排除某些在茶土和茶叶内部共有的细菌分别由不同渠道分别获得的可能性。
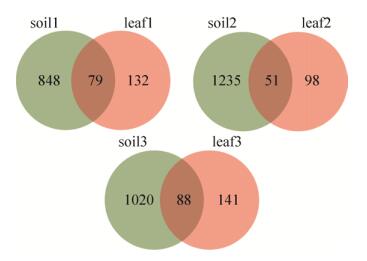 |
| 图 6 茶叶和茶土的OTUs维恩图 Figure 6 Venn diagrams of bacterial OTUs in samples of tea leaf and tea soil. |
| 图选项 |
聚类热图展示了各样品中相对丰度排名前50的属水平的细菌(图 7),从图中可以看出,茶叶和茶田土壤的菌群在高丰度菌种上交集非常少,鞘氨醇单胞菌(Sphingomonas)同时高丰度地存在于茶土菌群和茶叶内生菌群中;茶田土壤中约69%的细菌在土壤中非常丰富但并不能被叶际有效吸收;部分细菌在土壤中并不丰富,但被选择性富集于茶叶内,如甲基杆菌属(Methylobacterium)、微杆菌属(Microbacterium)、红球菌属(Rhodococcus);Aureimonas、Delftia和Curtobacterium等属的细菌则仅在茶叶样品中检测到,在土壤中完全没有,为非土壤来源,或为茶叶的专性内生菌。
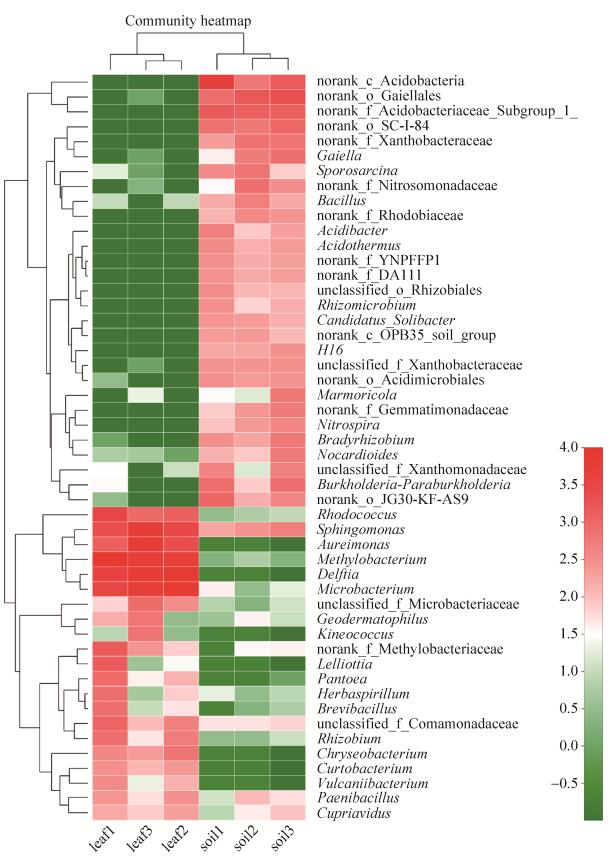 |
| 图 7 属水平聚类热图 Figure 7 Heatmap graph on genus level (Top50). The color was determined by lg(sequence number), showing species richness. |
| 图选项 |
3 讨论 基于16S rDNA基因扩增子测序的二代测序技术被广泛应用于细菌菌群的结构解析[12-13],然而该方法在植物内生菌群的研究方向进展缓慢,其中最大的挑战在于植物细胞器DNA(包括线粒体18S rDNA和叶绿体16S rDNA)与细菌16S rDNA的高度同源性所导致的大量宿主源DNA污染[14-15]。我们前期通过序列比对发现,茶树线粒体18S rDNA与细菌16S rDNA同源性较低,而测序引物799F和1193R能有效排除茶树叶绿体的污染,因此通过该引物对可完全避开茶树DNA污染,从而获得无污染的茶叶内生细菌16S rDNA扩增子文库,进而基于每个测序样品约3万条有效序列的数据量对茶叶内生细菌菌群进行准确解析。本研究首次将16S rDNA扩增子测序方法应用于解析茶叶内生细菌菌群的组成结构,填补了茶叶内生细菌非培养法研究的空白。
在菌群组成上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)是茶叶内生细菌的主要组分,与其他植物共生菌群组成相似;除此之外,茶叶中还有极少量的梭杆菌门(Fusobacteria)。属水平上,解析了茶叶内生细菌的100个属(按相对丰度排名的前100个属)。茶叶内生细菌菌群组成结构的深度解析为茶叶内生细菌功能的研究提供了菌群图谱。基于本论文的结果,进一步的研究可以开展茶叶益生菌的筛选从而改善茶叶品质,筛选抗农药胁迫或者可降解农药残留的益生菌以促进茶叶的绿色生产。
通过与茶田土壤菌群的比较发现,与其他植物不同,茶叶内生细菌只有少部分来源于土壤,60%以上的茶叶内生细菌都是非土壤来源的。究其原因,可能跟茶叶的生长周期有关。先前的研究大多是一年生草本植物,比如水稻,而茶树是多年生木本植物,其地上部分较长的生长周期使得空气中的细菌进入植物内的几率增大,叶片内生菌的组成也在更大程度上受空气环境影响;同时,较长的生长周期可能也会促进细菌与植物共生关系的建立从而利于形成植物专性内生细菌。另外,多年生植物Arabis alpine (高山南芥)的根围微生物和根部内生菌群被发现随植物在土壤中生活时间的延长而不断变化[18],进一步研究我们也将探索茶树的叶片微生物群落如何随茶龄的增长而逐年发生改变,茶叶内选择性富集的菌种是否会随茶龄增长而不断提高其相对丰度。本研究中茶叶内生细菌非土壤来源占大部分这一结果可以为茶树种植中菌肥的喷施提供借鉴意义——探究非土壤来源茶叶内生细菌的叶片促生菌,然后据此制作菌肥,并通过叶面喷洒的方式施肥。
References
| [1] | Bulgarelli D, Schlaeppi K, Spaepen S, Ver Loren van Themaat E, Schulze-Lefert P. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology, 2013, 64: 807-838. DOI:10.1146/annurev-arplant-050312-120106 |
| [2] | Müller DB, Vogel C, Bai Y, Vorholt JA. The plant microbiota:systems-level insights and perspectives. Annual Review of Genetics, 2016, 50: 211-234. DOI:10.1146/annurev-genet-120215-034952 |
| [3] | Bailly A, Groenhagen U, Schulz S, Geisler M, Eberl L, Weisskopf L. The inter-kingdom volatile signal indole promotes root development by interfering with auxin signalling. The Plant Journal, 2014, 80(5): 758-771. DOI:10.1111/tpj.2014.80.issue-5 |
| [4] | Glick BR. Bacteria with ACC deaminase can promote plant growth and help to feed the world. Microbiological Research, 2014, 169(1): 30-39. DOI:10.1016/j.micres.2013.09.009 |
| [5] | Ruppel S, Merbach W. Effect of ammonium and nitrate on 15N2-fixation of Azospirillum spp. and Pantoea agglomerans in association with wheat plants. Microbiological Research, 1997, 152(4): 377-383. DOI:10.1016/S0944-5013(97)80055-9 |
| [6] | Behnam S, Ahmadzadeh M, Sharifi Tehrani A, Hedjaroude GA, Farzaneh M. Biological control of Sclerotinia sclerotiorum (Lib.) de Bary, the causal agent of white mold, by Pseudomonas species on canola petals. Communications in Agricultural and Applied Biological Sciences, 2007, 72(4): 993-996. |
| [7] | Gulati A, Sood S, Rahi P, Thakur R, Chauhan S, Chawla I. Diversity analysis of diazotrophic bacteria associated with the roots of tea (Camellia sinensis (L.) O. Kuntze). Journal of Microbiology and Biotechnology, 2011, 21(6): 545-555. |
| [8] | Gao XH, Gao SH. Pathology analysis of micro zones on tea leaves. China Tea Processing, 2000(4): 34-37. (in Chinese) 高旭晖, 高曙晖. 茶树叶面微域环境的病理剖析. 中国茶叶加工, 2000(4): 34-37. |
| [9] | Tholozan JL, Cappelier JM, Tissier JP, Delattre G, Federighi M. Physiological characterization of viable-but-nonculturable Campylobacter jejuni cells. Applied & Environmental Microbiology, 1999, 65(3): 1110-1116. |
| [10] | Pace NR. A molecular view of microbial diversity and the biosphere. Science, 1997, 276(5313): 734-740. DOI:10.1126/science.276.5313.734 |
| [11] | Chelius MK, Triplett EW. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology, 2001, 41(3): 252-263. DOI:10.1007/s002480000087 |
| [12] | Bai Y, Müller DB, Srinivas G, Garrido-Oter R, Potthoff E, Rott M, Dombrowski N, Münch PC, Spaepen S, Remus-Emsermann M, Hüttel B, McHardy AC, Vorholt JA, Schulze-Lefert P. Functional overlap of the Arabidopsis leaf and root microbiota. Nature, 2015, 528(7582): 364-369. DOI:10.1038/nature16192 |
| [13] | Edwards J, Johnson C, Santos-Medellín C, Lurie E, Podishetty NK, Bhatnagar S, Eisen JA, Sundaresan V. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): E911-E920. DOI:10.1073/pnas.1414592112 |
| [14] | Ghyselinck J, Pfeiffer S, Heylen K, Sessitsch A, de Vos P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. PLoS One, 2013, 8(8): e71360. DOI:10.1371/journal.pone.0071360 |
| [15] | Bulgarelli D, Garrido-Oter R, Münch PC, Weiman A, Dr?ge J, Pan Y, McHardy AC, Schulze-Lefert P. Structure and function of the bacterial root microbiota in wild and domesticated barley. Cell Host & Microbe, 2015, 17(3): 392-403. |
| [16] | Horton MW, Bodenhausen N, Beilsmith K, Meng D, Muegge BD, Subramanian S, Vetter MM, Vilhjálmsson BJ, Nordborg M, Gordon JI, Bergelson J. Genome-wide association study of Arabidopsis thaliana leaf microbial community. Nature Communications, 2014, 5: 5320. DOI:10.1038/ncomms6320 |
| [17] | Schlaeppi K, Dombrowski N, Oter RG, Ver Loren van Themaat E, Schulze-Lefert P. Quantitative divergence of the bacterial root microbiota in Arabidopsis thaliana relatives. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(2): 585-592. DOI:10.1073/pnas.1321597111 |
| [18] | Dombrowski N, Schlaeppi K, Agler MT, Hacquard S, Kemen E, Garrido-Oter R, Wunder J, Coupland G, Schulze-Lefert P. Root microbiota dynamics of perennial Arabis alpina are dependent on soil residence time but independent of flowering time. The ISME Journal, 2017, 11(1): 43-55. DOI:10.1038/ismej.2016.109 |
