关统伟

 , 向慧平, 冯栩, 杨阳, 焦士蓉, 赵辉平
, 向慧平, 冯栩, 杨阳, 焦士蓉, 赵辉平 西华大学微生物研究所, 四川省高校食品生物技术重点实验室, 四川 成都 610039
收稿日期:2018-04-06;修回日期:2018-05-27;网络出版日期:2018-07-16
基金项目:教育部春晖计划(Z2012022, 13205639)
*通信作者:关统伟, Tel/Fax:+86-28-87720552, E-mail:guantongweily@163.com
摘要:[目的]认识和了解硝尔库勒湖可培养放线菌的多样性、功能酶和抗细菌活性特点,为今后的开发和利用奠定基础。[方法]应用可培养技术和基于16S rRNA基因序列的系统发育分析硝尔库勒盐湖沉积物中放线菌的多样性。常规方法检测样品成分因子,并筛选了嗜盐放线菌的蛋白酶、淀粉酶和酯酶活性;抑菌圈法检测放线菌新种的抗细菌活性。[结果]分离获得了51个OTUs,分属于24个不同的属,其中15个OTUs代表了放线菌新种;链霉菌属是优势菌属,占全部分离菌株数量的16.25%。硝尔库勒湖放线菌类群数量一定程度上受样品成分因子的协同影响。代表新种的菌株展示了良好的功能酶活性和抗细菌活性,其中代表链霉菌新种的菌株XHU5011不仅具有多种酶活性,而且具有强大的抗金黄葡萄球菌、耻垢分枝杆菌和荧光假单胞菌的能力,具有很好的开发潜能。[结论]硝尔库勒盐湖中存在丰富的可培养放线菌多样性,潜藏着大量的放线菌新资源,并且具有很好的功能酶和天然产物挖掘潜力。
关键词: 硝尔库勒湖 放线菌 功能酶 抗细菌活性
Diversity and antibacterial activity of culturable actinobacteria from Xiaoerkule Lake
Tongwei Guan

 , Huiping Xiang, Xu Feng, Yang Yang, Shirong Jiao, Huiping Zhao
, Huiping Xiang, Xu Feng, Yang Yang, Shirong Jiao, Huiping Zhao Key Laboratory of Food Biotechnology in Colleges and Universities in Sichuan Province, Institute of Microbiology, Xihua University, Chengdu 610039, Sichuan Province, China
Received 6 April 2018; Revised 27 May 2018; Published online 16 July 2018
*Corresponding author: Tongwei Guan, Tel/Fax: +86-28-87720552; E-mail: guantongweily@163.com
Supported by the Chunhui Project of Ministry of Education of China (Z2012022, 13205639)
Abstract: [Objective]The study is aimed to reveal the diversity of culturable actinobacteria in Xiaoerkule salt lake, to lay a foundation for further development.[Methods]Actinobacterial diversity of Xiaoerkule lake was studied by culturable method and phylogenetic analysis based on 16S rRNA gene sequences. Component factors of samples were tested by conventional methods. Activity for protease, amylase and asterase was tested by inoculating single colony method. Antibacterial activity of novel actinomycetes was detected by bacteriostasis ring method.[Results]In total 51 OTUs isolated from the salt lake belonged to 24 different genera, and 15 strains are novel actinomycetes. Streptomyces is predominated microorganisms for 16.25% of the total isolated amounts. Sample environmental factors affected the population of actinomycetes in this lake. Tested actinomycetes showed excellent functional enzyme activity and antibacterial activity. Strain XHU 5011, a novel actinomycete, showed great potential for anti-Staphylococcus aureus, anti-Mycobacterium smegmatis and anti-Pseudomonas fluoressens.[Conclusion]There is abundant actinobacterial diversity in the sediment of Xiaoerkule lake, and the result implies that there are large numbers of unknown actionobacterial groups here. These actinomycetes have excellent functional enzymes and provide the basis for further study on secondary metabolites.
Keywords: Xiaoerkule lake actinobacteria functional enzyme antibacterial activity
极端环境造就的极端微生物资源凭借其独特的生理与代谢产物,被认为是地球上最多、最具应用潜能、尚未开发的国家战略新资源。嗜盐放线菌作为极端生命形式的一部分,人们对它的了解还不够深入,数量也极为稀少。更为遗憾的是,近30年来,我国盐湖不断恶化,大约50%的盐湖基本干涸,20%的盐湖已经消失[1],这些嗜盐放线菌资源还来不及挖掘和开发就已经不复存在。但对于嗜盐放线菌的科学研究一直没有停下脚步,并发现它们在抗生素、酶制剂、生物技术等方面具有巨大的潜能[2-5]。因此,加大盐湖放线菌资源的挖掘和利用显得尤为重要。笔者前期针对硝尔库勒湖放线菌的非培养技术探测的结果表明,80%的克隆序列为未培养放线菌[6]。为此,笔者针对硝尔库勒湖沉积物可培养放线菌资源又进行了深入挖掘。依据自然界中细菌以群体的形式存在,并通过细胞间的小肽或群体感应产生信号进行细菌间的互相协作[7]为启示,在分离未培养盐湖放线菌时,在培养基中添加群落感应行为的信号因子N-酰基-高丝氨酸内酯和环腺苷酸,以挖掘更多的放线菌资源。避免由于试图避开宿主群体和有利的互作网络单独分离纯菌时,物种之间的信息交流被阻断,从而表现为不可培养的状态。同时,探讨盐湖放线菌功能酶及其抗细菌活性,深度了解盐湖放线菌的多样性及其开发潜力,为今后的工业化利用奠定基础。
1 材料和方法 1.1 材料
1.1.1 样品来源: 2007年6月,研究人员围绕硝尔库勒湖每隔大约5 km设置采集样点一个,采集湖底沉积物0-20 m表层土样。一共设置3个采集样点(X1、X2、X3),每个样点分别取样3个并混合均匀;其中X1为靠近湖水0.5 m处的湖岸样品(年份降雨量大的季节会被湖水淹没),无水覆盖;X2为湖中央的沉积物样品,水深1.13 m;X3为盐湖边缘浅水区样品,水深0.1 m。经检测样品pH为7.0-7.6,样品采集后放于4便携式冰箱保存,运抵实验室后立即做可培养分析。以上操作过程均进行严格的无菌操作,尽量排除操作污染。硝尔库勒湖的地理信息与生态环境参照关统伟(2008)[6]的描述。
1.1.2 主要试剂和仪器: PCR仪、电泳仪及凝胶成像分析系统购自美国Bio-Rad公司;离心机购自德国Eppendorf公司;细菌基因组提取试剂盒和2×PCR mix (含Taq DNA聚合酶、dNTPs、MgCl2)购自上海基因工程有限公司,DNA琼脂糖凝胶回收试剂盒购自生工生物工程(上海)股份有限公司;通用保守引物27f和1492r在生工生物工程(上海)股份有限公司合成。培养基中涉及的所有试剂均为国产分析纯试剂。
1.2 盐湖离子成分检测 将土样60℃烘干,等量混合5份土样过150目筛,用于理化因子测定,参照DZ/T0064.51-1993,用离子色谱仪测定Cl-、SO42-;参照GB/T15454-2009,用离子色谱仪测定Na+、K+、Ca2+、Mg2+;用滴定法测定CO32-、HCO3-。土壤pH参照ISO 10390-2005的说明文件进行检测。土壤有机质的检测参照GB 9834-1988描述的方法进行。
1.3 分离培养基与培养条件 根据盐湖样品离子化学检测结果进行分离策略设计,实验中采用6种分离嗜盐放线菌的培养基,即G1培养基(g/L):酪素0.3,甘露醇1.0,NaHCO2 10.0,CaCO3 0.2,(NH4)2SO4 2.0,KNO3 2.0,K2HPO4 1.0,MgSO4·7H2O 2.0,FeSO4·7H2O 0.001,MnCl2·4H2O 0.0001,ZnSO4·7H2O 0.001;
G2培养基(g/L):腐殖酸0.10,Na3CO2 5.00,CaCO3 0.02,Na2 HPO4 0.50,MgSO4·7H2O 0.50,KCl 1.70,FeSO4·7H2O 0.01,核黄素0.0005,硫胺素0.0005,维生素B6 0.0005,烟酸0.0005,肌醇0.0005,萘啶酸0.01,放线酮0.05;
G3培养基(g/L):葡萄糖10.00,水解酪素0.30,胞外多糖胶3.00,KNO3 2.00,MgSO4·7H2O 0.05,K2HPO4 2.00,CaCl2 1.00,MnCl2·4H2O 0.001,NiSO4·6H2O 0.001,ZnSO4·7H2O 0.001,萘啶酸0.01,甲氧苄啶0.05;
G4培养基(g/L):微晶纤维素5.00,酪蛋白酸水解产物0.50,精氨酸0.50,Na3CO2 5.00,KNO3 2.00,MgSO4·7H2O 2.00,FeSO4·7H2O 0.01;
G5培养基(g/L):L-天冬酰胺5.00,葡萄糖1.00,甘油2.00,K2HPO4 0.30,MgSO4·7H2O 0.05,KHCO3 2.00,CaCl2 1.00,MnCl2·4H2O 0.001,制霉菌素0.05,萘啶酸0.05;
G6培养基(g/L):淀粉2.00,微晶纤维素0.50,Na3C6H5O7·2H2O 3.00,KNO3 2.00,MgSO4·7H2O 0.10,KHCO3 1.00,K2HPO4 1.00,CaCl2 1.00,MnCl2·4H2O 0.001,ZnSO4·7H2O 0.001。
同时,在这些培养基中分别补充其终浓度为3%、12%和20%的NaCl以及0.001 g的N-酰基-高丝氨酸内酯和0.001 g的环腺苷酸。
取2 g鲜土样品加入含18 mL无菌蒸馏水的锥形瓶中,内置无菌玻璃珠,37、180 r/min振荡过夜。然后取10-2和10-3稀释度样品涂布于上述分离培养基平皿,每个平皿接种100 μL,每个稀释度设3个平行。37倒置培养5-30 d,然后挑菌纯化,获得纯培养菌株。
1.4 DNA的提取 菌株总DNA的提取、16S rRNA基因的PCR扩增均采用Cui等[8]使用的方法进行。
1.5 16S rRNA基因测定与系统发育分析 将扩增产物送到生工生物工程(上海)股份有限公司进行测序。根据测序结果,利用在线公共数据库https://www.ezbiocloud.net/[9]进行相关菌株的16S rRNA基因序列比对,并统计其相似度值,定义16S rRNA基因序列相似性低于99%作为不同的分类单元。
1.6 放线菌功能酶筛选 功能酶筛选基础培养基MM (g/L):可溶性淀粉15,CaCO3 1,(NH4)2SO4 4,MgSO4·7H2O 1,K2HPO4 1,MnCl2·4H2O 0.0002,ZnSO4·7H2O 0.0002。蛋白酶筛选时在最适生长盐浓度的基础培养基MM里加入1%脱脂牛奶;淀粉酶筛选时在基础培养基里补充至最适生长盐浓度;酯酶筛选时在最适生长盐浓度的基础培养基里分别加入1%的吐温-20、吐温-40、吐温-60、吐温-80。蛋白酶和酯酶筛选结果可直接用肉眼观察,淀粉酶筛选结果需滴加1%的碘化钾溶液后,观察并记录水解圈的产生情况。
1.7 抗细菌活性筛选 本实验选取5种细菌指示菌:金黄葡萄球菌(Staphylococcus aureus)、耻垢分枝杆菌(Mycobacterium smegmatis)、荧光假单胞菌(Pseudomonas fluorescens)、伤寒沙门氏菌(Salmonella typhi)和大肠杆菌(Escherichia coli),细菌采用LB培养基培养。
种子YD培养基(g/L):酵母浸出粉4,葡萄糖10,麦芽糖10,氯化镁2,氯化钙2,自然pH。
发酵用CM培养基(g/L):酪素水解物7.5、酵母粉4.0、柠檬酸三钠3.0、硫酸镁0.1、氯化钾2.0,根据不同菌株加入最适生长量的氯化钠,琼脂18.0,调整pH 7.3。
接种放线菌至液体种子培养基YD,37摇床培养72 h。取上述种子培养基按照1%的量加入到200 mL的液体CM培养基中,37、350 r/min培养9-11 d。高速离心去除菌体后取发酵上清液,用2倍体积的乙酸乙酯萃取,将获得的酯相在40条件下进行旋蒸,浓缩后用3 mL甲醇溶解,于室温避光干燥后,加入500 μL二甲基亚砜(DSMO)溶解,传统牛津杯法检测试验菌株的抗细菌活性,细菌置于LB培养基37 ℃培养3 d,观察并记录抑菌圈直径,并以抑菌圈直径大小(3个样本测量的平均值)来表示放线菌抗细菌的强弱。
1.8 RDA (redundancy analysis)分析 RDA分析[10]也称为约束性分析(constrained ordination)。从探索物种对环境的依赖性出发,利用回归统计或图表展示的方法作出生物要素与各种环境要素之间的关系,是普通的回归分析在多元统计分析中的扩展。
2 结果和分析 2.1 土壤样品成分组成 硝尔库勒湖土壤样品的盐离子组分、pH和有机质的测定结果见表 1。土壤样品的Na+含量比较高(121-151 g/kg),其次是Ca2+和K+(含量较低),最后是Mg2+;阴离子以Cl-为主,其次是SO42+,而HCO3-比较少,CO32-几乎没有。同时,pH值显示,采集的样品虽然含有较高的盐浓度,但3个样品的pH呈现中性或微碱性。总的来说,硝尔库勒湖是一个典型的极端生态环境,土壤中有机质含量极少,营养非常贫瘠,NaCl含量极高,并且该地区高温、干旱、辐射强。土壤样品盐离子成分等相关因子的测定,将为研究者设计分离培养基提供参考依据。
表 1. 硝尔库勒湖土壤样品成分组成 Table 1. Samples composition of the studied soils in Xiaoerkule lake
| Samples No. | Organic matter/% | pH | CO32-/(g/kg) | HCO3-/(g/kg) | Cl-/(g/kg) | SO42-/(g/kg) | Ca2+/(g/kg) | Mg2+/(g/kg) | Na+/(g/kg) | K+/(g/kg) |
| X1 | 1.52 | 7.2 | 0.01 | 0.21 | 183.30 | 26.67 | 2.02 | 0.38 | 121.49 | 2.79 |
| X2 | 1.63 | 7.6 | 0.01 | 0.21 | 181.22 | 23.70 | 2.13 | 0.31 | 123.42 | 1.72 |
| X3 | 1.29 | 7.0 | 0.03 | 0.38 | 177.07 | 20.25 | 3.44 | 0.28 | 151.09 | 1.96 |
表选项
2.2 硝尔库勒湖沉积物放线菌多样性 针对硝尔库勒湖的多个样品,研究人员设计了补充有细菌细胞信号诱导因子的N-酰基-高丝氨酸内酯和环腺苷酸的多种分离培养基。结果显示盐湖土壤样品中存在着多样化的放线菌菌落,如图 1,黑色箭头所指为不同的放线菌菌落在不同培养基中的形态。
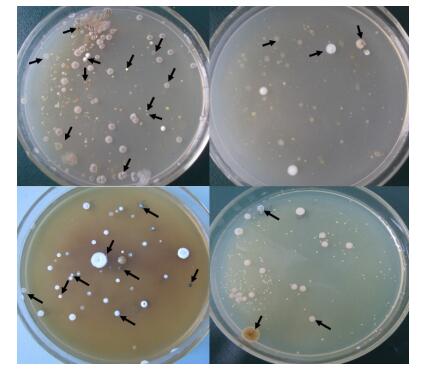 |
| 图 1 放线菌分离平板 Figure 1 Isolation plates of actinomycetes. |
| 图选项 |
对硝尔库勒湖沉积物样品分离的放线菌进行16S rRNA基因序列分析表明,盐湖中存在着丰富的可培养放线菌物种多样性(表 1)。一共分离获得160株菌,经系统发育分析和形态学观察,去除重复后,还有51个OTUs隶属于24个不同的属,即嗜盐糖霉菌属(Haloglycomyces)、链霉菌属(Streptomyces)、放线多孢菌属(Actinopolyspora)、糖霉菌属(Glycomyces)、小单孢菌属(Micromonospora)、链单孢菌属(Streptomonospora)、糖单孢菌属(Saccharomonospora)、拟无枝菌酸菌属(Amycolatopsis)、拟诺卡氏菌属(Nocardiopsis)、产丝菌属(Myceligenerans)、考克氏菌属(Kocuria)、栖白蚁菌属(Isoptericola)、普劳斯氏菌属(Prauserella)、短杆菌属(Brevibacterium)、糖多孢放线菌属(Saccharopolyspora)、疣孢菌属(Verrucosispora)、涅斯捷连科氏菌属(Nesterenkonia)、嗜盐放线产孢菌属(Haloactinospora)、迪茨氏菌属(Dietzia)、刘志恒菌属(Zhihengliuella)、沉积岩杆菌属(Ilumatobacter)、微杆菌属(Microbacterium)、乔治菌属(Georgenia)和微球菌属(Micrococcus)。其中链霉菌的数量最多,共26株,占全部分离放线菌数量的16.25%;其次是Actinopolyspora、Nocardiopsis、Streptomonospora、Amycolatopsi、Saccharomonospor、Microbacterium和Saccharopolyspora菌属,分别占到了全部分离数量的10.00%、8.75%、5.63%、5.00%、5.00%、4.38%和4.38%,还有少量的Dietzia、Zhihengliuella、Ilumatobacter、Georgenia、Micrococcus等。
不同水深的土壤样品获得的放线菌多样性差异较大(表 2)。实验中共获得51个OTUs,其中样品X1属于盐湖边缘无水覆盖区,获得的属级放线菌多样性最好,有34个OTUs,共计20个属,其中有11个属的放线菌能够产生菌丝,是样品中放线菌产丝最多的,可能与供氧量有关;X2水深1.13 m,有11个OTUs,分属于11个不同的属,且6个属的放线菌不产菌丝;X3样品,水深0.1 m,有19个OTUs,获得17个属的放线菌,有7个属产生菌丝。3个样品中都分离得到了一些环境特有的放线菌类群,如X1中的Haloglycomyces、Saccharomonospora、Myceligenerans、Haloactinospora和Dietzia,X2中的Ilumatobacter,以及X3中的Georgenia和Micrococcus。因此,即使是同一个盐湖的样品也同样存在微区域性的放线菌差异与独有性。
表 2. 分离菌株和OTUs的分类情况 Table 2. Classification of isolates and OTUs
| Sample X1 | Sample X2 | Sample X3 | ||||||||
| Genus | No. of isolates | OTUs | Genus | No. of isolates | OTUs | Genus | No. of isolates | OTUs | ||
| Haloglycomyces | 2 | 1 | Kocuria | 2 | 1 | Kocuria | 2 | 1 | ||
| Streptomyces | 13 | 6 | Streptomyces | 3 | 1 | Streptomyces | 10 | 2 | ||
| Actinopolyspora | 10 | 3 | Actinopolyspora | 2 | 1 | Actinopolyspora | 4 | 2 | ||
| Glycomyces | 6 | 2 | Isoptericola | 2 | 1 | Glycomyces | 1 | 1 | ||
| Micromonospora | 2 | 1 | Microbacterium | 6 | 1 | Micromonospora | 1 | 1 | ||
| Streptomonospora | 6 | 2 | Streptomonospora | 1 | 1 | Streptomonospora | 2 | 1 | ||
| Saccharomonospora | 7 | 1 | Ilumatobacter | 2 | 1 | Zhihengliuella | 1 | 1 | ||
| Amycolatopsis | 3 | 2 | Amycolatopsis | 3 | 1 | Amycolatopsis | 2 | 1 | ||
| Nocardiopsis | 10 | 4 | Nocardiopsis | 1 | 1 | Nocardiopsis | 3 | 1 | ||
| Myceligenerans | 3 | 1 | Verrucosispora | 3 | 1 | Verrucosispora | 3 | 1 | ||
| Kocuria | 1 | 1 | Nesterenkonia | 3 | 1 | Nesterenkonia | 1 | 1 | ||
| Isoptericola | 3 | 1 | Microbacterium | 1 | 1 | |||||
| Prauserella | 2 | 1 | Prauserella | 2 | 1 | |||||
| Brevibacterium | 4 | 1 | Brevibacterium | 5 | 1 | |||||
| Saccharopolyspora | 6 | 2 | Saccharopolyspora | 2 | 1 | |||||
| Verrucosispora | 1 | 1 | Georgenia | 1 | 1 | |||||
| Nesterenkonia | 3 | 1 | Micrococcus | 3 | 1 | |||||
| Haloactinospora | 2 | 1 | ||||||||
| Dietzia | 2 | 1 | ||||||||
| Zhihengliuella | 2 | 1 | ||||||||
| Total | 88 | 34 | 28 | 11 | 44 | 19 | ||||
表选项
2.3 硝尔库勒湖沉积物放线菌类群与样品成分的关联性分析 不同的地理环境因子造就了不同区域性微生物的多样性与特有性。本研究结合沉积物离子成分检测、环境因子(如pH、DL——代表样品覆盖的水深程度、SOM——代表样品中有机质含量)和盐湖放线菌多样性分析,可以在一定程度上解释不同离子和环境因子对盐湖沉积物放线菌种群形成的影响方式。通过RDA分析(图 2,空心箭头表示样品的离子成分与环境因子;实心箭头表示的是放线菌的属名)展示,Na+、Ca2+、CO32-、HCO3-与Georgenia、Micrococcus和Haloactinospora呈显著正相关(P < 0.05),而与Nesterenkonia和Dietzia呈显著负相关(P < 0.05),而对其他类群的影响较小;值得注意的是,Cl-、SO42-对目前发现的放线菌种群都显示出不显著状态;Mg2+对Streptomyces和Nocardiopsis呈现显著正相关。在环境因子影响方面,样品水深(DL)表现出对Ilumatobacter、Verrucosispora和Microbacterium的显著正相关,但对Micromonospora、Myceligenerans呈现显著的负相关;而SOM (有机质)和pH对Kocuria、Nesterenkonia和Dietzia呈现出一定的相关性,而对Prauserella和Haloactinospora呈显著负相关(P < 0.05)。因此,环境因子与样品离子成分对硝尔库勒湖不同区域样品放线菌的组成和数量呈现出一定的差异性影响,同时也表现出一定的相互交叉共同作用。
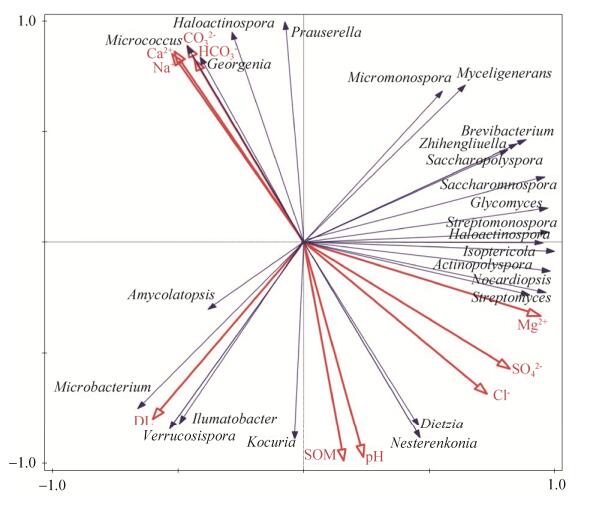 |
| 图 2 盐湖放线菌类群与样品成分的关联性分析 Figure 2 The correlative analysis of samples composition with the actinobacterial community in the salt lake. |
| 图选项 |
2.4 放线菌新种菌株的功能酶筛选及抗细菌活性 根据新的物种有望产生新的天然产物的推测,我们对其中经过系统发育分析预测为新种的15株放线菌进行了功能酶和抗细菌活性研究。15株菌中的11株(YIM92370、TRM40139、TRM40136、XHU5301、XHU5031、TRM40137、XHU5089、TRMF103、TRM40133、TRMF109和TRM415)经过多相分类,作为新种发表在不同的国际期刊上[1],其他菌株还在多相分类中。XHU5011与同源菌株Streptomyces mayteni的相似性为96.73%;XHU5017与同源菌株Streptomyces yatensis的相似性为97.59%;XHU1001与同源菌株Amycolatopsis salitolerans的相似性为98%;XHU5210与同源菌株Amycolatopsis salitolerans的相似性为98.65%。该15株实验菌株的系统发育地位、功能酶筛选和抗细菌活性筛选详细结果如表 3所示。
表 3. 潜在新种的抗菌活性及功能酶 Table 3. The results of functional enzymes activity and antimicrobial activity (mm) of novel strains
| Strain No. | Accession number | Closest match | Similarity/% | A | B | C | D | E | F | G | H | I | J | K |
| TRM40139 | JX485633 | Actinopolyspora alba | 97.62 | 8 | 10 | 0 | 9 | 0 | + | - | + | + | + | + |
| TRM40136 | GU479394 | Actinopolyspora mortivallis | 96.15 | 0 | 0 | 0 | 0 | 10 | + | + | + | + | + | + |
| TRMF103 | HQ436534 | Amycolatopsis halophila | 98.32 | 16 | 10 | 0 | 7 | 11 | + | + | + | + | - | |
| XHU5210 | MH114035 | Amycolatopsis salitolerans | 98.65 | 9 | 0 | 12 | 0 | 12 | + | - | + | + | + | + |
| XHU1001 | MH114034 | Amycolatopsis salitolerans | 98.00 | 19 | 7 | 13 | 0 | 0 | - | + | - | + | + | + |
| TRM415 | GU117109 | Brevibacterium album | 98.41 | 9 | 0 | 0 | 0 | 13 | + | - | - | + | - | - |
| XHU5089 | KT895607 | Glycomyces albus | 97.75 | 0 | 0 | 0 | 11 | 0 | + | - | + | + | + | + |
| XHU5301 | KY368645 | Glycomyces halotolerans | 96.00 | 13 | 0 | 0 | 0 | 8 | + | - | - | + | + | + |
| TRM40137 | KY368645 | Glycomyces sambucus | 95.02 | 9 | 7 | 0 | 11 | 0 | - | - | + | + | + | + |
| YIM92370 | EU660053 | Glycomyces arizonensis | 93.71 | 10 | 0 | 0 | 0 | 12 | + | + | - | + | + | + |
| TRMF109 | JX453452 | Isoptericola variabilis | 98.42 | 0 | 7 | 0 | 0 | 0 | - | - | - | - | + | + |
| XHU5031 | JX316007 | Myceligenerans xiligouense | 98.40 | 9 | 12 | 0 | 0 | 13 | - | + | + | + | + | + |
| TRM40133 | JF411070 | Saccharopolyspora qijiaojingensis | 96.53 | 12 | 9 | 13 | 7 | 0 | - | - | + | + | + | + |
| XHU5011 | MH114033 | Streptomyces mayteni | 96.73 | 37 | 25 | 18 | 0 | 7 | + | + | + | + | + | + |
| XHU5017 | MH114032 | Streptomyces yatensis | 97.59 | 20 | 0 | 11 | 0 | 8 | + | - | + | + | + | + |
| A: Staphylococcus aureus; B: Mycobacterium smegmatis; C: Pseudomonas fluorescens; D: Salmonella typhi; E: Escherichia coli; F: protease; G: amylase; H: Tween-20; I: Tween-40; J: Tween-60; K: Tween-80. +: positive; -: negative. | ||||||||||||||
表选项
根据15株嗜盐放线菌的功能酶活性筛选结果(表 3),15株嗜盐放线菌分别至少具有2种功能酶活性,其中菌株XHU5011和TRM40136的蛋白酶、淀粉酶和酯酶都显示为阳性,而TRM40137、TRMF109和TRM40133既没有蛋白酶活性,也没有淀粉酶活性。测试菌株中具有蛋白酶活性的嗜盐放线菌有9株,酶活性菌株检出率为60%;具有淀粉酶活性的有6株,酶活性菌株检出率为40%;具有4种酯酶活性的有9株,酶活性菌株检出率为60%;另外有3株菌同时具有蛋白酶和淀粉酶活性。有10株菌(66.67%)对Tween-20显示阳性,有14株菌(93.33%)分别对Tween-40和Tween-60显示阳性,有12株菌(80%)对Tween-80显示阳性。综上可见,盐湖放线菌普遍存在蛋白酶、淀粉酶和酯酶活性。
15株放线菌新种对细菌的抗性筛选表明,每株放线菌至少对其中的一株指示菌有抗菌活性,但没有哪一株菌放线菌对5种指示菌都有活性。其中对金黄葡萄球菌(Staphylococcus aureus)有抗菌活性的菌株最多,共12株,占到测试菌株的80%;对大肠杆菌(Escherichia coli)和耻垢分枝杆菌(Mycobacterium smegmatis)有活性的菌株分别有9株和8株,占到测试菌株的60%和53.33%;对荧光假单胞菌(Pseudomonas fluorescens)和伤寒沙门氏菌(Salmonella typhi)有活性的菌株较少,分别有5株,占到测试菌株的33.33%。其中,XHU5011、TRMF103和TRM40133有较好的细菌抗菌谱,对4种指示菌表现出了活性。尤其是XHU5011对金黄葡萄球菌(Staphylococcus aureus)、耻垢分枝杆菌(Mycobacterium smegmatis)和荧光假单胞菌(Pseudomonas fluorescens)表现出了最好的抗菌特性。XHU5011牛津杯法的抗菌实验图片显示对金黄色葡萄球菌的抗性最强,抑菌圈直径平均为37 mm;对耻垢分枝杆菌的抑菌圈平均为25 mm;对荧光假单胞菌的抑菌圈直径为18 mm。因此,XHU5011是一株很有开发潜力的极端环境放线菌资源,值得深入研究。
3 讨论 放线菌是一类代谢产物多样性极为丰富的宝贵资源,至今由微生物产生的2万多种生物活性物质中50%以上是由放线菌产生的[11],然而随着病原菌的耐药性越来越强大,而且普通环境中挖掘放线菌天然产物的重复率高达95%以上[12],极端环境放线菌资源成为新型天然产物探索的理想之地。硝尔库勒湖是一个处于极端环境条件下的地理隔离程度极高的天然封闭性内陆盐湖,也是异域分化产生放线菌新物种资源的天然实验室。通常,隔离程度高的区域往往特有物种区域分布也更丰富,而且异域物种分化形成新物种的概率也越大[13-14]。本研究表明硝尔库勒湖具有丰富的可培养放线菌多样性,稀有物种丰富,是挖掘新物种的好材料。实验共获得了24个属的放线菌,包括15个放线菌新种;其中稀有放线菌占到了83.75%,Ilumatobacter和Georgenia类群的菌株在盐湖中首次发现。这与我们前期对硝尔库勒湖放线菌的非培养结果[6]存在一定差异。比如本实验获得的嗜盐糖霉菌属(Haloglycomyces)、放线多孢菌属(Actinopolyspora)、糖霉菌属(Glycomyces)、小单孢菌属(Micromonospora)、拟无枝菌酸菌属(Amycolatopsis)、产丝菌属(Myceligenerans)、考克氏菌属(Kocuria)、栖白蚁菌属(Isoptericola)、普劳斯氏菌属(Prauserella)、短杆菌属(Brevibacterium)、疣孢菌属(Verrucosispora)、涅斯捷连科氏菌属(Nesterenkonia)、嗜盐放线产孢菌属(Haloactinospora)、迪茨氏菌属(Dietzia)、刘志恒菌属(Zhihengliuella)、沉积岩杆菌属(Ilumatobacter)、微杆菌属(Microbacterium)、乔治菌属(Georgenia)和微球菌属(Micrococcus)的菌在非培养研究中并没有探测到;同样非培养探测到的弗兰克氏菌属(Frankia)、贫养杆菌属(Modestobacter)、纤维单胞菌属(Cellulomonas)等中的放线菌类群在可培养研究中也都没有被分离到。说明反映一个生态环境微生物的多样性需要可培养和免培养的综合分析,才能够更好地反映一个环境中的微生物多样性。另外,免培养结果中硝尔库勒湖链霉菌是一个稀有类群,仅占到探测放线菌的1.50%,而可培养结果则达到了全部分离放线菌数量的16.25%,是一个主要类群。说明目前的免培养技术在反映环境微生物群体时还需要深度改进,以更好地反映微生物的实际概况。同时,也说明实验设计的培养基中添加细菌群体信号因子对于放线菌的分离取得了较好的效果,但仍需要不断改进和创新,这个结果距离免培养80%的克隆序列为未培养放线菌的深度挖掘还有很长的路要走。盐湖放线菌分离过程中不可忽略的是盐湖离子与环境因子对盐湖放线菌分离的协同影响效应。并且,即使是同一个区域的环境样品,也需要关注其微区域环境的差异性,从而获得更多的放线菌资源。
嗜盐酶一般来自于嗜盐菌,它的主要特点是严格依赖体系中一定的盐离子浓度,可以在高盐环境中维持其结构稳定,并且能够抵抗高温、pH和有机溶剂存在下的变性,因此在高盐、水/有机和非水介质环境的催化中具有重要的应用价值[15]。本研究表明硝尔库勒盐湖放线菌普遍存在蛋白酶、淀粉酶和酯酶活性,是很好的嗜盐酶挖掘资源。对于嗜盐放线菌而言功能酶的研究不如天然产物研究的多[16]。人们陆续从Streptimonospora salina[17]、Salinispora arenicola[18]、Actinopolyspora erythraea[19]、Nocardiopsis alba[20]等嗜盐放线菌中挖掘出多样化的天然产物。本研究发现盐湖放线菌普遍存在一定的抗细菌活性,是挖掘极端环境放线菌天然产物的重要资源。其中菌株XHU5011对金黄葡萄球菌(Staphylococcus aureus)、耻垢分枝杆菌(Mycobacterium smegmatis)和荧光假单胞菌(Pseudomonas fluorescens)展示出了强大的抗菌能力,而且该菌是一个新种,与同源菌株Streptomyces mayteni的相似性为96.73%,有望产生新型的具有知识产权保护的天然产物,开发潜力巨大,值得深入挖掘。Chen等[21]从嗜盐的链霉菌Streptomyces vermectinius中获得了2个具有较强抗结核活性的化合物Actinomycin X2和Actinomycin D。目前我国对嗜盐放线菌功能的开发利用明显不够,但随着科技的不断发展和科技工作者的不断努力,必将有更多的嗜盐放线菌新资源被挖掘,更多功能酶和新颖的天然产物被发现,从而更好地为人类健康服务。
References
| [1] | 关统伟. 中国盐湖放线菌. 北京: 中国轻工业出版社, 2017. |
| [2] | Zhao XQ, Xu XN, Chen LY. Production of enzymes from marine actinobacteria. Advanced Food and Nutrition Research, 2016, 78(2): 137-151. |
| [3] | Reed KA, Manam RR, Mitchell SS, Xu JL, Teisan S, Chao TH, Deyanat-Yazdi G, Neuteboom STC, Lam KS, Potts BCM. Salinosporamides D-J from the marine actinomycete Salinispora tropica, Bromosalinosporamide, and Thioester derivatives are potent inhibitors of the 20S proteasome. Journal of Natural Products, 2007, 70(2): 269-276. DOI:10.1021/np0603471 |
| [4] | Yang XW, Zhang GY, Ying JX, Yang B, Zhou XF, Steinmetz A, Liu YH, Wang N. Isolation, characterization, and bioactivity evaluation of 3-((6-methylpyrazin-2-yl) methyl)-1H-indole, a new alkaloid from a deep-sea-derived actinomycete Serinicoccus profundi sp. nov. Marines Drugs, 2013, 11(1): 33-39. |
| [5] | Sharma AK, Singh SP. Effect of amino acids on the repression of alkaline protease synthesis in haloalkaliphilic Nocardiopsis dassonvillei. Biotechnology Report, 2016, 12(4): 40-51. |
| [6] | Guan TW, Wu JY, Zhi XY, Tang SK, Xu LH, Li WJ, Zhang LL. Actinobacterial diversity of a sediment sample from Xiaoerkule Lake. Acta Microbiologica Sinica, 2008, 48(7): 851-856. (in Chinese) 关统伟, 吴晋元, 职晓阳, 唐蜀昆, 徐丽华, 李文均, 张利莉. 硝尔库勒湖沉积物中非培养放线菌多样性. 微生物学报, 2008, 48(7): 851-856. DOI:10.3321/j.issn:0001-6209.2008.07.002 |
| [7] | Mihai MM, Holban AM, Giurcaneanu C, Popa LG, Oanea RM. Microbial biofilms:impact on the pathogenesis of periodontitis, cystic fibrosis, chronic wounds and medical device-related infections. Current Topics Medicinal Chemistry, 2015, 15(16): 1552-1576. DOI:10.2174/1568026615666150414123800 |
| [8] | Cui XL, Mao P, Zeng M, Li WJ, Zhang LP, Xu LH, Jiang CL. Streptimonospora salina gen. nov., sp. nov., a new member of family Nocardiopsaceae. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(2): 357-363. DOI:10.1099/00207713-51-2-357 |
| [9] | Yoon SH, Ha SM, Kwon S, Lim J, Kim Y, Seo H, Chun J. Introducing EzBioCloud:A taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1613-1617. DOI:10.1099/ijsem.0.001755 |
| [10] | Legendre P, Gallagher ED. Ecologically meaningful transformations for ordination of species data. Oecologia, 2001, 129(2): 271-280. DOI:10.1007/s004420100716 |
| [11] | Demain AL, Sanchez S. Microbial drug discovery:80 years of progress. Journal of Antibiotics, 2009, 62(3): 5-16. |
| [12] | Fenical W, Baden D, Burg M. Marinederived pharmaceuticals and related bioactive compounds//Fenical W. From Monsoons to Microbes: Understanding the Ocean's Role in Human Health. National Academies Press, 1999, 6: 71-86. https: //www. mendeley. com/research-papers/marine-derived-pharmaceuticals-related-bioactive-compounds/ |
| [13] | Flaxman SM, Feder JL, Nosil P. Genetic hitchhiking and the dynamic buildup of genomic divergence during speciation with gene flow. Evolution, 2013, 67(9): 2577-2591. DOI:10.1111/evo.2013.67.issue-9 |
| [14] | Shafer ABA, Wolf JBW. Widespread evidence for incipient ecological speciation:a meta-analysis of isolation-by-ecology. Ecology Letters, 2013, 16(7): 940-950. DOI:10.1111/ele.12120 |
| [15] | Shi YY, Li XZ, Zhang GM. Advances in microbial halophilic enzymes. Acta Microbiologica Sinica, 2017, 57(8): 1180-1188. (in Chinese) 石云云, 李信志, 张桂敏. 微生物嗜盐酶的研究进展. 微生物学报, 2017, 57(8): 1180-1188. |
| [16] | Hamedi J, Mohammadipanah F, Ventosa A. Systematic and biotechnological aspects of halophilic and halotolerant actinomycetes. Extremophiles, 2013, 17(1): 1-13. DOI:10.1007/s00792-012-0493-5 |
| [17] | Liu WH, Li MG, Li YQ, Zhao JY, Ding ZG, Yang PW, Cui XL, Wen ML. Cytotoxic metabolites of Streptimonospora salina. Chemistry of Natural Compounds, 2008, 44(4): 503-505. DOI:10.1007/s10600-008-9102-3 |
| [18] | Asolkar RN, Freel KC, Jensen PR, Fenical W, Kondratyuk TP, Park EJ, Pezzuto JM. Arenamides A-C, ytotoxic NFκB inhibitors from the marine actinomycete Salinispora arenicola. Journal of Natural Products, 2009, 72(3): 396-402. DOI:10.1021/np800617a |
| [19] | Zhao LX, Huang SX, Tang SK, Jiang CL, Duan Y, Beutler JA, Henrich CJ, McMahon JB, Schmid T, Blees JS, Colburn NH, Rajski SR, Shen B. Actinopolysporins A-C and tubercidin as a Pdcd4 stabilizer from the halophilic actinomycete Actinopolyspora erythraea YIM 90600. Journal of Natural Products, 2011, 74(9): 1990-1995. |
| [20] | Zhang QB, Li SM, Chen YC, Tian XP, Zhang HB, Zhang GT, Yiguang Zhu, Zhang S, Zhang WM, Zhang CS. New diketopiperazine derivatives from a deep-sea-derived Nocardiopsis alba CSIO 03039. The Journal of Antibiotics, 2013, 66(1): 31-36. DOI:10.1038/ja.2012.88 |
| [21] | Chen CX, Song FH, Wang Q, Abdelmageed WM, Guo H, Fu CZ, Hou WY, Dai HQ, Liu XT, Yang N, Xie F, Yu K, Chen RX, Zhang LX. A marine-derived Streptomyces sp. MS449 produces high yield of actinomycin X2 and actinomycin D with potent anti-tuberculosis activity. Applid Microbiology and Biotechnolog, 2012, 95(4): 919-927. DOI:10.1007/s00253-012-4079-z |
