余凯凡, 张福哲, 朱伟云


江苏省消化道营养与动物健康重点实验室, 南京农业大学消化道微生物研究室, 江苏 南京 210095
收稿日期:2017-05-17;修回日期:2017-08-09;网络出版日期:2017-09-28
基金项目:国家重点基础研究发展计划(2013CB127300);国家自然科学基金(31430082)
*通信作者:朱伟云, Tel:+86-25-84395523;E-mail:zhuweiyun@njau.edu.cn
摘要:[目的]旨在通过微生物体外发酵技术,以回肠微生物为参照,研究猪盲肠及结肠微生物对在小肠微生物中代谢率较低的蛋氨酸的代谢特性。[方法]采集4头健康100 kg左右杜×长×大杂交猪的盲肠、结肠与回肠食糜作为接种物,分别接种于10 mmol/L蛋氨酸的培养基中,37℃体外培养24 h。分别设含蛋基酸溶液和含各肠段食糜接种物的空白对照组。[结果](1)不同肠段微生物以蛋氨酸为底物体外发酵,盲肠组蛋氨酸消失率(21.9%)显著高于结肠组(16.7%)与回肠组(16.3%)(P < 0.05)。盲肠组总SCFA量显著高于结肠与回肠组(P < 0.05),伴随着pH值下降程度最高;盲肠组MCP产量也显著高于结肠与回肠组(P < 0.05);在产气量与NH3-N浓度上,盲肠组与结肠组均显著低于回肠组(P < 0.05)。(2)以蛋氨酸为底物体外发酵,门水平上,总菌、厚壁菌门含量在各肠段组间无显著差异(P>0.05),拟杆菌门含量在盲肠组最高;与不加蛋氨酸底物的对照组比较,三个肠段试验组总菌、厚壁菌门含量均显著高于对照组(P < 0.05),而拟杆菌门含量在试验组与对照组间差异不显著(P>0.05)。属水平上,盲肠组和结肠组大肠杆菌属数量显著低于回肠组(P < 0.05),而柔嫩梭菌属和梭菌XIV属数量在盲肠组和结肠组均高于回肠组;各肠段组间双歧杆菌数量无显著差异(P>0.05)。[结论]以蛋氨酸为底物,体外培养猪盲肠微生物对蛋氨酸代谢率高于回肠微生物,伴随着其他发酵参数的变化,并且发酵产生更多的菌体蛋白。相比于回肠微生物发酵,大肠微生物发酵后,柔嫩梭菌属和梭菌XIV属数量较高,而大肠杆菌属数量较低。
关键词: 体外发酵 大肠微生物 蛋氨酸 猪
Metabolic characteristics of methionine by in vitro fermentation with bacteria from different swine intestinal segment
Yu Kaifan, Zhang Fuzhe, Zhu Weiyun


Laboratory of Gastrointestinal Microbiology, Jiangsu Key Laboratory of Gastrointestinal Nutrition and Animal Health, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, Jiangsu Province, China
Received 17 May 2017; Revised 9 August 2017; Published online 28 September 2017
*Corresponding author: Zhu Weiyun, Tel: +86-25-84395523; E-mail: zhuweiyun@njau.edu.cn
Supported by the National Basic Research Program of China (2013CB127300) and by the National Natural Science Foundation of China (31430082)
Abstract: [Objective]This study aims to study metabolic characteristics of methionine by caecal and colonic bacteria compared with ileal bacteria from pigs using in vitro fermentation.[Methods]We took ileal, caecal and colonic chyme from four Duroc×Landrace×Yorkshire hybridization pigs as inoculum, and fermented in vitro separately. Control group 1 was without adding the chyme and Control group 2 was without adding methionine.[Results]Methionine disappeared 21.9% in the cecum group, significantly higher than that in the ileum group (16.3%) and colon group (16.7%) (P < 0.05). The cecum group had the highest amount of short chain fatty acids (P < 0.05), with the highest decrease of pH value. Moreover, the cecum group had the highest concentration of microbial crude protein, compared with the other two groups (P < 0.05). Nevertheless, gas production and ammonia nitrogen (NH3N) concentration in the ileum group were significantly higher than those in the cecum and colon group (P < 0.05). At the phylum level, total bacteria and Firmicutes population were similar among all groups (P>0.05), and the counts of Bacteroidetes was highest in the cecum group. At the genus level, Escherichia coli counts in the cecum and colon group were significant lower than that in the ileum group (P < 0.05), whereas the counts of Clostridium leptum and Clostridium cluster XIVa in the cecum and colon group were both higher than those in the ileum group. Bifidobacterium counts were similar among all groups (P>0.05).[Conclusion]In vitro fermentation using methionine as a substrate, the utilization rate of methionine by caecal bacteria is higher than that by ileal bacteria from pigs, accomplished with altering other fermentation parameters and producing microbial protein. Compared with in vitro fermentation of ileal bacteria, the counts of Clostridium leptum and Clostridium cluster XIVa are higher, whereas the Escherichia coli counts is lower after fermentation of the large intestinal bacteria.
Key words: in vitro fermentation large intestinal bacteria methionine pigs
蛋氨酸是动物体内必需氨基酸之一,其在参与机体蛋白质合成以及维持机体免疫功能等方面发挥重要作用。营养学新观点认为,日粮中的大量氨基酸并没被吸收进入门静脉,而在肠道内被代谢利用[1]。其中,蛋氨酸到达猪门静脉的净平衡约69%[2]。氨基酸在肠道中可被肠黏膜细胞代谢利用,也可能会被肠道中数量繁多、复杂多样的微生物菌群所代谢。Chen等[3-4]研究发现,肠上皮细胞主要代谢支链氨基酸,而对于蛋氨酸的代谢几乎可以忽略不计,表明肠上皮细胞难以代谢蛋氨酸。Dai等研究表明,猪小肠微生物可少量代谢蛋氨酸[5];有意思的是,从十二指肠、空肠到回肠肠段,越靠近后肠肠段的微生物对蛋氨酸的代谢利用率越高。随着肠段向后到大肠,大肠微生物对进入到该肠段的蛋氨酸是否代谢尚不清楚,探明大肠微生物对蛋氨酸的代谢有助于丰富氨基酸营养理论。本研究采用微生物体外发酵技术以猪回肠微生物为参照,研究了盲肠、结肠微生物对蛋氨酸的代谢特性,并分析比较了可能参与蛋氨酸代谢的细菌区系丰度。
1 材料和方法 1.1 培养基与接种物制备 厌氧培养基参考Williams等[6]和Dai等[5]的方法配置。培养基持续通入CO2,至溶液澄清呈淡黄色后,每血清瓶分装88 mL,高压灭菌。在基础培养基中,注入100 mmol/L蛋氨酸母液10 mL作为蛋氨酸培养基。接种前加入1 mL维生素溶液和1 mL还原剂溶液,并将培养基37 ℃预热。
选取3头健康的6月龄杜×长×大育肥猪,采集回肠、盲肠和结肠中段内容物,分别将不同肠段的3份样品进行混匀、称量。37 ℃预热的PBS迅速冲洗食糜到持续通CO2的灭菌血清瓶,PBS与食糜按1:9比例混匀,4层无菌纱布过滤后作为接种物。
1.2 体外发酵 原代培养3个处理组分别为基础培养基+蛋氨酸溶液+回肠或盲肠或结肠食糜接种物;对照组一中含有基础培养基和蛋氨酸溶液;对照组二分别为基础培养基+回肠或盲肠或结肠食糜接种物。各4个重复。5 mL接种物注入到预热培养基,37 ℃培养24 h。
继代培养使用原代培养24 h的发酵液作为接种物接种10 mL,37 ℃培养,24 h为一代,连续传6代。采集继代培养的第2、4、6代的0 h和24 h发酵液。
1.3 发酵指标测定 测定0 h与培养24 h发酵液pH值。在发酵的4、8、12、16和24 h,参照Theodorou等[7]方法测定产气量。分别参照Muftic方法[8]测定24 h发酵液的氨态氮(NH3-N),比色法测定菌体蛋白(MCP)浓度。使用仪器GC-14B型气相色谱仪(日本岛津公司)测定24 h发酵液的短链脂肪酸(SCFA),参考Zhang等[9]的方法。取发酵样品1 mL加0.2 mL 25%偏磷酸和巴豆酸(内标法,100 mL溶液中含巴豆酸0.6464g)混合液1 mL,12000 r/min离心10 min,取上清液0.5 mL进行测定。柱温110 ℃,进样温度为180 ℃,检测器温度为180 ℃。
1.4 蛋氨酸测定 使用仪器高效液相色谱仪(Agilent 1100)测定发酵液蛋氨酸。样品前处理:200 μL发酵液,13000×g、4 ℃离心10 min。转移100 μL上清加入100 μL 1.5 mol/L冰HClO4,混匀后加入50 μL 2 mol/L冰K2CO3。打开盖子,释放CO2。13000×g 4℃离心10 min。转移上清至新的1.5 mL离心管。取100 μL样品,加入样品瓶中,再加入100 μL 1.2%苯甲酸,100 μL饱和K2B4O7,100 μL内标,1.4 mL水。HPLC检测:色谱柱C18,4.6 mm×250 mm;流速,1.1 mL/min;柱温,20–25 ℃;检测波长,Ex 340 nm,Em 455 nm;进样:15 μL样品溶液+ 15 μL OPA溶液,反应1 min。流动相:流动相A,27.3 g三水乙酸铵溶于1.6 L水中,加入96 μL 6 mol/L HCl,180 mL甲醇,10 mL四氢呋喃,定容至2 L (pH 7.2);流动相B,100%甲醇。
1.5 DNA提取和Real-time PCR定量菌群 DNA提取参照Zoetendal等[10],用磁珠法破碎,苯酚氯仿萃取。实时定量PCR使用Step One PlusTM平台、SYBR Premix Ex Taq酶体系对发酵液中总菌、厚壁菌门、拟杆菌门以及大肠杆菌、柔嫩梭菌、梭菌XIV和双歧杆菌属进行定量分析,引物序列见表 1。分别以相应的16S rRNA基因作为模板制作各目标菌定量的标准曲线。
表 1. 实时定量PCR引物序列 Table 1. Primers used in this study
| Target organisms | Forward primer (5′→3′) | Reverse primer (5′→3′) | References |
| Total bacteria | GTGSTGCAYGGYYGTCGTCA | ACGTCRTCCMCNCCTTCCTC | [10] |
| Firmicutes | GGAGYATGTGGTTTAATTCGAAGCA | AGCTGACGACAACCATGCAC | [11] |
| Bacteroidetes | GGARCATGTGGTTTAATTCGATGAT | AGCTGACGACAACCATGCAG | [12] |
| Clostridium leptum subgroup | GCACAAGCAGTGGAGT | CTTCCTCCGTTTTGTCAA | [13] |
| Escherichia coli | CATGCCGCGTGTATGAAGAA | CGGGTAACGTCAATGAGCAAA | [14] |
| Clostridium cluster XIVa | CGGTACCTGACTAAGAAGC | AGTTTYATTCTTGCGAACG | [15] |
| Bifidobacterium spp. | TCGCGTCYGGTGTGAAAG | GGTGTTCTTCCCGATATCTACA | [16] |
表选项
1.6 数据统计分析 氨基酸消失率按照公式(1)计算。
D24 (%) = [(AA0–AA24) A(PC0–PC24)–(NC0–NC24)]/AA0公式(1)
D24是24 h的蛋氨酸消失率,AA0、AA24是各处理组0 h、24 h的蛋氨酸浓度,PC0、NC0分别是对照组1、对照组2在0 h的蛋氨酸浓度,PC24、NC24分别是对照组1、对照组2在24 h的蛋氨酸浓度。
2 结果和分析 2.1 体外发酵24 h的累积产气量和pH值变化 不同肠段微生物以蛋氨酸为底物体外发酵24 h的累积产气量变化见表 2。微生物在24 h的发酵过程中,累积产气量不断增加;累积产气量由高到低依次为回肠组、盲肠组与结肠组,其中盲肠组与结肠组累积产气量显著低于回肠组(P < 0.05)。
表 2. 体外发酵24 h的累积产气量变化 Table 2. Cumulative gas production during 24 h in vitro fermentation (mL)
| t/h | Ileum | Cecum | Colon |
| 4 | 1.35±0.33 | 2.50±0.43 | 2.40±0.41 |
| 8 | 5.85±0.48 | 6.00±0.15 | 3.95±0.91 |
| 12 | 13.75±1.14a | 7.42±0.38 b | 5.57±0.76 b |
| 16 | 15.10±1.10a | 8.87±0.34b | 7.67±0.04b |
| 24 | 20.87±1.11a | 18.62±0.34b | 16.12±1.03c |
| Values in the table are mean±SEM. In the same row, values with no letter or the same letter superscripts mean no significant difference (P > 0.05), while with different small letter superscripts mean significant difference (P < 0.05). The same as below. | |||
表选项
微生物体外发酵24 h的pH变化见表 3。各肠段试验组24 h pH值与0 h pH值相比显著降低(P < 0.05);回肠试验组与对照组24 h pH值无显著差异(P > 0.05),而盲肠试验组、结肠试验组与各自肠段对照组相比24 h pH值显著下降(P < 0.05)。
表 3. 体外发酵24 h的pH变化 Table 3. Changes of pH value during 24 h in vitro fermentation
| Segments | Met | Control 2 | |||
| 0 h | 24 h | 0 h | 24 h | ||
| Ileum | 6.79±0.01a | 6.51±0.01b | 6.76±0.02a | 6.54±0.01b | |
| Cecum | 6.76±0.02a | 6.47±0.03b | 6.74±0.02a | 6.67±0.02a | |
| Colon | 6.80±0.01a | 6.55±0.01b | 6.79±0.01a | 6.63±0.02a | |
表选项
2.2 体外发酵24 h的SCFA产量 不同肠段微生物以蛋氨酸为底物体外发酵24 h的SCFA产量见表 4。盲肠组总SCFA产量显著高于结肠组与回肠组(P < 0.05);回肠组丙酸和戊酸产量较高,而盲肠与结肠组乙酸和丁酸产量较高。支链脂肪酸异丁酸与异戊酸在三组中产量都很低,且无显著差异。
表 4. 不同肠段微生物体外发酵24 h SCFA产量(mmol/L) Table 4. Concentration of SCFA after 24 h in vitro fermentation (mmol/L)
| Items | Ileum | Cecum | Colon |
| Acetate | – | 2.81±0.28a | 1.46±0.16b |
| Propionate | 4.91±0.03a | 3.11±0.17b | 2.62±0.17b |
| Butyrate | 0.62±0.09b | 2.40±0.11a | 2.02±0.12a |
| Valerate | 0.40±0.06a | 0.06±0.01b | 0.01±0.01b |
| Isobutyrate | 0.07±0.03 | 0.05±0.01 | 0.05±0.01 |
| Isovalerate | 0.03±0.01 | 0.06±0.02 | 0.06±0.03 |
| Total BCFA | 0.10±0.04 | 0.11±0.03 | 0.11±0.04 |
| Total SCFA | 4.64±0.40b | 8.50±0.48a | 6.22±0.20b |
表选项
2.3 体外发酵24 h的NH3-N和MCP浓度 不同肠段微生物以蛋氨酸为底物体外发酵24 h的MCP与NH3-N的结果见图 1。盲肠组MCP产量显著高于回肠组与结肠组(P < 0.05),回肠组与结肠组间差异不显著。盲肠组与结肠组NH3-N浓度显著低于回肠组(P < 0.05),盲肠组与结肠组间差异不显著。
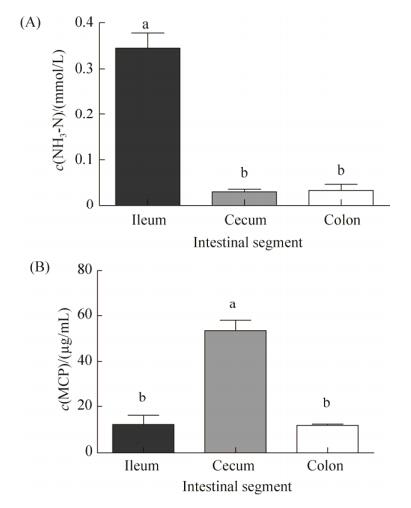 |
| 图 1 体外发酵24 h NH3-N和MCP浓度变化 Figure 1 Concentrations of NH3-N and MCP after 24 h in vitro fermentation. Values are the mean±SEM. Values with different letters (a, b) are significantly different (P < 0.05). |
| 图选项 |
2.4 体外发酵24 h的蛋氨酸消失率 不同肠段微生物体外发酵24 h后蛋氨酸消失率见图 2。盲肠组蛋氨酸消失率显著高于回肠组和结肠组(P < 0.05),回肠组与结肠组间蛋氨酸消失率差异不显著。
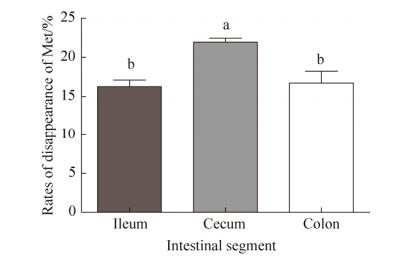 |
| 图 2 体外发酵24 h蛋氨酸消失率 Figure 2 Rates of disappearance (%) of Methionine after 24 h in vitro fermentation. Values are the mean±SEM. Values with different letters (a, b) are significantly different (P < 0.05). |
| 图选项 |
2.5 体外发酵24 h菌群变化 体外发酵24 h后,发酵液中总菌、厚壁菌门和拟杆菌门的数量见表 5。以蛋氨酸为底物,总菌、厚壁菌门含量在各肠段组间无显著差异,拟杆菌门含量在盲肠组最高。与不加蛋氨酸底物的对照组比较,3个肠段试验组总菌、厚壁菌门含量均显著高于对照组(P < 0.05),而拟杆菌门含量在试验组与对照组间差异不显著(P > 0.05)。
表 5. 体外发酵24 h细菌总菌、厚壁菌门、拟杆菌门数量 Table 5. Copy numbers of total bacteria, Firmicutes and Bacteroidetes after 24 h in vitro fermentation [Lg(copies/mL)]
| Items | Group | Segments | SEM | P value | ||
| Ileum | Cecum | Colon | ||||
| Total bacteria | Met | 11.34a | 11.37a | 11.13a | 0.06 | 0.20 |
| Control 2 | 10.62b | 10.60b | 10.72b | 0.05 | 0.21 | |
| SEM | 0.17 | 0.27 | 0.22 | |||
| P value | < 0.01 | < 0.01 | < 0.01 | |||
| Firmicutes | Met | 10.65a | 10.88a | 10.68a | 0.05 | 0.18 |
| Control 2 | 10.31b | 10.20b | 10.28b | 0.05 | 0.21 | |
| SEM | 0.05 | 0.20 | 0.18 | |||
| P value | < 0.01 | < 0.01 | < 0.01 | |||
| Bacteroidetes | Met | 9.93AB | 10.00A | 9.68B | 0.06 | 0.07 |
| Control 2 | 9.96 | 9.87 | 9.86 | 0.04 | 0.58 | |
| SEM | 0.04 | 0.11 | 0.12 | |||
| P value | 0.85 | < 0.01 | < 0.05 | |||
| Values in the table are mean±SEM. Values in the same row or column, which do not share the same small letter or capital letter are significantly different (P < 0.05), respectively. | ||||||
表选项
属水平上,大肠杆菌、柔嫩梭菌、梭菌XIV和双歧杆菌的数量见表 6。盲肠组和结肠组大肠杆菌属数量显著低于回肠组(P < 0.05),而柔嫩梭菌属和梭菌XIV属数量在盲肠组和结肠组均高于回肠组;各肠段组间双歧杆菌数量无显著差异(P > 0.05)。与不加蛋氨酸底物的对照组比较,大肠杆菌数量在回肠试验组显著高于对照组,而在盲肠和结肠试验组则显著低于对照组(P < 0.05);双歧杆菌属数量在盲肠和结肠试验组显著高于对照组(P < 0.05),而在回肠试验组与对照组无显著差异(P > 0.05);柔嫩梭菌属和梭菌XIV属数量在3个肠段试验组均显著高于对照组(P < 0.05)。
表 6. 体外发酵24 h大肠杆菌、双歧杆菌、柔嫩梭菌、梭菌XIV数量 Table 6. Copy numbers of Escherichia coli, Bifidobacterium spp., Clostridium leptum subgroup, Clostridium cluster XIVa after 24 h in vitro fermentation [Lg(copies/mL)]
| Items | Group | Segments | SEM | P value | ||
| Ileum | Cecum | Colon | ||||
| Escherichia coli | Met | 10.65Aa | 7.76Bb | 7.93Bb | 0.47 | < 0.01 |
| Control 2 | 10.50Ab | 8.06Ba | 8.40Ca | 0.38 | < 0.01 | |
| SEM | 0.04 | 0.07 | 0.08 | |||
| P value | < 0.05 | < 0.01 | < 0.01 | |||
| Bifidobacterium spp. | Met | 8.99 | 8.90a | 8.87a | 0.05 | 0.64 |
| Control 2 | 8.96A | 8.12Bb | 8.18Bb | 0.14 | < 0.01 | |
| SEM | 0.02 | 0.14 | 0.11 | |||
| P value | 0.60 | < 0.01 | < 0.01 | |||
| Clostridium leptum subgroup | Met | 8.27Ba | 9.51Aa | 9.11Aa | 0.20 | < 0.05 |
| Control 2 | 7.62Cb | 8.14Bb | 8.44Ab | 0.12 | < 0.01 | |
| SEM | 0.10 | 0.20 | 0.12 | |||
| P value | < 0.01 | < 0.01 | < 0.05 | |||
| Clostridium cluster XIVa | Met | 10.25Ba | 10.76Aa | 10.54ABa | 0.09 | 0.05 |
| Control 2 | 9.27Bb | 9.59Ab | 9.66Ab | 0.07 | < 0.05 | |
| SEM | 0.16 | 0.17 | 0.13 | |||
| P value | < 0.05 | < 0.01 | < 0.01 | |||
| Values in the table are mean±SEM. Values in the same row or column, which do not share the same small letter or capital letter are significantly different (P < 0.05), respectively. | ||||||
表选项
3 讨论 3.1 不同肠段微生物体外培养发酵参数的比较 pH对肠道微生物的生存有十分重要的影响,猪肠道内由前肠到后肠pH呈逐渐增加的趋势[17],大肠微生物的最适pH一般为6.5–7.5左右。在猪肠道内,SCFA和NH3-N含量均可影响pH值变化。本研究中培养液的pH在24 h培养过程中呈逐渐降低的趋势,这主要是生成的酸累加作用造成的。盲肠组在24 h发酵过程与对照组相比下降最多,表明盲肠内酸的累计产生量最多,这也与盲肠接种物体外发酵总SCFA产量最高的结果相吻合。
猪肠道中SCFA是微生物发酵的主要终产物之一[18-19],研究表明肠道上皮可吸收94.4%–97.6%产生的SCFA[20]。之前认为SCFA的产生主要来自纤维以及抗性淀粉[21],不过后来人们发现大肠内未消化的蛋白质代谢也是SCFA的重要来源[22]。本研究发现,盲肠接种物发酵,其乙酸、丙酸、丁酸以及总SCFA含量都处于较高的水平,这暗示了体外条件下盲肠微生物对蛋氨酸的利用能力在3个肠段中最强。
3.2 不同肠段微生物体外培养NH3-N、MCP的比较 NH3-N的含量一定程度上可以反映出微生物分解含氮物质产生NH3-N及对其摄取利用的情况,是机体氮代谢水平的重要指标之一[23]。一般机体肠道内氨的浓度很低,然而在日粮蛋白质增加的情况下肠腔以及粪中氨浓度会显著升高[24]。产生的氨可被肠黏膜吸收[25];此外,在有能量和碳架的情况下,NH3-N是微生物合成MCP的主要氮源。MCP浓度反映微生物利用NH3-N、氨基酸等底物合成蛋白质的能力。本研究中,回肠组NH3-N产生量显著高于盲肠组与结肠组,而相对的形成MCP的含量较少,提示回肠内产氨的细菌较多,蛋氨酸在回肠组中一个显著的代谢去路是形成了NH3-N,而利用NH3-N的细菌相对较少。相比较,盲肠微生物利用蛋氨酸体外发酵合成了较多的MCP,提示较回、结肠微生物,盲肠微生物氮代谢的主要代谢去路为微生物自身增殖利用。
3.3 大肠微生物与小肠微生物对蛋氨酸代谢率的比较 研究表明,不同肠段微生物对于同一种氨基酸的利用存在肠段特异性[26-27],然而此前的研究关注小肠微生物对氨基酸代谢的影响。本研究发现,盲肠组的蛋氨酸消失率显著高于回肠组与结肠组,同时不同肠段微生物利用蛋氨酸得到的代谢产物也存在较大差异,提示不同肠段优势菌群各不相同,造成对蛋氨酸利用效率、代谢产物含量有所不同。
3.4 不同肠段微生物对蛋氨酸代谢的菌群区系变化 已有研究表明,Clostridium、Bacteriodes及Peptostreptococcus属细菌在大肠中可作为发酵氨基酸的细菌[4, 28],以单一蛋氨酸作为氮底物哪些细菌对其代谢利用能力强尚无定论。一些研究表明,日粮蛋氨酸摄入会显著影响肠道微生物区系。李永洙[29]在蛋鸡低蛋白日粮中额外添加蛋氨酸、赖氨酸和苏氨酸时发现,蛋鸡盲肠内乳杆菌、梭菌属和普雷沃氏菌属显著增加,并可显著改善蛋鸡生产性能。王洪荣[30]体外培养瘤胃微生物并选择性缺省个别种类氨基酸,发现缺少蛋氨酸会显著限制细菌以及原虫的生长。本研究发现,以蛋氨酸为底物,盲肠组总菌、厚壁菌门、拟杆菌门数量均为3个肠段最高,这与盲肠蛋氨酸消失率及MCP较高的结果一致,体现出细菌数量与蛋氨酸代谢效率有关。
在属水平上,本研究中以蛋氨酸为底物,盲肠组和结肠组大肠杆菌属数量显著低于回肠组,同时也显著低于不加蛋氨酸底物的对照组的大肠杆菌数量。大肠杆菌为革兰氏阴性菌,它与其他种类细菌的繁殖存在竞争作用。盲肠与结肠试验组中大肠杆菌数量少,可能是因为盲肠与结肠接种物中其他细菌含量丰富,发酵过程中大量繁殖,与大肠杆菌形成了竞争性抑制作用;而回肠接种物中总体细菌数量较少,在发酵过程中对大肠杆菌的抑制能力较弱,导致回肠试验组大肠杆菌大量繁殖。本研究中另外还发现,大肠杆菌属数量与NH3N含量显著正相关。柔嫩梭菌属是厚壁菌门的主要成员之一,同时也是最主要的产丁酸菌之一[31]。本研究中,盲肠组柔嫩梭菌含量最高,其发酵产生丁酸的含量在三组间也最高,两者间存在显著正相关。相比于未加蛋氨酸底物对照组,蛋氨酸试验组中柔嫩梭菌属和梭菌XIV属在3个肠段均较高,提示这2个菌属中可能依赖蛋氨酸作为氮源。
4 结论 综上所述,猪盲肠、结肠与回肠微生物以蛋氨酸为底物体外发酵,盲肠微生物对蛋氨酸的代谢率较高,伴随着其他发酵参数的变化,并且发酵产生更多的菌体蛋白。与回肠微生物发酵相比,盲肠和结肠微生物发酵后的大肠杆菌属数量较低,而柔嫩梭菌属和梭菌XIV属数量较高。
References
| [1] | Wu GY. Functional amino acids in growth, reproduction, and health. Advances in Nutrition, 2010, 1(1): 31-37. DOI:10.3945/an.110.1008 |
| [2] | Shoveller AK, Brunton JA, Pencharz PB, Ball RO. The methionine requirement is lower in neonatal piglets fed parenterally than in those fed enterally. Journal of Nutrition, 2003, 133(5): 1390-1397. DOI:10.1093/jn/133.5.1390 |
| [3] | Chen LX, Li P, Wang JJ, Li XL, Gao HJ, Yin YL, Hou YQ, Wu GY. Catabolism of nutritionally essential amino acids in developing porcine enterocytes. Amino Acids, 2009, 37(1): 143-152. DOI:10.1007/s00726-009-0268-1 |
| [4] | Chen LX, Yin YL, Jobgen WS, Jobgen SC, Knabe DA, Hu WX, Wu GY. In vitro oxidation of essential amino acids by jejunal mucosal cells of growing pigs. Livestock Science, 2007, 109(1/3): 19-23. |
| [5] | Dai ZL, Zhang J, Wu GY, Zhu WY. Utilization of amino acids by bacteria from the pig small intestine. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [6] | Williams BA, Bosch MW, Boer H, Verstegen MWA, Tamminga S. An in vitro batch culture method to assess potential fermentability of feed ingredients for monogastric diets. Animal Feed Science and Technology, 2005, 123-124: 445-462. DOI:10.1016/j.anifeedsci.2005.04.031 |
| [7] | Theodorou MK, Williams BA, Dhanoa MS, Mcallan AB, France J. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Animal Feed Science and Technology, 1994, 48(3-4): 185-197. DOI:10.1016/0377-8401(94)90171-6 |
| [8] | Muftic MK. A new phenol-hypochlorite reaction for ammonia. Nature, 1964, 201(4919): 622-623. DOI:10.1038/201622a0 |
| [9] | Zhang CJ, Yu M, Yang YX, Mu CL, Su Y, Zhu WY. Effect of early antibiotic administration on cecal bacterial communities and their metabolic profiles in pigs fed diets with different protein levels. Anaerobe, 2016, 42: 188-196. DOI:10.1016/j.anaerobe.2016.10.016 |
| [10] | Zoetendal EG, Akkermans ADL, de vos WM. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria. Applied and Environmental Microbiology, 1998, 64(10): 3854-3859. |
| [11] | Xin JG, Zeng D, Wang HS, Ni XQ, Yi D, Pan KC, Jing B. Preventing non-alcoholic fatty liver disease through Lactobacillus johnsonii BS15 by attenuating inflammation and mitochondrial injury and improving gut environment in obese mice. Applied Microbiology and Biotechnology, 2014, 98(15): 6817-6829. DOI:10.1007/s00253-014-5752-1 |
| [12] | Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell, 2006, 124(4): 837-848. DOI:10.1016/j.cell.2006.02.017 |
| [13] | Shen J, Zhang BR, Wei GF, Pang X, Wei H, Li M, Zhang Y, Jia W, Zhao LP. Molecular profiling of the Clostridium leptum subgroup in human fecal microflora by PCR-denaturing gradient gel electrophoresis and clone library analysis. Applied and Environmental Microbiology, 2006, 72(8): 5232-5238. DOI:10.1128/AEM.00151-06 |
| [14] | Huijsdens XW, Linskens RK, Mak MT, Meuwissen SGM, Vandenbroucke-Grauls CMJE, Savelkoul PHM. Quantification of bacteria adherent to gastrointestinal mucosa by real-time PCR. Journal of Clinical Microbiology, 2002, 40(12): 4423-4427. DOI:10.1128/JCM.40.12.4423-4427.2002 |
| [15] | Hartman AL, Lough DM, Barupal DK, Fiehn O, Fishbein T, Zasloff M, Eisen JA. Human gut microbiome adopts an alternative state following small bowel transplantation. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(40): 17187-17192. DOI:10.1073/pnas.0904847106 |
| [16] | Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze XL, Brown D, Stares MD, Scott P, Bergerat A, Louis P, McIntosh F, Johnstone AM, Lobley GE, Parkhill J, Flint HJ. Dominant and diet-responsive groups of bacteria within the human colonic microbiota. The ISME Journal, 2011, 5(2): 220-230. DOI:10.1038/ismej.2010.118 |
| [17] | Rao H. The factors affecting gastrointestinal pH and pepsin activity in weaned piglets. Swine Industry Science, 2008(6): 58-60. (in Chinese) 饶辉. 影响断奶仔猪胃肠道pH值及胃蛋白酶活性的因素. 猪业科学, 2008(6): 58-60. |
| [18] | Elsden SR, Hilton MG, Waller JM. The end products of the metabolism of aromatic amino acids by Clostridia. Archives of Microbiology, 1976, 107(3): 283-288. DOI:10.1007/BF00425340 |
| [19] | Rechkemmer G, R nnau K, von Engelhardt W. Fermentation of polysaccharides and absorption of short chain fatty acids in the mammalian hindgut. Comparative Biochemistry and Physiology Part A: Physiology, 1988, 90(4): 563-568. DOI:10.1016/0300-9629(88)90668-8 |
| [20] | Christensen DN, Knudsen KEB, Wolstrup J, Jensen BB. Integration of ileum cannulated pigs and in vitro fermentation to quantify the effect of diet composition on the amount of short-chain fatty acids available from fermentation in the large intestine. Journal of the Science of Food and Agriculture, 1999, 79(5): 755-762. DOI:10.1002/(ISSN)1097-0010 |
| [21] | Laparra JM, Sanz Y. Interactions of gut microbiota with functional food components and nutraceuticals. Pharmacological Research, 2010, 61(3): 219-225. DOI:10.1016/j.phrs.2009.11.001 |
| [22] | Mortensen PB, Holtug K, Bonnén H, Clausen MR. The degradation of amino acids, proteins, and blood to short-chain fatty acids in colon is prevented by lactulose. Gastroenterology, 1990, 98(2): 353-360. DOI:10.1016/0016-5085(90)90825-L |
| [23] | Wang YQ, Yu L, Wang CM, Zhao GQ, Sun LS, Huang J. Effects of different dietary protein level on pH, NH3-N and urea-N in gastrointestinal tract of Hu sheep. Animal Husbandry & Veterinary Medicine, 2008, 40(3): 34-39. (in Chinese) 王雅倩, 俞路, 王春梅, 赵国琦, 孙龙生, 黄俊. 日粮蛋白质水平对湖羊胃肠道pH、氨态氮及尿素氮的影响. 畜牧与兽医, 2008, 40(3): 34-39. |
| [24] | Geypens B, Claus D, Evenepoel P, Hiele M, Maes B, Peeters M, Rutgeerts P, Ghoos Y. Influence of dietary protein supplements on the formation of bacterial metabolites in the colon. Gut, 1997, 41(1): 70-76. DOI:10.1136/gut.41.1.70 |
| [25] | Summerskill WH, Wolpert E. Ammonia metabolism in the gut. The American Journal of Clinical Nutrition, 1970, 23(5): 633-639. DOI:10.1093/ajcn/23.5.633 |
| [26] | 张京. 猪小肠氨基酸代谢菌的分离和鉴定. 南京农业大学硕士学位论文, 2009. |
| [27] | 戴兆来. 猪小肠微生物氨基酸代谢的生态学分析. 南京农业大学博士学位论文, 2010. |
| [28] | Smith EA, Macfarlane GT. Enumeration of amino acid fermenting bacteria in the human large intestine: effects of pH and starch on peptide metabolism and dissimilation of amino acids. FEMS Microbiology Ecology, 1998, 25(4): 355-368. DOI:10.1111/fem.1998.25.issue-4 |
| [29] | Li YZ. Effect of amino acids supplementation in low-protein feed on the performance and cecal microflora structure of laying hens. Journal of China Agricultural University, 2012, 17(2): 108-116. (in Chinese) 李永洙. 氨基酸对蛋鸡生产性能及盲肠微生物菌群结构的影响. 中国农业大学学报, 2012, 17(2): 108-116. |
| [30] | Wang HR, Xu AQ, Wang MZ, Li SX, Wang HL, Zhang HW. Effects of amino acids on the rumen microbes growth and fermentation in vitro. Acta Veterinaria et Zootechnica Sinica, 2010, 41(9): 1109-1116. (in Chinese) 王洪荣, 徐爱秋, 王梦芝, 李世霞, 王欢莉, 张红伟. 氨基酸对体外培养瘤胃微生物生长及发酵的影响. 畜牧兽医学报, 2010, 41(9): 1109-1116. |
| [31] | Barcenilla A, Pryde SE, Martin JC, Duncan SH, Stewart CS, Henderson C, Flint HJ. Phylogenetic relationships of butyrate-producing bacteria from the human gut. Applied and Environmental Microbiology, 2000, 66(4): 1654-1661. DOI:10.1128/AEM.66.4.1654-1661.2000 |
