 ,1,*, 戚益军
,1,*, 戚益军 ,2,*
,2,*Small RNA, No Small Feat: Plants Deploy 22 nt siRNAs to Cope with Environmental Stress
Liang Wu ,1,*, Yijun Qi
,1,*, Yijun Qi ,2,*
,2,*通讯作者:
责任编辑: 孙冬花
收稿日期:2020-05-1接受日期:2020-05-2网络出版日期:2020-05-01
| 基金资助: |
Corresponding authors:
Received:2020-05-1Accepted:2020-05-2Online:2020-05-01

摘要
关键词:
Abstract
Keywords:
PDF (1998KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
武亮, 戚益军. 小RNA, 大本领: 22 nt siRNAs在植物适应逆境中的重要作用. 植物学报, 2020, 55(3): 270-273 doi:10.11983/CBB20070
Wu Liang, Qi Yijun.
植物一旦生根发芽, 就不再移动, 而是在原地开花结实, 平凡地度过一生。然而, 植物的一生并不平静, 真可谓“树欲静而风不止”, 它们会遭遇各种各样的环境变化和逆境挑战, 如高温、低温、干旱和营养匮乏等。如何面对和适应不同的环境条件对植物来说是生死攸关的大事。
在植物体内, 除了具有编码蛋白功能的mRNA外, 还存在着多种多样的非编码RNA (non-coding RNA, ncRNA), 其中包括RNA干扰(RNA interference, RNAi)通路中的21-24 nt的小RNA (small RNA, sRNA)。
sRNA通常由一类称为DCL (Dicer-like)的RNase-III型核酸酶切割前体RNA产生, 与AGO (ARGONAUTE)家族蛋白结合形成沉默复合物, 参与靶标基因的表达调控(Song et al., 2019)。植物中表达丰度最高的sRNA包括21 nt microRNA (miRNA)和24 nt siRNA (small interfering RNA)。目前, 对这两类sRNA的作用方式和生物学功能已研究得较为清楚。miRNA通常由DCL1切割其具有发卡结构的前体产生, 与AGO1结合后以切割靶标mRNA或抑制其翻译的方式调控基因的表达; 24 nt siRNA通常来自转座子和重复序列区域, 它们由RNA依赖的RNA聚合酶RDR2 (RNA Dependent RNA Polymerase 2)合成的双链RNA前体经DCL3加工产生, 在与AGO4结合后通过招募甲基化酶DRM2 (DOMAINS REARRAN-GED METHYLTRANSFERASE 2), 介导DNA甲基化, 从而抑制转座子活性和重复序列的转录(Song et al., 2019)。
除了DCL1和DCL3, 拟南芥(Arabidopsis thaliana)中另外2个DCL蛋白(DCL2和DCL4)在特定条件下也可产生其它sRNA。例如, 当植物遇到病毒侵染后, DCL2和DCL4可产生大量病毒来源的21 nt和22 nt siRNAs, 抵御病毒侵染(Deleris et al., 2006)。此外, 长度为22 nt的miRNA剪切靶标RNA, 其切割产物可经RDR6和DCL4进一步加工, 产生次级21 nt siRNA。由于这些次级siRNA首尾相连呈阶段性排布, 因此也被称为phasiRNAs (phased siRNA)。phasiRNA在植物发育中具有重要调控作用(Deng et al., 2018)。内源22 nt siRNA表达丰度低, 一直被研究者所忽视, 其调控机制和生物学功能迄今未知。
郭红卫团队前期(2015年)在拟南芥中筛选过量表达乙烯信号转导通路重要转录因子基因EIN3 (ETHYLENE INSENSITIVE3)的抑制子过程中, 发现细胞质核糖核酸外切酶基因EIN5以及DExH-box RNA解旋酶基因SKI2 (Super-Killer2)突变, 可以回补EIN3过量表达造成的发育缺陷; 并进一步证明EIN5和SKI2分别介导的细胞质5'-3'和3'-5' RNA降解(RNA decay)通路对植物抑制内源基因的沉默非常重要(Zhang et al., 2015)。当EIN5和SKI2基因功能同时丧失时, 两条细胞质RNA降解通路同时受阻, 植物因此积累大量非正常的双向mRNAs (aberrant bidirectional mRNAs), 而植物体内的RDR6能够以这些异常mRNA分子为模板扩增出双链RNA分子, 随后这些双链RNA分子由DCL4和DCL2加工产生大量的内源21 nt及22 nt siRNAs (coding transcript-derived siRNAs, ct-siRNAs)。ct-siRNAs与AGO1结合, 识别并切割正常功能的mRNAs, 造成破坏性的内源基因沉默, 从而导致植物出现多种生长发育缺陷(Zhang et al., 2015)。由于22 nt siRNA通常会触发次级siRNA的扩增来进一步切割mRNA并增强转录后水平(post-transcriptional silencing, PTGS)的沉默效果, 因而他们猜测当两条RNA降解途径同时阻断时, DCL4产生的21 nt ct-siRNAs可能与DCL2产生的22 nt ct-siRNAs存在直接相互竞争, 从而降低RNA降解的破坏力(Zhang et al., 2015)。但是, 仅阻断一条RNA降解途径会出现什么情况, 以及这些22 nt ct-siRNAs究竟行使哪些生物学功能, 当时并不清楚(Zhang et al., 2015)。
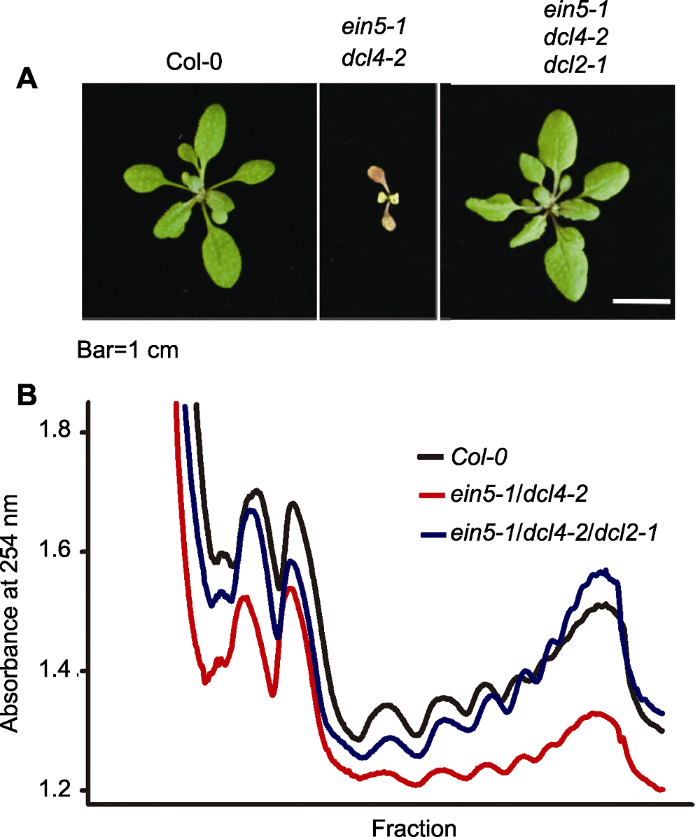
在上述研究中, 郭红卫团队建立了完善的植物siRNA产生和作用机制的研究系统, 为深入解析植物内源22 nt siRNAs的生物学功能奠定了前期基础。近期, 该研究团队在Nature杂志上发文, 报道了其最新工作。他们首先发现, 当植物缺失其中任意一条RNA 降解通路并抑制DCL4活性后, 即在ein5/dcl4和ski2/dcl4双重突变体中, 植物在叶片生长、顶端分生组织发育及色素沉着等方面表现出多种异常性状, 而在ein5/dcl2、ski2/dcl2和ein5/dcl2/dcl4等突变体中基本正常, 由于DCL4与DCL2在剪切sRNA前体时存在竞争, 且分别加工产生21 nt和22 nt siRNA, 因此猜测ein5/dcl4和ski2/dcl4中发育缺陷可能是由于植物增加了内源22 nt siRNAs的积累所致(图1A)。他们进一步验证了该设想, 通过高通量测序发现, 与野生型相比, 内源22 nt siRNAs在ein5/dcl4和ski2/dcl4突变体中显著增加, 而在ein5/dcl2和ski2/dcl2突变体中保持不变, 说明植物内源22 nt siRNAs的增加确实可以导致植物异常(Wu et al., 2020)。需要指出的是, 这些增加的siRNA并非广泛产生于基因组的众多位点, 而是主要来源于2个硝酸还原酶基因(NIA1和NIA2), 其丰度达到了22 nt siRNAs总量的近50%, 说明该类siRNA的产生具有基因位点特异性(Wu et al., 2020)。虽然这一现象背后的机制仍不清楚, 但是NIA1和NIA2基因区域积累如此多的22 nt siRNA引起了该研究团队极大的兴趣, 他们随即对这2个特定位点产生siRNA的生物学功能进行了探索。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1拟南芥EIN5 (RNA降解通路关键基因)和DCL4缺陷的突变体产生大量内源22 nt siRNAs, 造成了多重生长缺陷表型(A)和全局性翻译抑制(B)
Col-0: 野生型拟南芥
Figure 1Arabidopsis RNA decay (EIN5) and DCL4 mutants accumulate endogenous 22 nt siRNAs that cause pleiotropic growth disorders (A) and global translational repression (B)
Col-0: Wild-type Arabidopsis plant
不同于21 nt siRNA切割靶标基因mRNA, 转录组测序并未发现产生这些22 nt siRNAs的基因表达发生明显变化; 然而通过测定核糖体结合的mRNA显示, 与野生型或引入dcl2突变的植株相比, ein5/dcl4、ski2/dcl4突变体中核糖体结合NIA1和NIA2的mRNA丰度显著降低, 说明NIA1和NIA2的翻译效率可能受到抑制。免疫印迹分析进一步证实, 22 nt siRNAs确实抑制NIA1和NIA2的翻译(Wu et al., 2020)。而在全基因组水平检测发现, ein5/dcl4与野生型和ein5/dcl4/dcl2突变体相比, 其核糖体结合mRNA的水平呈现明显下降, 进一步明确了22 nt siRNAs是在翻译水平抑制靶标基因的表达(图1B)。
鉴于sRNA一般需要与AGO家族蛋白结合发挥功能, 为了探究这类22 nt siRNAs通过与拟南芥中哪个AGO结合发挥翻译抑制作用, 研究团队通过一系列遗传学研究发现, 类似于经典的miRNA, 22 nt siRNAs主要与AGO1 (而非AGO2或AGO4)结合实现对靶标基因的翻译抑制过程。通过测定AGO1结合的22 nt siRNAs以及体外重组AGO1介导的蛋白抑制复合物等生化实验, 他们进一步证明了AGO1对于22 nt siRNAs抑制翻译的重要性(Wu et al., 2020)。但该研究发现, 不同于miRNA与AGO1结合介导翻译抑制依赖于内质网膜定位因子AMP1 (ALTEREDMERIS- TEM PROGRAM 1) (Li et al., 2013), 22 nt siRNAs介导的翻译抑制并不需要AMP1的参与(Wu et al., 2020)。
生物和非生物逆境可以诱导植物产生新类型的sRNA (Hua et al., 2018)。由于拟南芥NIA1和NIA2直接参与氮同化过程, 且其基因位点产生了大量22 nt siRNAs, Wu等(2020)观察了野生型植株和dcl4突变体在缺氮培养基上的表型。与野生型相比, dcl4突变体表现更加敏感。与此一致, dcl4中的NIA1和NIA2蛋白几乎完全消失, 进一步提示DCL4的缺失导致DCL2加工产生更多的22 nt siRNA, 从而严重抑制了NIA1和NIA2的翻译。结合低氮条件下NIA1和NIA2的转录水平也显著下降, 这2种水平的协同调控可以保证植物在极端缺氮条件下最大限度地降低氮同化效率, 确保植物减少能耗直至完成整个生活史(Wu et al., 2020)。
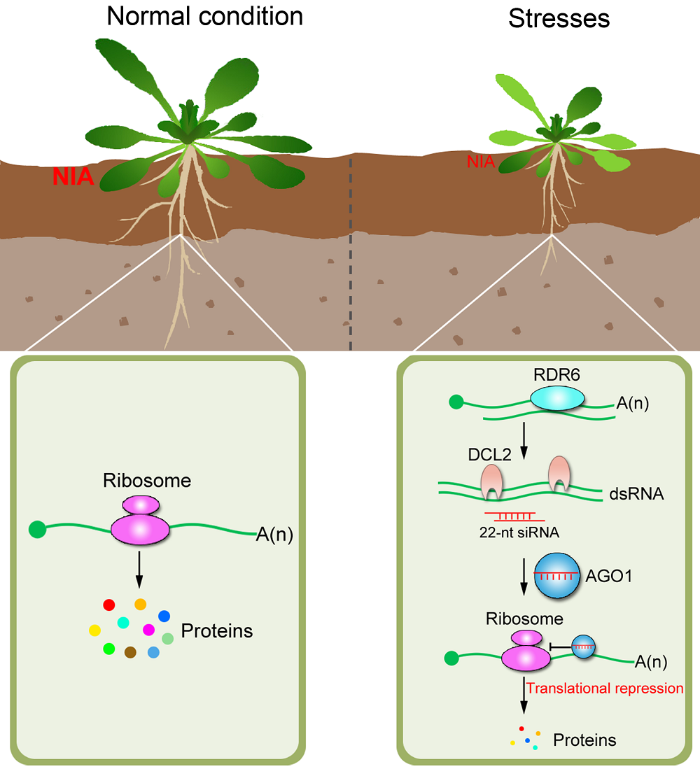
NIA1和NIA2作为氮同化过程的关键调控节点, 通过22 nt siRNA介导的翻译水平调控, 不仅有助于维持植物在低氮条件下的生存, 而且在高盐和脱落酸(abscisic acid)处理等多种非生物胁迫条件下, 可通过暂时抑制植物的生长, 同时激活逆境响应而协调植物生长发育与抗逆反应的平衡(Wu et al., 2020)。在正常条件下, 22 nt siRNA保持低水平的积累, “暗藏杀机”, 当遭遇逆境时, 则“一触即发”, 以保证植物的“生生不息”(图2)。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2拟南芥22 nt siRNA的工作模式
正常条件下22 nt siRNA几乎不表达, 在氮饥饿等逆境条件下被大量诱导, 进入AGO1沉默复合物, 抑制NIA等基因的翻译, 平衡植物生长发育与抗逆。
Figure 2A working model for 22 nt siRNAs in plant stress adaptation
The 22 nt siRNAs are barely accumulated under normal conditions, but can be dramatically induced when plants are exposed to adverse environments. These sRNAs are recruited into AGO1 complex and lead to the translational inhibition of NIA genes, thereby balancing plant development and stress tolerance.
目前, 拟南芥仅有少量的基因位点可以产生22 nt siRNA的原因还不十分清楚, 是否有RNA结合蛋白帮助DCL2识别特异RNA双链产生22 nt siRNA? 22 nt siRNA是否也存在于其它重要农作物中? 它们是否也参与这些植物对环境的应答? 由于sRNA具有细胞非自主性(Hua et al., 2018), 22 nt siRNA是否还可以调控远端器官中的靶标基因? 相信在不久的将来这些有趣的问题均可以得到解答。
致谢
本文图1由南方科技大学郭红卫教授提供, 图2由浙江大学秦正睿博士协助绘制, 在此一并致谢。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
URLPMID:29327403 [本文引用: 1]
URLPMID:29229568 [本文引用: 2]
[本文引用: 1]
URLPMID:30848930 [本文引用: 2]
URLPMID:32376953 [本文引用: 8]
[本文引用: 4]
Hierarchical action and inhibition of plant Dicer-like proteins in antiviral defen-se
1
2006
... 除了DCL1和DCL3, 拟南芥(Arabidopsis thaliana)中另外2个DCL蛋白(DCL2和DCL4)在特定条件下也可产生其它sRNA.例如, 当植物遇到病毒侵染后, DCL2和DCL4可产生大量病毒来源的21 nt和22 nt siRNAs, 抵御病毒侵染(
Biogenesis and regulatory hierarchy of phased small interfering RNAs in plants
1
2018
... 除了DCL1和DCL3, 拟南芥(Arabidopsis thaliana)中另外2个DCL蛋白(DCL2和DCL4)在特定条件下也可产生其它sRNA.例如, 当植物遇到病毒侵染后, DCL2和DCL4可产生大量病毒来源的21 nt和22 nt siRNAs, 抵御病毒侵染(
Trans-Kingdom RNA silencing in plant-fungal pathogen interactions
2
2018
... 生物和非生物逆境可以诱导植物产生新类型的sRNA (
... 目前, 拟南芥仅有少量的基因位点可以产生22 nt siRNA的原因还不十分清楚, 是否有RNA结合蛋白帮助DCL2识别特异RNA双链产生22 nt siRNA? 22 nt siRNA是否也存在于其它重要农作物中? 它们是否也参与这些植物对环境的应答? 由于sRNA具有细胞非自主性(
MicroRNAs inhibit the translation of target mRNAs on the endoplasmic reticulum in Arabidop-sis
1
2013
... 鉴于sRNA一般需要与AGO家族蛋白结合发挥功能, 为了探究这类22 nt siRNAs通过与拟南芥中哪个AGO结合发挥翻译抑制作用, 研究团队通过一系列遗传学研究发现, 类似于经典的miRNA, 22 nt siRNAs主要与AGO1 (而非AGO2或AGO4)结合实现对靶标基因的翻译抑制过程.通过测定AGO1结合的22 nt siRNAs以及体外重组AGO1介导的蛋白抑制复合物等生化实验, 他们进一步证明了AGO1对于22 nt siRNAs抑制翻译的重要性(
MicroRNAs and their regulatory roles in plant-environment interactions
2
2019
... sRNA通常由一类称为DCL (Dicer-like)的RNase-III型核酸酶切割前体RNA产生, 与AGO (ARGONAUTE)家族蛋白结合形成沉默复合物, 参与靶标基因的表达调控(
... ).植物中表达丰度最高的sRNA包括21 nt microRNA (miRNA)和24 nt siRNA (small interfering RNA).目前, 对这两类sRNA的作用方式和生物学功能已研究得较为清楚.miRNA通常由DCL1切割其具有发卡结构的前体产生, 与AGO1结合后以切割靶标mRNA或抑制其翻译的方式调控基因的表达; 24 nt siRNA通常来自转座子和重复序列区域, 它们由RNA依赖的RNA聚合酶RDR2 (RNA Dependent RNA Polymerase 2)合成的双链RNA前体经DCL3加工产生, 在与AGO4结合后通过招募甲基化酶DRM2 (DOMAINS REARRAN-GED METHYLTRANSFERASE 2), 介导DNA甲基化, 从而抑制转座子活性和重复序列的转录(
Plant 22 nt siRNAs mediate translational repression and stress adaptation
8
2020
... 在上述研究中, 郭红卫团队建立了完善的植物siRNA产生和作用机制的研究系统, 为深入解析植物内源22 nt siRNAs的生物学功能奠定了前期基础.近期, 该研究团队在Nature杂志上发文, 报道了其最新工作.他们首先发现, 当植物缺失其中任意一条RNA 降解通路并抑制DCL4活性后, 即在ein5/dcl4和ski2/dcl4双重突变体中, 植物在叶片生长、顶端分生组织发育及色素沉着等方面表现出多种异常性状, 而在ein5/dcl2、ski2/dcl2和ein5/dcl2/dcl4等突变体中基本正常, 由于DCL4与DCL2在剪切sRNA前体时存在竞争, 且分别加工产生21 nt和22 nt siRNA, 因此猜测ein5/dcl4和ski2/dcl4中发育缺陷可能是由于植物增加了内源22 nt siRNAs的积累所致(
... ), 其丰度达到了22 nt siRNAs总量的近50%, 说明该类siRNA的产生具有基因位点特异性(
... 不同于21 nt siRNA切割靶标基因mRNA, 转录组测序并未发现产生这些22 nt siRNAs的基因表达发生明显变化; 然而通过测定核糖体结合的mRNA显示, 与野生型或引入dcl2突变的植株相比, ein5/dcl4、ski2/dcl4突变体中核糖体结合NIA1和NIA2的mRNA丰度显著降低, 说明NIA1和NIA2的翻译效率可能受到抑制.免疫印迹分析进一步证实, 22 nt siRNAs确实抑制NIA1和NIA2的翻译(
... 鉴于sRNA一般需要与AGO家族蛋白结合发挥功能, 为了探究这类22 nt siRNAs通过与拟南芥中哪个AGO结合发挥翻译抑制作用, 研究团队通过一系列遗传学研究发现, 类似于经典的miRNA, 22 nt siRNAs主要与AGO1 (而非AGO2或AGO4)结合实现对靶标基因的翻译抑制过程.通过测定AGO1结合的22 nt siRNAs以及体外重组AGO1介导的蛋白抑制复合物等生化实验, 他们进一步证明了AGO1对于22 nt siRNAs抑制翻译的重要性(
... ), 22 nt siRNAs介导的翻译抑制并不需要AMP1的参与(
... 生物和非生物逆境可以诱导植物产生新类型的sRNA (
... 的转录水平也显著下降, 这2种水平的协同调控可以保证植物在极端缺氮条件下最大限度地降低氮同化效率, 确保植物减少能耗直至完成整个生活史(
... NIA1和NIA2作为氮同化过程的关键调控节点, 通过22 nt siRNA介导的翻译水平调控, 不仅有助于维持植物在低氮条件下的生存, 而且在高盐和脱落酸(abscisic acid)处理等多种非生物胁迫条件下, 可通过暂时抑制植物的生长, 同时激活逆境响应而协调植物生长发育与抗逆反应的平衡(
Suppression of endogenous gene silencing by bidirectional cytoplasmic RNA decay in Arabi-dopsis
4
2015
... 郭红卫团队前期(2015年)在拟南芥中筛选过量表达乙烯信号转导通路重要转录因子基因EIN3 (ETHYLENE INSENSITIVE3)的抑制子过程中, 发现细胞质核糖核酸外切酶基因EIN5以及DExH-box RNA解旋酶基因SKI2 (Super-Killer2)突变, 可以回补EIN3过量表达造成的发育缺陷; 并进一步证明EIN5和SKI2分别介导的细胞质5'-3'和3'-5' RNA降解(RNA decay)通路对植物抑制内源基因的沉默非常重要(
... 基因功能同时丧失时, 两条细胞质RNA降解通路同时受阻, 植物因此积累大量非正常的双向mRNAs (aberrant bidirectional mRNAs), 而植物体内的RDR6能够以这些异常mRNA分子为模板扩增出双链RNA分子, 随后这些双链RNA分子由DCL4和DCL2加工产生大量的内源21 nt及22 nt siRNAs (coding transcript-derived siRNAs, ct-siRNAs).ct-siRNAs与AGO1结合, 识别并切割正常功能的mRNAs, 造成破坏性的内源基因沉默, 从而导致植物出现多种生长发育缺陷(
... ).由于22 nt siRNA通常会触发次级siRNA的扩增来进一步切割mRNA并增强转录后水平(post-transcriptional silencing, PTGS)的沉默效果, 因而他们猜测当两条RNA降解途径同时阻断时, DCL4产生的21 nt ct-siRNAs可能与DCL2产生的22 nt ct-siRNAs存在直接相互竞争, 从而降低RNA降解的破坏力(
... ).但是, 仅阻断一条RNA降解途径会出现什么情况, 以及这些22 nt ct-siRNAs究竟行使哪些生物学功能, 当时并不清楚(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
