 ,1,2,*
,1,2,*The Application of Double-barreled Particle Bombardment for Transient Gene Expression in Arabidopsis
Hua Zhao1, Guangda Shao1,2, Wenxin Gao1,2, Biao Gu ,1,2,*
,1,2,*通讯作者:
责任编辑: 朱亚娜
收稿日期:2019-08-28接受日期:2019-11-28网络出版日期:2020-03-01
| 基金资助: |
Corresponding authors:
Received:2019-08-28Accepted:2019-11-28Online:2020-03-01

摘要
关键词:
Abstract
Keywords:
PDF (17671KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
赵华, 邵广达, 高文鑫, 顾彪. 双管基因枪介导的基因瞬时表达技术在拟南芥中的应用. 植物学报, 2020, 55(2): 182-191 doi:10.11983/CBB19169
Zhao Hua, Shao Guangda, Gao Wenxin, Gu Biao.
在农作物生长发育和抗逆相关研究中, 由于作物自身特点等客观条件的限制, 需要借助模式植物异源表达验证目标基因的功能。拟南芥(Arabidopsis thaliana)是植物科学研究中的经典模式植物, 具有十分广泛的研究基础和极为丰富的突变体资源, 不但为作物增产和抗逆相关基因功能研究提供了宝贵的资源, 也作为遗传操作性强的介体材料被引入众多实验体系中, 在农业科学基础研究中发挥重要的桥梁作用(Koornneef and Meinke, 2010)。
瞬时表达技术作为高效、便捷的基因功能分析手段在植物中广泛使用。应用于拟南芥的基因瞬时表达技术主要包括原生质体转化法、农杆菌(Agrobacterium tumefaciens)介导的基因瞬时转化法和基因枪法。用原生质体转化法直接处理单个细胞, 易于观测目标基因产生的表型, 但原生质体缺乏完整细胞壁结构, 有限的再生率会限制细胞周期调控相关研究(Yoo et al., 2007)。农杆菌侵染法可在完整植株上进行, 便于真实地反映目标基因在植物体内的表达情况, 但农杆菌侵染拟南芥叶片会引起免疫反应并导致表达效率低(Tsuda et al., 2012)。基因枪法介导的瞬时表达体系实验周期短, 可进行较高通量分析, 但拟南芥的叶片小, 且转化效率差异大(Ueki et al., 2009)。
利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差。改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差。即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(Kale and Tyler, 2011)。然而, 双管基因枪介导的基因瞬时表达技术目前仅在大豆(Glycine max) (Dou et al., 2008; Dong et al., 2011)和本氏烟(Nicotiana benthamiana) (Wang et al., 2011a, 2011b)中成功应用。
本研究以植物免疫诱发的细胞坏死为指征, 以GUS为报告基因, 借助双管基因枪技术在拟南芥叶片中进行基因瞬时表达分析。借助双管基因枪在每次轰击过程中均可设置平行对照的优势, 以同一叶片上处理和对照中GUS蓝斑数量的比值为样本数据进行统计分析, 仅用10次轰击重复即可在莲座叶中准确分析目标基因的功能, 可为高效利用模式植物进行基因功能研究提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 植物材料实验材料为拟南芥(Arabidopsis thaliana L.) Col-0生态型。种子经表面消毒处理后点种于1/2MS固体培养基上, 4°C黑暗处理3天后置于20°C、光周期为14小时光照/10小时黑暗的植物培养箱中培养8天左右。然后将幼苗移栽至营养土中, 于20°C、光周期为12小时光照/12小时黑暗的植物培养间培养3周后, 取第6-10叶位中伸展完全的莲座叶(图1A), 用于双管基因枪介导的瞬时表达实验。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1利用双管基因枪在拟南芥和本氏烟叶片中瞬时表达GFP和GUS报告基因
(A) 用于基因瞬时表达的拟南芥植株, 红色箭头所示为选用的莲座叶(Bar=5 mm); (B) 拟南芥叶片中GFP报告基因荧光显微观察(Bar=50 μm); (C), (D) 分别为拟南芥和本氏烟叶片中GUS报告基因的表达情况。黑色数字代表统计的GUS蓝斑数量(Bars=5 mm)。
Figure 1Transient expression of GFP and GUS reporter genes in Arabidopsis thaliana and Nicotiana benthamiana leaves via double-barreled particle bombardment
(A) The rosette leaves (red arrow pointed) of A. thaliana were selected for transient gene expression (Bar=5 mm); (B) Observation of green fluorescent reporter gene (GFP) with fluorescent microscopy (Bar=50 μm); (C), (D) Transient expression of GUS in A. thaliana and N. benthamiana leaves, respectively. Numbers of GUS positive spots are indicated in black numbers (Bars=5 mm).
将本氏烟(Nicotiana benthamiana L.)种子点种于营养土中, 置于22°C、光周期为14小时光照/10小时黑暗条件下培养10天左右。然后移栽至营养钵中培养4周, 取中上部完全展开叶用于双管基因枪瞬时转化实验。
1.1.2 质粒材料
分别扩增GFP、GUS、BAX、Avh238、Avrblb1、RB、ATR13和Rpp13目标基因, 构建由35S启动子和NOS终止子调控的载体pUC-GUS、pUC-GFP、pUC- BAX、pUC-mAvh238、pUC-mATR13、pUC-Rpp13、pUC-Avrblb1和pUC-RB, 用大量质粒提取试剂盒(Tiangen, Cat No.DP117)抽提质粒, 调节质粒浓度至4-5 μg∙μL-1。-20°C保存备用。
1.2 方法
1.2.1 基因枪微粒子弹制备及双孔枪头的组装和轰击参数设置称取45-60 mg钨粉(Tungsten M-10 Microcarriers, BIO-RAD), 用1 mL 75%乙醇涡旋洗涤钨粉后静置15分钟, 瞬时离心5秒后弃上清。加入1 mL无菌水, 用相同方法洗涤2次, 37°C烘干后加入1 mL 50%无菌甘油, 混匀后立即使用或于-80°C冻存。取100 μL钨粉混悬液, 离心后弃上清(50 μL), 等质量比加入25 μL 1种或多种质粒并混匀。加入65 μL 2.5 mol∙L-1 NaCl, 混匀, 加入25 μL 0.1 mol∙L-1亚精胺溶液, 混匀后瞬时离心, 弃上清。再加入200 μL无水乙醇清洗钨粉并瞬时离心, 弃上清。最终用20 μL无水乙醇重悬钨粉, 置于冰上备用。
将单孔枪头卡座内隔离环和阻挡网支架取下后, 用双孔枪头(U.S. Patent 20090011510)替换单孔枪头; 调节破裂膜(Rupture Disk, INBIO GOLD)支持盖与微载体发射器(Macrocarrier, INBIO GOLD)之间的距离为0.6 cm, 将靶标支持板置于12 cm刻度位置, 氦气罐压强6.20×106 Pa (900 psi) (本氏烟)或10.34×106 Pa (1 500 psi) (拟南芥), 样品室真空度>0.17×106 Pa (25 psi), 爆破压强4.48×106 Pa (650 psi) (本氏烟)或7.58×106 Pa (1 100 psi) (拟南芥), 靶标受体与阻挡网(Stopping Screens, INBIO GOLD)相距12 cm, 开始抽真空至膜破裂时间15秒。
1.2.2 轰击转化
将基因枪(BIO-RAD PDS1000)的轰击舱及相关用品用75%乙醇消毒后晾干。各取1 μL涡旋混匀后的对照微粒子弹和1 μL测试微粒子弹滴加在载体膜上, 使二者分别对准2个枪孔; 将供试叶片上表面向上平铺在含有1%水琼脂培养基的培养皿内, 置于双枪孔的正下方, 抽真空至0.17×106 Pa (25 psi)后轰击靶叶片。轰击后将叶片置于铺有浸湿滤纸的培养皿内, 封口保湿, 黑暗条件下25°C培养。
1.2.3 报告基因的检测与观察
轰击转化叶片培养2-3天后进行GUS染色, 染液参照Kale和Tyler (2011)的方法。37°C下染色4-8小时可见GUS蓝斑。甲醇脱色后, 在实体显微镜(OLYMPUS SZX7) 2倍放大条件下观察, 统计轰击位点的蓝斑数量。统计完毕后, 在培养皿内将叶片浸入蒸馏水中拍照; 或转化叶片培养2-3天后, 利用荧光显微镜(OLYMPUS BX53), 在488 nm激发光条件、20倍目镜下观察荧光信号, 选取轰击点上GFP高量表达区域进行拍照。
每次实验每处理10张叶片, 每轰击1次调换1次处理和对照的相对位置, 以排除叶片不同部位对基因表达的影响, 从而减小系统误差。实验整体重复2次。
1.2.4 双管基因枪转化结果统计分析
以同一叶片上测试质粒和对照质粒轰击后形成蓝斑数量的比值作为样本数据, 采用威尔科克森符号轶和检验(Wilcoxon rank sum test)进行统计分析(Dou et al., 2008; Kale and Tyler, 2011)。
1.2.5 本氏烟中农杆菌介导的基因瞬时表达
分别扩增GFP、Inf1、Avrblb1和RB目标基因, 再连入经改造的pCambia1300 (35S-NOS)载体。用农杆菌GV3101介导GFP、Inf1和Avrblb1/RB在6-8周的本氏烟叶片上进行瞬时表达, 具体步骤参照Gu等(2011)的方法。
1.2.6 转基因拟南芥的制备与检测
以拟南芥Col-0生态型为受体植物, 采用农杆菌蘸花法稳定转化抗病基因RB。获得T0代的转化种子后, 利用含对应抗生素的平板培养基进行筛选, 移栽正常生长的植株并通过RT-PCR检测转基因植株中目的基因的表达, 将含有RB基因的植株留种待用, 具体步骤参照Weigel和Glazebrook (2002)的方法。目标基因表达水平检测引物为qRB-F/R, 拟南芥内参基因引物为qUBC9-F/R (表1)。
Table 1
表1
表1PCR和qRT-PCR引物序列
Table 1
| Primer name | Forward primer (5'-3') | Reverse primer (5'-3') |
|---|---|---|
| GFP | CTAGCCCCGGGATGGTGAGCAAGGGCGAG | CTGAGGTACCTTACTTGTACAGCTCGTC |
| GUS | CTAGCCCCGGGATGGTAGATCTGAGGAACC | CTGAGGTACCTCACACGTGATGGTGATGG |
| BAX | CTAGCCCCGGGATGGACGGGTCCGGGGAG | GTGCAGGATCCCTGGAAGAAGATGGGCTGA |
| Avh238 | CTAGCCCCGGGATGGAGGCGAAGCTCTTG | GTGCAGGATCCGTTGGCCAAGCCTGTGTAG |
| Avrblb1 | CTAGCCCCGGGATGGTTTCATCCAATCTCAAC | GTGCAGGTACCCTAGCTAGGGCCAACGTTTTTATC |
| RB | CTAGCCCCGGGATGGCTGAAGCTTTCATTCAAG | GTGCAGGATCCTTAAATATATATATTCACATTAG |
| ATR13 | CTAGCCCCGGGATGAATCTGCTCCACGCCCATG | GTGCAGGATCCTTACTGACTGGCAACGGCAGTC |
| Rpp13 | CTAGCCCCGGGATGGTAGATGCGATCACGGAG | GTGCAGGATCCCTAAACGCTCGCAATCGGTTTG |
| qRB | GAGAAGAGCAATTCCCTGTGC | GTTAGGTGCTGCAATCCCTCTG |
| qUBC9 | CATCGGATAGCCCTTATTCTG | TGGAACACCTTCGTCCTAAAA |
新窗口打开|下载CSV
2 结果与讨论
2.1 拟南芥中双管基因枪介导报告基因的瞬时表达
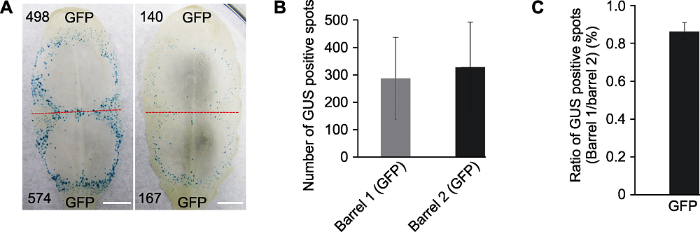
以本氏烟叶片为对照, 利用双管基因枪法检测绿色荧光蛋白编码基因(GFP)和β-葡萄糖苷酸酶基因(GUS)在拟南芥莲座叶中能否高效表达。依据叶型, 本氏烟叶片以主脉为轴左右对称轰击处理与对照, 拟南芥叶片以叶尖和叶柄上下对称轰击处理与对照(图2, 图3, 红色分割虚线)。结果显示, 轰击pUC-GFP质粒后, 可在拟南芥叶片下表皮细胞中检测到大量GFP荧光信号(图1B)。GFP (GFP:GUS=1:1)在拟南芥莲座叶片上平均每个轰击位点可产生298个GUS蓝斑, 并围绕轰击位点形成环状(图1C); 而GFP (GFP:GUS=1:1)在本氏烟叶片上平均每个轰击位点可产生875个GUS蓝斑, 并围绕轰击位点形成环状(图1D)。表明双管基因枪介导GFP和GUS基因在营养生长旺盛的拟南芥莲座叶片上可以高效表达(图1B-D), pUC-GUS和pUC-GFP皆可以在后续实验中作为对照或报告基因使用。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同拟南芥植株莲座叶中瞬时表达GUS报告基因的效率
(A) 不同莲座叶中双管基因枪介导GFP/GUS混合报告基因瞬时表达, 红色虚线划分轰击后双管基因枪2个枪孔形成的GUS蓝斑, 黑色数字代表形成的GUS蓝斑数量(Bars=5 mm); (B) 统计分析20片莲座叶中叶尖(Barrel 1)和叶柄(Barrel 2)产生GUS蓝斑的数量(误差线表示±标准差, P>0.1); (C) 将图B中的数据, 按照相同叶片Barrel 1和Barrel 2产生GUS蓝斑数量的比率进行统计分析(误差线表示±标准差)。每次选取2株拟南芥的10个叶片进行测试, 实验重复2次。将Barrel 1与Barrel 2产生GUS蓝斑数量进行对数转换后用威尔科克森符号轶和确定统计差异。
Figure 2The efficiency of transient expression of GUS gene in different rosette leaves of Arabidopsis thaliana
(A) Co-bombardment of GFP/GUS gene mixture in different rosette leaves, the red dotted line separates two positions produced by double-barreled particle bombardment, numbers of GUS blue spots are indicated in black numbers (Bars=5 mm); (B) Statistic analysis of GUS spots counted from the tip of leaf blade (Barrel 1) and petiole (Barrel 2) (error bar represents ± SD, P>0.1); (C) Ratios of GUS spot numbers in Barrel 1 and Barrel 2 of the same leaf (error bar represents ± SD). Ten rosette leaves from two A. thaliana plants were tested and the test was repeated twice. Statistical analysis by Wilcoxon rank sum test using log ratios of GUS spot numbers in Barrel 1 and Barrel 2.
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3拟南芥和本氏烟叶片中的病原菌效应基因致死活性检测
=利用双管基因枪在拟南芥和本氏烟叶片上瞬时表达哺乳动物细胞凋亡因子BAX、大豆疫霉菌RxLR效应基因Avh238以及拟南芥霜霉菌效应基因ATR13和拟南芥抗病基因Rpp13后, GUS蓝斑指示的细胞坏死情况, GFP为对照。红色虚线划分轰击后双管基因枪2个枪孔形成的GUS蓝斑, 黑色数字代表形成的GUS蓝斑数量(Bars=5 mm)。
Figure 3Cell death induction by various pathogen effectors in Arabidopsis thaliana and Nicotiana benthamiana leaves
Mammalian apoptosis inducer BAX, RxLR effector gene Avh238 of Phytophthora sojae, effector gene ATR13 of Hyaloperonospora arabidopsidis and disease resistance gene Rpp13 of A. thaliana gene pairs were transiently expressed in leaves of A. thaliana and N. benthamiana by double-barreled particle bombardment, cell necrosis was indicated by GUS blue spots, with GFP as control. The red dotted line separates two positions produced by co-bombardment, numbers of GUS spots are indicated in black numbers (Bars=5 mm).
2.2 双管基因枪可有效降低样本的变异度
前期测试发现, 相同叶片不同部位、同一植株不同叶位或不同植株叶片间, GUS基因表达水平存在明显差异, 通常采用交换叶位和增加重复的方式减少实验误差(Kale and Tyler, 2011)。为检测双管基因枪介导的瞬时表达技术能否在拟南芥叶片上准确分析待测基因的功能, 我们首先将混合GFP和GUS质粒的微粒子弹, 轰击至拟南芥不同植株相同叶位的莲座叶片。在同一叶片上以枪筒1 (叶尖)作为处理, 枪筒2 (叶柄)作为对照, 比较直接以GUS蓝斑数量作为样本数据和以处理与对照GUS蓝斑数量比值作为样本数据并进行差异显著性分析。结果(图2A-C)显示, GUS蓝斑数量在相同叶位的不同莲座叶上差异明显, 在同一叶片不同叶位表达的GUS蓝斑数量差异不显著。在轰击参数完全相同的条件下, 左侧叶片相对表达效率较高, 枪筒1和枪筒2部位分别产生498和574个GUS斑, 而右侧叶片分别形成了140和167个GUS斑(图2A)。在2组共计20个莲座叶轰击表达GFP的测试中, 枪筒1 (Barrel 1)和枪筒2 (Barrel 2)下产生的GUS斑分别为287±149和328±164 (图2B), 2个枪筒之间无显著差异, 但是组内标准差都很大(图2B, 误差线所示)。可见, 不同叶片间GUS斑数量会形成较大极差, 所以小样本量测试中, 直接统计GUS斑数量难以准确评价目标基因的功能。若比较同一叶片2个枪筒下蓝斑数的比值, 图2A中左右2个叶片上蓝斑比率(Barrel 1/Barrel 2)分别为0.88和0.84; 在2组共计20个莲座叶测试中, 相同叶片上枪筒1和枪筒2产生GUS蓝斑的比率均值为0.86, 标准差为0.05 (图2C, 误差线所示), 有效减少了不同叶片基因表达效率差异带来的随机误差, 有助于开展较高通量的基因功能筛选。因此, 后续实验中我们以轰击后处理与对照形成GUS蓝斑数量的比值作为统计数据进行基因功能分析。
2.3 拟南芥叶片中应用双管基因枪介导瞬时表达测定效应基因功能
细胞坏死是植物抵抗病原菌入侵的一种典型表现。病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(Yoo et al., 2007), 或利用台盼蓝染色以及叶片浸出液电导率等指标分析坏死表型(Coll et al., 2010)。鉴于双管基因枪介导GFP和GUS基因在拟南芥叶片中高效表达, 我们进一步利用该技术体系评价细胞凋亡诱导基因BAX (Dou et al., 2008)、大豆疫霉(Phytophthora sojae) RxLR效应基因Avh238 (Yang et al., 2017)、致病疫霉(P. infestans)效应基因Avrblb1和对应马铃薯(Solanum tuberosum)抗病基因RB (Champouret et al., 2009)、拟南芥霜霉(Hyaloperonospora arabi- dopsidis) RXLR效应基因ATR13和对应拟南芥抗病基因Rpp13 (Sohn et al., 2007)在拟南芥叶片上诱导细胞坏死的活性。结果显示, BAX、Avh238和ATR13/Rpp13均可在拟南芥叶片中诱发细胞坏死, 表现为GUS蓝斑数量分别仅为对照GFP产生蓝斑数量的23%、17%和22% (表2), 其表达效果和实验结果与在本氏烟上的测试结果一致(图3; 表2)。此外, 统计分析结果表明, 利用相同叶片上处理和对照的比率作为样本数据, 其离散程度小, 小样本量测试(10片莲座叶)即可有效避免样本随机误差, 进而准确评价目标基因的功能(表2)。Table 2
表2
表2在拟南芥和本氏烟叶片中测试BAX、Avh238和ATR13/Rpp13诱导细胞坏死的活性
Table 2
| BAX ± SD | Avh238 ± SD | ATR13/Rpp13 ± SD | |||
|---|---|---|---|---|---|
| GFP/GFP | BAX/GFP | GFP/GFP | Avh238/GFP | ATR13 + Rpp13/GFP | |
| Arabidopsis thaliana | 0.92±0.13 | 0.23±0.13* | 0.84±0.17 | 0.94±0.15 | 0.22±0.08* |
| Nicotiana benthamiana | 1.05±0.23 | 0.13±0.07* | 0.92±0.21 | 0.94±0.10 | 0.22±0.05* |
新窗口打开|下载CSV
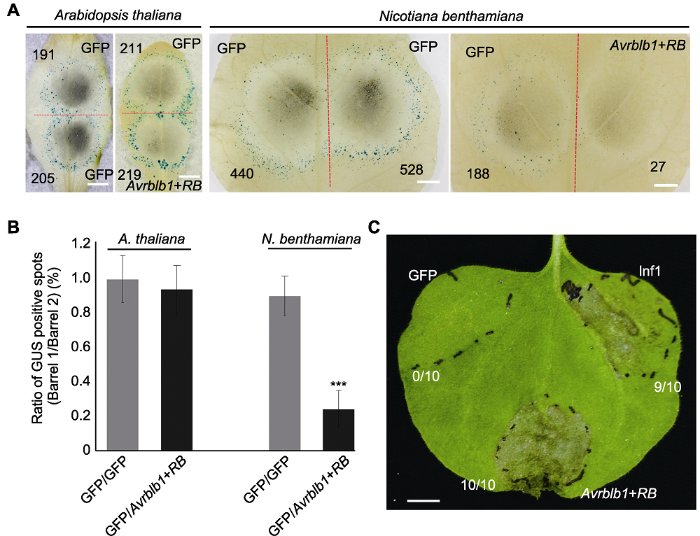
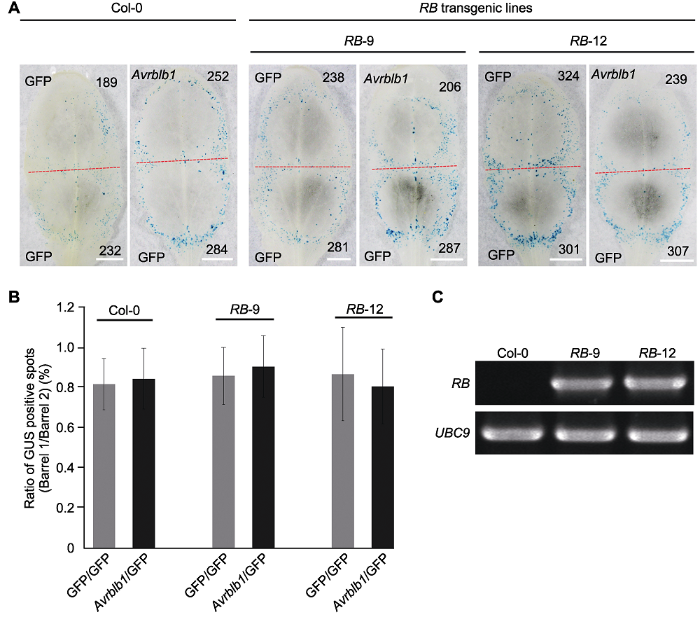
然而, 正常情况下致病疫霉效应基因Avrblb1和对应马铃薯抗病基因RB识别会诱发效应子诱导的免疫反应(effector triggered immunity, ETI), 导致细胞坏死(Champouret et al., 2009)。但本研究中, 在拟南芥叶片上共表达Avrblb1和RB并未引发坏死表型, 表达GFP和Avrblb1/RB形成的蓝斑与对照相似, 二者比率分别为0.99±0.13和0.93±0.14 (图4A, B)。同样用基因枪法在本氏烟上共表达该基因对后坏死表型显著, GFP和Avrblb1/RB形成的蓝斑比率为0.89±0.11, 对照为0.24±0.09 (图4A, B)。同时, 将Avrblb1和RB质粒转入农杆菌并在烟草叶片上进行瞬时表达, 其在10个重复中均可引起强烈的坏死表型; GFP对照所有注射位点均未出现坏死表型, 阳性对照Inf1在9个注射位点(共10个注射位点)表现出细胞坏死(图4C)。为排除Avrblb1与RB未能在同一细胞中表达, 造成细胞坏死表型丧失的可能性, 我们应用农杆菌蘸花法稳定转化抗病基因RB, 再利用双管基因枪法在拟南芥转基因株系RB-9和RB-12中瞬时表达Avrblb1, 观察并记录坏死情况。如在野生型和转基因植株(RB-9和RB-12)中, Avrblb1相较于GFP的蓝斑比率分别为0.85±0.2、0.91±0.15和0.80±0.19, 并与各自的GFP对照比率无显著差异, 表明没有明显的诱导坏死表型(图5A-C)。上述结果表明, Avrblb1与RB识别可能需要茄科植物特异的受体, 该受体在拟南芥中存在变异或缺失。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4拟南芥和本氏烟叶片中致病疫霉效应基因Avrblb1和马铃薯抗病基因RB致死活性检测
(A) 拟南芥和本氏烟中双管基因枪介导Avrblb1/Rpp13基因对瞬时表达, GFP为对照, 红色虚线划分轰击后双管基因枪2个枪孔形成的GUS蓝斑, 黑色数字指示GUS蓝斑数量(Bars=5 mm); (B) GUS蓝斑比率(拟南芥和本氏烟各10个叶片, 实验重复2次, 误差线表示±标准差)。处理与对照产生GUS斑数进行对数转换后用威尔科克森符号轶和确定统计差异, ***表示差异极显著(P<0.001); (C) 本氏烟叶片中农杆菌介导Avrblb1/RB瞬时表达, GFP为阴性对照, PAMP分子Inf1为阳性对照, 注射4天后拍照。每个处理重复注射10次(Bar=5 mm)。
Figure 4Cell death induction triggered by Avrblb1 of Phytophthora infestans and RB of Solanum tuberosum in Arabidopsis thaliana and Nicotiana benthamiana leaves
(A) Co-bombardment mediated transient expression of Avrblb1/Rpp13 gene pair in A. thaliana and N. benthamiana leaves, the red dotted line separates two positions produced by co-bombardment, numbers of GUS spots are indicated in black numbers (Bars=5 mm); (B) Ratio of GUS positive spots (ten leaves from each plant were tested, and the test was repeated twice, error bar represents ± SD). P values for treatments and the control were calculated from the log ratios using the Wilcoxon rank sum test, *** indicates extremely significant differences (P<0.001); (C) Agrobacterium-mediated transient expression of Avrblb1/RB in N. benthamiana leaves, GFP and Inf1 were used as negative and positive control, respectively. Pictures were taken 4 days post infiltration, each treatment contains 10 replicates (Bar=5 mm).
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5拟南芥RB转基因株系RB-9和RB-12中效应基因Avrblb1致死活性检测
(A) 在拟南芥RB转基因株系RB-9和RB-12中瞬时表达Avrblb1后GUS报告基因表达分析, GFP为对照(红色虚线划分轰击后双管基因枪2个枪孔形成的GUS蓝斑, 黑色数字指示GUS蓝斑数量(Bars=5 mm)); (B) 在拟南芥RB转基因株系中瞬时表达Avrblb1基因后的GUS蓝斑数量统计(拟南芥和本氏烟各10片叶, 实验重复2次, 处理与对照产生GUS斑数进行对数转换后用威尔科克森符号轶和确定统计差异(误差线表示±标准差, P>0.1)); (C) 利用RT-PCR检测拟南芥RB转基因株系RB-9和RB-12中RB基因的表达, UBC9为内参基因。
Figure 5Measurement of cell death induction by effector gene Avrblb1 in Arabidopsis transgenic line RB-9 and RB-12
(A) Co-bombardment mediated transient expression of Avrblb1 in transgenic lines RB-9 and RB-12, with GFP as control (the red dotted line separates two positions produced by co-bombardment, numbers of GUS spots are indicated in black numbers (Bars=5 mm)); (B) The diagram showed that transient expression of Avrblb1 in RB transgenic lines (ten leaves of each plant were tested, and the test was repeated twice, P values for treatments and the control were calculated from the log ratios using the Wilcoxon rank sum test (error bar represents ± SD, P>0.1)); (C) The RT-PCR detection of RB expressed in transgenic line RB-9 and RB-12, UBC9 was used as the reference gene.
2.4 讨论
相对于稳定遗传转化, 瞬时转化技术具有省时高效的特点, 更有利于高效开展目标基因的功能筛选(Mangano et al., 2014)。然而, 拟南芥由于叶片小、瞬时转化效率低以及亲和性等问题, 研究人员更多地选择在本氏烟上进行目标基因的瞬时转化, 导致无法利用拟南芥丰富的遗传资源。传统基因枪介导的基因瞬时表达受到供试植物个体、微粒子弹吸附DNA以及轰击时微粒子弹加速过程的影响, 导致转化效率大幅波动。在非大量重复的前提下, 这种随机产生的误差会干扰对目标基因(如效应基因)真实变化(如GUS蓝斑数量)的准确判断和评价。而双管基因枪技术一次轰击可以在相同的植物组织上同时实现2个基因的转化, 其中之一引入对照基因, 既可以有效控制样本内由不同批次的轰击过程导致的随机误差, 同时也规避了植物个体差异导致的数据极差增大, 克服了基因枪介导的瞬时转化技术缺陷。该技术已经成功应用于烟草、大豆与病原菌效应子相互作用研究中, 但在拟南芥中尚无应用报道。
在植物与病原物互作研究中, 经常需要引入模式植物拟南芥及其突变体来研究受病原物攻击或利用的植物蛋白以及相关信号通路的机理。因此, 我们尝试将该技术应用于拟南芥瞬时转化中, 以便更多地利用拟南芥的遗传资源高效推进相关研究工作。但由于拟南芥叶片较小, 正常培养条件下其叶面积无法满足双管基因枪轰击后的覆盖区域。我们采用低温、高湿、短日照等手段促进拟南芥营养生长, 可有效增大莲座叶片的叶面积, 从而满足实验要求。同时, 细胞坏死诱导基因BAX、Avh238以及效应基因与抗病基因对ATR13/Rpp13的高效表达, 为后续高效筛选抑制植物免疫反应的候选基因建立了良好体系。然而, 并非所有的病原菌效应基因都可以通过基因枪法在拟南芥叶片中进行瞬时表达进而分析其功能, 如本研究中致病疫霉效应基因Avrblb1和马铃薯抗病基因RB。二者在马铃薯和烟草体系中可以相互识别, 引起细胞过敏性坏死反应, 但在拟南芥中二者丧失了引发细胞坏死的活性, 可能Avrblb1-RB诱导的ETI反应需要茄科植物特异的受体介导。因此, 建议不要应用单一的表达体系分析基因功能, 以避免体系差异造成对实验结果的误判。
双管基因枪介导的瞬时表达体系具有高效地将多个质粒共转入同一植物细胞的优点, 可作为原生质体和农杆菌介导瞬时表达系统以外的另一种基因高效表达方法, 实现在拟南芥及其相关突变体中高通量准确评价候选基因的生物学功能。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
In: McDowell J, ed.
[本文引用: 4]
[本文引用: 1]
In: Sanchez-Serrano JJ, Salinas J, eds.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
Phytophthora infestans isolates lacking class I ipiO variants are virulent on Rpi-blb1 potato
2
2009
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
... 然而, 正常情况下致病疫霉效应基因Avrblb1和对应马铃薯抗病基因RB识别会诱发效应子诱导的免疫反应(effector triggered immunity, ETI), 导致细胞坏死(
Arabidopsis type I metacaspases control cell death
1
2010
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
Phytophthora sojae avirulence effector Avr3b is a secreted NADH and ADP-ribose pyrophosphorylase that modulates plant immunity
1
2011
... 利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差.改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差.即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(
Conserved C-terminal motifs required for avirulence and suppression of cell death by Phytophthora sojae effector Avr1b
3
2008
... 利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差.改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差.即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(
... 以同一叶片上测试质粒和对照质粒轰击后形成蓝斑数量的比值作为样本数据, 采用威尔科克森符号轶和检验(Wilcoxon rank sum test)进行统计分析(
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
Rust secreted protein Ps87 is conserved in diverse fungal pathogens and contains a RXLR-like motif sufficient for translocation into plant cells
1
2011
... 分别扩增GFP、Inf1、Avrblb1和RB目标基因, 再连入经改造的pCambia1300 (35S-NOS)载体.用农杆菌GV3101介导GFP、Inf1和Avrblb1/RB在6-8周的本氏烟叶片上进行瞬时表达, 具体步骤参照
Assaying effector function in Planta using double-barreled particle bombardment
4
2011
... 利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差.改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差.即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(
... 轰击转化叶片培养2-3天后进行GUS染色, 染液参照
... 以同一叶片上测试质粒和对照质粒轰击后形成蓝斑数量的比值作为样本数据, 采用威尔科克森符号轶和检验(Wilcoxon rank sum test)进行统计分析(
... 前期测试发现, 相同叶片不同部位、同一植株不同叶位或不同植株叶片间, GUS基因表达水平存在明显差异, 通常采用交换叶位和增加重复的方式减少实验误差(
The development of Arabidopsis as a model plant
1
2010
... 在农作物生长发育和抗逆相关研究中, 由于作物自身特点等客观条件的限制, 需要借助模式植物异源表达验证目标基因的功能.拟南芥(Arabidopsis thaliana)是植物科学研究中的经典模式植物, 具有十分广泛的研究基础和极为丰富的突变体资源, 不但为作物增产和抗逆相关基因功能研究提供了宝贵的资源, 也作为遗传操作性强的介体材料被引入众多实验体系中, 在农业科学基础研究中发挥重要的桥梁作用(
Agrobacterium tumefaciens-mediated transient transformation of Arabidopsis thaliana leaves
1
2014
... 相对于稳定遗传转化, 瞬时转化技术具有省时高效的特点, 更有利于高效开展目标基因的功能筛选(
The downy mildew effector proteins ATR1 and ATR13 promote disease susceptibility in Arabidopsis thaliana
1
2007
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
An efficient Agrobacterium-mediated transient transformation of Arabidopsis
1
2012
... 瞬时表达技术作为高效、便捷的基因功能分析手段在植物中广泛使用.应用于拟南芥的基因瞬时表达技术主要包括原生质体转化法、农杆菌(Agrobacterium tumefaciens)介导的基因瞬时转化法和基因枪法.用原生质体转化法直接处理单个细胞, 易于观测目标基因产生的表型, 但原生质体缺乏完整细胞壁结构, 有限的再生率会限制细胞周期调控相关研究(
Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment
1
2009
... 瞬时表达技术作为高效、便捷的基因功能分析手段在植物中广泛使用.应用于拟南芥的基因瞬时表达技术主要包括原生质体转化法、农杆菌(Agrobacterium tumefaciens)介导的基因瞬时转化法和基因枪法.用原生质体转化法直接处理单个细胞, 易于观测目标基因产生的表型, 但原生质体缺乏完整细胞壁结构, 有限的再生率会限制细胞周期调控相关研究(
Transcriptional programming and functional interactions within the Phytophthora sojae RXLR effector repertoire
1
2011
... 利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差.改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差.即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(
TaDAD2, a negative regulator of programmed cell death, is important for the interaction between wheat and the stripe rust fungus
1
2011
... 利用传统基因枪系统(BIO-RAD PDS1000)对基因功能进行定量分析时, 需要设置大量重复以避免因金属粒子间不均匀的分布与加速, 以及受轰击个体材料间差异所造成的误差.改进的双管基因枪通过同步轰击处理和对照样品, 解决了上述2个因素带来的误差.即在少数重复的情况下, 实现目标基因功能较为准确的定量分析(
Arabidopsis: a Laboratory Manual
1
2011
... 以拟南芥Col-0生态型为受体植物, 采用农杆菌蘸花法稳定转化抗病基因RB.获得T0代的转化种子后, 利用含对应抗生素的平板培养基进行筛选, 移栽正常生长的植株并通过RT-PCR检测转基因植株中目的基因的表达, 将含有RB基因的植株留种待用, 具体步骤参照
Distinct regions of the Phytophthora essential effector Avh238 determine its function in cell death activation and plant immunity suppression
1
2017
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis
2
2007
... 瞬时表达技术作为高效、便捷的基因功能分析手段在植物中广泛使用.应用于拟南芥的基因瞬时表达技术主要包括原生质体转化法、农杆菌(Agrobacterium tumefaciens)介导的基因瞬时转化法和基因枪法.用原生质体转化法直接处理单个细胞, 易于观测目标基因产生的表型, 但原生质体缺乏完整细胞壁结构, 有限的再生率会限制细胞周期调控相关研究(
... 细胞坏死是植物抵抗病原菌入侵的一种典型表现.病原菌入侵后这种抗性反应在茄科植物叶片上表现为明显的坏死斑, 但在拟南芥叶片上细胞坏死表型常难以辨认, 因此通常借助荧光素酶(LUC)、β-葡萄糖苷酸酶(GUS)和荧光蛋白(GFP)等报告基因(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
