 ,*, 周俭民中国科学院遗传与发育生物学研究所, 北京 100101
,*, 周俭民中国科学院遗传与发育生物学研究所, 北京 100101Luciferase Complementation Assay for Detecting Protein Interactions
Yan Zhao ,*, Jianmin ZhouInstitute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China
,*, Jianmin ZhouInstitute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China通讯作者:
责任编辑: 朱亚娜
收稿日期:2019-11-24接受日期:2019-12-2网络出版日期:2020-01-01
| 基金资助: |
Corresponding authors:
Received:2019-11-24Accepted:2019-12-2Online:2020-01-01

摘要
关键词:
Abstract
Keywords:
PDF (1554KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
赵燕, 周俭民. 萤火素酶互补实验检测蛋白互作. 植物学报, 2020, 55(1): 69-75 doi:10.11983/CBB19229
Zhao Yan, Zhou Jianmin.
蛋白质作为生命体的基本组分, 是细胞功能的最终执行者。研究蛋白质-蛋白质相互作用是理解生命活动的基础。目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(Morsy et al., 2008; 徐重益, 2020)。不同的蛋白互作研究技术各有优缺点。酵母双杂交技术适合进行高通量蛋白质互作的筛选, 但自身有转录功能的蛋白会造成假阳性的发生, 且不利于核外蛋白的研究(Fields and Song, 1989; Causier, 2004)。基于抗原-抗体反应的免疫共沉淀是研究蛋白相互作用的经典方法, 常被用于鉴定特定蛋白复合物中未知的蛋白组分, 缺点是两种蛋白质的结合可能不是直接结合, 且实验过程比较繁琐, 对实验者的操作技术要求较高。利用双分子荧光互补技术可直观、快速判断目标蛋白在活细胞中的定位和相互作用, 但其片段的自发互补会导致假阴性和假阳性的发生(Hu et al., 2002; Bhat et al., 2006)。此外, 荧光共振能量转移技术广泛用于研究蛋白分子间的距离及其相互作用, 相对于双分子荧光互补技术, 荧光共振能量转移技术需要更精密的仪器, 且操作更复杂(Ha et al., 1996; Bhat et al., 2006)。萤火素酶互补实验(Luciferase Complementation Assay, LCA)则因其高灵敏度、可定量化、操作简单高效被广泛应用于植物学和动物学蛋白质互作研究(Fujikawa and Kato, 2007; Chen et al., 2008; Zhou et al., 2018)。
萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(Luker et al., 2004), 后来用于检测植物蛋白质-蛋白质的相互作用(Fujikawa and Kato, 2007; Chen et al., 2008; Li et al., 2014; Zhou et al., 2018)。其实验原理是以萤火素(luciferin)为底物来检测萤火素酶(luciferase)的活性。具体而言, 生物体来源的萤火素酶催化底物萤火素发生氧化, 发出最强波长在560 nm左右的生物荧光(bioluminescence)。目前, 应用最为广泛的萤火素酶基因来源于北美萤火虫(firefly luciferase), 该基因编码550个氨基酸组成的萤火素酶蛋白(大小为62 kDa)。实验中, 萤火素酶蛋白被切成N端和C端2个功能片段, 即NLuc (2-416 aa)和CLuc (398-550 aa) (Luker et al., 2004; Chen et al., 2008)。在一个实验体系中, 待检测的2个目标蛋白分别与NLuc和CLuc融合, 如果2个目标蛋白相互作用, 则萤火素酶的NLuc和CLuc在空间上会足够靠近并正确组装, 从而发挥萤火素酶活性, 即分解底物产生荧光(Fujikawa and Kato, 2007; Chen et al., 2008; Zhou et al., 2018)。
本实验借助烟草(Nicotiana benthamiana)瞬时表达系统, 将含有融合蛋白的植物表达载体转化农杆菌(Agrobacterium tumefaciens)后注射烟草叶片。24-48小时后, 加入反应底物萤火素, 利用植物活体分子影像系统(CCD imaging system)或luminometer来定性定量检测荧光强度, 以判定目标蛋白之间是否存在相互作用及互作的程度。
1 实验材料
实验材料为4周苗龄的本氏烟草(Nicotiana benthamiana L.)。2 试剂及用具
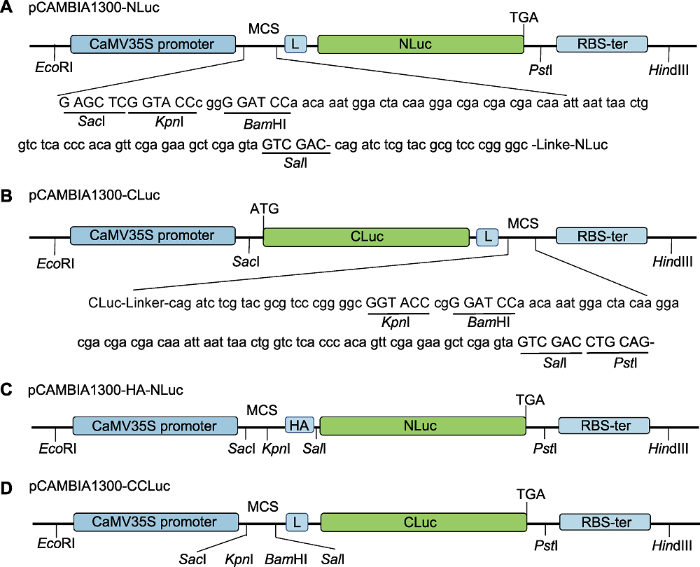
• 目标蛋白基因序列• pCAMBIA1300-NLuc (pNL)质粒(图1A)
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1表达载体示意图
(A) pCAMBIA1300-NLuc (pNL); (B) pCAMBIA1300-CLuc (pCL); (C) pCAMBIA1300-HA-NLuc (pHNL); (D) pCAMBIA1300-CCLuc (pCCL)。构建的表达载体中均包含pCAMBIA1300骨架, NLuc位于目标基因C末端, CLuc位于目标基因的N末端或C末端; 序列中显示的是单酶切位点。MCS: 多克隆酶切位点; L: 连接序列; RBS: 转录终止子; ATG: 翻译起始密码子; TGA: 翻译终止密码子; HA: 标签蛋白
Figure 1Plasmid maps
(A) pCAMBIA1300-NLuc (pNL); (B) pCAMBIA1300-CLuc (pCL); (C) pCAMBIA1300-HA-NLuc (pHNL); (D) pCAMBIA1300-CCLuc (pCCL). All the vectors have a framework of pCAMBIA1300 and allow expression of the target genes with a C-terminal NLuc fusion and N-terminal or C-terminal CLuc fusion. Unique sites are shown in sequence. MCS: Multiple cloning sites; L: Linker sequence; RBS: Transcription terminator; ATG: Translation initiation codon; TGA: Translation stop codon; HA: Tag protein
• pCAMBIA1300-CLuc (pCL)质粒(图1B)
• 农杆菌感受态细胞(GV3101)
• 蛋白提取液
• LB培养基
• 1/2MS培养基(PhytoTechnology Laboratories, Cat No.M519)
• 乙酰丁香酮(Sigma, Cat No.2478-38-8)
• 萤火素(D-luciferin) (Biovision, Cat No.7903; 100 mmol∙L-1母液于-80°C保存, 使用浓度为1 mmol∙L-1)
• Anti-luciferase antibody (Sigma, Cat No.L0159)
• Anti-CLuc antibody (Sigma, Cat No.L2164)
• Anti-HA antibody (CWBIO, Cat No.CW0092)
• 1 mL注射器
• 小喷雾器(5 mL)
• 打孔器(直径0.6 cm)
• 96孔酶标板(Corning)
3 试剂配方
• 蛋白提取液: 50 mmol∙L-1 HEPES, pH7.5, 150 mmol∙L-1 KCl, 1 mmol∙L-1 EDTA, 0.5% Triton X-100 (Amresco, Cat No.9002-93-1), 1 mmol∙ L-1 DTT, 1× protease inhibitors (Roche, Cat No.30827-99-7), 现用现配。4 仪器设备
• 植物活体分子影像系统(Night SHADE LB 985, Berthold Technologies)• Luminometer (EnSpire R_Multimode Plate Reader, PerkinElmer)
• 蛋白电泳系统(Bio-Rad)及暗室
• 28°C摇床(New Brunswick Scientific)
• 28°C培养箱(Memmert)
• 分光光度计(Beckman Coulter)
• 离心机(Eppendorf 5417R)
5 实验程序
5.1 融合蛋白表达载体的构建
(1) 植物表达载体如图1(A-D)所示。利用pCAMBIA1300-NLuc (pNL)和pCAMBIA1300-CLuc (pCL)中的酶切位点(Chen et al., 2008; Zhou et al., 2018), 将目标基因与报告基因融合, 获得含有目标基因的重组质粒(Struhl, 2001)。(2) 将构建好的重组质粒分别转化农杆菌感受态细胞(GV3101), 28°C恢复培养40分钟, 涂于LB板上(含50 μg·mL-1卡那霉素和50 μg·mL-1庆大霉素), 28°C培养过夜(Potter and Heller, 2011)。
5.2 烟草注射
(1) 挑取转化有重组质粒的农杆菌单菌落, 接种到2 mL LB液体培养基中(含50 μg·mL-1卡那霉素和50 μg·mL-1庆大霉素), 28°C 220 rpm培养过夜。(2) 农杆菌培养至OD600为1.0, 1 700 ×g离心5分钟收集菌体后, 用1/2MS液体培养基清洗菌体2次; 用含有150 μmol∙L-1乙酰丁香酮的1/2MS液体培养基将每种菌的OD600值调至1.0。实际操作中, 可以用无菌水代替1/2MS液体培养基。
(3) 将待检测的2种农杆菌菌液按照1:1体积比进行混合, 使每种菌液的OD600值为0.5。
(4) 选取生长期为1个月左右完全伸展的烟草叶片(图2A), 将混合好的菌液用1 mL注射器(去掉针头)从烟草叶背面进行注射。为保证实验结果的一致性, 需要将对照载体和待检测目标载体的菌液注射在同一叶片的不同部位上, 以保证相同的生长背景(图2B, D); 相同的菌液至少注射3-5枚烟草叶片以利于后续的实验观察。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2萤火素酶互补实验示意图
(A) 选取4周龄完全伸展的烟草叶片进行农杆菌注射, 24-48小时后取样观察(Bar=2 cm); (B) 截取完整的农杆菌注射后的烟草叶片, 叶背向上平放于培养皿中(Bar=1 cm); (C) 利用植物活体分子影像系统检测烟草叶片的发光情况并拍照; (D) 选取农杆菌注射后的烟草叶片, 置于培养皿中用打孔器打孔(Bar=1 cm); (E) 将直径为0.6 cm的烟草圆片置于装有200 μL无菌水的96孔酶标板中; (F) 利用luminometer检测烟草叶片的荧光强度。图中圆圈示农杆菌注射部位。
Figure 2Schematic diagram of the Luciferase Complementation Assay
(A) Select fully expanded young leaves of Nicotiana benthamiana (four-week old) for Agrobacterium injection, observe after 24-48 h (Bar=2 cm); (B) Cut the infiltrated tobacco leaves and put them into the petri dish (Bar=1 cm); (C) Use CCD imaging system to detect the luminescence of the complete tobacco leaves and captured the pictures; (D) Select infiltrated leaves for punch (Bar=1 cm); (E) Punch tobacco leaf discs of 0.6 cm in diameter from infiltrated leaf areas by a cork borer and place leaf discs in a 96-well plate containing 200 μL sterile water in each well; (F) Use luminometer to scan the fluorescence intensity of the tobacco leaves. The circles show the injection sites of Agrobacterium.
(5) 正常温室生长条件下, 24-48小时即可取样观察。为保证蛋白在烟草叶片中的表达效果, 可以通过加盖塑料壳来保持湿度。
5.3 萤火素酶活性观察
萤火素酶活性观察分为定性检测和定量检测, 分别利用植物活体分子影像系统(CCD imaging system)和luminometer来进行检测。植物活体分子影像系统是将蛋白质间的互作以图像的形式呈现出来, 简单直观, 即定性观察(Lin et al., 2015) (图2C); 而luminometer检测则是将样品置于96孔酶标板中, 通过扫描荧光的强度来判定蛋白之间是否互作及互作的强度(图2E, F)。5.3.1 植物活体成像系统定性检测萤火素酶活性
(1) 选取注射农杆菌24-48小时后的烟草叶片, 用含1 mmol∙L-1萤火素底物D-luciferin的反应液喷湿叶片背面; 将烟草植株在黑暗中静置7分钟。
(2) 截取烟草叶片, 将其反面向上置于培养皿中(图2B), 移入植物活体成像系统中检测发光情况(图2C)。如果有发光, 即说明待测蛋白之间存在互作。为了保证实验的准确性和一致性, 同一株烟草至少选取3个重复进行荧光检测, 此操作重复3次。
(3) 根据实验结果调整曝光强度并拍照(图3A)。
图3
 新窗口打开|下载原图ZIP|生成PPT
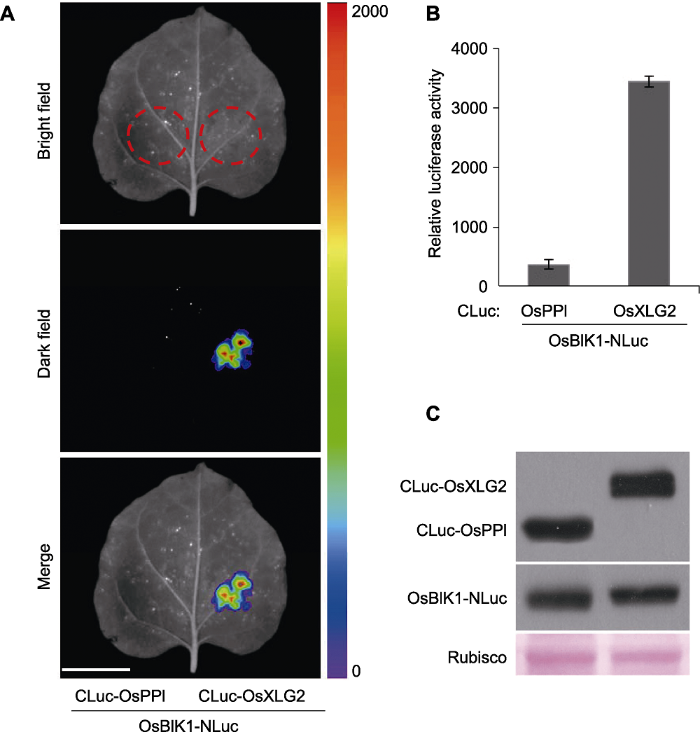
新窗口打开|下载原图ZIP|生成PPT图3蛋白质OsXLG2-OsBIK1互作实例
将分别含有CLuc-OsXLG2和OsBIK1-NLuc质粒的农杆菌液1:1体积比混合后注射4周龄烟草叶片, 24-48小时后进行检测, 以CLuc-OsPPI和OsBIK1-NLuc作为负对照(未发表)。(A) 利用植物活体成像系统采集烟草叶片的发光图像(Bar=2 cm); (B) 使用luminometer检测萤火素酶活性, 误差表示平均值的标准偏差(n=8); (C) Western blot检测CLuc和NLuc融合蛋白的表达, 融合蛋白分别用anti-luciferase和anti-CLuc抗体来检测。
Figure 3An example of dynamic OsXLG2-OsBIK1 interactions
Four-week old Nicotiana benthamiana leaves co-infiltrated with Agrobacterium expressing CLuc-OsXLG2 and OsBIK1-NLuc. CLuc-OsPPI and OsBIK1-NLuc are used as negative control (unpublished). (A) The luminescence images were captured using a CCD imaging system (Bar=2 cm); (B) The luciferase activity measurement using a luminometer, the error bars represent the standard deviation from the mean (n=8); (C) Western blot analysis of the expressed proteins of CLuc- and NLuc- fusions, the fusions are detected using anti-luciferase and anti-CLuc antibodies, respectively.
5.3.2 luminometer定量检测荧光强度
(1) 选取注射农杆菌40-48小时后的烟草叶片(图2D), 用打孔器(直径约0.6 cm)打孔, 将烟草圆片转移到含有200 μL无菌水的白色96孔酶标板中(图2E)。为了保证实验的准确性, 同一烟草注射部位至少设8个重复。
(2) 用排枪移走96孔酶标板内的无菌水, 加入200 μL含有1 mmol∙L-1萤火素底物的反应液, 孵育5-10分钟。在操作过程中移液器的枪头尽量不要触碰叶片, 避免应激反应。
(3) 使用luminometer进行荧光扫描, 扫描间隔时间为0.5秒, 25-40个循环(图2F)。
(4) 根据扫描的数值绘制柱形图, 以显示萤火素酶分解底物后产生荧光的强度, 判断目标蛋白之间的互作程度(图3B)。此实验重复3次。
5.4 蛋白检测
(1) 将等量检测后的烟草叶片置于1.5 mL离心管中, 加入400 μL蛋白裂解液, 用研磨棒研碎叶片, 或置于研钵中研磨以破碎细胞。(2) 取破碎后的样品进行离心, 收集上清液, 加入4×蛋白上样缓冲液, 100°C煮5分钟, 离心收集蛋白提取液。
(3) 利用常规方法, 通过SDS-PAGE胶分离蛋白, western-blot (WB)检测蛋白表达(Ni et al., 2016)。含有NLuc的融合蛋白可以用anti-luciferase抗体检测; 连有CLuc的融合蛋白可以通过anti-CLuc抗体来检测(图3C)。
6 注意事项
(1) 表达载体的选用。融合蛋白质的正确表达是实验成功的关键。首先, 构建的重组质粒要通过测序保证目标基因与报告基因在同一个阅读框; 其次, 由于不同蛋白质在行使功能时空间构象的变化及其在细胞中的定位不同, 需要考虑选择目标蛋白的哪一个末端与报告蛋白进行融合, 如NLuc只能位于目标蛋白的C末端(图1A), 而Cluc既可位于目标蛋白的N末端(pCL) (图1B), 也可以位于目标蛋白的C末端(pCAMBIA1300-CCLuc, pCCL) (图1D)。此外, 由于anti-luciferase抗体既可以检测NLuc片段, 也可以检测CLuc片段, 为了更有效地区分NLuc和CLuc融合蛋白, 表达载体pCAMBIA1300-HA-NLuc (pHNL)中增加了3XHA标签, 可直接用HA抗体来检测NLuc融合蛋白的表达(图1C)。
(2) 表达载体的构建。随着克隆技术的不断改进, 受目标基因酶切位点的限制, 推荐大家使用In-fusion反应进行载体构建, 具体方法参阅试剂盒使用说明书(In-Fusion HD Cloning Kit) (Takara, Cat No.639650)。
(3) 正负对照的设定。理论上, 每次实验应该设置正负对照以检测实验体系的可行性。建议选用已经发表的并证明在同一个蛋白复合体中互作的蛋白质对作为正对照; 空载体pNL和pCL不能作为负对照, 因为pNL中NLuc序列起始端没有翻译起始密码子, pCL的CLuc序列末端没有翻译终止密码子; 理想的负对照应该选用与待检测蛋白具有相似的亚细胞定位, 但并不互作的蛋白质, 或者选择没有活性的待检测目标蛋白(如突变后)。
(4) 蛋白检测表达的重要性。判定蛋白之间的互作是建立在融合蛋白都可以正确表达的基础之上, 只有各融合蛋白都正确表达才能判断目标蛋白之间是否存在相互作用。如果待测蛋白没有发生互作, 即使正负对照都正常表达, 应首先利用WB来检测待测目标蛋白质对在瞬时表达体系中是否表达及表达的丰度。
(5) 大规模蛋白质互作的筛选和验证。LCA可以定性检测和定量检测蛋白质的互作(Li et al., 2011)。利用luminometer进行荧光检测时, 96孔酶标板可以同时检测12对蛋白的互作(包括正、负对照), 且每一对样品有8个重复, 因此操作简单、便捷, 结果可靠。此外, 利用luminometer还可以检测不同处理条件下目标蛋白质对的互作变化情况, 如冷、光的刺激、盐反应及添加各种激素和化学信号分子(Zhou et al., 2018)。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 5]
[本文引用: 1]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 5]
植物中验证蛋白相互作用的Pull-down和Co-IP技术
1
2020
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
The visible touch: in planta visualization of protein-protein interactions by fluorophore-based methods
2
2006
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
... ;
Studying the interactome with the yeast two-hybrid system and mass spectrometry
1
2004
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
Firefly luciferase complementation imaging assay for protein-protein interactions in plants
5
2008
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
... 萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(
... ;
... ;
... (1) 植物表达载体如
A novel genetic system to detect protein-protein interactions
1
1989
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
TECHNICAL ADVANCE: split luciferase complementation assay to study protein-protein interactions in Arabidopsis protoplasts
3
2007
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
... 萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(
... ).在一个实验体系中, 待检测的2个目标蛋白分别与NLuc和CLuc融合, 如果2个目标蛋白相互作用, 则萤火素酶的NLuc和CLuc在空间上会足够靠近并正确组装, 从而发挥萤火素酶活性, 即分解底物产生荧光(
Probing the interaction between two single molecules: fluorescence resonance energy transfer between a single donor and a single acceptor
1
1996
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation
1
2002
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
Large-scale protein-protein interaction analysis in Arabidopsis mesophyll protoplasts by split firefly luciferase complementation
1
2011
... (5) 大规模蛋白质互作的筛选和验证.LCA可以定性检测和定量检测蛋白质的互作(
The FLS2-associated kinase BIK1 directly phosphorylates the NADPH oxidase RbohD to control plant immunity
1
2014
... 萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(
PBL13 is a serine/threonine protein kinase that negatively regulates Arabidopsis immune responses
1
2015
... 萤火素酶活性观察分为定性检测和定量检测, 分别利用植物活体分子影像系统(CCD imaging system)和luminometer来进行检测.植物活体分子影像系统是将蛋白质间的互作以图像的形式呈现出来, 简单直观, 即定性观察(
Kinetics of regulated protein-protein interactions revealed with firefly luciferase complementation imaging in cells and living animals
2
2004
... 萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(
... ).其实验原理是以萤火素(luciferin)为底物来检测萤火素酶(luciferase)的活性.具体而言, 生物体来源的萤火素酶催化底物萤火素发生氧化, 发出最强波长在560 nm左右的生物荧光(bioluminescence).目前, 应用最为广泛的萤火素酶基因来源于北美萤火虫(firefly luciferase), 该基因编码550个氨基酸组成的萤火素酶蛋白(大小为62 kDa).实验中, 萤火素酶蛋白被切成N端和C端2个功能片段, 即NLuc (2-416 aa)和CLuc (398-550 aa) (
Charting plant interactomes: possibilities and challenges
1
2008
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
Protein blotting: immunoblotting
1
2016
... (3) 利用常规方法, 通过SDS-PAGE胶分离蛋白, western-blot (WB)检测蛋白表达(
Transfection by electroporation
1
2011
... (2) 将构建好的重组质粒分别转化农杆菌感受态细胞(GV3101), 28°C恢复培养40分钟, 涂于LB板上(含50 μg·mL-1卡那霉素和50 μg·mL-1庆大霉素), 28°C培养过夜(
Subcloning of DNA fragments
1
1991
... (1) 植物表达载体如
Luciferase complementation assay for protein-protein interactions in plants
5
2018
... 蛋白质作为生命体的基本组分, 是细胞功能的最终执行者.研究蛋白质-蛋白质相互作用是理解生命活动的基础.目前, 研究蛋白质互作的方法除了体外的Pull-down技术外, 生物体内检测蛋白互作的方法有酵母双杂交(Yeast Two-hybrid, Y2H)、免疫共沉淀(Co-Immunoprecipitation, Co-IP)、双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)及荧光共振能量转移技术(Fluorescence Resonance Energy Transfer, FRET)等(
... 萤火素酶互补实验最初应用于哺乳动物细胞内蛋白质互作研究(
... ;
... (1) 植物表达载体如
... (5) 大规模蛋白质互作的筛选和验证.LCA可以定性检测和定量检测蛋白质的互作(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
