 ,3,*
,3,*An Quick and Efficient Assay for In Vivo Protein Ubiquitination
Lijing Liu1, Qingzhen Zhao2, Qi Xie3,4, Feifei Yu ,3,*
,3,*通讯作者:
责任编辑: 白羽红
收稿日期:2019-08-12接受日期:2019-09-24网络出版日期:2019-11-01
| 基金资助: |
Corresponding authors:
Received:2019-08-12Accepted:2019-09-24Online:2019-11-01

摘要
关键词:
Abstract
Keywords:
PDF (1333KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
刘利静, 赵庆臻, 谢旗, 于菲菲. 快速高效检测植物体内蛋白泛素化修饰研究方法. 植物学报, 2019, 54(6): 753-763 doi:10.11983/CBB19153
Liu Lijing, Zhao Qingzhen, Xie Qi, Yu Feifei.
泛素化是蛋白质发挥生物学功能的重要调节机制。蛋白泛素化能够调节短寿命蛋白或非正常折叠蛋白的稳定性、改变蛋白质的亚细胞定位以及蛋白质的组装和蛋白活性等(Vierstra, 2012; Proietto et al., 2015)。在拟南芥(Arabidopsis thaliana)中, 涉及泛素化途径的蛋白质占总蛋白的5%, 可见泛素化修饰在植物生长过程中发挥非常广泛而重要的作用(Vierstra, 2003; Smalle and Vierstra, 2004)。蛋白泛素化由其特异的泛素激活酶(E1)、泛素耦联酶(E2)和泛素连接酶(E3)催化的级联反应完成, 而底物的特异性主要由泛素连接酶决定。因此, 建立有效的泛素连接酶/底物特异性检测体系, 对了解泛素化修饰系统在植物的生理生化过程中的调控机制非常重要。
一般而言, 植物学家通过3个方面的实验来证明某个蛋白质是某一泛素连接酶的底物: (1) 体内或体外实验证明二者的相互作用; (2) 体外的泛素化实验证明泛素连接酶可以将泛素分子加在目的蛋白上; (3) 在泛素连接酶的突变体中检测到目的蛋白量的增加, 或者在泛素连接酶的过表达植株中检测到目的蛋白量的降低, 并且泛素连接酶和目的蛋白二者的突变体具有相反的表型。例如, Yeast two-hybrid实验和体外pull down实验证明, 参与生长素信号途径的SINAT5和NAC1这对泛素连接酶/底物有相互作用; 体外泛素化实验证明SINAT5可以泛素化修饰NAC1; 在SINAT5无功能突变形式蛋白表达的植株中, NAC1的蛋白量明显增加。由此证明, NAC1特异性地被SINAT5降解, 是SINAT5的底物(Xie et al., 2002)。此外, Liu和Stone (2010)报道的参与ABA信号途径的泛素连接酶/底物蛋白KEG (keep on going)/ABI5 (ABA insensitive 5): 体外pull down实验证明二者相互作用; 体外泛素化实验证明KEG可以泛素化修饰ABI5; 表型上KEG是ABA信号途径的负调控因子, 该基因的缺失使植株对ABA更加敏感, 而ABI5是ABA信号的正调控因子, 缺失ABI5之后植物对ABA产生抗性, 并且在keg突变体中ABI5大量积累(Stone et al., 2006; Liu and Stone, 2010)。
用上述方法来证明泛素连接酶和底物的特异性是可信的, 但其不足之处也显而易见。一方面, 体外泛素化反应很难被检测, 这从KEG对ABI5的修饰上就可以证实。2006年已报道KEG可能通过降解ABI5来调节ABA信号途径, 但直到2010年KEG体外泛素化修饰ABI5才见报道。而且, 体外泛素化反应自身存在局限性, 可能产生假阳性或假阴性结果。体外反应将定位于不同细胞器的泛素连接酶和目的蛋白人为地置于同一个空间, 导致产生假阳性结果。假阴性是由于体外泛素化反应所用蛋白质是在大肠杆菌中表达的, 而这些原核系统中表达的蛋白质由于缺乏泛素连接酶或底物蛋白发挥功能所必需的修饰(如磷酸化修饰), 可能不具有活性或不能被泛素化(赵庆臻等, 2019)。另一方面, 转基因植物的获得需要几个月到1年的时间, 并且由于蛋白质的表达量通常较低, 底物蛋白量在泛素连接酶突变体或者高表达植株中的变化并不是总能被检测到。为了避免这些问题, 科学家采用原生质体瞬时表达技术。例如, 在证明参与植物干旱胁迫信号转导的泛素连接酶/底物对Rma1H1 (RING membrane-anchor 1 homolog 1)/PIP2; 1 (plasma membrane intrinsic protein 2;1)时, 用原生质体瞬时表达实验证明共同转化Rma1H1后PIP2;1的蛋白量降低, 并且用同样的方法证明Rma1H1可以增强PIP2;1蛋白的泛素化(Lee et al., 2009)。采用瞬时表达法检测泛素连接酶和底物蛋白的特异性借鉴了动物学的经验(Fang et al., 2000; Chen et al., 2008), 弥补了上述传统方法的不足。但原生质体转化实验步骤繁琐, 每次得到的样品量较少, 并且很多蛋白质表达量并不高。因此, 需要探索其它瞬时表达手段来代替。
在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(Goodin et al., 2002; Lee et al., 2009; Ueki et al., 2009)。其中, 最简单易行的是农杆菌注射法。首先将目的基因构建于植物表达载体上; 再将重组质粒转化农杆菌; 最后将所得的重组农杆菌悬浮液直接注射入植物叶片; 至少1天后即可观测基因的表达。农杆菌注射的方法已用于分析RNA、小RNA (small RNA)、蛋白定位及抗体生产, 并被证明行之有效(Goodin et al., 2002; Kościańska et al., 2005; Rodriguez et al., 2005)。可用于注射的植物有多种, 但在烟草(Nicotiana benthamiana)中的应用最为广泛(Mokrzycki-Issartel et al., 2003; Wroblewski et al., 2005; Chakrabarty et al., 2007)。用农杆菌注射烟草来瞬时表达蛋白有以下优势: (1) 烟草是一种应用广泛的模式植物, 所有植物研究实验室都可以很好地种植烟草; (2) 通过农杆菌注射法可以很好地表达蛋白, 也容易得到较高的蛋白表达量, 并且同时注射含有基因沉默抑制子P19或P1/HC-Pro等重组质粒可以大幅提高蛋白的表达水平(Johansen and Carrington, 2001; Voinnet et al., 2003; Ma et al., 2009); (3) 得到的样品量大, 容易进行后续实验, 如有需要, 每次可以同时注射多片烟草叶片以保证有足够多的样品进行多种分析; (4) 如上所述, 注射的整个流程简单快捷, 不需要特殊的仪器, 且从准备注射到取样分析仅需1周时间。因此, 用烟草注射法瞬时表达蛋白来检测泛素化是目前的最佳选择。
1 实验材料
1.1 烟草
烟草(Nicotiana benthamiana L.)用于农杆菌注射实验。将烟草种子直接播于营养土中, 2周后将幼苗单独移栽到9 cm×9 cm的小钵中继续生长4-6周, 长至8-12片叶子时用于注射。1.2 菌株
所用菌株包括大肠杆菌(Escherichia coli)株系XL1- blue和根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105。1.3 载体
带各种标签(HA、GFP、MYC、FLAG)的植物表达载体。2 试剂
$\bullet$免疫沉淀实验和western blot实验相关试剂(1) 抗体: anti-HA、anti-GFP、anti-MYC、anti-FLAG、anti-Ubiquitin (anti-Ub)抗体、Nichel-HRP、兔源和鼠源二抗;
(2) Protein G agrose beads;
(3) MG132;
(4) 化学发光底物液;
(5) 脱脂奶粉;
(6) X光片;
(7) 醋酸纤维素膜。
$\bullet$RT-PCR相关试剂
(1) Trizol;
(2) 氯仿;
(3) 异丙醇;
(4) 乙醇;
(5) DNase;
(6) 反转录试剂盒;
(7) PCR反应所需DNA聚合酶、反应液和dNTP等。
$\bullet$各种抗生素
$\bullet$1 mL一次性注射器(无针头)
3 试剂配方
(1) LB培养基: 10 g·L-1胰蛋白胨, 5 g·L-1酵母提取物, 10 g·L-1 NaCl。固体培养基另加15 g·L-1琼脂粉。(2) 1 mol·L-1 MES (2-(N-morpholine)-ethanesulfonic acid)溶液。配制方法: 溶解21.325 g MES至50 mL无菌蒸馏水中, 调pH值至5.6, 定容至100 mL, 用孔径为0.2 μm滤膜抽滤灭菌。室温保存。
(3) 100 mmol•L-1乙酰丁香酮(acetosyringone, AS)溶液。配制方法: 溶解1.962 g AS到100 mL DMSO中。-20°C保存。
(4) 10 mmol•L-1 MgCl2溶液。配制方法: 将0.952 g MgCl2溶于1 L无菌蒸馏水中, 高压灭菌。室温保存。
(5) 非变性提取缓冲液: 50 mmol•L-1 Tris-MES (pH8.0), 0.5 mol•L-1 sucrose, 1 mmol•L-1 MgCl2, 10 mmol•L-1 EDTA, 5 mmol•L-1 DTT, protease inhibitor cocktail CompleteMini tablet。
(6) SDS-PAGE上样缓冲液(4×): 0.25 mol·L-1 Tris- HCl (pH6.8), 8% SDS, 40% glycerol, 0.005% bromophenol blue, 20% β-mercaptoethanol。
(7) Western blot电泳缓冲液: 3.03 g·L-1 Tris base, 14.4 g·L-1 甘氨酸, 1 g·L-1 SDS。
(8) Western blot转膜液: 3.03 g·L-1 Tris base, 14.4 g·L-1甘氨酸, 20%甲醇。
(9) PBS: 137 mmol·L-1 NaCl, 2.7 mmol·L-1 KCl, 10 mmol·L-1 Na2HPO4, 2 mmol·L-1 KH2PO4。
(10) 体外泛素化反应反应缓冲液(20×): 1 mol·L-1 Tris (pH7.5), 100 mmol·L-1 ATP, 200 mmol·L-1 MgCl2, 40 mmol·L-1 DTT。
4 设备与软件
所需设备和系统包括研钵或研磨仪、PCR仪、核酸电泳系统、离心机、水浴锅、蛋白电泳系统、样品混匀仪、4°C冷室和暗室等。5 实验程序
5.1 检测泛素连接酶和底物蛋白间的相互作用
泛素连接酶和底物的相互作用是检测底物蛋白被泛素连接酶泛素化的第1步, 因此首先要通过免疫共沉淀方法来检测已知泛素连接酶与其预期底物蛋白是否可以在体内相互作用。5.1.1 实验流程
(1) 泛素连接酶和预期底物重组农杆菌的构建。① 将编码泛素连接酶和预期底物的编码区(coding sequence, CDS)分别克隆到不同的35S启动子控制的植物表达载体上(植物表达载体需有可检测的表达标签GFP、HA、MYC和FLAG等), 同时, 泛素连接酶和底物需连接不同的表达标签; ② 将连有泛素连接酶和预期底物编码区的重组载体及相对应的泛素连接酶空载体分别转入农杆菌EHA105株系中。
(2) 烟草注射。① 挑取重组农杆菌单克隆菌落转入3 mL含有相应抗生素的LB培养液中, 28°C摇菌培养过夜; ② 培养得到的菌液以1:100体积比转接于10 mL LB培养液中(含相应抗生素、10 μmol·L-1 MES和40 μmol·L-1 AS), 28°C摇菌培养过夜; ③ 次日菌液OD600值约为3.0时, 收集菌液入离心管; ④ 4 000 ×g离心10分钟收集菌体, 重悬于10 mmol·L-1 MgCl2中; ⑤ 将悬浮液浓度调整为OD600=1.5, 在其中添加AS至终浓度为200 μmol·L-1, 室温静置2-5小时; ⑥ 选择烟草植株上部生长状态良好的叶片, 在叶片主脉与边缘的中间位置用针尖戳细孔, 用1 mL注射器吸取农杆菌悬浮液, 通过小孔将农杆菌注射到叶片下表皮。泛素连接酶和预期底物分别注入不同的烟草叶片(见注意事项(1))。
(3) 免疫共沉淀反应。① 注射3天后收集叶片, 迅速放入液氮中; ② 用非变性提取缓冲液提取烟草叶片总蛋白, 分别得到泛素连接酶和预期底物的蛋白提取液,两种蛋白提取液各取1/3混合得到泛素连接酶+预期
底物蛋白混合液; ③ 分别在1 mL泛素连接酶、预期底物和泛素连接酶+预期底物的总蛋白提取液中加入10 μg泛素连接酶或底物所带表达标签相应的抗体, 同时加入终浓度为50 μmol·L-1的MG132, 以阻止蛋白被26S蛋白酶体降解; ④ 4°C缓慢旋转反应过夜; ⑤ 加入20 μL Protein G agrose beads; ⑥ 4°C缓慢旋转反应2小时; ⑦ 14 000 ×g离心5秒, 去上清; ⑧ 用预冷的提取缓冲液洗beads 4次, 每次1 mL; ⑨ 完全去除上清, 所得沉淀即是免疫共沉淀的复合体(见注意事项(2)和(3))。
(4) 检测泛素连接酶与预期底物蛋白的相互作用。① 在获得的免疫共沉淀复合体中加入50 μL 2× SDSPAGE上样缓冲液(用去离子水将4×SDS-PAGE上样缓冲液稀释1倍), 95°C处理5分钟变性蛋白; ② 蛋白电泳使用BIO-RAD公司的蛋白电泳系统, 安装SDS-PAGE胶, 加入电泳缓冲液后上样, 稳压180 V至溴酚蓝跑出分离胶时卸下胶板; ③ Western blot: 蛋白样品经SDS-PAGE胶电泳分离后, 安装转膜装置, 100 V转移75分钟, 将蛋白质转移至NC膜并取出NC膜, 用5%脱脂奶粉/PBS室温封闭2小时或4°C过夜; 加入由3%脱脂奶粉/PBS合理稀释的一抗(如用泛素连接酶的表达标签免疫共沉淀, 则用预测底物的表达标签进行western blot, 反之亦然), 室温孵育1小时; 用PBST (PBS加0.1% Tween 20)洗涤2次, 每次15分钟; 加入用3%脱脂奶粉/PBS合理稀释的连有HRP的二抗, 室温孵育1小时; 再用PBST洗涤2次, 每次15分钟; 向膜上加HRP的化学发光底物液显色5分钟, 在暗室用X光片检测信号。
5.1.2 实例说明
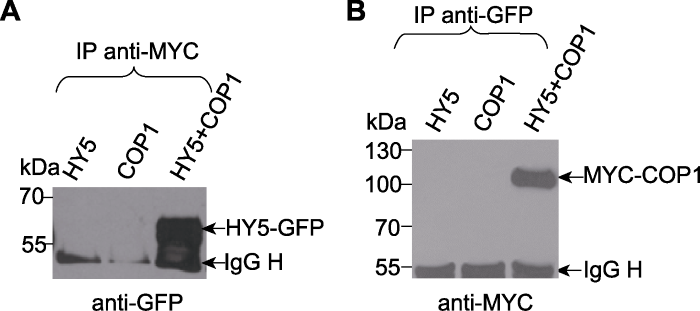
COP1 (constitutive photomorphogenic 1)和HY5 (elongated hypocotyl 5)是植物中控制光形态建成的泛素连接酶/底物对。将COP1编码区和HY5编码区构建在植物表达载体上。COP1构建于pBA002载体上与MYC标签相连并由35S启动子启动, 得到35S::MYC-COP1。HY5构建于pVR载体上, 与GFP标签相连并同样由35S启动子启动, 得到35S::HY5-GFP。将2个表达载体分别转入农杆菌EHA105中。将2个重组农杆菌分别注入烟草叶片中瞬时表达MYC-COP1和HY5-GFP蛋白。提取注射后烟草叶片的总蛋白进行免疫共沉淀反应, 所用样品分别为HY5-GFP、MY-C-COP1及HY5-GFP和MYC-COP1的混合样品。首先用anti-MYC抗体进行免疫共沉淀反应, 使MYC- COP1及其互作蛋白沉淀, 将得到的免疫共沉淀复合物用SDS-PAGE电泳分离, 用anti-GFP抗体检测。结果(图1A)显示, 只能在HY5-GFP和MYC-COP1混合样品中检测到HY5-GFP信号。同一批样品用anti- GFP抗体进行免疫共沉淀反应, 用anti-MYC抗体检测反应后的信号。同样地, 也只能在HY5-GFP和MYC-COP1的混合样品中检测到MYC-COP1信号(图1B)。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1用烟草注射法检测HY5与COP1之间的相互作用(Liu et al., 2010)
(A) 利用anti-MYC抗体进行免疫共沉淀反应, 用anti-GFP抗体进行western blot检测; (B) 利用anti-GFP抗体进行免疫共沉淀反应, 用anti-MYC抗体进行western blot检测。左侧数字是蛋白marker的分子量(kDa); IgG H: IgG重链蛋白
Figure 1HY5 and COP1 interact with each other in Nicotiana benthamiana (Liu et al., 2010)
(A) Samples were immunoprecipitated with anti-MYC antibody and immunoblotted with anti-GFP antibody; (B) Samples were immunoprecipitated with anti-GFP antibody and immunoblotted with anti-MYC antibody. The numbers on the left show the molecular masses of marker proteins in kiloDaltons (kDa). IgG H: IgG heavy chains
5.2 检测体内表达预期底物蛋白的泛素化修饰
5.2.1 实验流程(1) 构建预期底物蛋白和用作对照的GFP的表达载体并转化农杆菌(见注意事项(4))。
(2) 用上述方法在烟草中分别瞬时表达预期底物蛋白和GFP(见注意事项(5))。
(3) 取样前12小时在注射过农杆菌的叶片上注射终浓度为50 μmol·L-1的MG132, 以抑制26S蛋白酶体对目的蛋白的降解。
(4) 取样后用非变性提取缓冲液提取烟草叶片总蛋白, 进而用目的蛋白所连接的表达标签进行免疫沉淀反应(步骤如上所述)。
(5) 用western blot方法检测底物蛋白(一抗为预期底物所连接的表达标签)和已被泛素化修饰的底物蛋白(一抗为泛素抗体)。如二者的信号可以重叠, 则证明预期底物可以被泛素化修饰(见注意事项(3)和(6))。
5.2.2 实例说明
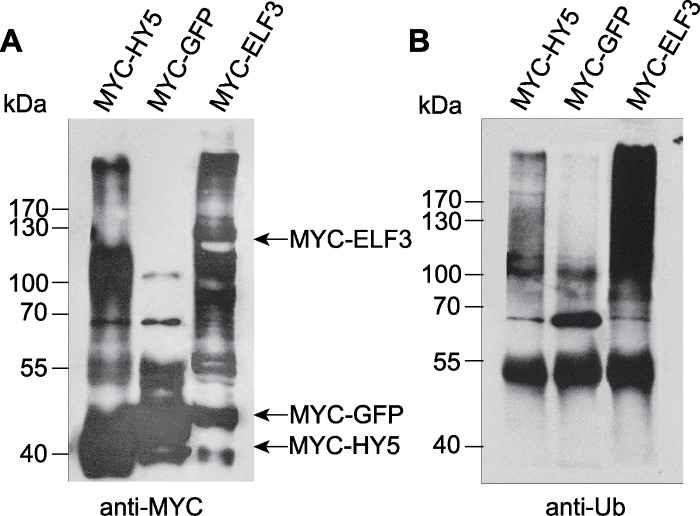
本实验选用2个COP1底物HY5和ELF3 (early flowering 3)。将这2个基因和用作对照的GFP编码区全长分别连接到pCAMBIA-1300-221载体上并与MYC标签相连, 得到35S::MYC-HY5、35S::MYC-ELF3和35S::MYC-GFP。将所得重组农杆菌注入烟草叶片, 以表达相应蛋白, 提取蛋白后用anti-MYC兔源多抗进行免疫沉淀反应。所得免疫沉淀复合物用鼠源anti-MYC单克隆抗体进行western blot检测。结果显示, 在MYC-HY5和MYC-ELF3样品中, 除2个蛋白本身的条带外, 还检测到分子量大于蛋白本身的弥散条带, 这些条带呈现蛋白被泛素化的特征(图2A)。而在MYC-GFP样品中未检测到类似条带。同样的免疫共沉淀复合物在SDS-PAGE胶分离后用anti-Ub抗体检测, 发现在MYC-HY5和MYC-ELF3样品中, anti- Ub能够识别anti-MYC抗体检测到的大分子量修饰条带(图2B), 从而证实这些条带是MYC-HY5和MYC- ELF3被泛素化修饰后的产物。在该过程中起泛素连接酶作用的可能是烟草自身的COP1同源蛋白或其它可以泛素化HY5和ELF3的泛素连接酶。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2烟草注射法检测底物蛋白HY5和ELF3体内的自身泛素化情况(Liu et al., 2010)
(A) 利用anti-MYC抗体对免疫沉淀的样品进行western blot检测; (B) 利用anti-Ub抗体对免疫沉淀的样品进行western blot检测。左侧数字是蛋白marker的分子量(kDa)。
Figure 2Polyubiquitinated MYC-HY5 and MYC-ELF3 can be detected in Nicotiana benthamiana (Liu et al., 2010)
(A) Immunoblots of immunoprecipitated samples with anti- MYC antibody; (B) Immunoblots of immunoprecipitated samples with anti-Ub antibody. The numbers on the left show the molecular masses of marker proteins in kiloDaltons (kDa).
5.3 检测26S蛋白酶体抑制剂MG132对预期底物蛋白降解的抑制作用
5.3.1 实验流程(1) 用上述方法准备用于注射的预期底物和GFP的农杆菌。重悬于10 mmol·L-1 MgCl2后, 将二者混合共同注入烟草叶片(见注意事项(7)和(8))。
(2) 取样前12小时在注射过农杆菌的烟草叶片上注射终浓度为50 μmol·L-1的MG132或空白对照(10 mmol·L-1 MgCl2)。
(3) 分别取注射MG132和空白对照的烟草叶片。
(4) 用非变性提取缓冲液提取2个样品烟草叶片总蛋白(留出部分烟草样品用于mRNA提取); Western blot检测预期底物蛋白(一抗为预期底物所连接的表达标签)和GFP的表达量(一抗为GFP抗体)。
(5) 比较预期底物蛋白和GFP在MG132和空白对照样品中的相对含量, 得出MG132是否影响预期底物蛋白表达量的结论。
(6) 提取MG132和空白对照样品的mRNA。① 取0.1 g新鲜烟草叶片于液氮中速冻, 磨碎后将样品转移至1.5 mL Eppendorf管中; ② 加入1 mL的Trizol提取缓冲液, 混匀, 室温放置5分钟; ③ 加入0.2 mL氯仿, 混匀, 室温放置5分钟; ④ 4°C、12 000 ×g离心15分钟; ⑤ 取上清, 加入0.6倍上清体积的异丙醇, 混匀, 冰上放置10分钟; ⑥ 4°C、12 000 ×g离心15分钟沉淀RNA; ⑦ 用800 μL 70%乙醇洗涤沉淀2次; 去上清, 空气干燥数分钟; ⑧ 用适量TE或dH2O溶解沉淀; 待RNA充分溶解后, 测OD值并进行电泳以对RNA进行定量并检查其质量。
(7) 反转录后检测预期底物在RNA水平的表达是否受MG132影响。① 取2 μg总RNA, 用DNase去除其中的DNA; ② 根据Promega公司MMLV (Cat.No. M170A) (或实验室常用反转录试剂盒)的使用方法进行cDNA第1条链的合成; ③ 设计预期底物基因的引物序列, 以合成的cDNA为模板进行PCR反应, 以ACTIN或UBQITIN的表达量作为内参; ④ 通过琼脂糖凝胶来检测预期底物基因在RNA水平的表达量。
5.3.2 实例说明
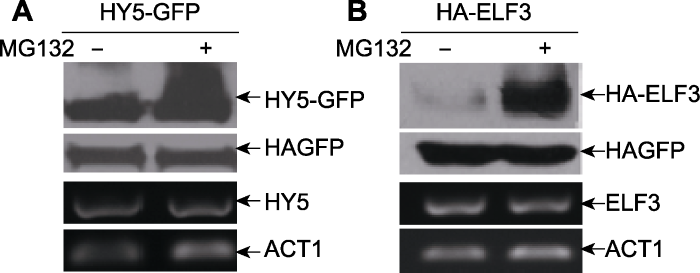
本实例中HY5选用前述构建的35S::HY5-GFP。ELF3构建于pJIM载体上与HA标签相连, 并由35S启动子启动, 得到35S::HA-ELF3。35S::HA-GFP构建于pCANG载体上作为注射时蛋白表达的内参。将这些构建的载体分别转入农杆菌EHA105。将35S::HA-GFP农杆菌作为内参分别与2个底物的重组农杆菌混合共注射烟草。样品收集12小时前在部分注射过的烟草叶片中注射MG132, 用于抑制26S蛋白酶体的功能, 另一部分注射过的叶片注射空白对照(10 mmol·L-1 MgCl2)。收集的烟草样品一部分提取蛋白, 用于western blot检测分析蛋白表达量, 另一部分提取RNA, 用于通过RT-PCR方法来检测相应构建中基因的表达情况。图3A和B是2个底物HY5和ELF3对MG132的反应情况, 显示与拟南芥中检测到的结果一致(Osterlund et al., 2000; Yu et al., 2008)。加入MG132后2个蛋白的稳定性明显提高, 而MG132并不影响2个底物蛋白在RNA水平上的表达量及内参蛋白HA-GFP的表达量。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3烟草注射法检测MG132对底物蛋白稳定性的影响(Liu et al., 2010)
(A) MG132对HY5-GFP蛋白稳定性的影响; (B) MG132对HA-ELF3蛋白稳定性的影响
Figure 3Effects of MG132 on protein stabilities of substrates in Nicotiana benthamiana (Liu et al., 2010)
(A) The effect of MG132 on protein stability of HY5-GFP; (B) The effect of MG132 on protein stability of HA-ELF3
5.4 体内实验检测泛素连接酶对底物降解的促进作用
5.4.1 实验流程(1) 用上述方法制备用于注射的泛素连接酶、泛素连接酶空载体、预期底物和GFP农杆菌。农杆菌重悬于10 mmol·L-1 MgCl2后, 将其中三者(泛素连接酶、预期底物和GFP, 或者泛素连接酶空载体、预期底物和GFP)按一定比例混合后共同注入烟草叶片(见注意事项(7)-(9))。
(2) 3天后分别取样。
(3) 用非变性提取缓冲液提取2个样品烟草叶片总蛋白(留出部分烟草样品用于mRNA提取)。Western blot检测预期底物蛋白(一抗为预期底物所连接的表达标签)、泛素连接酶(一抗为泛素连接酶所连接的表达标签)和GFP的表达量(一抗为GFP抗体)。
(4) 比较共表达空载体和共表达泛素连接酶中预期底物蛋白及GFP的相对含量, 得出泛素连接酶是否影响预期底物蛋白表达量的结论。
(5) 提取共表达泛素连接酶样品和共表达空载体样品的mRNA。
(6) 反转录后检测预期底物在RNA水平的表达是否受泛素连接酶影响。
5.4.2 实例说明
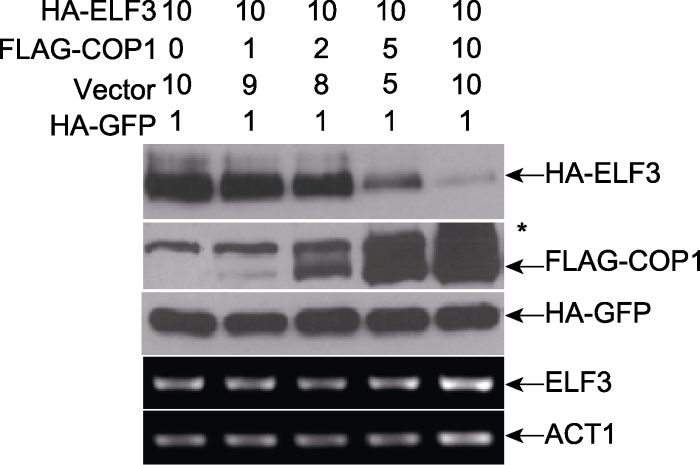
本部分用泛素连接酶COP1及其底物ELF3进行说明。将COP1构建于pTA-7002载体上与FLAG标签相连, 并由35S启动子启动, 得到35S::FLAG-COP1。将相同量的含有35S::HA-ELF3的重组农杆菌与不同量的含有35S::FLAG-COP1的重组农杆菌混合, 以含有pBA-MYC空载体的农杆菌来补足体积, 同时加入少量的HA-GFP重组农杆菌作为内参(图4)。将不同组合的农杆菌混合物分别注射烟草, 3天后取样。收集烟草样品一部分提取蛋白用于western blot检测, 另一部分提取RNA用于RT-PCR检测样品中ELF3基因的表达情况。如图4所示, 随着泛素连接酶FLAG-COP1蛋白量的增加, 底物HA-ELF3的蛋白量逐渐降低, 而在不同组合的混合样品中, 内参HA-GFP的表达量并不受FLAG-COP1的影响。同时, HAELF3在mRNA水平的表达也没有随着FLAG-COP1升高而发生变化。因此, COP1是在蛋白水平上调节ELF3的稳定性。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4烟草注射法在体内检测COP1蛋白量对ELF3稳定性的影响(Liu et al., 2010)
* 为anti-FLAG抗体检测到的非特异性条带。
Figure 4COP1-promoted ELF3 degradation can be detected in Nicotiana benthamiana (Liu et al., 2010)
* Unspecific bands detected by anti-FLAG antibody.
5.5 半体内的蛋白降解反应
5.5.1 实验流程(1) 用上述方法制备用于注射的泛素连接酶和预期底物农杆菌。农杆菌重悬于10 mmol·L-1 MgCl2后将二者分别注入烟草叶片(见注意事项(10))。
(2) 于3天后取样。分别收集表达泛素连接酶和底物蛋白的烟草叶片, 收集未注射的烟草作为对照。
(3) 用非变性提取缓冲液分别提取3个样品蛋白, 向最终蛋白提取液中加入终浓度为10 mmol·L-1的ATP以维持26S蛋白酶体的活性。
(4) 将底物蛋白样品提取液分别与泛素连接酶或对照样品提取液混合(见注意事项(11))。
(5) 将混合后的样品放置于4°C或室温, 缓慢旋转反应相应时间(见注意事项(12)和(13))。
(6) 加入SDS-PAGE上样缓冲液(4×), 95°C 5分钟终止反应。
(7) Western blot杂交检测预期底物蛋白(一抗为预期底物所连接的表达标签)及泛素连接酶(一抗为泛素连接酶所连接的表达标签)的蛋白量。
5.5.2 实例说明
本部分选用35S::FLAG-COP1和35S::HY5-GFP进行说明。将含有35S::FLAG-COP1和35S::HY5-GFP的重组农杆菌分别注入烟草叶片, 3天后取样提取蛋白质, 同时以未注射的空白烟草(mock)作为FLAG-COP1的对照。将HY5-GFP蛋白提取液分别与FLAG-COP1、mock提取液混合后置于4°C进行蛋白降解实验, 在相应时间点取样。取出的样品加入蛋白上样缓冲液并沸水浴5分钟终止反应。将最终得到的各时间点的反应样品通过SDS-PAGE胶分离后用anti-GFP抗体检测HY5-GFP蛋白的变化情况, 同时用anti-FLAG抗体检测FLAG-COP1。结果(图5)显示, 随着时间的延长, 两种反应混合液中HY5-GFP蛋白量都逐渐减少, 同时降解形式的HY5-GFP蛋白逐渐增多, 但在HY5+COP1样品中HY5蛋白的降解速率明显高于样品HY5+mock。HY5蛋白在HY5+mock样品中的降解可能是由于在烟草中存在COP1的同源蛋白。以上实验结果证明, COP1介导对HY5的降解, 且其对HY5的降解作用随时间的延长而增强。
图5
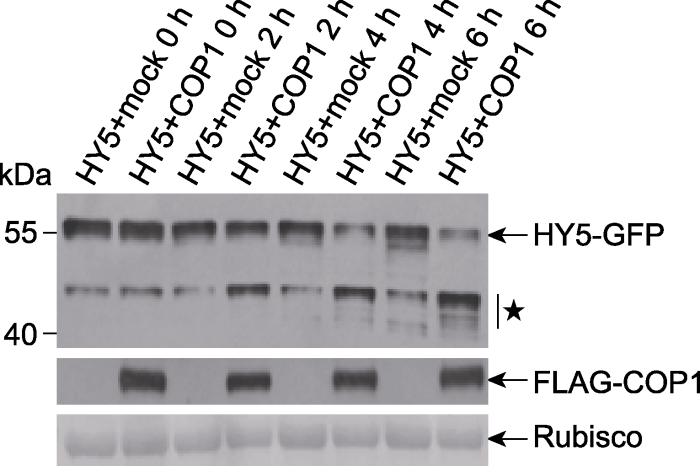 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5半体内实验检测COP1促进HY5的降解(Liu et al., 2010)
★为降解形式的HY5-GFP。左侧数字是蛋白marker的分子量(kDa)。
Figure 5Detection of COP1-promoted HY5 degradation in a semi-in vivo experiment (Liu et al., 2010)
★ The degradation form of HY5-GFP. The numbers on the left show the molecular masses of marker proteins in kiloDaltons (kDa).
5.6 检测26S蛋白酶体抑制剂MG132对泛素连接酶促进底物蛋白降解的抑制作用
5.6.1 实验流程(1) 对于在体内检测泛素连接酶对底物降解的促进作用而言, 取样前12小时分别在注射农杆菌的烟草叶片中再次注射50 μmol·L-1 MG132或10 mmol·L-1 MgCl2 (对照), 然后以同样的实验流程检测蛋白的稳定性以及MG132对底物蛋白稳定性的影响(见注意事项(14))。
(2) 对于半体内检测泛素连接酶对底物降解的促进作用而言, 在混合泛素连接酶和预期底物后, 向混合液中加入50 μmol·L-1 MG132或相应量的DMSO。然后以同样的实验流程检测蛋白的稳定性以及MG132对底物蛋白稳定性的影响(见注意事项(14)和(15))。
5.6.2 实例说明
本实例中HY5+COP1和HY5+mock样品皆均分为2份。在其中一份中加入终浓度为50 μmol·L-1的MG132; 另一份中加入等量的DMSO。反应混合液在4°C放置6小时后加入蛋白上样缓冲液并煮沸5分钟终止反应。结果(图6)显示, 在加入和未加入COP1的样品中HY5的降解皆被MG132抑制, 降解形式的HY5GFP蛋白不受MG132的影响, 说明HY5的降解确实是通过26S蛋白酶体完成。
图6
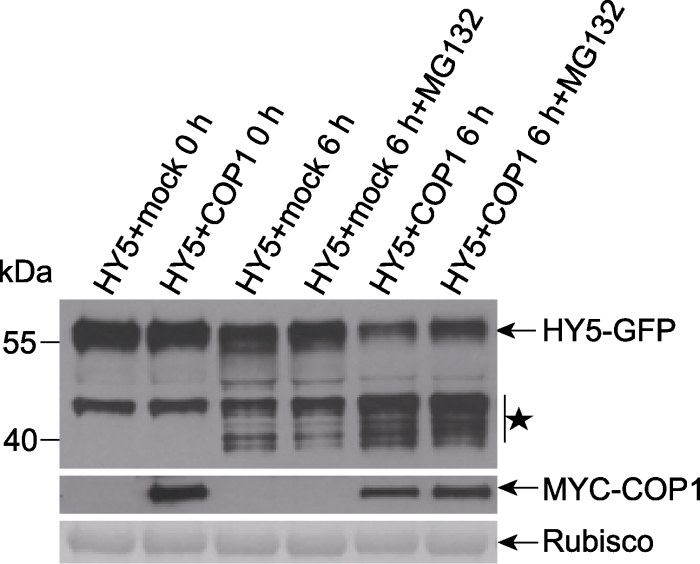 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6半体内实验检测MG132抑制COP1对HY5的降解(Liu et al., 2010)
★为降解形式的HY5-GFP。左侧数字是蛋白marker的分子量(kDa)。
Figure 6MG132 inhibition on COP1 promote HY5 degradation can be detected in a semi-in vivo experiment (Liu et al., 2010)
★ The degradation form of HY5-GFP. The numbers on the left show the molecular masses of marker proteins in kiloDaltons (kDa).
5.7 用烟草注射表达的蛋白质进行体外泛素化反应
研究表明, 体内泛素连接酶对底物的泛素化降解反应可能是间接原因造成, 如泛素连接酶影响其它蛋白质的稳定性, 而该蛋白质的存在为待测底物蛋白保持稳定状态所必需, 或者泛素连接酶的存在使整个细胞的状态发生改变从而使底物蛋白由于某些原因被降解。因此, 体外底物泛素化反应对于证明特定泛素连接酶和底物之间的特异性非常重要。但由于在大肠杆菌中表达的蛋白质缺少翻译后的蛋白修饰, 从而使一些泛素连接酶不能很好地发挥作用。同样, 一些底物蛋白也可能由于缺乏修饰而不能被泛素化, 如有些蛋白需要先磷酸化才能被泛素化进而被降解。在动物泛素化研究领域, 科学家在细胞系中瞬时表达泛素连接酶与底物蛋白, 纯化后用于体外泛素化反应, 从而避免原核生物表达真核蛋白导致的修饰问题(Fang et al., 2000; Chen et al., 2008)。基于同样的设想, 通过烟草注射系统表达的蛋白纯化后也能够用于体外泛素化实验。5.7.1 实验流程
(1) 获得免疫共沉淀复合体。① 用上述方法在烟草中分别瞬时表达泛素连接酶和预期底物; ② 取样后用非变性提取缓冲液提取烟草叶片总蛋白; ③ 混合泛素连接酶和预期底物的提取液, 进而用预期底物所连接的表达标签进行免疫共沉淀反应(步骤如上所述) (见注意事项(11))。
(2) 体外泛素化反应。① 向反应后所得的免疫共沉淀复合体中加入900 μL 50 mmol·L-1 Tris-HCl (pH7.5)重悬beads, 迅速均匀地将其分装至3个1.5 mL Eppendorf管中; ② 向每个管中再加入1 mL预冷的50 mmol·L-1 Tris-HCl (pH7.5), 离心, 去上清; ③ 向每个管中加入1.5 μL反应缓冲液(20×), 4 μg纯化His-Ub; ④ 3个管分别标注为+E1、+E2和+E1E2, 在+E1和+E1E2管中加入50 ng wE1, 在+E2和+E1E2管中加入100 ng hE2 UBCh5b, 最终3个管皆补dH2O至总体积为30 μL; ⑤ 30°C、900 ×g孵育90分钟; ⑥ 向管中分别加入SDS-PAGE上样缓冲液(4×), 95°C5分钟终止反应; ⑦ Western blot检测预期底物蛋白(一抗为预期底物所连接的表达标签)及其泛素化情况(Nichel-HRP)。
5.7.2 实例说明
本部分选用35S::HY5-GFP和35S::MYC-COP1两个重组载体进行实例说明。在烟草中分别表达HY5- GFP和MYC-COP1。用非变性缓冲液进行蛋白提取后, 将HY5-GFP和MYC-COP1提取液混合。用anti- MYC抗体进行免疫共沉淀反应, 得到HY5-GFP/MYC-COP1复合体。将所得复合物平均分为3份, 相应地加入E1、E2和泛素蛋白Ub后置于30°C、900 ×g条件下反应90分钟。反应后的产物用SDS-PAGE胶分离。Western blot检测HY5-GFP蛋白时用anti-GFP抗体, 发现只有在E1、E2和Ub都存在的情况下才能检测到高于HY5-GFP自身条带大小的信号, 说明HY5被COP1泛素化(图7A)。同样的样品用Nichel-HRP检测His-Ub及其修饰的蛋白, 结果显示只有在E1、E2和Ub都存在的情况下才能检测到泛素化修饰的大分子量条带(图7B)。推测这些条带可能是COP1自身泛素化及HY5泛素化条带的混合物。
图7
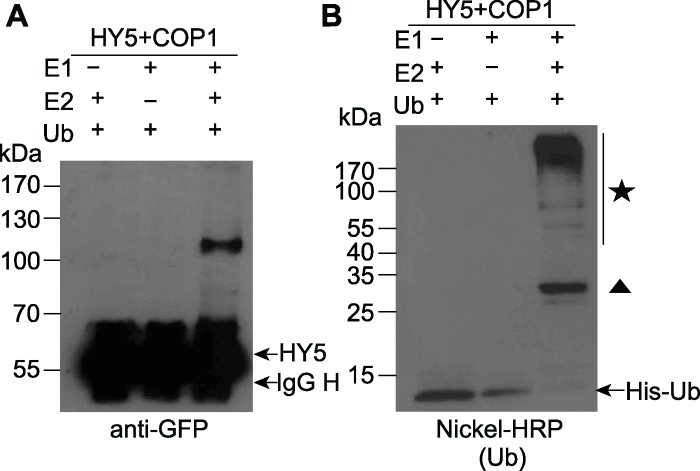 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7烟草注射法表达的蛋白可用于体外泛素化实验(Liu et al., 2010)
(A) 利用anti-GFP检测样品的体外泛素化情况; (B) 利用Nickel-HRP检测样品的体外泛素化情况。★为COP1自身泛素化及HY5泛素化条带的混合物。▲为泛素化的E2。左侧数字是蛋白marker的分子量(kDa)。IgG H: IgG重链蛋白
Figure 7Proteins expressed in tobacco can be used for in vitro ubiquitination reaction (Liu et al., 2010)
(A) Immunoblots of the in vitro ubiquitination assays samples with anti-GFP antibody; (B) Immunoblots of the in vitro ubiquitination assays samples with Nickel-HRP to detect His-ubiquitin. ★ The mixture of poly-ubiquitinated HY5-GFP and Myc-COP1. ▲ Mono-ubiquitinated E2. The numbers on the left show the molecular masses of marker proteins in kiloDaltons (kDa). IgG H: IgG heavy chain
6 注意事项
(1) 获得足量的蛋白质是生化实验的第1步, 因此如果蛋白表达量低, 请参考以下建议: ① 烟草的状态对蛋白质的表达很重要, 不健康的烟草或开花的烟草都会降低蛋白的表达量; ② 基因沉默抑制子P19可以大幅提高蛋白的表达量, 将表达P19的农杆菌和表达目的基因蛋白的农杆菌混合后注入烟草可有效增加蛋白表达水平; ③ 不同的表达载体同样会影响蛋白的表达量, 如果蛋白质在烟草中表达量低, 可以尝试更换表达载体; ④ 不同蛋白质在烟草中的表达时间不一样, 可以通过注射后不同天数取样, 来确定蛋白质的最佳取样时间。(2) 由于不同蛋白质的稳定性不同, 因此在实验初期需要通过设置时间梯度实验来决定免疫共沉淀实验的适宜时间。
(3) 用于免疫沉淀的抗体和后期western blot检测的抗体最好不同源(鼠源、兔源等), 这样可以最大限度地避免检测到免疫共沉淀所用抗体的重链和轻链, 减少不必要的非特异性信号。
(4) GFP和预期底物应构建于相同的目的载体, 以便与后期实验比较。
(5) GFP的表达量一般远高于目的蛋白的表达量, 因此注射时可适度降低GFP农杆菌的量。
(6) 如果未检测到分子量大于目的底物本身的弥散条带, 或者相应条带信号偏弱, 可以共注射泛素连接酶和预期底物, 进一步观察泛素连接酶是否促进预期底物的泛素化。
(7) 对该实验而言, 需选择生长状态较一致的烟草, 这样其mRNA和蛋白质的表达量比较一致, 有利于后续实验的比较。
(8) 由于GFP的表达量一般远高于目的蛋白的表达量, 因此在混合GFP和预期底物的农杆菌时应适量减少含GFP农杆菌的比例, 一般为预期底物农杆菌的1/10-1/5。
(9) 泛素连接酶和底物蛋白的表达量同样可能有较大的差距, 因此需要根据其表达量来调整相应农杆菌的比例。
(10) 对于一些表达量高且稳定性强的底物, 有时体内实验很难直接检测到泛素连接酶对底物蛋白降解的影响。而半体内的方法可以通过改变反应时间来达到研究目的。
(11) 泛素连接酶和底物蛋白的表达量可能有较大的差异, 因此需要根据二者的表达量来调整相应提取液的比例。
(12) 一般情况下, 室温可以加快蛋白质降解, 但如果泛素连接酶或预期底物在溶液中稳定性较差, 则应选择低温下进行实验。
(13) 由于不同蛋白的稳定性不同, 因此在实验初期需要通过时间梯度实验来确定最佳取样时间点。
(14) 可同时加入MG132和MG115来增强对26S蛋白酶体的抑制作用。
(15) 该实验是在检测泛素连接酶对底物降解的促进作用的基础上进行。一般只选择1个泛素连接酶与预期底物的农杆菌浓度比例和1个时间点。
致谢
感谢John Wiley and Sons出版社授权文中插图的使用许可。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 16]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
植物蛋白的体外泛素化检测方法
1
2019
... 用上述方法来证明泛素连接酶和底物的特异性是可信的, 但其不足之处也显而易见.一方面, 体外泛素化反应很难被检测, 这从KEG对ABI5的修饰上就可以证实.2006年已报道KEG可能通过降解ABI5来调节ABA信号途径, 但直到2010年KEG体外泛素化修饰ABI5才见报道.而且, 体外泛素化反应自身存在局限性, 可能产生假阳性或假阴性结果.体外反应将定位于不同细胞器的泛素连接酶和目的蛋白人为地置于同一个空间, 导致产生假阳性结果.假阴性是由于体外泛素化反应所用蛋白质是在大肠杆菌中表达的, 而这些原核系统中表达的蛋白质由于缺乏泛素连接酶或底物蛋白发挥功能所必需的修饰(如磷酸化修饰), 可能不具有活性或不能被泛素化(
PSITE vectors for stable integration or transient expression of autofluorescent protein fusions in plants: probing Nicotiana benthamiana -virus interactions
1
2007
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
MDM2 E3 ubiquitin ligase mediates UT-A1 urea transporter ubiquitination and degradation
2
2008
... 用上述方法来证明泛素连接酶和底物的特异性是可信的, 但其不足之处也显而易见.一方面, 体外泛素化反应很难被检测, 这从KEG对ABI5的修饰上就可以证实.2006年已报道KEG可能通过降解ABI5来调节ABA信号途径, 但直到2010年KEG体外泛素化修饰ABI5才见报道.而且, 体外泛素化反应自身存在局限性, 可能产生假阳性或假阴性结果.体外反应将定位于不同细胞器的泛素连接酶和目的蛋白人为地置于同一个空间, 导致产生假阳性结果.假阴性是由于体外泛素化反应所用蛋白质是在大肠杆菌中表达的, 而这些原核系统中表达的蛋白质由于缺乏泛素连接酶或底物蛋白发挥功能所必需的修饰(如磷酸化修饰), 可能不具有活性或不能被泛素化(
... 研究表明, 体内泛素连接酶对底物的泛素化降解反应可能是间接原因造成, 如泛素连接酶影响其它蛋白质的稳定性, 而该蛋白质的存在为待测底物蛋白保持稳定状态所必需, 或者泛素连接酶的存在使整个细胞的状态发生改变从而使底物蛋白由于某些原因被降解.因此, 体外底物泛素化反应对于证明特定泛素连接酶和底物之间的特异性非常重要.但由于在大肠杆菌中表达的蛋白质缺少翻译后的蛋白修饰, 从而使一些泛素连接酶不能很好地发挥作用.同样, 一些底物蛋白也可能由于缺乏修饰而不能被泛素化, 如有些蛋白需要先磷酸化才能被泛素化进而被降解.在动物泛素化研究领域, 科学家在细胞系中瞬时表达泛素连接酶与底物蛋白, 纯化后用于体外泛素化反应, 从而避免原核生物表达真核蛋白导致的修饰问题(
MDM2 is a RING finger-dependent ubiquitin protein ligase for itself and p53
2
2000
... 用上述方法来证明泛素连接酶和底物的特异性是可信的, 但其不足之处也显而易见.一方面, 体外泛素化反应很难被检测, 这从KEG对ABI5的修饰上就可以证实.2006年已报道KEG可能通过降解ABI5来调节ABA信号途径, 但直到2010年KEG体外泛素化修饰ABI5才见报道.而且, 体外泛素化反应自身存在局限性, 可能产生假阳性或假阴性结果.体外反应将定位于不同细胞器的泛素连接酶和目的蛋白人为地置于同一个空间, 导致产生假阳性结果.假阴性是由于体外泛素化反应所用蛋白质是在大肠杆菌中表达的, 而这些原核系统中表达的蛋白质由于缺乏泛素连接酶或底物蛋白发挥功能所必需的修饰(如磷酸化修饰), 可能不具有活性或不能被泛素化(
... 研究表明, 体内泛素连接酶对底物的泛素化降解反应可能是间接原因造成, 如泛素连接酶影响其它蛋白质的稳定性, 而该蛋白质的存在为待测底物蛋白保持稳定状态所必需, 或者泛素连接酶的存在使整个细胞的状态发生改变从而使底物蛋白由于某些原因被降解.因此, 体外底物泛素化反应对于证明特定泛素连接酶和底物之间的特异性非常重要.但由于在大肠杆菌中表达的蛋白质缺少翻译后的蛋白修饰, 从而使一些泛素连接酶不能很好地发挥作用.同样, 一些底物蛋白也可能由于缺乏修饰而不能被泛素化, 如有些蛋白需要先磷酸化才能被泛素化进而被降解.在动物泛素化研究领域, 科学家在细胞系中瞬时表达泛素连接酶与底物蛋白, 纯化后用于体外泛素化反应, 从而避免原核生物表达真核蛋白导致的修饰问题(
pGD vectors: versatile tools for the expression of green and red fluorescent protein fusions in agroinfiltrated plant leaves
2
2002
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
... ).其中, 最简单易行的是农杆菌注射法.首先将目的基因构建于植物表达载体上; 再将重组质粒转化农杆菌; 最后将所得的重组农杆菌悬浮液直接注射入植物叶片; 至少1天后即可观测基因的表达.农杆菌注射的方法已用于分析RNA、小RNA (small RNA)、蛋白定位及抗体生产, 并被证明行之有效(
Silencing on the spot. Induction and suppression of RNA silencing in the Agrobacterium -mediated transient expression system
1
2001
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
Analysis of RNA silencing in agroinfiltrated leaves of Nicotiana benthamiana and Nicotiana tabacum
1
2005
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
Drought stress-induced Rma1H1, a RING membrane- anchor E3 ubiquitin ligase homolog, regulates aquaporin levels via ubiquitination in transgenic Arabidopsis plants
2
2009
... 用上述方法来证明泛素连接酶和底物的特异性是可信的, 但其不足之处也显而易见.一方面, 体外泛素化反应很难被检测, 这从KEG对ABI5的修饰上就可以证实.2006年已报道KEG可能通过降解ABI5来调节ABA信号途径, 但直到2010年KEG体外泛素化修饰ABI5才见报道.而且, 体外泛素化反应自身存在局限性, 可能产生假阳性或假阴性结果.体外反应将定位于不同细胞器的泛素连接酶和目的蛋白人为地置于同一个空间, 导致产生假阳性结果.假阴性是由于体外泛素化反应所用蛋白质是在大肠杆菌中表达的, 而这些原核系统中表达的蛋白质由于缺乏泛素连接酶或底物蛋白发挥功能所必需的修饰(如磷酸化修饰), 可能不具有活性或不能被泛素化(
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
Abscisic acid increases Arabidopsis ABI5 transcription factor levels by promoting KEG E3 ligase self-ubiquitination and proteasomal degradation
16
2010
... 一般而言, 植物学家通过3个方面的实验来证明某个蛋白质是某一泛素连接酶的底物: (1) 体内或体外实验证明二者的相互作用; (2) 体外的泛素化实验证明泛素连接酶可以将泛素分子加在目的蛋白上; (3) 在泛素连接酶的突变体中检测到目的蛋白量的增加, 或者在泛素连接酶的过表达植株中检测到目的蛋白量的降低, 并且泛素连接酶和目的蛋白二者的突变体具有相反的表型.例如, Yeast two-hybrid实验和体外pull down实验证明, 参与生长素信号途径的SINAT5和NAC1这对泛素连接酶/底物有相互作用; 体外泛素化实验证明SINAT5可以泛素化修饰NAC1; 在SINAT5无功能突变形式蛋白表达的植株中, NAC1的蛋白量明显增加.由此证明, NAC1特异性地被SINAT5降解, 是SINAT5的底物(
... ;
... COP1 (constitutive photomorphogenic 1)和HY5 (elongated hypocotyl 5)是植物中控制光形态建成的泛素连接酶/底物对.将COP1编码区和HY5编码区构建在植物表达载体上.COP1构建于pBA002载体上与MYC标签相连并由35S启动子启动, 得到35S::MYC-COP1.HY5构建于pVR载体上, 与GFP标签相连并同样由35S启动子启动, 得到35S::HY5-GFP.将2个表达载体分别转入农杆菌EHA105中.将2个重组农杆菌分别注入烟草叶片中瞬时表达MYC-COP1和HY5-GFP蛋白.提取注射后烟草叶片的总蛋白进行免疫共沉淀反应, 所用样品分别为HY5-GFP、MY-C-COP1及HY5-GFP和MYC-COP1的混合样品.首先用anti-MYC抗体进行免疫共沉淀反应, 使MYC- COP1及其互作蛋白沉淀, 将得到的免疫共沉淀复合物用SDS-PAGE电泳分离, 用anti-GFP抗体检测.结果(
... (A) 利用anti-MYC抗体进行免疫共沉淀反应, 用anti-GFP抗体进行western blot检测; (B) 利用anti-GFP抗体进行免疫共沉淀反应, 用anti-MYC抗体进行western blot检测.左侧数字是蛋白marker的分子量(kDa); IgG H: IgG重链蛋白
... 本实验选用2个COP1底物HY5和ELF3 (early flowering 3).将这2个基因和用作对照的GFP编码区全长分别连接到pCAMBIA-1300-221载体上并与MYC标签相连, 得到35S::MYC-HY5、35S::MYC-ELF3和35S::MYC-GFP.将所得重组农杆菌注入烟草叶片, 以表达相应蛋白, 提取蛋白后用anti-MYC兔源多抗进行免疫沉淀反应.所得免疫沉淀复合物用鼠源anti-MYC单克隆抗体进行western blot检测.结果显示, 在MYC-HY5和MYC-ELF3样品中, 除2个蛋白本身的条带外, 还检测到分子量大于蛋白本身的弥散条带, 这些条带呈现蛋白被泛素化的特征(
... (A) 利用anti-MYC抗体对免疫沉淀的样品进行western blot检测; (B) 利用anti-Ub抗体对免疫沉淀的样品进行western blot检测.左侧数字是蛋白marker的分子量(kDa).
... 本实例中HY5选用前述构建的35S::HY5-GFP.ELF3构建于pJIM载体上与HA标签相连, 并由35S启动子启动, 得到35S::HA-ELF3.35S::HA-GFP构建于pCANG载体上作为注射时蛋白表达的内参.将这些构建的载体分别转入农杆菌EHA105.将35S::HA-GFP农杆菌作为内参分别与2个底物的重组农杆菌混合共注射烟草.样品收集12小时前在部分注射过的烟草叶片中注射MG132, 用于抑制26S蛋白酶体的功能, 另一部分注射过的叶片注射空白对照(10 mmol·L-1 MgCl2).收集的烟草样品一部分提取蛋白, 用于western blot检测分析蛋白表达量, 另一部分提取RNA, 用于通过RT-PCR方法来检测相应构建中基因的表达情况.
... (A) MG132对HY5-GFP蛋白稳定性的影响; (B) MG132对HA-ELF3蛋白稳定性的影响
... 本部分用泛素连接酶COP1及其底物ELF3进行说明.将COP1构建于pTA-7002载体上与FLAG标签相连, 并由35S启动子启动, 得到35S::FLAG-COP1.将相同量的含有35S::HA-ELF3的重组农杆菌与不同量的含有35S::FLAG-COP1的重组农杆菌混合, 以含有pBA-MYC空载体的农杆菌来补足体积, 同时加入少量的HA-GFP重组农杆菌作为内参(
... * 为anti-FLAG抗体检测到的非特异性条带.
... 本部分选用35S::FLAG-COP1和35S::HY5-GFP进行说明.将含有35S::FLAG-COP1和35S::HY5-GFP的重组农杆菌分别注入烟草叶片, 3天后取样提取蛋白质, 同时以未注射的空白烟草(mock)作为FLAG-COP1的对照.将HY5-GFP蛋白提取液分别与FLAG-COP1、mock提取液混合后置于4°C进行蛋白降解实验, 在相应时间点取样.取出的样品加入蛋白上样缓冲液并沸水浴5分钟终止反应.将最终得到的各时间点的反应样品通过SDS-PAGE胶分离后用anti-GFP抗体检测HY5-GFP蛋白的变化情况, 同时用anti-FLAG抗体检测FLAG-COP1.结果(
... ★为降解形式的HY5-GFP.左侧数字是蛋白marker的分子量(kDa).
... 本实例中HY5+COP1和HY5+mock样品皆均分为2份.在其中一份中加入终浓度为50 μmol·L-1的MG132; 另一份中加入等量的DMSO.反应混合液在4°C放置6小时后加入蛋白上样缓冲液并煮沸5分钟终止反应.结果(
... ★为降解形式的HY5-GFP.左侧数字是蛋白marker的分子量(kDa).
... 本部分选用35S::HY5-GFP和35S::MYC-COP1两个重组载体进行实例说明.在烟草中分别表达HY5- GFP和MYC-COP1.用非变性缓冲液进行蛋白提取后, 将HY5-GFP和MYC-COP1提取液混合.用anti- MYC抗体进行免疫共沉淀反应, 得到HY5-GFP/MYC-COP1复合体.将所得复合物平均分为3份, 相应地加入E1、E2和泛素蛋白Ub后置于30°C、900 ×g条件下反应90分钟.反应后的产物用SDS-PAGE胶分离.Western blot检测HY5-GFP蛋白时用anti-GFP抗体, 发现只有在E1、E2和Ub都存在的情况下才能检测到高于HY5-GFP自身条带大小的信号, 说明HY5被COP1泛素化(
... (A) 利用anti-GFP检测样品的体外泛素化情况; (B) 利用Nickel-HRP检测样品的体外泛素化情况.★为COP1自身泛素化及HY5泛素化条带的混合物.▲为泛素化的E2.左侧数字是蛋白marker的分子量(kDa).IgG H: IgG重链蛋白
An efficient system to detect protein ubiquitination by agroinfiltration in Nicotiana benthamiana
0
2010
A viral suppressor P1/HC-pro increases the GFP gene expression in Agrobacterium-mediated transient assay
1
2009
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
A transient tobacco expression system coupled to MALDI-TOFMS allows validation of the impact of differential targeting on structure and activity of a recombinant therapeutic glycoprotein produced in plants
1
2003
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
Targeted destabilization of HY5 during light-regulated development of Arabidopsis
1
2000
... 本实例中HY5选用前述构建的35S::HY5-GFP.ELF3构建于pJIM载体上与HA标签相连, 并由35S启动子启动, 得到35S::HA-ELF3.35S::HA-GFP构建于pCANG载体上作为注射时蛋白表达的内参.将这些构建的载体分别转入农杆菌EHA105.将35S::HA-GFP农杆菌作为内参分别与2个底物的重组农杆菌混合共注射烟草.样品收集12小时前在部分注射过的烟草叶片中注射MG132, 用于抑制26S蛋白酶体的功能, 另一部分注射过的叶片注射空白对照(10 mmol·L-1 MgCl2).收集的烟草样品一部分提取蛋白, 用于western blot检测分析蛋白表达量, 另一部分提取RNA, 用于通过RT-PCR方法来检测相应构建中基因的表达情况.
Epigenetic and posttranslational modifications in light signal transduction and the circadian clock in Neurospora crassa
1
2015
... 泛素化是蛋白质发挥生物学功能的重要调节机制.蛋白泛素化能够调节短寿命蛋白或非正常折叠蛋白的稳定性、改变蛋白质的亚细胞定位以及蛋白质的组装和蛋白活性等(
Transient expression in tobacco leaves of an aglycosylated recombinant antibody against the epidermal growth factor receptor
1
2005
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
The ubiquitin 26S proteasome proteolytic pathway
1
2004
... 泛素化是蛋白质发挥生物学功能的重要调节机制.蛋白泛素化能够调节短寿命蛋白或非正常折叠蛋白的稳定性、改变蛋白质的亚细胞定位以及蛋白质的组装和蛋白活性等(
KEEP ON GOING, a RING E3 ligase essential for Arabidopsis growth and development, is involved in abscisic acid signaling
1
2006
... 一般而言, 植物学家通过3个方面的实验来证明某个蛋白质是某一泛素连接酶的底物: (1) 体内或体外实验证明二者的相互作用; (2) 体外的泛素化实验证明泛素连接酶可以将泛素分子加在目的蛋白上; (3) 在泛素连接酶的突变体中检测到目的蛋白量的增加, 或者在泛素连接酶的过表达植株中检测到目的蛋白量的降低, 并且泛素连接酶和目的蛋白二者的突变体具有相反的表型.例如, Yeast two-hybrid实验和体外pull down实验证明, 参与生长素信号途径的SINAT5和NAC1这对泛素连接酶/底物有相互作用; 体外泛素化实验证明SINAT5可以泛素化修饰NAC1; 在SINAT5无功能突变形式蛋白表达的植株中, NAC1的蛋白量明显增加.由此证明, NAC1特异性地被SINAT5降解, 是SINAT5的底物(
Functional transient genetic transformation of Arabidopsis leaves by biolistic bombardment
1
2009
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
The ubiquitin/26S proteasome pathway, the complex last chapter in the life of many plant proteins
1
2003
... 泛素化是蛋白质发挥生物学功能的重要调节机制.蛋白泛素化能够调节短寿命蛋白或非正常折叠蛋白的稳定性、改变蛋白质的亚细胞定位以及蛋白质的组装和蛋白活性等(
The expanding universe of ubiquitin and ubiquitin-like modifiers
1
2012
... 泛素化是蛋白质发挥生物学功能的重要调节机制.蛋白泛素化能够调节短寿命蛋白或非正常折叠蛋白的稳定性、改变蛋白质的亚细胞定位以及蛋白质的组装和蛋白活性等(
An enhanced transient expression system in plants based on suppression of gene silencing by the P19 protein of tomato bushy stunt virus
1
2003
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
Optimization of Agrobacterium-mediated transient assays of gene expression in lettuce, tomato and Arabidopsis
1
2005
... 在植物中瞬时表达蛋白的方法有原生质体转化法、基因枪注射法(biolistic bombardment)和农杆菌注射法(
SINAT5 promotes ubiquitin-related degradation of NAC1 to attenuate auxin signals
1
2002
... 一般而言, 植物学家通过3个方面的实验来证明某个蛋白质是某一泛素连接酶的底物: (1) 体内或体外实验证明二者的相互作用; (2) 体外的泛素化实验证明泛素连接酶可以将泛素分子加在目的蛋白上; (3) 在泛素连接酶的突变体中检测到目的蛋白量的增加, 或者在泛素连接酶的过表达植株中检测到目的蛋白量的降低, 并且泛素连接酶和目的蛋白二者的突变体具有相反的表型.例如, Yeast two-hybrid实验和体外pull down实验证明, 参与生长素信号途径的SINAT5和NAC1这对泛素连接酶/底物有相互作用; 体外泛素化实验证明SINAT5可以泛素化修饰NAC1; 在SINAT5无功能突变形式蛋白表达的植株中, NAC1的蛋白量明显增加.由此证明, NAC1特异性地被SINAT5降解, 是SINAT5的底物(
COP1 and ELF3 control circadian function and photoperiodic flowering by regulating GI stability
1
2008
... 本实例中HY5选用前述构建的35S::HY5-GFP.ELF3构建于pJIM载体上与HA标签相连, 并由35S启动子启动, 得到35S::HA-ELF3.35S::HA-GFP构建于pCANG载体上作为注射时蛋白表达的内参.将这些构建的载体分别转入农杆菌EHA105.将35S::HA-GFP农杆菌作为内参分别与2个底物的重组农杆菌混合共注射烟草.样品收集12小时前在部分注射过的烟草叶片中注射MG132, 用于抑制26S蛋白酶体的功能, 另一部分注射过的叶片注射空白对照(10 mmol·L-1 MgCl2).收集的烟草样品一部分提取蛋白, 用于western blot检测分析蛋白表达量, 另一部分提取RNA, 用于通过RT-PCR方法来检测相应构建中基因的表达情况.
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
