 ,3,*
,3,*In Vitro Ubiquitination Assay for Plant Proteins
Qingzhen Zhao1, Lijing Liu2, Qi Xie3,4, Feifei Yu ,3,*
,3,*通讯作者:
责任编辑: 朱亚娜
收稿日期:2019-08-12接受日期:2019-10-31网络出版日期:2019-11-01
| 基金资助: |
Corresponding authors:
Received:2019-08-12Accepted:2019-10-31Online:2019-11-01

摘要
关键词:
Abstract
Keywords:
PDF (3367KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
赵庆臻, 刘利静, 谢旗, 于菲菲. 植物蛋白的体外泛素化检测方法. 植物学报, 2019, 54(6): 764-772 doi:10.11983/CBB19152
Zhao Qingzhen, Liu Lijing, Xie Qi, Yu Feifei.
蛋白质泛素化修饰在真核细胞内具有重要的生物学功能。泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (Bachmair et al., 2001)。在拟南芥(Arabidopsis thaliana)基因组中编码涉及泛素化途径蛋白质的基因占基因组的近5%, 表明泛素化修饰是植物体内非常复杂精细的调控网络(Vierstra, 2003; Smalle and Vierstra, 2004)。泛素化蛋白种类繁多, 这些蛋白参与真核细胞内几乎所有的生理生化途径。泛素化修饰能够通过多种生化分子机制调控这些生理过程, 如调控短寿命蛋白及错误折叠蛋白的稳定性、改变蛋白的亚细胞定位、影响蛋白的组装和活性以及影响染色质的折叠(Vierstra, 2012; Proietto et al., 2015; Miricescu et al., 2018)。
在消耗ATP的前提下, 泛素(ubiquitin, Ub)羧基端的甘氨酸残基与泛素激活酶(E1)活性中心的半胱氨酸巯基之间形成硫酯键, 接着泛素分子被转移到泛素耦联酶的半胱氨酸巯基上, 然后由泛素连接酶(E3)介导, 将泛素转移到靶蛋白分子的赖氨酸残基上。E3根据其作用方式分为两大类型: HECT类型的E3首先接受E2上的泛素分子, 与泛素通过硫酯键连接, 然后再将泛素转移到底物上; 而RING/U-box类型的E3并不与泛素共价连接, 它作为中间体将E2和底物在空间上尽量靠近, 促使泛素分子从E2上直接转移到底物蛋白。被泛素化的蛋白质在被26S蛋白酶体降解之前, 由去泛素化酶(deubiquitinating enzyme, DUB)将泛素链从底物蛋白上移除, 供循环利用(Smalle and Vierstra, 2004; Hua and Vierstra, 2011)。
拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶。特异性底物的识别主要由E3决定(Xie et al., 2002; Yu et al., 2008; Zhang et al., 2015), 而E2参与调节泛素化修饰的具体形式, 如单泛素化、多位点的单泛素化及不同构型的多聚泛素链的生成(Michelle et al., 2009; Vierstra, 2009)。因此, 不同E2-E3-底物的组合决定了对特定蛋白质进行特定形式的泛素化修饰, 从而影响该底物的命运, 并对它参与的生理生化途径实现调控(Kraft et al., 2005; Callis, 2014)。因此, 建立有效的泛素化检测体系对分析泛素耦联酶/泛素连接酶和泛素连接酶/底物特异性, 从而理解泛素化修饰调控植物生长发育及代谢网络机制非常重要。
在大肠杆菌(Escherichia coli)中表达蛋白是获得目的基因产物最简便快速的方法。该方法不仅容易获得大量蛋白, 而且因大肠杆菌中少有植物同源蛋白, 利用原核系统表达纯化的蛋白进行实验, 能够更好地说明2个不同植物基因编码蛋白间存在的直接关系。尽管由于缺乏翻译后修饰等原因使得在大肠杆菌中表达的某些真核基因的蛋白质没有活性, 但大部分真核基因在大肠杆菌中表达的蛋白质是有活性的, 可用于后续分析。因此, 通常首先尝试采用原核表达的蛋白进行待测蛋白的活性检测。本文提供了一种利用原核表达纯化的蛋白快速简便地进行体外泛素化活性分析的方法。
1 实验材料
1.1 菌株
用于蛋白原核表达的大肠杆菌(Escherichia coli)菌株, 包括BL21 (DE3)和BL21 (pLysS)等。1.2 质粒
(1) 包含小麦(Triticum aestivum) E1及人类(Homo sapiens) E2基因(作为对照)的质粒: pET3a-wheat- E1 (GI: 136632)和pET15b-UBCH5b。(2) 包含拟南芥(Arabidopsis thaliana)泛素基因的质粒: pET28a-UBQ14 (At4g02890)。
(3) 包含拟南芥泛素激活酶(E1)的质粒: pET28a- UBA2 (At5g06460)。
(4) 包含拟南芥泛素耦联酶(E2)的质粒: 拟南芥E2 (UBC)基因编码蛋白分属于12个亚家族, 将每个亚家族中至少1个成员的蛋白质编码序列克隆到pET28a载体上, 包括UBC27 (At5g50870)、UBC1 (At1g14400)、UBC2 (At2g02760)、UBC3 (At5g62540)、UBC10 (At5g53300)、UBC32 (At3g17000, 删除跨膜结构域)、UBC13 (At3g46460)、UBC4 (At5g41340)、UBC5 (At1g63800)、UBC6 (At2g46030)、UBC21 (At5g25760)、UBC19 (At3g20060)、UBC35 (At1g78870)、UBC16 (At1g75440)、UBC26 (At1g53020)、UBC22 (At5g05080)、UBC24 (At2g33770, 仅克隆UBC结构域)。
(5) 包含拟南芥或其它植物的待测RING/U-box类型泛素连接酶(E3)的质粒: 需保证待测蛋白与6×His及T7以外的蛋白标签融合。本实验中使用的是pMalC2载体, 目的蛋白的N端融合有MBP标签。
2 试剂及耗材
试剂包括LB培养基及相应抗生素、异丙基硫代-β-D-半乳糖苷(IPTG)、二硫苏糖醇(DTT)或β-巯基乙醇、苯甲基磺酰氟(PMSF)、ATP和用于标签蛋白纯化的产品。如谷胱甘肽-琼脂糖4B (Glutathione sepharose 4B, GE healthcare, Cat No.17-0756-01)用于GST融合蛋白的纯化、淀粉酶树脂(Amylose resin, NEB, Cat No.E8021)用于MBP融合蛋白的纯化、Ni-NTA agarose用于6×His融合蛋白的纯化(见注意事项1); western blot试剂及标签蛋白抗体包括anti-His、anti-MBP、anti-GST及泛素蛋白抗体(本文所用为本实验室自产的anti-Ub抗体, 也可购买Sigma公司产品)。耗材主要包括超滤离心管(Amicon Ultra-15, Millipore)。3 试剂配方
3.1 储存液
$\bullet$100 mmol·L-1 IPTG: 用水溶解(见注意事项2), 0.22 μm无菌膜过滤, -20°C保存(见注意事项3)。$\bullet$1 mol·L-1 DTT: 用10 mmol·L-1 NaAc溶解, 0.22 μm无菌膜过滤, -20°C保存(见注意事项3)。
$\bullet$100 mmol·L-1 PMSF: 用异丙醇溶解, -20°C保存(见注意事项3)。
$\bullet$1 mol·L-1 ATP: 用水溶解, -20°C保存(见注意事项3)。
$\bullet$用于E2与泛素分子生成对DTT敏感的硫酯键检测的反应缓冲液(20×): 1 mol·L-1 Tris-HCl (pH7.4), 200 mmol·L-1 MgCl2, 200 mmol·L-1 ATP。-20°C保存(见注意事项3)。
$\bullet$用于E2-E3及E3-底物泛素化反应的反应缓冲液(20×): 1 mol·L-1 Tris-HCl (pH7.4), 200 mmol·L-1 MgCl2, 100 mmol·L-1 ATP, 40 mmol·L-1 DTT。-20°C保存(见注意事项3)。
$\bullet$含有β-巯基乙醇(或DTT)的SDS蛋白上样缓冲液(4×): 0.25 mol·L-1 Tris-HCl (pH6.8), 8% SDS, 40%甘油, 0.004%溴酚蓝, 20% β-巯基乙醇(或8mmol·L-1 DTT)。4°C保存。
$\bullet$不含β-巯基乙醇(或DTT)的SDS蛋白上样缓冲液(4 ×): 0.25 mol·L-1 Tris-HCl (pH6.8), 8% SDS, 40%甘油, 0.004%溴酚蓝。4°C保存。
3.2 蛋白表达及纯化缓冲液
$\bullet$ 6×His标签融合蛋白缓冲液(1) 裂解缓冲液A: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF。
(2) 结合缓冲液: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 20 mmol·L-1咪唑, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF。
(3) 洗涤缓冲液: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 50 mmol·L-1咪唑, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF。
(4) 洗脱缓冲液1: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 100 mmol·L-1咪唑, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF。
(5) 洗脱缓冲液2: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 200 mmol·L-1咪唑, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF。
(6) 洗脱缓冲液3: 50 mmol·L-1 NaH2PO4, 300 mmol·L-1 NaCl, 300 mmol·L-1咪唑, 调pH=8.0。4°C保存。使用前加入1 mmol·L-1 PMSF (见注意事项4)。
$\bullet$ MBP标签蛋白缓冲液
(1) 裂解缓冲液B (column buffer): 200 mmol·L-1 NaCl, 20 mmol·L-1 Tris-HCl (pH7.4), 1 mmol·L-1 EDTA, 使用前加入1 mmol·L-1 DTT和1 mmol·L-1 PMSF。
(2) 洗脱缓冲液4: 200 mmol·L-1 NaCl, 20 mmol·L-1 Tris-HCl (pH7.4), 1 mmol·L-1 EDTA, 10 mmol·L-1麦芽糖, 使用前加入1 mmol·L-1 DTT和1 mmol·L-1 PMSF。
3.3 原核表达的E1、E2和泛素蛋白
蛋白包括小麦及拟南芥E1、人的E2基因(见1. 2节(1) )在大肠杆菌中表达的蛋白粗提物、纯化的拟南芥泛素、E1、E2和E3蛋白。-20°C保存。4 设备
设备包括恒温摇床、冷冻高速离心机、翻转混合仪和恒温混匀仪。5 实验程序
5.1 蛋白质在大肠杆菌中的表达及纯化
5.1.1 大肠杆菌中蛋白质的诱导表达将质粒转化至大肠杆菌BL21 (DE3)或其它适宜菌株中。挑取2-3个克隆放入5 mL含有相应抗生素的LB液体培养基中, 37°C振荡培养。将过夜培养物用含有0.2%葡萄糖及抗生素的LB液体培养基稀释至光吸收值OD600?0.1, 然后18°C振荡培养。当OD600值达到0.4-0.6时, 用终浓度为0.2 mmol·L-1的IPTG诱导蛋白表达。将细胞继续在18°C下振荡培养12-16小时, 4°C离心收集菌体。将表达带有6×His标签蛋白质的细胞沉淀用裂解缓冲液A重悬, 而含有MBP融合蛋白的菌体则用裂解缓冲液B悬浮, 然后用超声波细胞粉碎仪或压力细胞破碎仪将细胞裂解。细胞裂解物在4°C、13 000 ×g离心45分钟, 将上清液移至新管中。
5.1.2 6×His标签融合蛋白的纯化
将Ni-NTA agarose装柱。用裂解缓冲液A洗涤珠子后, 用相当于珠子10倍体积的结合缓冲液平衡柱子, 然后使含有重组蛋白的上清液流过柱子(流速控制在约1 mL·min-1)。随后用相当于珠子5倍体积的洗涤缓冲液洗涤柱子, 再依次用适当体积(如每种2 mL)的洗脱缓冲液1、2、3将蛋白从柱子上洗脱下来(见注意事项5), 收集每一步操作的样品, 采用SDS-PAGE电泳检测纯化结果。
5.1.3 MBP标签融合蛋白的纯化
将淀粉酶树脂(amylase resin)珠子装柱, 用裂解缓冲液B洗涤珠子后, 使含有重组蛋白的上清液流过柱子(流速控制在约1 mL·min-1)。用相当于珠子12倍体积的裂解缓冲液B洗涤柱子, 然后用洗脱缓冲液4 (即含有10 mmol·L-1麦芽糖的裂解缓冲液B)洗脱蛋白。以1 mL体积为单位依次收集洗脱成分。通常在前5个管中可以得到足够多的目的蛋白。收集每一步操作的样品, 采用SDS-PAGE电泳检测纯化结果。
5.1.4 纯化蛋白的超滤脱盐
将洗脱缓冲液中已纯化的蛋白质用PBS (1×)稀释至15 mL, 将此溶液加至用无菌水预洗过的超滤管(Amicon ultra 15)的滤膜上。4°C、4 000 ×g离心至膜上剩余体积在0.2-0.5 mL左右。超滤后的蛋白可定量检测或用SDS-PAGE凝胶电泳进行分析。超滤后蛋白可加入15%-20%体积的甘油。小体积分装蛋白, -80°C保存(见注意事项6)。
5.2 E2-泛素形成对DTT敏感的硫酯键的分析(E2活性的检测)
由于在泛素化修饰过程中, E2的保守Cys通过硫酯键与泛素分子的羧基共价连接, 而这种连接可以通过添加还原剂被打开, 因此可以通过检测是否能与泛素形成对DTT或巯基乙醇敏感的硫酯键来判断预测为E2的蛋白是否真正具有E2活性(Zhao et al., 2013; 张祥云等, 2018)。总反应体系为30 μL, 包括1.5 μL 20× buffer (见3.1节)、50 ng E1、200-500 ng E2及2 μg泛素蛋白。将反应体系在37°C孵育5分钟, 平均分为2份, 分别加入含有或不含有DTT (或β-巯基乙醇)的SDS上样缓冲液(4×)终止反应, 100°C煮沸样品5分钟, 反应产物用12% SDS-PAGE电泳分离, 并用anti-His (或Nickel-HRP)或anti-Ub抗体进行western blot检测。实验时要注意设置不加泛素的对照反应。具体反应实例见图1 (Zhao et al., 2013)。在E2和Ub同时存在时, 箭头所指条带只在无DTT的反应产物中出现, 而在添加DTT的泳道中消失了, 同时该条带分子量与E2-Ub中间体或者E2耦联2个或多个Ub的化合物(E2-Ubn)分子量相符, 说明该条带代表了对DTT敏感的E2-Ub或E2-Ubn, 因此该条带的出现表明该E2具有泛素耦联酶活性。只有E2而未加入Ub的泳道作为对照, 能显示出未参与泛素化反应的E2蛋白的位置(三角形所指条带)。图1所用的9个E2中, 除UBC27的反应产物未出现E2-Ub或E2-Ubn外, 其它8个蛋白都有此类条带出现, 说明在现有反应条件下未能检测到UBC27的E2活性, 而UBC3、UBC19、UBC6、UBC35、UBC5、UBC22、UBC32和UBC13均具有E2活性。
图1
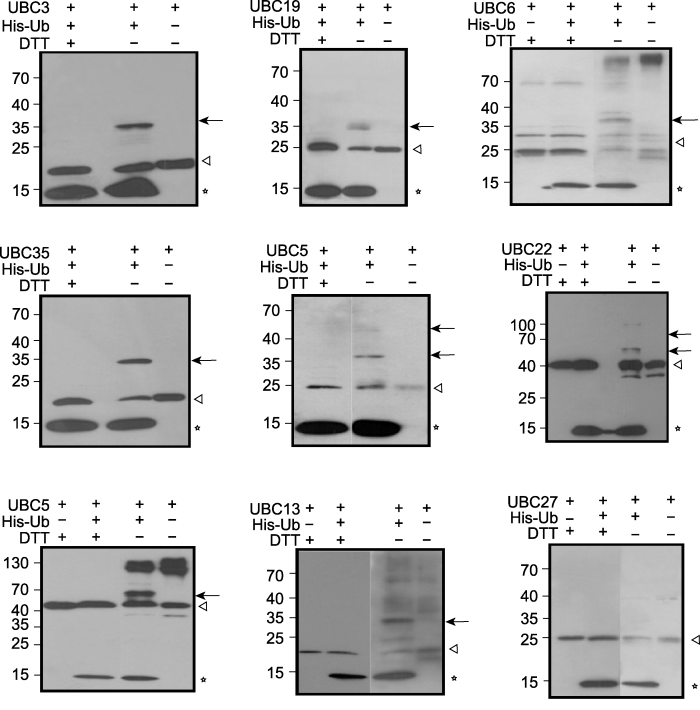 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1E2-泛素结合能力实验(Zhao et al., 2013)
利用原核表达纯化得到的His-E2和His-Ub进行体外泛素化反应, 根据是否能产生对DTT敏感的硫酯键, 判断E2是否具有结合泛素的能力。箭头所指条带即为含有对DTT敏感硫酯键的His-E2-Ub或His-E2-Ubn化合物, 三角形所指是未与Ub结合的His-E2, 星号所指为游离的His-Ub。
Figure 1E2 ubiquitin conjugation assay (Zhao et al., 2013)
In vitro ubiquitination assay was performed with purified His-E2 and His-Ub protein expressed in bacteria. E2-ubiquitin conjugation was detected by whether the DTT-sensitive thioester linkage can form or not. The arrows indicate the DTT-sensitive thioester linkage, the open triangles indicate bands of E2 protein itself that was not attached to Ub, and asterisks indicate His’s-tagged Ub.
5.3 E3活性检测及不同E2-E3特异性组合的活性分析
5.3.1 亲和纯化E3蛋白在泛素化反应前进行E3蛋白纯化。将结合在淀粉酶树脂珠子上的MBP-E3蛋白直接进行泛素化活性分析。具体步骤为: 用1 mL裂解缓冲液B预洗珠子, 400 ×g离心2分钟, 小心地去除上清, 向含有预洗好的珠子的管中加入0.5-1 mL蛋白粗提物(其中含有E3蛋白总量为0.5-1 μg), 室温下旋转孵育1小时使蛋白与珠子充分结合, 400 ×g离心2分钟, 小心地去除上清, 分别用1 mL 50 mmol·L-1 Tris-HCl (pH7.5)洗涤珠子3次, 最后用细小的枪头小心移去所有上清。
5.3.2 E3自身泛素化活性分析(待测E3的泛素化活性检测)
准备总体积为30 μL的反应体系。包括1.5 μL反应缓冲液(20×) (见3.1节)、50 ng小麦或拟南芥E1、200-500 ng E2和5 μg泛素蛋白。将反应体系加入含有已结合上MBP-E3蛋白的amylase resin珠子的eppendorf管中, 在恒温混匀仪上30°C振荡(≥900 rpm)孵育1.5小时(已经提前亲和纯化洗脱并超滤的E3蛋白, 可直接与反应体系混合孵育, 无须振荡)。反应结束后, 加入含有β-巯基乙醇(或DTT)的SDS上样缓冲液(4×)终止反应, 100°C煮沸样品5分钟, 反应产物用10%-12% SDS-PAGE电泳分离, 用anti-His或anti-Ub抗体进行western blot检测是否有多聚泛素链的生成。同样的反应产物还可以用anti-MBP进行western blot分析, 可以对比确定是否在E3蛋白上有单泛素化或多聚泛素化链的修饰。注意需要设置不同的对照反应, 包括分别缺少E1、E2以及用标签蛋白MBP代替MBP-E3等。
对于待测E3活性的蛋白, 可以先选用已知活性比较广谱的小麦E1和人的E2 (见1.2节(1))进行E3活性检测。也可用拟南芥的E1和E2进行反应。具体反应实例见图2 (Zhang et al., 2007)。向反应体系中加入小麦E1和人的E2 UBCH5b进行MBP-SDIR1的泛素化反应, 反应产物分别利用Nickel-HRP (检测HisUb蛋白)及anti-MBP抗体进行western blot分析。图2左图中只有在E1、E2和MBP-SDIR1同时存在时, 用Nickel-HRP才可以检测到多聚泛素链的生成; 右图中MBP抗体可以检测到各泳道中的MBP-SDIR1及作为对照的MBP蛋白。但只有E1、E2和MBP-SDIR1同时存在的泳道中, MBP-SDIR1蛋白分子量上方有大量的弥散条带存在, 表明多聚泛素链确实已连接到MBP-SDIR1分子上; 当缺少E1、E2任意一种蛋白时, 则不能检测到这种泛素链的存在。将SDIR1的RING结构域中关键位点H234突变成Y后, 则不能形成泛素链(图2中H234Y泳道), 表明RING结构域对于SDIR1的自身泛素化活性必不可少。上述结果表明SDIR1具有自身泛素化活性, 是一个真正的RING类型的泛素连接酶(E3)。
图2
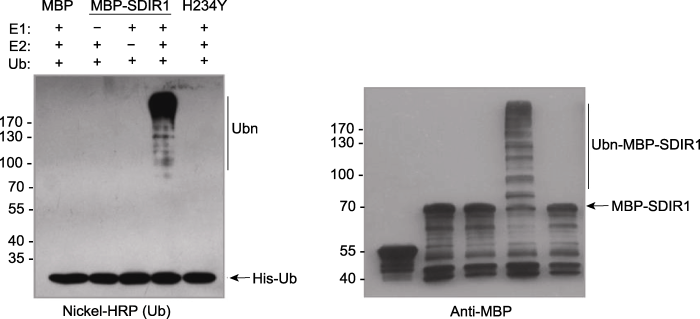 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2SDIR1的自身泛素化反应(E3活性检测) (Zhang et al., 2007)
在小麦E1、E2 (UBCH5b)和His-Ub存在的情况下, 检测MBP-SDIR1及其突变形式MBP-SDIR1 (H234Y)的E3活性, 以MBP蛋白作为阴性对照。反应产物经8% SDS-PAGE胶分离后, 分别用Nickel-HRP (左图)和anti-MBP抗体(右图)进行western blot检测。
Figure 2Autoubiquitination assay (E3 activity assay) of SDIR1 (Zhang et al., 2007)
The E3 ligase activity of MBP-SDIR1 and its mutation form MBP-SDIR1 (H234Y) was detected at the presence of E1, E2 (UBCH5b) and His-Ub. MBP acts as the negative control. The reaction products were resolved by 8% SDS-PAGE gel and then western blot was performed with Nickel-HRP (left part) or anti-MBP (right part) antibody, respectively.
5.3.3 E2-E3组合特异性的分析
任何一个蛋白质被泛素化修饰都需要特定E1、E2和E3的共同参与。拟南芥基因组只有2个E1, 它们在所有的泛素化反应中是比较通用的; 但37个E2与1 500多个E3之间存在着大量的E2-E3特异性组合, 即一个特定的E2/E3会与一个或几个特定的E3/E2协同作用, 负责特定底物蛋白的泛素化修饰, 从而在不同信号通路或代谢途径中发挥重要调控作用, 已有研究也证实了这一点(Turek et al., 2018)。但目前已知的特定E2-E3组合还很少, 大量的E2-E3组合有待挖掘。首先通过体外反应进行不同E2-E3组合的泛素化活性检测, 是简便快捷地获得大量信息的有效方式, 可为生物体内功能分析提供有价值的研究线索和方向。
拟南芥中37个E2分属12个亚家族, 利用本系统克隆表达了这12个亚家族各自至少1个成员, 分别与特定E3蛋白进行泛素化反应, 用于分析E2-E3泛素化反应的特异性。同时设置多个平行的反应体系, 采用相同的E1并分别加入1种拟南芥E2, 与待测E3进行5.3.2节所述的泛素化反应, 就可以分析该E3在不同E2存在时是否表现出泛素化活性; 同样地, 也可以将同一种E2分别与多个E3蛋白组合进行泛素化反应。通过分析这些不同的E2-E3组合能否产生多聚泛素链, 可以初步找出特异性协同作用的E2-E3组合, 为研究它们在体内的生物学功能提供线索。具体反应实例见图3 (Zhao et al., 2013)。
图3
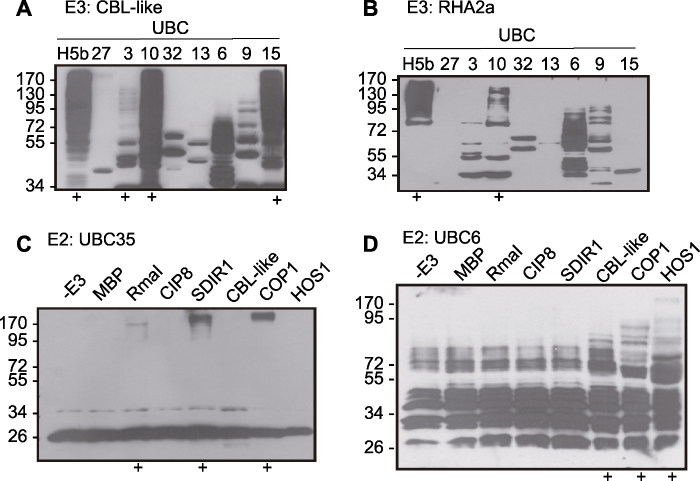 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同E2-E3特异性相互作用(Zhao et al., 2013)
将一种E3分别与不同E2组合(A, B), 或者将同一种E2分别与不同的E3组合(C, D)进行体外泛素化反应。其中, (A)和(B)中UBCH5b为阳性对照, (C)和(D)中-E3及MBP为阴性对照。反应产物用anti-His抗体进行western blot检测。泳道下方的+代表多聚泛素链的生成。
Figure 3The specificity of various E2-E3 combinations (Zhao et al., 2013)
The ubiquitination activity was detected at the case of one E3 combined with different E2s (A, B) or one E2 combined with different E3s (C, D). UBCH5b is positive control in (A) and (B) while -E3 and MBP are negative control in (C) and (D). The outcome of reaction was detected by western blot with anti-His antibody. Plus symbols below the lanes indicate the formation of poly-Ub chains.
图3A (CBL-like)和B (RHA2a)用于检测同一E3与不同E2的作用特异性。其中, 以人的UBCH5b作为正对照, 拟南芥UBC27、UBC3、UBC10、UBC32、UBC13、UBC6、UBC19及UBC15作为待测E2。结果显示, CBL-like在UBC10或UBC35存在时有较强的多聚泛素链信号, UBC3参与的反应中有很弱的信号出现, 因此UBC10-CBL-like、UBC35-CBL-like和UBC3-CBL-like可能是体内存在的特异E2-E3组合, 其它几个E2的功能可能与CBL-like无关, 可能与其它的E3协同作用。同样地, UBC10-RHA2a可能是体内天然存在的E2-E3组合, 其它7个E2与RHA2a无协同作用。
图3C (UBC35)和D (UBC6)用于检测同一E2与不同E3的特异性作用。其中以-E3及MBP为阴性对照, 在这2个泳道出现的条带代表His-E2蛋白和/或E2-Ub、E2-Ubn信号(即E2自身泛素化活性), 反应产物中出现比E3蛋白分子量更大的条带时才是E3催化产生的多聚泛素链, 此信号代表E3具有活性。结果表明, 在UBC35作为E2时, RmaI、SDIR1和COP1泳道可检测到多聚泛素链信号, CIP8、CBL-like和HOS1则未表现出自身泛素化活性(图3C); 而UBC6作为E2时, CBL-like、COP1和HOS1能检测到较弱的多聚泛素链信号, RmaI、CIP8和SDIR1则未检测到活性(图3D)。因此, UBC35-RmaI、UBC35-SDIR1、UBC35-COP1、UBC6-CBL-like、UBC6-COP1和UBC6-HOS1可能是特定的E2-E3组合。
5.4 E3/底物泛素化反应分析
通过对特定蛋白质的泛素化修饰调节其随后的降解或去向等, 可以使细胞对特定信号迅速做出响应, 以适应内外环境的改变。因此, 对于一个特定的泛素化修饰事件, 底物的选择至关重要。泛素连接酶(E3)通过与底物直接相互作用, 在底物的特异性选择上起决定作用。由于细胞内作为泛素化底物的蛋白质种类极其多, 因此探索上千种E3的底物特异性, 是一项重要且艰巨的任务。我们利用体外泛素化系统能同时检测多个E3-底物组合的泛素化活性, 从而为体内功能分析提供重要信息和线索。首先分别构建E3和底物的表达载体以进行相应的蛋白表达和纯化。一般情况下, E3可利用原核系统进行表达纯化(若原核中表达情况不理想也可用植物或其它系统表达蛋白), 如构建在pMalC2载体上得到MBP-E3融合蛋白。底物可根据具体情况选择原核或者植物系统表达, 但一定要选择与E3不同的标签融合来构建重组蛋白(Xie et al., 2002; Zhang et al., 2015)。
利用亲和纯化方法得到带有E3蛋白的珠子(可以在此情况下直接进行后续反应, 也可用洗脱下来的蛋白), 然后向含有该珠子的EP管中加入以下反应成分(总体积30 μL): 1.5 μL反应缓冲液(20×) (见3.1节), 50 ng E1, 200-500 ng E2, 0.5-2 μg底物蛋白, 5 μg泛素蛋白。将反应体系在恒温混匀仪上30°C振荡孵育1.5小时, 加入10 μL含有β-巯基乙醇的SDS上样缓冲液(4×)终止反应, 100°C煮沸样品5分钟。反应产物用10%或12%的SDS-PAGE电泳分离, 用相应的标签抗体及anti-Ub进行western blot分析。注意需要设置不同的对照反应, 包括分别缺少E1、E2以及用标签蛋白MBP代替MBP-E3等。反应实例见图4 (Zhang et al., 2015)。
图4
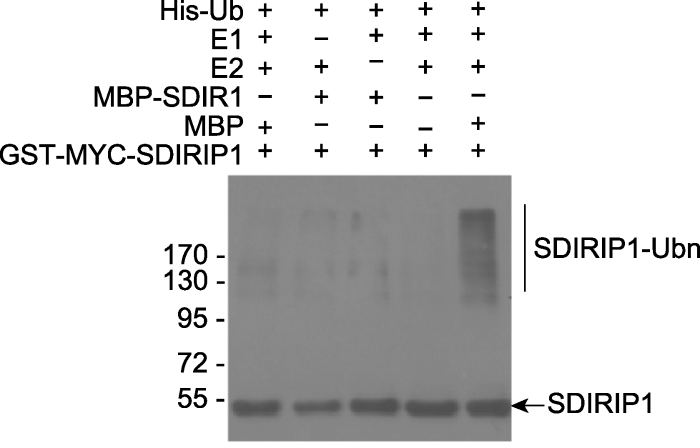 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4SDIR1-SDIRIP1的E3-底物泛素化反应(Zhang et al., 2015)
MBP-SDIR1和GST-MYC-SDIRIP1共同孵育进行体外泛素化反应。反应产物用anti-MYC进行western blot检测。
Figure 4E3-substrate ubiquitination assay of SDIR1-SDIRIP1 pair (Zhang et al., 2015)
MBP-SDIR1 and GST-MYC-SDIRIP1 was incubated together for in vitro ubiquitination assay. The western blot was analyzed using anti-MYC antibody.
首先得到原核表达纯化MBP-SDIR1 (E3)和GST-MYC-SDIRIP1 (底物)蛋白。将这两种蛋白按照上述方法进行E3/底物体外泛素化反应, 反应产物利用anti-MYC抗体进行western blot分析。在E1、E2及泛素同时存在的情况下(右侧第1泳道), SDIRIP1可以被SDIR1进行多聚泛素化修饰, 而当缺少其中任意一种蛋白时则不能检测到这种泛素化的存在。左侧第1泳道以MBP代替MBP-SDIR1, 结果未检测到多聚泛素链信号, 说明右侧第1泳道多聚泛素链的出现是SDIR1而非MBP的作用结果。上述结果表明, SDIRIP1是E3 SDIR1的底物蛋白。
6 注意事项
(1) 目前各种标签融合蛋白获得方法是购买相应的磁珠产品, 根据产品说明书进行蛋白纯化。磁珠纯化相比常规的亲和纯化步骤简化, 但费用较高, 可以根据实际情况选择。本文列出的是对MBP标签和His标签进行常规亲和纯化所需用品及方法。(2) 本实验所用的“水”均是电阻值为18.2 ΜΩ的超纯水;
(3) IPTG、DTT、PMSF和ATP等试剂在室温下会快速失活, 因此这些试剂的母液及用ATP、DTT配置的泛素化反应缓冲液的母液均需小体积分装并在-20°C保存。在使用前取出溶解, 并避免反复冻融。
(4) 3种His标签融合蛋白洗脱缓冲液的唯一区别是咪唑的浓度不同。建议第1次实验时摸索不同洗脱缓冲液效果, 以便确定哪种洗脱缓冲液中能够包含最大量的目的蛋白。
(5) 6×His融合蛋白的纯化需要使用高纯度的咪唑。结合缓冲液、洗涤缓冲液及洗脱缓冲液中咪唑的浓度对于蛋白纯化的效率至关重要。为了得到最高纯度的目的蛋白, 建议在实验前设置咪唑的浓度梯度进行预实验, 以确定最适咪唑使用浓度。
(6) 为了最大限度地保留蛋白的活性, 相关操作均应在冰上快速进行。通常情况下, 保存在-80°C或-20°C比在4°C下更有利于蛋白活性的维持。蛋白在4°C下放置一段时间后其活性会明显下降。因此应将蛋白小体积分装成多份, 在-80°C保存, 使用前再取出融化。同时要避免反复冻融。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 5]
[本文引用: 3]
[本文引用: 7]
小麦TaUBC基因泛素结合酶活性分析
1
2018
... 由于在泛素化修饰过程中, E2的保守Cys通过硫酯键与泛素分子的羧基共价连接, 而这种连接可以通过添加还原剂被打开, 因此可以通过检测是否能与泛素形成对DTT或巯基乙醇敏感的硫酯键来判断预测为E2的蛋白是否真正具有E2活性(
Ubiquitylation in plants: a post-genomic look at a post-translational modification
1
2001
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
The ubiquitination machinery of the ubiquitin system
1
2014
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
The cullin-RING ubipuitinprotein ligases
1
2011
... 在消耗ATP的前提下, 泛素(ubiquitin, Ub)羧基端的甘氨酸残基与泛素激活酶(E1)活性中心的半胱氨酸巯基之间形成硫酯键, 接着泛素分子被转移到泛素耦联酶的半胱氨酸巯基上, 然后由泛素连接酶(E3)介导, 将泛素转移到靶蛋白分子的赖氨酸残基上.E3根据其作用方式分为两大类型: HECT类型的E3首先接受E2上的泛素分子, 与泛素通过硫酯键连接, 然后再将泛素转移到底物上; 而RING/U-box类型的E3并不与泛素共价连接, 它作为中间体将E2和底物在空间上尽量靠近, 促使泛素分子从E2上直接转移到底物蛋白.被泛素化的蛋白质在被26S蛋白酶体降解之前, 由去泛素化酶(deubiquitinating enzyme, DUB)将泛素链从底物蛋白上移除, 供循环利用(
Genome analysis and functional characterization of the E2 and RING-type E3 ligase ubiquitination enzymes of Arabidopsis
1
2005
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
What was the set of ubiquitin and ubiquitin-like conjugating enzymes in the eukaryote common ancestor?
1
2009
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
Ubiquitylation in plants: signaling hub for the integration of environmental signals
1
2018
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
Epigenetic and posttranslational modifications in light signal transduction and the circadian clock in Neurospora crassa
1
2015
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
The ubiquitin 26S proteasome proteolytic pathway
2
2004
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
... 在消耗ATP的前提下, 泛素(ubiquitin, Ub)羧基端的甘氨酸残基与泛素激活酶(E1)活性中心的半胱氨酸巯基之间形成硫酯键, 接着泛素分子被转移到泛素耦联酶的半胱氨酸巯基上, 然后由泛素连接酶(E3)介导, 将泛素转移到靶蛋白分子的赖氨酸残基上.E3根据其作用方式分为两大类型: HECT类型的E3首先接受E2上的泛素分子, 与泛素通过硫酯键连接, 然后再将泛素转移到底物上; 而RING/U-box类型的E3并不与泛素共价连接, 它作为中间体将E2和底物在空间上尽量靠近, 促使泛素分子从E2上直接转移到底物蛋白.被泛素化的蛋白质在被26S蛋白酶体降解之前, 由去泛素化酶(deubiquitinating enzyme, DUB)将泛素链从底物蛋白上移除, 供循环利用(
Multi-tiered pairing selectivity between E2 ubiquitin-conjugating enzymes and E3 ligases
1
2018
... 任何一个蛋白质被泛素化修饰都需要特定E1、E2和E3的共同参与.拟南芥基因组只有2个E1, 它们在所有的泛素化反应中是比较通用的; 但37个E2与1 500多个E3之间存在着大量的E2-E3特异性组合, 即一个特定的E2/E3会与一个或几个特定的E3/E2协同作用, 负责特定底物蛋白的泛素化修饰, 从而在不同信号通路或代谢途径中发挥重要调控作用, 已有研究也证实了这一点(
The ubiquitin/26S proteasome pathway, the complex last chapter in the life of many plant proteins
1
2003
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
The ubiquitin-26S proteasome system at the nexus of plant biology
1
2009
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
The expanding universe of ubiquitin and ubiquitin-like modifiers
1
2012
... 蛋白质泛素化修饰在真核细胞内具有重要的生物学功能.泛素蛋白共价连接到底物上需要3种酶依次的协同作用: 泛素激活酶(ubiquitin activating enzyme, E1)、泛素耦联酶(ubiquitin conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3) (
SINAT5 promotes ubiquitin-related degradation of NAC1 to attenuate auxin signals
2
2002
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
... 首先分别构建E3和底物的表达载体以进行相应的蛋白表达和纯化.一般情况下, E3可利用原核系统进行表达纯化(若原核中表达情况不理想也可用植物或其它系统表达蛋白), 如构建在pMalC2载体上得到MBP-E3融合蛋白.底物可根据具体情况选择原核或者植物系统表达, 但一定要选择与E3不同的标签融合来构建重组蛋白(
COP1 and ELF3 control circadian function and photoperiodic flowering by regulating GI stability
1
2008
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
The RING finger ubiquitin E3 ligase SDIR1 targets SDIR1-INTERACTING PROTEIN1 for degradation to modulate the salt stress response and ABA signaling in Arabidopsis
5
2015
... 拟南芥中有2个泛素激活酶、37个泛素耦联酶、8个泛素耦联酶-like蛋白, 以及超过1 500个泛素连接酶.特异性底物的识别主要由E3决定(
... 首先分别构建E3和底物的表达载体以进行相应的蛋白表达和纯化.一般情况下, E3可利用原核系统进行表达纯化(若原核中表达情况不理想也可用植物或其它系统表达蛋白), 如构建在pMalC2载体上得到MBP-E3融合蛋白.底物可根据具体情况选择原核或者植物系统表达, 但一定要选择与E3不同的标签融合来构建重组蛋白(
... 利用亲和纯化方法得到带有E3蛋白的珠子(可以在此情况下直接进行后续反应, 也可用洗脱下来的蛋白), 然后向含有该珠子的EP管中加入以下反应成分(总体积30 μL): 1.5 μL反应缓冲液(20×) (见3.1节), 50 ng E1, 200-500 ng E2, 0.5-2 μg底物蛋白, 5 μg泛素蛋白.将反应体系在恒温混匀仪上30°C振荡孵育1.5小时, 加入10 μL含有β-巯基乙醇的SDS上样缓冲液(4×)终止反应, 100°C煮沸样品5分钟.反应产物用10%或12%的SDS-PAGE电泳分离, 用相应的标签抗体及anti-Ub进行western blot分析.注意需要设置不同的对照反应, 包括分别缺少E1、E2以及用标签蛋白MBP代替MBP-E3等.反应实例见
... SDIR1-SDIRIP1的E3-底物泛素化反应(
... MBP-SDIR1和GST-MYC-SDIRIP1共同孵育进行体外泛素化反应.反应产物用anti-MYC进行western blot检测.
SDIR1 is a RING finger E3 ligase that positively regulates stress-responsive abscisic acid signaling in Arabidopsis
3
2007
... 对于待测E3活性的蛋白, 可以先选用已知活性比较广谱的小麦E1和人的E2 (见1.2节(1))进行E3活性检测.也可用拟南芥的E1和E2进行反应.具体反应实例见
... SDIR1的自身泛素化反应(E3活性检测) (
... 在小麦E1、E2 (UBCH5b)和His-Ub存在的情况下, 检测MBP-SDIR1及其突变形式MBP-SDIR1 (H234Y)的E3活性, 以MBP蛋白作为阴性对照.反应产物经8% SDS-PAGE胶分离后, 分别用Nickel-HRP (左图)和anti-MBP抗体(右图)进行western blot检测.
A plant-specific in vitro ubiquitination analysis system
7
2013
... 由于在泛素化修饰过程中, E2的保守Cys通过硫酯键与泛素分子的羧基共价连接, 而这种连接可以通过添加还原剂被打开, 因此可以通过检测是否能与泛素形成对DTT或巯基乙醇敏感的硫酯键来判断预测为E2的蛋白是否真正具有E2活性(
... 总反应体系为30 μL, 包括1.5 μL 20× buffer (见3.1节)、50 ng E1、200-500 ng E2及2 μg泛素蛋白.将反应体系在37°C孵育5分钟, 平均分为2份, 分别加入含有或不含有DTT (或β-巯基乙醇)的SDS上样缓冲液(4×)终止反应, 100°C煮沸样品5分钟, 反应产物用12% SDS-PAGE电泳分离, 并用anti-His (或Nickel-HRP)或anti-Ub抗体进行western blot检测.实验时要注意设置不加泛素的对照反应.具体反应实例见
... E2-泛素结合能力实验(
... 利用原核表达纯化得到的His-E2和His-Ub进行体外泛素化反应, 根据是否能产生对DTT敏感的硫酯键, 判断E2是否具有结合泛素的能力.箭头所指条带即为含有对DTT敏感硫酯键的His-E2-Ub或His-E2-Ubn化合物, 三角形所指是未与Ub结合的His-E2, 星号所指为游离的His-Ub.
... 拟南芥中37个E2分属12个亚家族, 利用本系统克隆表达了这12个亚家族各自至少1个成员, 分别与特定E3蛋白进行泛素化反应, 用于分析E2-E3泛素化反应的特异性.同时设置多个平行的反应体系, 采用相同的E1并分别加入1种拟南芥E2, 与待测E3进行5.3.2节所述的泛素化反应, 就可以分析该E3在不同E2存在时是否表现出泛素化活性; 同样地, 也可以将同一种E2分别与多个E3蛋白组合进行泛素化反应.通过分析这些不同的E2-E3组合能否产生多聚泛素链, 可以初步找出特异性协同作用的E2-E3组合, 为研究它们在体内的生物学功能提供线索.具体反应实例见
... 不同E2-E3特异性相互作用(
... 将一种E3分别与不同E2组合(A, B), 或者将同一种E2分别与不同的E3组合(C, D)进行体外泛素化反应.其中, (A)和(B)中UBCH5b为阳性对照, (C)和(D)中-E3及MBP为阴性对照.反应产物用anti-His抗体进行western blot检测.泳道下方的+代表多聚泛素链的生成.
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
