叶雯澜, 马国兰, 袁李亚男, 郑士仪, 程琳乔, 方媛
, * , 饶玉春
, * 浙江师范大学化学与生命科学学院, 金华 321004
Research Progress on Pathogenic Characteristics and Resistance of Bacterial Panicle Blight of Rice Wenlan Ye, Guolan Ma, liyanan Yuan, Shiyi Zheng, Linqiao Cheng, Yuan Fang
, * , Yuchun Rao
, * College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China
通讯作者: * E-mail: fy0579@zjnu.cn ; ryc@zjnu.cn 责任编辑: 朱亚娜
收稿日期: 2018-09-17
接受日期: 2018-12-10
网络出版日期: 2019-03-10
基金资助: 国家转基因重大科技专项 (2016ZX08009003-003-008 )2018年浙江省大学生科技创新活动计划新苗人才计划 (2018R404001 )2018年浙江省大学生科技创新活动计划新苗人才计划 (2018R404029 )
Corresponding authors: * E-mail: fy0579@zjnu.cn ; ryc@zjnu.cn Received: 2018-09-17
Accepted: 2018-12-10
Online: 2019-03-10
摘要 水稻(Oryza sativa )细菌性穗枯病是世界性的重要病害之一, 严重威胁全球范围水稻的高产稳产。虽然该病目前仍被列为我国的检疫性病害, 但近几年的研究表明, 穗枯病随时有在内地蔓延的潜在危险, 因此除了加强检疫工作, 开展针对性的防控技术研发也十分必要。水稻细菌性穗枯病菌在侵染过程中涉及多种毒力因子, 同时, 水稻在与病原菌的长期互作过程中演化出了多种防卫机制, 抗性基因是主要的防卫机制之一。挖掘水稻基因组中抗细菌性穗枯病遗传位点并培育抗病品种是最安全且经济有效的防治途径。该文综述了水稻细菌性穗枯病的病原菌特性、发病特征、发病机制、病害循环和对水稻细菌性穗枯病的抗性研究现状, 以期为挖掘和分离水稻穗枯病抗性位点提供参考。 关键词: 水稻 ;
细菌性穗枯病 ;
颖壳伯克氏菌 ;
抗性 Abstract Bacterial panicle blight of rice (BPBR) is one of the most important diseases of rice; it seriously threatens the high and stable yield of rice in the world. Although the disease is still listed as a quarantine disease in China, recent studies have shown that BPBR can spread at any time. Therefore, in addition to strengthening quarantine work, targeted control technology research is needed. During the process of infection, Burkholderia glumae has evolved multiple virulence factors. However, at the same time, rice has evolved a variety of defense mechanisms during the long-term interaction between rice and pathogens. Resistance genes are one of the main defense mechanisms. Therefore, mining the resistance locus of BPBR on the rice genome and breeding resistant varieties is the safest and most effective way to control the disease. To provide references for excavation and separation resistance sites, this paper reviews the pathogenic characteristics, pathogenesis, disease cycle and rice resistance to BPBR. Keywords: rice ;
bacterial panicle blight ;
Burkholderia glumae ;
resistance PDF (2032KB) 摘要页面 多维度评价 相关文章 导出 EndNote |
Ris |
Bibtex 收藏本文 引用本文 叶雯澜, 马国兰, 袁李亚男, 郑士仪, 程琳乔, 方媛, 饶玉春 . 水稻细菌性穗枯病的病原特性和抗性研究进展. 植物学报, 2019,
54 (2): 277-283 doi:10.11983/CBB18197
Ye Wenlan, Ma Guolan, Yuan liyanan, Zheng Shiyi, Cheng Linqiao, Fang Yuan, Rao Yuchun .
Research Progress on Pathogenic Characteristics and Resistance of Bacterial Panicle Blight of Rice .
Chinese Bulletin of Botany , 2019,
54 (2): 277-283 doi:10.11983/CBB18197
水稻细菌性穗枯病(bacterial panicle blight of rice, BPBR), 又称水稻细菌性颖枯病(bacterial panicle rot), 是限制水稻(
Oryza sativa )产量和品质的主要病害之一。水稻细菌性穗枯病发病时不但侵害谷粒, 还引起秧苗严重腐烂(
罗金燕等, 2008 )。该病最早于1956年在日本九州由
Goto和Ohata (1956) 发现, 初期一直是日本水稻的次要病害, 后因大面积工厂化育苗而逐渐成为日本水稻生产上的严重病害。目前该种病害已经蔓延到东南亚、非洲及美洲的水稻种植地, 造成大幅减产。
Trung等(1993) 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%。2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险。
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势。
细菌性穗枯病在各地流行前期很容易被忽略, 一是由于感病轻的带病稻种无明显症状, 基本与健康稻种无异; 二是水稻细菌性穗枯病与由水稻真菌性穗枯病引起的谷粒外部症状十分相似。因此, 尽管目前细菌性穗枯病未发现在我国爆发成灾, 但随着全球气候变暖以及工厂化育秧和机械化移栽技术的广泛应用, 适宜的外部条件很有可能引起病害流行。然而, 国内对于细菌性穗枯病的综合研究仅处于早期阶段。为避免我国重蹈其它国家的覆辙, 除了加强检疫工作, 开展针对性的防控技术研发, 如利用传统的实验技术与现代分子生物学技术相结合来探明水稻细菌性穗枯病抗性基因, 进而培育抗病品种也是当务之急。
1 病原菌 水稻细菌性穗枯病病原菌是颖壳伯克氏菌。
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 )。目前已成功研发出用于检测该菌的选择性培养基。在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 )。
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 )。
运用高通量测序和生物信息学分析,
B. glumae 的组学研究得到了快速发展。
Lim等(2009) 首先报道来自韩国的水稻品种标准菌株
B. glumae BGR1的基因组序列, 该菌株包含2条染色体和4条质粒。浙江大学生物技术研究所发表了高毒力菌株LMG2196的基因组草图(
Cui et al., 2016 )。
Francis等(2013) 开展了BGR1和从美国分离的高毒力菌株336gr-1的比较基因组学分析, 发现了含有可移动因子和噬菌体相关基因的独特区域, 这些区域的强可塑性使细菌能够适应各种环境变化, 有可能就是预测的基因组岛, 但两种菌株在已知和潜在的毒力因子中只检测到很小的变异。
Kim等(2014) 通过转录组学分析发现, 在体内条件下, 与介导细菌趋化性运动、抗坏血酸和海藻糖代谢以及糖转运蛋白(包括阿拉伯糖和木糖)相关的大多数基因高度富集, 且其转录水平显著升高。
2 发病症状 细菌性穗枯病的病症十分明显, 但水稻不同发育时期受病原菌侵染引起的病症不同。谷粒萌发时, 表现为谷粒腐烂, 且在腐烂植株周围可形成发病中心。谷粒萌发后, 幼芽弯曲, 出现淡褐色条斑, 后逐渐枯死, 幸存病苗的叶鞘病健交界处明显呈深褐色带状。病原菌群体数量较少时, 被侵染的水稻秧苗不会表现出明显的病症, 移栽后也不会表现出症状, 但病原菌潜伏在稻株内, 直到孕穗期病菌急剧增殖, 在剑叶叶鞘内部(发病较轻时)或外部(发病较重时)呈现黄褐色或褐色长条状病斑。在抽穗期, 幼穗因挤压被病菌感染的叶鞘而感病, 感病稻穗在田间呈块状分布, 发病较重的稻株常出现腐败、枯死, 发病较轻的叶片变白, 叶鞘发褐, 叶舌卷曲。在乳熟期, 少量病原菌侵染稻穗便可以迅速引起谷粒变色, 谷粒感染后, 初期呈现似失水状萎凋的苍白色, 后逐渐变为灰白色至深褐色, 且出现空瘪不实或萎缩畸形的现象, 而枝梗和穗轴仍表现为健康稻穗的绿色(
罗金燕, 2007 )。
李路等(2015) 将其病状简单概括为“秆青, 叶绿, 穗腐, 谷枯”。
3 发病机制 水稻细菌性穗枯病的发病机制是一个复杂的过程, 涉及多种毒力因子。运用分子遗传学研究手段已经确定
B. glumae 为主要致病因素。其中, 最重要的因素是毒黄菌素(toxoflavin)、脂肪酶和鞭毛依赖的运动性, 其它因子包括KatG过氧化氢酶、III型效应因子、PehA和PehB多聚半乳糖醛酸酶及胞外多糖(EPS)等。这些因子主要受LuxI和LuxR的同源蛋白TofI和TofR介导的群体感应(QS)系统调控(
Kim et al., 2014 )。
3.1 植物毒素 B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin)。毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 )。迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 )。作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 )。毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成。
3.2 依赖鞭毛的运动性 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用。鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 )。
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 )。群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 )。鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 )。
3.3 脂肪酶 B. glumae 具有很强的产生脂肪酶能力, 脂肪酶能水解三酰基甘油和合成酰基甘油酯(
Frenken et al., 1993 ), 在工业上用途广泛, 如生产洗涤剂等(
Boeke- ma et al., 2007 )。LipA是一种活跃的细胞外脂肪酶, 和
B. glumae 的致病性相关性最强, 它通过II型分泌系统分泌(
Ham et al., 2011 ), 在调控植物的防御反应等生理活动中发挥重要作用(
李春宏等, 2014 )。另一种重要的脂肪酶是LipB, 它参与LipA的生物合成, 对获得活性LipA必不可少, 同时对水解蛋白的稳定性也有深远影响。在不利条件下, Ca
2+ 对稳定
B. glumae 的脂肪酶结构发挥积极作用。
3.4 Kate G过氧化氢酶 当
B. glumae 暴露在可见光下时, 细菌会产生大量过氧化氢, 为了保护细菌免受光毒性作用, 有必要合成过氧化氢酶。Kate G是一种主要的过氧化氢酶, 在光照条件下对稻穗表面
B. glumae 的生存至关重要(
Chun et al., 2009 )。
3.5 Hrp III型分泌系统 III型分泌系统(T3SS)在许多革兰氏阴性细菌病原毒力中发挥关键作用。一项关于
B. glumae 的蛋白质组学研究显示, 34个编码III型分泌系统的基因中, 21个在其上游调控区具有特定的HrpB结合序列, 其编码的46个蛋白质中, 有34种胞外蛋白的分泌独立于Hrp T3SS, 并且有16种通过II型蛋白分泌系统(T2SS)分泌(
Kang et al., 2008 )。缺乏T2SS或Hrp T3SS的突变体仍会产生毒黄菌素, 但对稻穗的毒性较低。
4 病害循环 水稻种子感染
B. glumae 与多种内源和外源性因素有关, 如宿主易感性、接种密度、温度及湿度等。高温高湿的环境非常适宜
B. glumae 生长, 若水稻抽穗前后1周, 高温少日照且降雨量适当, 则易造成穗枯病的迅速蔓延(
谢关林等, 2003 )。
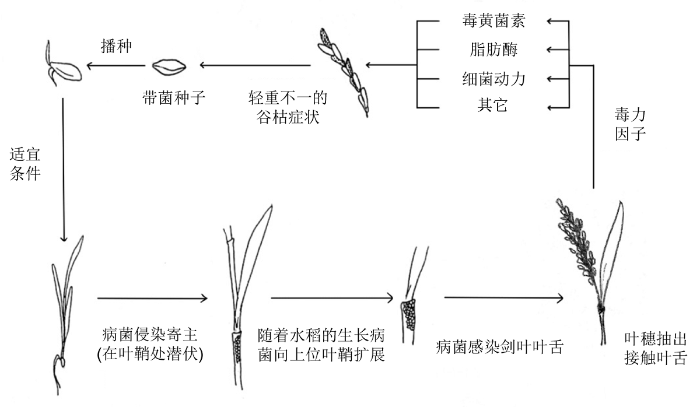
水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 )。病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主。一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种。来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 )。若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重。此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长。
图1 新窗口打开 |
下载原图ZIP |
生成PPT 图1水稻细菌性穗枯病的病害循环 Figure 1Disease cycle of bacterial panicle blight of rice 5 水稻细菌性穗枯病抗性研究 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种。
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性。
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状。前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础。目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 )。
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型。当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性。
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应。
由于水稻细菌性穗枯病抗性机制相关研究还非常初步, 许多具体机制还需进一步研究。例如, 尽管细菌性穗枯病可以引起烂秧和谷枯, 但是尚未发现两种抗性机制的相关性。而且细菌性穗枯病产生的是广谱性毒素, 找到理想的抗原十分困难。此外, 不同时期同一抗病品种或不同材料在不同的杂交组合中, 对不同菌株的抗性机制又呈显著性差异。因此, 水稻抗细菌性穗枯病基因的组成及其遗传规律还有待进一步研究。
6 水稻细菌性穗枯病抗性QTL定位 截至目前, 已在水稻中报道了2个细菌性穗枯病抗性QTLs。一是对Nona Bokra (抗性)和Koshihikari (易感)及其杂交得到的染色体片段置换系进行分析, 在第10号染色体短臂上检测到1个抗性QTL (
qRBS1 ), 并将其定位于RM24930-RM24944之间393 kb的物理范围内(
Mizobuchi et al., 2013a )。二是对高抗籼稻Kele和易感粳稻Hitomebore及其后代110个重组自交系进行分析, 检测到1个位于第1号染色体长臂上的主效QTL, 分别解释了重组自交系中患病小穗比例和患病小穗面积25.7%和12.1%的变异, 进一步遗传分析将其定位于RM1216-RM11727之间502 kb的物理范围内(
Mizobuchi et al., 2013b ,
2015 )。如果有更多的穗枯病抗性位点被发现, 通过选取效应值较大的几个位点, 运用常规的分离手段, 逐步缩短这些位点的物理距离, 构建关于这些位点的近等基因系, 然后进行多个抗性QTLs的聚合, 就可应用于抗细菌性穗枯病育种工作。目前, 关于水稻细菌性穗枯病的QTL定位研究还远远落后于水稻其它病害。
7 总结与展望 水稻细菌性穗枯病传播能力强, 目前已于世界上多个国家和地区爆发成灾, 给粮食生产带来了极大的损失。目前该病害在我国仍处于潜伏状态, 一旦生态气候条件适宜, 很有可能转化并发生流行。国内外的植物病理学家对水稻细菌性穗枯病进行了大量研究, 但由于穗枯病抗性是一种受各种环境因素影响的复杂性状, 不同地区之间病原菌的遗传多样性差异明显。目前各地的研究大都集中于病原菌的分离与鉴定、致病机制和抗原筛选等方面, 而关于抗性鉴定、抗病机制以及抗性基因挖掘方面的研究尚不深入, 导致水稻抗细菌性穗枯病遗传育种工作进展缓慢。
带菌种子是细菌性穗枯病传播的重要途径, 穗期感病的影响最大, 而且一旦大田中出现穗枯病症便很难再进行控制。因此, 目前的防治措施主要是选育不带菌种子或对种子进行药剂消毒处理, 孕穗后期病症出现前再辅以药剂保护大田。在日本, 控制穗枯病蔓延的主要方法是用喹啉衍生物奥索利酸(oxolinic acid)处理种子, 再对大田喷施恶喹酸(
Hikichi et al., 1989 )。该方法虽然有一定防效, 但随着病原菌对药剂耐药性菌株出现, 田间药剂的施用量将越来越大, 农业环境污染不断加重, 从而陷入恶性循环。日本于1998年和2004年先后分离到了对恶喹酸的抗性菌株(
Maeda et al., 2004 )。筛选对穗枯病菌有拮抗作用的拮抗细菌进行生物防治是较理想的防治措施,
P. fluorescen 、
P. putida 、
B. cepacia 和
Bacillus spp.是应用较多的类群(
罗金燕, 2007 ), 但其安全性和防治效果还有待验证。参考对水稻细菌性病害的其它防治措施, 利用在水稻基因组上获得的抗细菌性穗枯病位点, 导入到生产上常用的水稻主栽品种中, 培育更好的抗穗枯病主栽品种, 以适应各地不同的气候条件, 可极大降低细菌性穗枯病发病率。而且这种聚合方法是纯有机的, 能保证农业生产的绝对安全, 同时也有利于提高水稻品种的经济价值。
The authors have declared that no competing interests exist. 作者已声明无竞争性利益关系。 [1] 李春宏 , 付三雄 , 戚存扣 ( 2014 ). 应用基因芯片分析甘蓝型油菜柱头特异表达基因植物学报 49, 246 -253 . [本文引用: 1] [2] 李路 , 刘连盟 , 王国荣 , 汪爱娟 , 王玲 , 孙磊 , 黎起秦 , 黄世文 ( 2015 ). 水稻穗腐病和穗枯病的研究进展中国水稻科学 29, 215 -222 . [本文引用: 4] [3] 李路 , 徐以华 , 梁梦琦 , 王玲 , 刘连盟 , 侯雨萱 , 黎起秦 , 黄世文 ( 2017 ). 水稻对穗枯病的抗病机理初步研究中国水稻科学 31, 551 -558 . [本文引用: 1] [4] 龙海 , 李芳荣 , 冯建军 , 李一农 ( 2015 ). 水稻细菌性谷枯病研究进展中国植保导刊 35(7 ), 73 -78 . [本文引用: 1] [5] 罗金燕 ( 2007 ). 水稻细菌性谷枯病菌的风险分析、鉴定检测及其拮抗细菌的研究博士论文. 杭州: 浙江大学 . pp. 2 -85 . [本文引用: 4] [6] 罗金燕 , 谢关林 , 李斌 ( 2003 ). 水稻细菌性谷枯病的生物学特征及其检疫意义植物检疫 17, 243 -245 . [本文引用: 1] [7] 罗金燕 , 徐福寿 , 王平 , 徐丽慧 , 谢关林 ( 2008 ). 水稻细菌性谷枯病病原菌的分离鉴定中国水稻科学 22, 82 -86 . [本文引用: 2] [8] 谢关林 , 罗金燕 , 李斌 ( 2003 ). 水稻危险性病害——细菌性谷枯病及其病原鉴别植物保护 29(5 ), 47 -49 . [本文引用: 1] [9] 徐丽慧 ( 2008 ). 水稻细菌性谷枯病菌的分子检测及细菌性褐条病病原鉴定研究硕士论文. 杭州: 浙江大学. pp . 3 . [本文引用: 1] [10] 朱金国 , 莫瑾 , 朱水芳 , 赵文军 , 彭梓 , 刘红霞 , 钟文英 ( 2010 ). 利用双重PCR-DHPLC技术检测水稻细菌性谷枯病菌的研究植物病理学报 40, 449 -455 . [本文引用: 1] [11] Boekema BKL Beselin A Breuer M Hauer B Koster M Rosenau F Jaeger KE Tommassen J 2007 ). Hexa- decane and Tween 80 stimulate lipase production in Burkholderia glumae by different mechanismsAppl Environ Microbiol 3838 -3844 . [本文引用: 1] [12] Chun H Choi O Goo E Kim N Kim H Kang Y Kim J Moon JS Hwang I 2009 ). The quorum sensing dependent gene katG of Burkholderia glumae is important for protection from visible lightJ Bacteriol 4152 -4157 . [本文引用: 1] [13] Cui ZQ Zhu B Xie GL Li B Huang SW 2016 ). Research status and prospect of Burkholderia glumae , the pathogen causing bacterial panicle blightRice Sci 111 -118 . [本文引用: 1] [14] Daniels R Vanderleyden J Michiels J 2004 ). Quorum sensing and swarming migration in bacteriaFEMS Microbiol Rev 261 -289 . DOI:
10.1016/j.femsre.2003.09.004 URL [本文引用: 1] [15] Davey ME O’Toole GA 2000 ). Microbial biofilms: from ecology to molecular geneticsMicrobiol Mol Biol 847 -867 . DOI:
10.1128/MMBR.64.4.847-867.2000 URL [本文引用: 1] [16] Devescovi G Bigirimana J Degrassi G Cabrio L LiPuma JJ Kim J Hwang I Venturi V 2007 ). Involvement of a quorum-sensing-regulated lipase secreted by a clinical isolate of Burkholderia glumae in severe disease symptoms in riceAppl Environ Microbiol 4950 -4958 . [本文引用: 1] [17] Francis F Kim J Ramaraj T Farmer A Rush MC Ham JH 2013 ). Comparative genomic analysis of two Burkholderia glumae strains from different geographic origins reveals a high degree of plasticity in genome structure associated with genomic islands Mol Genet Genomics 195 -203 . [本文引用: 1] [18] Frenken LGJ Bos JW Visser C Müller W Tommassen J Verrips CT 1993 ). An accessory gene, lipB , required for the production of active Pseudomonas glumae lipaseMol Microbiol 579 -589 . [本文引用: 1] [19] Goto K Ohata K 1956 ). New bacterial diseases of rice (brown stripe and grain rot)Ann Phytopathol Soc Jpn 46 -47 . [本文引用: 1] [20] Ham JH Melanson RA Rush MC 2011 ). Burkholderia glumae : next major pathogen of rice?Mol Plant Pathol 329 -339 . [本文引用: 1] [21] Hikichi Y Noda C Shimizu K 1989 ). Oxolic acidJpn Pestic Infect 21 -23 . [本文引用: 1] [22] Jang MS Goo E An JH Kim J Hwang I 2014 ). Quorum sensing controls flagellar morphogenesis in Burkholderia glumae PLoS One e84831 . [本文引用: 1] [23] Jeong Y Kim J Kim S Kang Y Nagamatsu T Hwang I 2003 ). Toxoflavin produced by Burkholderia glumae causing rice grain rot is responsible for inducing bacterial wilt in many field cropsPlant Dis 890 -895 . [本文引用: 1] [24] Kang Y Kim J Kim S Kim H Lim JY Kim M Kwak J Moon JS Hwang I 2008 ). Proteomic analysis of the proteins regulated by HrpB from the plant pathogenic bacterium Burkholderia glumaeProteomics 106 -121 . DOI:
10.1002/(ISSN)1615-9861 URL [本文引用: 1] [25] Kawaradani M Okada K Kusakari S 2000 ). New selective medium for isolation of Burkholderia glumae from rice seedsJ Gen Plant Pathol 234 -237 . [本文引用: 1] [26] Kim S Park J Kim JH Lee J Bang B Hwang I Seo YS 2013 ). RNAseq-based transcriptome analysis of Burk- holderia glumae quorum sensingPlant Pathol J 249 -259 . [本文引用: 1] [27] Kim S Park J Lee J Shin D Park DS Lim JS Choi IY Seo YS 2014 ). Understanding pathogenic Burkholderia glumae metabolic and signaling pathways within rice tissues through in vivo transcriptome analysesGene 77 -85 . [本文引用: 2] [28] Lim J Lee TH Nahm BH Choi YD Kim M Hwang I 2009 ). Complete genome sequence of Burkholderia glumae BGR1 J Bacteriol 3758 -3759 . [本文引用: 1] [29] Maeda Y Kiba A Ohnishi K Hikichi Y 2004 ). New method to detect oxolinic acid-resistant Burkholderia glumae infesting rice seeds using a mismatch amplification mutation assay polymerase chain reactionJ Gen Plant Pathol 215 -217 . [本文引用: 1] [30] Magbanua ZV Arick M 2nd Buza T Hsu CY Showmaker KC Chouvarine P Deng P Peterson DG Lu S 2014 ). Transcriptomic dissection of the rice- Burkholderia glumae interactionBMC Genomics 755 . [本文引用: 1] [31] Melanson RA Barphagha I Osti S Lelis TP Karki HS Chen RX Shrestha BK Ham JH 2017 ). Identification of new regulatory genes involved in the pathogenic functions of the rice-pathogenic bacterium Burkholderia glumae Mi- crobiology 266 -279 . [本文引用: 1] [32] Mizobuchi R Sato H Fukuoka S Tanabata T Tsushima S Imbe T Yano M 2013 a). Mapping a quantitative trait locus for resistance to bacterial grain rot in riceRice 13 . DOI:
10.1186/1939-8433-6-13 [本文引用: 1] [33] Mizobuchi R Sato H Fukuoka S Tsushima S Imbe T Yano M 2013 b). Identification of qRBS1 , a QTL involved in resistance to bacterial seedling rot in riceTheor Appl Genet 2417 -2425 . [本文引用: 1] [34] Mizobuchi R Sato H Fukuoka S Tsushima S Yano M 2015 ). Fine mapping of RBG2 , a quantitative trait locus for resistance to Burkholderia glumae , on rice chromosome 1Mol Breed 15 . [本文引用: 1] [35] Nandakumar R Rush MC 2008 ). Analysis of gene expression in Jupiter rice showing partial resistance to rice panicle blight caused by Burkholderia glumae Phytopathology 112 . [本文引用: 1] [36] Nickzad A Lépine F Déziel E 2015 ). Quorum sensing controls swarming motility of Burkholderia glumae through regulation of rhamnolipidsPLoS One e0128509 . [本文引用: 1] [37] Pinson SRM Shahjahan AKM Rush MC Groth DE 2010 ). Bacterial panicle blight resistance QTLs in rice and their association with other disease resistance loci and heading dateCrop Sci 1287 -1297 . DOI:
10.2135/cropsci2008.07.0447 URL [本文引用: 1] [38] Sha X Linscombe SD Groth DE Bond JA White LM Utomo HS Dunand RT 2006 ). Registration of ‘Jupiter’ riceCrop Sci 1811 -1812 . DOI:
10.2135/cropsci2005.08-0265 URL [本文引用: 1] [39] Suzuki F Sawada H Azegami K Tsuchiya K 2004 ). Molecular characterization of the tox operon involved in toxoflavin biosynthesis of Burkholderia glumae J Gen Plant Pathol 97 -107 . [本文引用: 1] [40] Trung HM Van NV Vien NV Lam DT Lien M 1993 ). Occurrence of rice grain rot disease in VietnamInt Rice Res Notes 30 . [本文引用: 1] [41] Tsushima S Mogi S Naito H Saito H 1989 ). Existence of Pseudomonas glumae on the rice seeds and development of the simple method for detecting P. glumae from the rice seedsBull Kyushu Natl Agric Exp Stn 261 -270 . [本文引用: 1] [42] Tsushima S Wakimoto S Mogi S 1986 ). Selective medium for detecting Pseudomonas glumae Kurita et Tabei, the causal bacterium of grain rot of riceJpn J Phytopathol 253 -259 . [本文引用: 1] 应用基因芯片分析甘蓝型油菜柱头特异表达基因
1
2014
...
B. glumae 具有很强的产生脂肪酶能力, 脂肪酶能水解三酰基甘油和合成酰基甘油酯(
Frenken et al., 1993 ), 在工业上用途广泛, 如生产洗涤剂等(
Boeke- ma et al., 2007 ).LipA是一种活跃的细胞外脂肪酶, 和
B. glumae 的致病性相关性最强, 它通过II型分泌系统分泌(
Ham et al., 2011 ), 在调控植物的防御反应等生理活动中发挥重要作用(
李春宏等, 2014 ).另一种重要的脂肪酶是LipB, 它参与LipA的生物合成, 对获得活性LipA必不可少, 同时对水解蛋白的稳定性也有深远影响.在不利条件下, Ca
2+ 对稳定
B. glumae 的脂肪酶结构发挥积极作用. ...
水稻穗腐病和穗枯病的研究进展
4
2015
... 水稻细菌性穗枯病(bacterial panicle blight of rice, BPBR), 又称水稻细菌性颖枯病(bacterial panicle rot), 是限制水稻(
Oryza sativa )产量和品质的主要病害之一.水稻细菌性穗枯病发病时不但侵害谷粒, 还引起秧苗严重腐烂(
罗金燕等, 2008 ).该病最早于1956年在日本九州由
Goto和Ohata (1956) 发现, 初期一直是日本水稻的次要病害, 后因大面积工厂化育苗而逐渐成为日本水稻生产上的严重病害.目前该种病害已经蔓延到东南亚、非洲及美洲的水稻种植地, 造成大幅减产.
Trung等(1993) 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%.2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险.
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势. ...
... 细菌性穗枯病的病症十分明显, 但水稻不同发育时期受病原菌侵染引起的病症不同.谷粒萌发时, 表现为谷粒腐烂, 且在腐烂植株周围可形成发病中心.谷粒萌发后, 幼芽弯曲, 出现淡褐色条斑, 后逐渐枯死, 幸存病苗的叶鞘病健交界处明显呈深褐色带状.病原菌群体数量较少时, 被侵染的水稻秧苗不会表现出明显的病症, 移栽后也不会表现出症状, 但病原菌潜伏在稻株内, 直到孕穗期病菌急剧增殖, 在剑叶叶鞘内部(发病较轻时)或外部(发病较重时)呈现黄褐色或褐色长条状病斑.在抽穗期, 幼穗因挤压被病菌感染的叶鞘而感病, 感病稻穗在田间呈块状分布, 发病较重的稻株常出现腐败、枯死, 发病较轻的叶片变白, 叶鞘发褐, 叶舌卷曲.在乳熟期, 少量病原菌侵染稻穗便可以迅速引起谷粒变色, 谷粒感染后, 初期呈现似失水状萎凋的苍白色, 后逐渐变为灰白色至深褐色, 且出现空瘪不实或萎缩畸形的现象, 而枝梗和穗轴仍表现为健康稻穗的绿色(
罗金燕, 2007 ).
李路等(2015) 将其病状简单概括为“秆青, 叶绿, 穗腐, 谷枯”. ...
...
B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin).毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 ).迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 ).作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 ).毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成. ...
... 水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 ).病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主.一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种.来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 ).若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重.此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长. ...
水稻对穗枯病的抗病机理初步研究
1
2017
... 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种.
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性.
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状.前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础.目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 ).
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型.当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性.
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应. ...
水稻细菌性谷枯病研究进展
1
2015
... 水稻细菌性穗枯病病原菌是颖壳伯克氏菌.
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 ).目前已成功研发出用于检测该菌的选择性培养基.在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 ).
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 ). ...
水稻细菌性谷枯病菌的风险分析、鉴定检测及其拮抗细菌的研究
4
2007
... 水稻细菌性穗枯病病原菌是颖壳伯克氏菌.
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 ).目前已成功研发出用于检测该菌的选择性培养基.在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 ).
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 ). ...
... 细菌性穗枯病的病症十分明显, 但水稻不同发育时期受病原菌侵染引起的病症不同.谷粒萌发时, 表现为谷粒腐烂, 且在腐烂植株周围可形成发病中心.谷粒萌发后, 幼芽弯曲, 出现淡褐色条斑, 后逐渐枯死, 幸存病苗的叶鞘病健交界处明显呈深褐色带状.病原菌群体数量较少时, 被侵染的水稻秧苗不会表现出明显的病症, 移栽后也不会表现出症状, 但病原菌潜伏在稻株内, 直到孕穗期病菌急剧增殖, 在剑叶叶鞘内部(发病较轻时)或外部(发病较重时)呈现黄褐色或褐色长条状病斑.在抽穗期, 幼穗因挤压被病菌感染的叶鞘而感病, 感病稻穗在田间呈块状分布, 发病较重的稻株常出现腐败、枯死, 发病较轻的叶片变白, 叶鞘发褐, 叶舌卷曲.在乳熟期, 少量病原菌侵染稻穗便可以迅速引起谷粒变色, 谷粒感染后, 初期呈现似失水状萎凋的苍白色, 后逐渐变为灰白色至深褐色, 且出现空瘪不实或萎缩畸形的现象, 而枝梗和穗轴仍表现为健康稻穗的绿色(
罗金燕, 2007 ).
李路等(2015) 将其病状简单概括为“秆青, 叶绿, 穗腐, 谷枯”. ...
... 水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 ).病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主.一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种.来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 ).若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重.此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长. ...
... 带菌种子是细菌性穗枯病传播的重要途径, 穗期感病的影响最大, 而且一旦大田中出现穗枯病症便很难再进行控制.因此, 目前的防治措施主要是选育不带菌种子或对种子进行药剂消毒处理, 孕穗后期病症出现前再辅以药剂保护大田.在日本, 控制穗枯病蔓延的主要方法是用喹啉衍生物奥索利酸(oxolinic acid)处理种子, 再对大田喷施恶喹酸(
Hikichi et al., 1989 ).该方法虽然有一定防效, 但随着病原菌对药剂耐药性菌株出现, 田间药剂的施用量将越来越大, 农业环境污染不断加重, 从而陷入恶性循环.日本于1998年和2004年先后分离到了对恶喹酸的抗性菌株(
Maeda et al., 2004 ).筛选对穗枯病菌有拮抗作用的拮抗细菌进行生物防治是较理想的防治措施,
P. fluorescen 、
P. putida 、
B. cepacia 和
Bacillus spp.是应用较多的类群(
罗金燕, 2007 ), 但其安全性和防治效果还有待验证.参考对水稻细菌性病害的其它防治措施, 利用在水稻基因组上获得的抗细菌性穗枯病位点, 导入到生产上常用的水稻主栽品种中, 培育更好的抗穗枯病主栽品种, 以适应各地不同的气候条件, 可极大降低细菌性穗枯病发病率.而且这种聚合方法是纯有机的, 能保证农业生产的绝对安全, 同时也有利于提高水稻品种的经济价值. ...
水稻细菌性谷枯病的生物学特征及其检疫意义
1
2003
... 水稻细菌性穗枯病病原菌是颖壳伯克氏菌.
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 ).目前已成功研发出用于检测该菌的选择性培养基.在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 ).
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 ). ...
水稻细菌性谷枯病病原菌的分离鉴定
2
2008
... 水稻细菌性穗枯病(bacterial panicle blight of rice, BPBR), 又称水稻细菌性颖枯病(bacterial panicle rot), 是限制水稻(
Oryza sativa )产量和品质的主要病害之一.水稻细菌性穗枯病发病时不但侵害谷粒, 还引起秧苗严重腐烂(
罗金燕等, 2008 ).该病最早于1956年在日本九州由
Goto和Ohata (1956) 发现, 初期一直是日本水稻的次要病害, 后因大面积工厂化育苗而逐渐成为日本水稻生产上的严重病害.目前该种病害已经蔓延到东南亚、非洲及美洲的水稻种植地, 造成大幅减产.
Trung等(1993) 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%.2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险.
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势. ...
... 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%.2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险.
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势. ...
水稻危险性病害——细菌性谷枯病及其病原鉴别
1
2003
... 水稻种子感染
B. glumae 与多种内源和外源性因素有关, 如宿主易感性、接种密度、温度及湿度等.高温高湿的环境非常适宜
B. glumae 生长, 若水稻抽穗前后1周, 高温少日照且降雨量适当, 则易造成穗枯病的迅速蔓延(
谢关林等, 2003 ). ...
水稻细菌性谷枯病菌的分子检测及细菌性褐条病病原鉴定研究
1
2008
... 水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 ).病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主.一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种.来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 ).若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重.此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长. ...
利用双重PCR-DHPLC技术检测水稻细菌性谷枯病菌的研究
1
2010
... 水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 ).病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主.一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种.来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 ).若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重.此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长. ...
Hexa- decane and Tween 80 stimulate lipase production in
Burkholderia glumae by different mechanisms
1
2007
...
B. glumae 具有很强的产生脂肪酶能力, 脂肪酶能水解三酰基甘油和合成酰基甘油酯(
Frenken et al., 1993 ), 在工业上用途广泛, 如生产洗涤剂等(
Boeke- ma et al., 2007 ).LipA是一种活跃的细胞外脂肪酶, 和
B. glumae 的致病性相关性最强, 它通过II型分泌系统分泌(
Ham et al., 2011 ), 在调控植物的防御反应等生理活动中发挥重要作用(
李春宏等, 2014 ).另一种重要的脂肪酶是LipB, 它参与LipA的生物合成, 对获得活性LipA必不可少, 同时对水解蛋白的稳定性也有深远影响.在不利条件下, Ca
2+ 对稳定
B. glumae 的脂肪酶结构发挥积极作用. ...
The quorum sensing dependent gene
katG of
Burkholderia glumae is important for protection from visible light
1
2009
... 当
B. glumae 暴露在可见光下时, 细菌会产生大量过氧化氢, 为了保护细菌免受光毒性作用, 有必要合成过氧化氢酶.Kate G是一种主要的过氧化氢酶, 在光照条件下对稻穗表面
B. glumae 的生存至关重要(
Chun et al., 2009 ). ...
Research status and prospect of
Burkholderia glumae , the pathogen causing bacterial panicle blight
1
2016
... 运用高通量测序和生物信息学分析,
B. glumae 的组学研究得到了快速发展.
Lim等(2009) 首先报道来自韩国的水稻品种标准菌株
B. glumae BGR1的基因组序列, 该菌株包含2条染色体和4条质粒.浙江大学生物技术研究所发表了高毒力菌株LMG2196的基因组草图(
Cui et al., 2016 ).
Francis等(2013) 开展了BGR1和从美国分离的高毒力菌株336gr-1的比较基因组学分析, 发现了含有可移动因子和噬菌体相关基因的独特区域, 这些区域的强可塑性使细菌能够适应各种环境变化, 有可能就是预测的基因组岛, 但两种菌株在已知和潜在的毒力因子中只检测到很小的变异.
Kim等(2014) 通过转录组学分析发现, 在体内条件下, 与介导细菌趋化性运动、抗坏血酸和海藻糖代谢以及糖转运蛋白(包括阿拉伯糖和木糖)相关的大多数基因高度富集, 且其转录水平显著升高. ...
Quorum sensing and swarming migration in bacteria
1
2004
... 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用.鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 ).
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 ).群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 ).鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 ). ...
Microbial biofilms: from ecology to molecular genetics
1
2000
... 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用.鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 ).
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 ).群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 ).鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 ). ...
Involvement of a quorum-sensing-regulated lipase secreted by a clinical isolate of
Burkholderia glumae in severe disease symptoms in rice
1
2007
... 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用.鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 ).
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 ).群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 ).鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 ). ...
Comparative genomic analysis of two
Burkholderia glumae strains from different geographic origins reveals a high degree of plasticity in genome structure associated with genomic islands
1
2013
... 运用高通量测序和生物信息学分析,
B. glumae 的组学研究得到了快速发展.
Lim等(2009) 首先报道来自韩国的水稻品种标准菌株
B. glumae BGR1的基因组序列, 该菌株包含2条染色体和4条质粒.浙江大学生物技术研究所发表了高毒力菌株LMG2196的基因组草图(
Cui et al., 2016 ).
Francis等(2013) 开展了BGR1和从美国分离的高毒力菌株336gr-1的比较基因组学分析, 发现了含有可移动因子和噬菌体相关基因的独特区域, 这些区域的强可塑性使细菌能够适应各种环境变化, 有可能就是预测的基因组岛, 但两种菌株在已知和潜在的毒力因子中只检测到很小的变异.
Kim等(2014) 通过转录组学分析发现, 在体内条件下, 与介导细菌趋化性运动、抗坏血酸和海藻糖代谢以及糖转运蛋白(包括阿拉伯糖和木糖)相关的大多数基因高度富集, 且其转录水平显著升高. ...
An accessory gene,
lipB , required for the production of active
Pseudomonas glumae lipase
1
1993
...
B. glumae 具有很强的产生脂肪酶能力, 脂肪酶能水解三酰基甘油和合成酰基甘油酯(
Frenken et al., 1993 ), 在工业上用途广泛, 如生产洗涤剂等(
Boeke- ma et al., 2007 ).LipA是一种活跃的细胞外脂肪酶, 和
B. glumae 的致病性相关性最强, 它通过II型分泌系统分泌(
Ham et al., 2011 ), 在调控植物的防御反应等生理活动中发挥重要作用(
李春宏等, 2014 ).另一种重要的脂肪酶是LipB, 它参与LipA的生物合成, 对获得活性LipA必不可少, 同时对水解蛋白的稳定性也有深远影响.在不利条件下, Ca
2+ 对稳定
B. glumae 的脂肪酶结构发挥积极作用. ...
New bacterial diseases of rice (brown stripe and grain rot)
1
1956
... 水稻细菌性穗枯病(bacterial panicle blight of rice, BPBR), 又称水稻细菌性颖枯病(bacterial panicle rot), 是限制水稻(
Oryza sativa )产量和品质的主要病害之一.水稻细菌性穗枯病发病时不但侵害谷粒, 还引起秧苗严重腐烂(
罗金燕等, 2008 ).该病最早于1956年在日本九州由
Goto和Ohata (1956) 发现, 初期一直是日本水稻的次要病害, 后因大面积工厂化育苗而逐渐成为日本水稻生产上的严重病害.目前该种病害已经蔓延到东南亚、非洲及美洲的水稻种植地, 造成大幅减产.
Trung等(1993) 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%.2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险.
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势. ...
Burkholderia glumae : next major pathogen of rice?
1
2011
...
B. glumae 具有很强的产生脂肪酶能力, 脂肪酶能水解三酰基甘油和合成酰基甘油酯(
Frenken et al., 1993 ), 在工业上用途广泛, 如生产洗涤剂等(
Boeke- ma et al., 2007 ).LipA是一种活跃的细胞外脂肪酶, 和
B. glumae 的致病性相关性最强, 它通过II型分泌系统分泌(
Ham et al., 2011 ), 在调控植物的防御反应等生理活动中发挥重要作用(
李春宏等, 2014 ).另一种重要的脂肪酶是LipB, 它参与LipA的生物合成, 对获得活性LipA必不可少, 同时对水解蛋白的稳定性也有深远影响.在不利条件下, Ca
2+ 对稳定
B. glumae 的脂肪酶结构发挥积极作用. ...
Oxolic acid
1
1989
... 带菌种子是细菌性穗枯病传播的重要途径, 穗期感病的影响最大, 而且一旦大田中出现穗枯病症便很难再进行控制.因此, 目前的防治措施主要是选育不带菌种子或对种子进行药剂消毒处理, 孕穗后期病症出现前再辅以药剂保护大田.在日本, 控制穗枯病蔓延的主要方法是用喹啉衍生物奥索利酸(oxolinic acid)处理种子, 再对大田喷施恶喹酸(
Hikichi et al., 1989 ).该方法虽然有一定防效, 但随着病原菌对药剂耐药性菌株出现, 田间药剂的施用量将越来越大, 农业环境污染不断加重, 从而陷入恶性循环.日本于1998年和2004年先后分离到了对恶喹酸的抗性菌株(
Maeda et al., 2004 ).筛选对穗枯病菌有拮抗作用的拮抗细菌进行生物防治是较理想的防治措施,
P. fluorescen 、
P. putida 、
B. cepacia 和
Bacillus spp.是应用较多的类群(
罗金燕, 2007 ), 但其安全性和防治效果还有待验证.参考对水稻细菌性病害的其它防治措施, 利用在水稻基因组上获得的抗细菌性穗枯病位点, 导入到生产上常用的水稻主栽品种中, 培育更好的抗穗枯病主栽品种, 以适应各地不同的气候条件, 可极大降低细菌性穗枯病发病率.而且这种聚合方法是纯有机的, 能保证农业生产的绝对安全, 同时也有利于提高水稻品种的经济价值. ...
Quorum sensing controls flagellar morphogenesis in
Burkholderia glumae 1
2014
... 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用.鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 ).
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 ).群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 ).鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 ). ...
Toxoflavin produced by
Burkholderia glumae causing rice grain rot is responsible for inducing bacterial wilt in many field crops
1
2003
...
B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin).毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 ).迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 ).作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 ).毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成. ...
Proteomic analysis of the proteins regulated by HrpB from the plant pathogenic bacterium Burkholderia glumae
1
2008
... III型分泌系统(T3SS)在许多革兰氏阴性细菌病原毒力中发挥关键作用.一项关于
B. glumae 的蛋白质组学研究显示, 34个编码III型分泌系统的基因中, 21个在其上游调控区具有特定的HrpB结合序列, 其编码的46个蛋白质中, 有34种胞外蛋白的分泌独立于Hrp T3SS, 并且有16种通过II型蛋白分泌系统(T2SS)分泌(
Kang et al., 2008 ).缺乏T2SS或Hrp T3SS的突变体仍会产生毒黄菌素, 但对稻穗的毒性较低. ...
New selective medium for isolation of
Burkholderia glumae from rice seeds
1
2000
... 水稻细菌性穗枯病病原菌是颖壳伯克氏菌.
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 ).目前已成功研发出用于检测该菌的选择性培养基.在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 ).
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 ). ...
RNAseq-based transcriptome analysis of
Burk- holderia glumae quorum sensing
1
2013
...
B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin).毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 ).迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 ).作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 ).毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成. ...
Understanding pathogenic
Burkholderia glumae metabolic and signaling pathways within rice tissues through
in vivo transcriptome analyses
2
2014
... 运用高通量测序和生物信息学分析,
B. glumae 的组学研究得到了快速发展.
Lim等(2009) 首先报道来自韩国的水稻品种标准菌株
B. glumae BGR1的基因组序列, 该菌株包含2条染色体和4条质粒.浙江大学生物技术研究所发表了高毒力菌株LMG2196的基因组草图(
Cui et al., 2016 ).
Francis等(2013) 开展了BGR1和从美国分离的高毒力菌株336gr-1的比较基因组学分析, 发现了含有可移动因子和噬菌体相关基因的独特区域, 这些区域的强可塑性使细菌能够适应各种环境变化, 有可能就是预测的基因组岛, 但两种菌株在已知和潜在的毒力因子中只检测到很小的变异.
Kim等(2014) 通过转录组学分析发现, 在体内条件下, 与介导细菌趋化性运动、抗坏血酸和海藻糖代谢以及糖转运蛋白(包括阿拉伯糖和木糖)相关的大多数基因高度富集, 且其转录水平显著升高. ...
... 水稻细菌性穗枯病的发病机制是一个复杂的过程, 涉及多种毒力因子.运用分子遗传学研究手段已经确定
B. glumae 为主要致病因素.其中, 最重要的因素是毒黄菌素(toxoflavin)、脂肪酶和鞭毛依赖的运动性, 其它因子包括KatG过氧化氢酶、III型效应因子、PehA和PehB多聚半乳糖醛酸酶及胞外多糖(EPS)等.这些因子主要受LuxI和LuxR的同源蛋白TofI和TofR介导的群体感应(QS)系统调控(
Kim et al., 2014 ). ...
Complete genome sequence of
Burkholderia glumae BGR1 1
2009
... 运用高通量测序和生物信息学分析,
B. glumae 的组学研究得到了快速发展.
Lim等(2009) 首先报道来自韩国的水稻品种标准菌株
B. glumae BGR1的基因组序列, 该菌株包含2条染色体和4条质粒.浙江大学生物技术研究所发表了高毒力菌株LMG2196的基因组草图(
Cui et al., 2016 ).
Francis等(2013) 开展了BGR1和从美国分离的高毒力菌株336gr-1的比较基因组学分析, 发现了含有可移动因子和噬菌体相关基因的独特区域, 这些区域的强可塑性使细菌能够适应各种环境变化, 有可能就是预测的基因组岛, 但两种菌株在已知和潜在的毒力因子中只检测到很小的变异.
Kim等(2014) 通过转录组学分析发现, 在体内条件下, 与介导细菌趋化性运动、抗坏血酸和海藻糖代谢以及糖转运蛋白(包括阿拉伯糖和木糖)相关的大多数基因高度富集, 且其转录水平显著升高. ...
New method to detect oxolinic acid-resistant
Burkholderia glumae infesting rice seeds using a mismatch amplification mutation assay polymerase chain reaction
1
2004
... 带菌种子是细菌性穗枯病传播的重要途径, 穗期感病的影响最大, 而且一旦大田中出现穗枯病症便很难再进行控制.因此, 目前的防治措施主要是选育不带菌种子或对种子进行药剂消毒处理, 孕穗后期病症出现前再辅以药剂保护大田.在日本, 控制穗枯病蔓延的主要方法是用喹啉衍生物奥索利酸(oxolinic acid)处理种子, 再对大田喷施恶喹酸(
Hikichi et al., 1989 ).该方法虽然有一定防效, 但随着病原菌对药剂耐药性菌株出现, 田间药剂的施用量将越来越大, 农业环境污染不断加重, 从而陷入恶性循环.日本于1998年和2004年先后分离到了对恶喹酸的抗性菌株(
Maeda et al., 2004 ).筛选对穗枯病菌有拮抗作用的拮抗细菌进行生物防治是较理想的防治措施,
P. fluorescen 、
P. putida 、
B. cepacia 和
Bacillus spp.是应用较多的类群(
罗金燕, 2007 ), 但其安全性和防治效果还有待验证.参考对水稻细菌性病害的其它防治措施, 利用在水稻基因组上获得的抗细菌性穗枯病位点, 导入到生产上常用的水稻主栽品种中, 培育更好的抗穗枯病主栽品种, 以适应各地不同的气候条件, 可极大降低细菌性穗枯病发病率.而且这种聚合方法是纯有机的, 能保证农业生产的绝对安全, 同时也有利于提高水稻品种的经济价值. ...
Transcriptomic dissection of the rice-
Burkholderia glumae interaction
1
2014
... 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种.
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性.
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状.前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础.目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 ).
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型.当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性.
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应. ...
Identification of new regulatory genes involved in the pathogenic functions of the rice-pathogenic bacterium
Burkholderia glumae 1
2017
...
B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin).毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 ).迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 ).作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 ).毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成. ...
Mapping a quantitative trait locus for resistance to bacterial grain rot in rice
1
2013
... 截至目前, 已在水稻中报道了2个细菌性穗枯病抗性QTLs.一是对Nona Bokra (抗性)和Koshihikari (易感)及其杂交得到的染色体片段置换系进行分析, 在第10号染色体短臂上检测到1个抗性QTL (
qRBS1 ), 并将其定位于RM24930-RM24944之间393 kb的物理范围内(
Mizobuchi et al., 2013a ).二是对高抗籼稻Kele和易感粳稻Hitomebore及其后代110个重组自交系进行分析, 检测到1个位于第1号染色体长臂上的主效QTL, 分别解释了重组自交系中患病小穗比例和患病小穗面积25.7%和12.1%的变异, 进一步遗传分析将其定位于RM1216-RM11727之间502 kb的物理范围内(
Mizobuchi et al., 2013b ,
2015 ).如果有更多的穗枯病抗性位点被发现, 通过选取效应值较大的几个位点, 运用常规的分离手段, 逐步缩短这些位点的物理距离, 构建关于这些位点的近等基因系, 然后进行多个抗性QTLs的聚合, 就可应用于抗细菌性穗枯病育种工作.目前, 关于水稻细菌性穗枯病的QTL定位研究还远远落后于水稻其它病害. ...
Identification of
qRBS1 , a QTL involved in resistance to bacterial seedling rot in rice
1
2013
... 截至目前, 已在水稻中报道了2个细菌性穗枯病抗性QTLs.一是对Nona Bokra (抗性)和Koshihikari (易感)及其杂交得到的染色体片段置换系进行分析, 在第10号染色体短臂上检测到1个抗性QTL (
qRBS1 ), 并将其定位于RM24930-RM24944之间393 kb的物理范围内(
Mizobuchi et al., 2013a ).二是对高抗籼稻Kele和易感粳稻Hitomebore及其后代110个重组自交系进行分析, 检测到1个位于第1号染色体长臂上的主效QTL, 分别解释了重组自交系中患病小穗比例和患病小穗面积25.7%和12.1%的变异, 进一步遗传分析将其定位于RM1216-RM11727之间502 kb的物理范围内(
Mizobuchi et al., 2013b ,
2015 ).如果有更多的穗枯病抗性位点被发现, 通过选取效应值较大的几个位点, 运用常规的分离手段, 逐步缩短这些位点的物理距离, 构建关于这些位点的近等基因系, 然后进行多个抗性QTLs的聚合, 就可应用于抗细菌性穗枯病育种工作.目前, 关于水稻细菌性穗枯病的QTL定位研究还远远落后于水稻其它病害. ...
Fine mapping of
RBG2 , a quantitative trait locus for resistance to
Burkholderia glumae , on rice chromosome 1
1
2015
... 截至目前, 已在水稻中报道了2个细菌性穗枯病抗性QTLs.一是对Nona Bokra (抗性)和Koshihikari (易感)及其杂交得到的染色体片段置换系进行分析, 在第10号染色体短臂上检测到1个抗性QTL (
qRBS1 ), 并将其定位于RM24930-RM24944之间393 kb的物理范围内(
Mizobuchi et al., 2013a ).二是对高抗籼稻Kele和易感粳稻Hitomebore及其后代110个重组自交系进行分析, 检测到1个位于第1号染色体长臂上的主效QTL, 分别解释了重组自交系中患病小穗比例和患病小穗面积25.7%和12.1%的变异, 进一步遗传分析将其定位于RM1216-RM11727之间502 kb的物理范围内(
Mizobuchi et al., 2013b ,
2015 ).如果有更多的穗枯病抗性位点被发现, 通过选取效应值较大的几个位点, 运用常规的分离手段, 逐步缩短这些位点的物理距离, 构建关于这些位点的近等基因系, 然后进行多个抗性QTLs的聚合, 就可应用于抗细菌性穗枯病育种工作.目前, 关于水稻细菌性穗枯病的QTL定位研究还远远落后于水稻其它病害. ...
Analysis of gene expression in Jupiter rice showing partial resistance to rice panicle blight caused by
Burkholderia glumae 1
2008
... 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种.
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性.
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状.前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础.目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 ).
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型.当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性.
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应. ...
Quorum sensing controls swarming motility of
Burkholderia glumae through regulation of rhamnolipids
1
2015
... 依赖鞭毛的运动在
B. glumae 致病性中也发挥重要作用.鞭毛能够使细菌到达潜在宿主的感染部位, 并在感染的初始阶段发挥显著的选择性优势(
Davey and O’Toole, 2000 ).
B. glumae 的极性鞭毛负责细菌的2种运动: 游动(swimming)和群集运动(swarming) (
De- vescovi et al., 2007 ).群集运动是一种受QS调控的多细胞行为, 鼠李糖脂能够促进这种运动(
Daniels et al., 2004 ).鞭毛的极性和运动性还受QS和温度之间相互作用的影响: 在28°C, 病原菌明显产生更多的极性鞭毛(
Jang et al., 2014 ), 此时几乎不合成毒黄菌素, 因此毒黄菌素和依赖鞭毛的运动可能在不同温度下起作用, 进而成功地感染稻谷; QS缺陷株在37°C下鞭毛几乎失去极性以及运动性(
Nickzad et al., 2015 ). ...
Bacterial panicle blight resistance QTLs in rice and their association with other disease resistance loci and heading date
1
2010
... 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种.
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性.
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状.前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础.目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 ).
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型.当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性.
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应. ...
Registration of ‘Jupiter’ rice
1
2006
... 迄今为止, 已有一些水稻细菌性穗枯病的抗性相关研究, 但尚未发现完全免疫的水稻品种.
Sha等(2006) 检测了100个水稻品种对
B. glumae 的抗性, 未发现完全抗病的品种; 在被认定具有部分抗性的水稻品种中, Jupiter表现出相对比较明显的抗病性.
Pinson等(2010) 从Lemont的突变株中筛选到1种突变体LM-1表现出明显的抗细菌性穗枯病性状.前人研究中发现的这些具有部分抗性的水稻品种为我们后续研究水稻细菌性抗穗枯病机制提供了材料并奠定了基础.目前已发现与抗性有关的基因包括防御素基因、种子进化蛋白基因和有关信号转导、淀粉代谢、转录调节以及其它细胞活动的基因(
Nandakumar and Rush, 2008 ).
Magbanua等(2014) 通过转录组学测序(RNA-Seq), 提出水稻抗细菌性穗枯病的模型.当NBS-LRR抗性基因、第8和11条染色体中相关类型的抗性基因簇、
PIF -like ORF1转录水平提高以及ATP与蛋白质结合富集时, 都可增强水稻对细菌性穗枯病的抗性.
李路等(2017) 采用喷雾法和注射法分别对苗期和孕穗期的抗、感病水稻品种接种
B. glumae , 发现
B. glumae 能诱导孕穗期水稻产生较强的抗病反应, 其中水杨酸信号转导途径是参与抗病的主要反应. ...
Molecular characterization of the
tox operon involved in toxoflavin biosynthesis of
Burkholderia glumae 1
2004
...
B. glumae 产生3种分子结构类似的植物性毒素: 毒黄菌素、热诚菌素(fervenulin)和路霉素(reumycin).毒黄菌素和热诚菌素对造成水稻秧苗和谷物腐烂必不可少, 它们能抑制水稻根和苗生长, 在稻穗上表现典型的穗枯病症状(
Jeong et al., 2003 ).迄今为止, 大多数毒素研究集中在毒黄菌素, 毒黄菌素被认为是
B. glumae 最重要的毒力因子(
Melanson et al., 2017 ), 其合成和转运分别受2个操纵子(
toxABCDE 和
toxFGHI )控制(
Suzuki et al., 2004 ).作为一种非常有效的电子载体, 毒黄菌素能够产生活性氧(ROS), 损伤线粒体和基底膜, 引起循环和呼吸系统显现病理性损害(
Kim et al., 2013 ;
李路等, 2015 ).毒黄菌素的产生取决于生长温度, 并在37°C达到最高水平, 而在25-28°C则检测不到毒黄菌素的合成. ...
Occurrence of rice grain rot disease in Vietnam
1
1993
... 水稻细菌性穗枯病(bacterial panicle blight of rice, BPBR), 又称水稻细菌性颖枯病(bacterial panicle rot), 是限制水稻(
Oryza sativa )产量和品质的主要病害之一.水稻细菌性穗枯病发病时不但侵害谷粒, 还引起秧苗严重腐烂(
罗金燕等, 2008 ).该病最早于1956年在日本九州由
Goto和Ohata (1956) 发现, 初期一直是日本水稻的次要病害, 后因大面积工厂化育苗而逐渐成为日本水稻生产上的严重病害.目前该种病害已经蔓延到东南亚、非洲及美洲的水稻种植地, 造成大幅减产.
Trung等(1993) 报道, 细菌性穗枯病发病严重时水稻产量损失可高达75%.2007年, 我国正式将其列为检疫性病害, 目前仅在台湾、黑龙江和海南等省有过报道, 但
罗金燕等(2008) 在无穗枯病症状的稻种上也检测到了水稻细菌性穗枯病病原菌的存在, 表明细菌性穗枯病有在我国大肆蔓延的潜在风险.
李路等(2015) 在海南岛、两广以及长江流域的湘、鄂、赣、皖、江、浙及东北三省等广大稻区进行实地调查, 均发现细菌性穗枯病症状, 并从田间采集的感病稻穗上分离到了颖壳伯克氏菌(
Burkholderia glumae ), 证实近几年细菌性穗枯病已在我国呈大面积普遍发生态势. ...
Existence of
Pseudomonas glumae on the rice seeds and development of the simple method for detecting
P. glumae from the rice seeds
1
1989
... 水稻细菌性穗枯病的初侵染源包括3种: 一是带病菌的稻种,
B. glumae 寄生于种子内部, 病原菌在室内的病种上可存活3年, 因此该病菌可随种子远距离传播; 二是爆发过穗枯病的土壤; 三是被该细菌寄生的田间杂草, 其中发病的稻穗是再侵染的重要因素(
Tsushima et al., 1989 ;
罗金燕, 2007 ;
李路等, 2015 ).病菌通过胚芽鞘、叶片的气孔、组织生长或昆虫咬食造成的伤口侵染寄主.一部分在育苗期间感染发病, 直接烂秧枯死; 幸存下来的一部分带菌苗中, 病菌潜伏在叶鞘等部位, 引起叶鞘薄壁组织分解的同时, 随着稻株的生长渐向上位叶鞘扩展, 感染剑叶的叶舌, 一旦稻穗抽出接触叶舌, 便极易感染稻谷(
徐丽慧, 2008 ;
朱金国等, 2010 ), 形成轻重程度不同的穗枯病症状以及带菌稻种.来年再次播种带菌谷粒, 在适宜的发病条件下极易发病, 由此形成一个病害循环(
图1 ).若在花期遭遇强风, 稻穗相互摩擦, 造成伤口有利病菌侵入, 使病害更加严重.此外, 隐藏在土壤、病谷和病草中的病菌可存活到第2年7-8月间, 发病潜伏期较长. ...
Selective medium for detecting
Pseudomonas glumae Kurita et Tabei, the causal bacterium of grain rot of rice
1
1986
... 水稻细菌性穗枯病病原菌是颖壳伯克氏菌.
B. glumae 是革兰氏阴性杆菌, 基因组大小为5.81-7.89 Mb, 菌体大小(1.5-2.5)×(0.5-0.7) μm, 具有1-7根极性鞭毛, 无芽孢, 有荚膜, 好气性, 生长温度为11-40°C, 最适生长温度(30-35°C)较高, 最适生长pH6.0-7.5 (
罗金燕, 2007 ;
龙海等, 2015 ).目前已成功研发出用于检测该菌的选择性培养基.在S-PG培养基上, 菌落呈褐色或紫红色圆形凸起(
Tsushima et al., 1986 ); 在CCNT培养基上, 菌落呈黄白色圆形凸起, 并产生黄色色素(
Kawaradani et al., 2000 ).
B. glumae 的寄主范围极广, 除危害水稻、薏苡(
Coix lacryma-jobi )和燕麦(
Avena sativa )等单子叶植物外, 叶部接种实验表明, 双子叶植物中蓼科、豆科、菊科及车前科的多种植物都易感病(
罗金燕等, 2003 ). ...
备案号:
京ICP备16067583号-21 版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由
北京玛格泰克科技发展有限公司 设计开发
 ,*, 饶玉春
,*, 饶玉春 ,*浙江师范大学化学与生命科学学院, 金华 321004
,*浙江师范大学化学与生命科学学院, 金华 321004 ,*, Yuchun Rao
,*, Yuchun Rao ,*College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China
,*College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT