 ,1,2,3,*
,1,2,3,*Establishment of a Genetic Transformation System for Dioscorea opposita Using Microtuber
Junhua Li1,2,3,?, Shiyu Liu1,?, Chenglong Li1, Linlin Han1, Yahui Dong1, Xiaoli Zhang1,2,3, Xiting Zhao1,2,3, Mingjun Li ,1,2,3,*
,1,2,3,*通讯作者:
收稿日期:2018-05-15接受日期:2018-09-13网络出版日期:2019-01-30
| 基金资助: |
Corresponding authors:
Received:2018-05-15Accepted:2018-09-13Online:2019-01-30

摘要
关键词:
Abstract
Keywords:
PDF (34171KB)摘要页面多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
李俊华, 刘世宇, 李成龙, 韩林林, 董亚辉, 张晓丽, 赵喜亭, 李明军. 铁棍山药微型块茎遗传转化体系的建立. 植物学报, 2019, 54(1): 72-80 doi:10.11983/CBB18118
Li Junhua, Liu Shiyu, Li Chenglong, Han Linlin, Dong Yahui, Zhang Xiaoli, Zhao Xiting, Li Mingjun.
铁棍山药(Dioscorea opposita cv. ‘Tiegun’)属薯蓣科薯蓣属, 为多年生缠绕藤本植物, 是四大怀药之一怀山药(D. opposita)的优良品种(李明军, 2013)。近年来, 铁棍山药因其特殊的营养保健功能而备受青睐, 具有良好的经济价值和推广应用前景。然而, 铁棍山药在实际生产中存在严重的病毒感染和种质退化等问题(李明军等, 2003), 而在薯蓣作物中进行常规育种较困难(Mignouna et al., 2008), 这极大地阻碍了铁棍山药的生产应用。因此运用现代生物学手段对铁棍山药进行遗传改良具有重要意义。
目前, 有关薯蓣属植物的遗传转化研究还比较少。T?r等(1993, 1998)曾分别利用基因枪法和PEG介导法转化大薯(D. alata), 实验中均能检测到基因的瞬时表达, 但都未得到转基因植株。许云(2014)在大薯中以类原球茎为材料建立了遗传转化体系。范俊强(2008)分别以胚性愈伤组织、花序诱导的愈伤组织及花序3种材料为受体, 利用农杆菌介导法获得了盾叶薯蓣(D. zingiberensis)转基因植株。Nyaboga等(2014)通过农杆菌介导法获得了圆山药(D. rotundata)转基因植株。我们前期在怀山药中建立了根癌农杆菌介导的瞬时表达技术, 使β-葡糖醛酸酶基因(GUS)和绿色荧光蛋白报告基因(GFP)在山药叶片中瞬时表达(韩林林等, 2016), 但关于怀山药或铁棍山药稳定遗传转化体系的研究尚未见报道。
微型块茎是指在山药试管苗腋芽处形成的变态块茎(李明军等, 2017), 易诱导形成, 便于取材。本实验以铁棍山药微型块茎为受体材料, 进行由农杆菌介导的遗传转化研究, 并将克隆的基因转入铁棍山药, 获得再生苗。本研究旨在探索并优化铁棍山药微型块茎遗传转化体系, 为转基因技术在铁棍山药中的应用提供技术支撑。
1 植物材料
铁棍山药试管苗由河南省道地药材保育及利用工程技术研究中心继代培养, 微型块茎由单节茎段经一步振荡诱导法诱导获得(Li et al., 2015)。植物双元表达载体pCAMBIA1301购于郑州久是生物公司。pART27由中国农业大学观赏园艺与园林系观赏植物采后与逆境生理实验室惠赠。大肠杆菌(Escherichia coli) DH5α和根癌农杆菌(Agrobacte- rium tumefaciens) EHA105为本实验室保存菌株。DoSERK2基因为铁棍山药中克隆得到的体细胞胚发生相关类受体蛋白激酶基因(未发表资料)。遗传转化所用植物过表达载体为pCAMBIA1301-DoSERK2 (图1A), 携带GUS报告基因并具有潮霉素(Hyg)抗性; 沉默载体为pART27-DoSERK2 (图1B), 具有卡那霉素(Kan)抗性。
图1
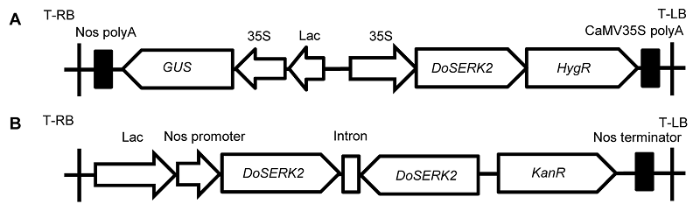 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1过表达载体和沉默载体结构示意图
(A) 过表达载体pCAMBIA1301-DoSERK2; (B) 沉默载体pART27-DoSERK2
Figure 1Schematic maps of the overexpression vector and silencing vector used in this study
(A) The overexpression vector pCAMBIA1301-DoSERK2; (B) The silencing vector pART27-DoSERK2
GUS染色液购于北京奥博来科技有限责任公司。RNA提取试剂盒购于宝生物工程(大连)有限公司。反转录试剂盒购于南京诺唯赞生物科技有限公司。
2 培养基成分与培养条件
2.1 培养基成分
在参考本实验室前期建立的铁棍山药微型块茎再生体系(李明军等, 2004; 王运英, 2016)所用培养基的基础上添加转化所需的其它成分。培养基成分见表1。Table 1
表1
表1铁棍山药遗传转化和植株再生培养基
Table 1
| Media | Composition |
|---|---|
| MS0 | MS major salts, MS minor salts and MS vitamins +30 g·L-1 sucrose+6 g·L-1 fungible agar, pH5.8- 6.2 |
| MS0 1 | MS0+1 mg·L-1 6-BA+1 mg?L-1 IAA |
| MS0 2 | MS0+2 mg?L-1 PP333+0.05 mg?L-1 NAA |
| MS0 1-A | MS0 1+100 μmol?L-1 Acetosyringone (AS) |
| MS0 1-T | MS0 1+500 mg?L-1 Timentin (Tim) |
| MS0 1-TH | MS0 1+500 mg?L-1 Tim+15 mg?L-1 Hyg |
| MS0 1-TK | MS0 1+500 mg?L-1 Tim+120 mg?L-1 Kan |
| MS0 2-H | MS0 2+20 mg?L-1 Hyg |
| MS0 2-K | MS0 2+160 mg?L-1 Kan |
新窗口打开|下载CSV
2.2 外植体对抑菌剂Tim的敏感性实验
由于铁棍山药类原球茎增殖分化速度快, 因此我们选用类原球茎为外植体探究山药组织对抑菌剂Tim的敏感性, 设置浓度范围为0-500 mg·L-1。将直径为5 mm、生长状况良好的类原球茎增殖培养14天、分化培养21天后观察类原球茎生长状况, 以确定添加抑菌剂的最佳浓度。所用相关培养基成分见李瑞雪等(2018)。2.3 筛选剂选择压的确定
过表达载体及沉默载体转化铁棍山药后, 分别以Hyg和Kan作为筛选剂, 并确定其选择压。我们分别设计了两者在植株再生和生根2个阶段的筛选浓度梯度, Hyg浓度分别为0、5、10、15、20、25 mg·L-1和0、5、15、20、25 mg·L-1; Kan浓度分别为0、100、120、140、160、180 mg·L-1和0、120、140、160、180 mg·L-1。植株再生阶段, 将微型块茎薄片分别接种于添加不同浓度Hyg或Kan的再生培养基上(MS0 1), 45天后观察外植体生长状况; 生根阶段, 切取3-5 cm高的再生苗, 分别转接入添加不同浓度Hyg或Kan的生根培养基(MS0 2)中, 30天后观察植株生长状况。2.4 农杆菌介导的微型块茎的遗传转化
将携带过表达载体pCAMBIA1301-DoSERK2的农杆菌菌液于28°C、每分钟180转条件下振荡培养至OD600=0.5, 8 000 ×g离心10分钟, 收集菌体后用MS液体培养基悬浮, 重新离心1次, 再用含100 μmol·L-1 AS的MS培养基重悬菌体, 使菌液OD600=0.5。重悬后的菌体放入摇床, 28°C、每分钟180转条件下培 养30分钟后用于侵染。微型块茎薄片用菌液侵染30分钟后, 转入共培养培养基(MS0 1-A), 在暗处放置3天; 再转接入抑菌培养基(MS0 1-T); 7天后转接至再生苗培养基(添加500 mg·L-1 Tim和15 mg·L-1 Hyg), 进行再生苗诱导及抗生素筛选培养; 之后每10天更换1次新鲜再生苗培养基(MS0 1-TH), 直到切片上有幼苗再生, 且苗长至3-5 cm。从微型块茎切片上切取再生苗, 转接至生根培养基(MS0 2-H)进行生根筛选培养, 每20天更换1次新鲜生根培养基, 直到再生苗生根。含沉默载体pART27-DoSERK2的农杆菌菌液制备、侵染外植体及外植体的培养方法均同上, 仅再生苗和生根培养基改为MS0 1-TK与MS0 2-K。
2.5 转基因植株的PCR检测
按照Edwards等(1991)的方法提取对照、Hyg或Kan抗性植株的叶片基因组DNA。过表达及沉默转基因植株PCR检测引物序列见表2。Table 2
表2
表2引物序列
Table 2
| Primers | Sequences (5'-3') |
|---|---|
| DoSERK2-OE-F | ATGACGGCTTGGGTTTTC |
| DoSERK2-OE-R | TCACCTCGGACCAGATAGC |
| DoSERK2-RNAi-F | CAGATGATACAGAAAAGCACCG |
| DoSERK2-RNAi-R | TAACTTTCGGTAGAGCGGAC |
| DoActin-F | CTCATTGATCGGCATGGAAGC |
| DoActin-R | GGGGAACATAGTTGAACCACCAC |
| DoSERK2-qRT-F | TATCTGGACCAGTTCCATCC |
| DoSERK2-qRT-R | CTTCAGCAGGCACATCATAG |
新窗口打开|下载CSV
2.6 过表达转基因植株GUS表达的组织化学检测
将对照和Hyg抗性植株的茎叶浸入GUS染色液中, 避光条件下37°C保温过夜。依次用30%、50%和70%乙醇脱去叶绿素, 观察颜色反应。2.7 沉默转基因植株的RT-qPCR检测
选取对照和Kan抗性植株叶片, 参照植物RNA提取试剂盒说明书提取mRNA, 反转录获得cDNA。以Do- Actin为内参基因进行RT-qPCR检测(Zhao et al., 2016), 检测DoSERK2基因在RNAi转基因株系中的表达。引物序列见表2。3 结果与讨论
3.1 外植体对抑菌剂Tim的敏感性
在铁棍山药类原球茎分化过程中, 向培养基添加0-500 mg·L-1 Tim, 结果表明, 此浓度范围内类原球茎的增殖分化无明显差异, 均无褐化死亡现象, 分化率均为100%, 再生芽长势也无明显差异(图2A-F)。因此, 为了达到较好的抑菌效果, 我们建议将遗传转化过程中Tim的浓度定为500 mg·L-1。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同浓度Tim对铁棍山药类原球茎(PLBs)增殖分化的影响
cv. ‘Tiegun’(A) 0 mg·L-1; (B) 100 mg·L-1; (C) 200 mg·L-1; (D) 300 mg·L-1; (E) 400 mg·L-1; (F) 500 mg·L-1。Bars=1 cm
Figure 2Effects of different concentrations of Tim on the proliferation and differentiation of protocorm-like bodies (PLBs) in Dioscorea opposita
(A) 0 mg·L-1; (B) 100 mg·L-1; (C) 200 mg·L-1; (D) 300 mg·L-1; (E) 400 mg·L-1; (F) 500 mg·L-1. Bars=1 cm
3.2 筛选剂浓度的确定
筛选剂对微型块茎苗再生及再生苗生根的影响如图3及表3和表4所示。当再生培养基中不添加Hyg时, 微型块茎切片再生率为60%, 且茎叶生长旺盛(图3A); 随着Hyg浓度的增加, 再生率逐渐降低, 再生苗叶片卷曲, 茎变短(图3B); 当其浓度为10 mg·L-1时, 有33.33%的切片再生, 但分化出的幼苗茎叶生长缓慢, 部分会褐化死亡(图3C); 当Hyg浓度增至15 mg·L-1时, 切片的再生率仍有25.56%, 但大部分再生苗白化死亡(图3D); 继续增加Hyg浓度, 只有极少的切片再生, 且再生苗均褐化死亡(图3E, F)。综上, 以微型块茎切片为受体的遗传转化的Hyg最适浓度为15 mg·L-1。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3筛选剂对铁棍山药微型块茎苗再生及再生苗生根的影响
(A)-(F) 不同浓度Hyg对微型块茎苗再生的影响, Hyg浓度分别为0、5、10、15、20和25 mg·L-1; (G)-(L) 不同浓度Kan对微型块茎苗再生的影响, Kan浓度分别为0、80、100、120、140和160 mg·L-1; (M) 不同浓度Hyg对再生苗生根的影响; (N) 不同浓度Kan对再生苗生根的影响。(A)-(L) Bars=0.5 cm; (M), (N) Bars=2 cm
Figure 3Effects of antibiotic on microtuber regeneration and rooting of regenerated seedlings in Dioscorea opposita cv. ‘Tiegun’
(A)-(F) Effects of different concentrations of Hyg on microtuber regeneration, the concentrations of Hyg are 0, 5, 10, 15, 20, 25 mg·L-1, respectively; (G)-(L) Effects of different concentrations of Kan on microtuber regeneration, the concentrations of Kan are 0, 80, 100, 120, 140, 160 mg·L-1, respectively; (M) Effects of different concentrations of Hyg on rooting of regenerated plantlets; (N) Effects of different concentrations of Kan on rooting of regenerated plantlets. (A)-(L) Bars=0.5 cm; (M), (N) Bars=2 cm
当生根培养基中不添加Hyg时, 再生苗的生根率可达100%, 且生长状况良好, 根系发达。随着Hyg浓度的增加, 再生苗增殖速度下降, 分枝几乎不增加, 生根效果也逐渐下降; 当Hyg浓度为20 mg·L-1时, 生根率为0, 再生苗几乎不生长; 继续增加筛选剂的用量, 再生苗几乎全部白化死亡。因此, 我们认为20 mg·L-1 Hyg为最适生根选择压(图3M)。
当再生培养基中不添加Kan时, 微型块茎切片再生率为65.56%, 再生苗生长旺盛, 叶片大且舒展(图3G)。随着Kan浓度的增加, 苗再生率降低, 再生苗生长变弱(图3H, I); 当Kan浓度增至120 mg·L-1时, 切片的再生率仍有8.89%, 但分化出的苗大部分白化死亡, 基本不能进一步发育(图3J)。再增加Kan浓度, 大部分切片褐化死亡, 极少数再生苗存活, 但均表现白化(图3K, L)。因此, 我们将微型块茎切片为受体遗传转化的Kan最适筛选浓度定为120 mg·L-1。
当生根培养基中不添加Kan时, 生根率可达100%, 再生苗生长状况良好, 根系发达。随着Kan浓度的增加, 生根率逐渐下降; 当Kan浓度为140 mg·L-1时, 仅极少数生根, 但再生苗仍可生长; 当Kan浓度达到160 mg·L-1时, 生根率为0, 再生苗几乎不生长。若继续增加筛选剂的用量, 再生苗几乎全部白化死亡。因此, 我们选择160 mg·L-1 Kan作为生根选择压(图3N)。
Table 3
表3
表3不同浓度筛选剂对铁棍山药微型块茎切片再生的影响
Table 3
| Concentration of Hyg (mg·L-1) | Regeneration (%) | Concentration of Kan (mg·L-1) | Regeneration (%) | Growth of seedlings |
|---|---|---|---|---|
| 0 | 60.00±2.00 | 0 | 65.56±2.52 | Strong growth vigor |
| 5 | 55.56±1.15 | 80 | 48.89±1.53 | Well |
| 10 | 33.33±2.00 | 100 | 34.44±1.53 | Slow, albefaction in some seedlings |
| 15 | 25.56±0.58 | 120 | 8.89±3.06 | Slow, albefaction in many seedlings |
| 20 | 2.22±1.15 | 140 | 1.11±0.58 | Growth stopped, albefaction seriously |
| 25 | 0 | 160 | 0 | All dead |
新窗口打开|下载CSV
Table 4
表4
表4不同浓度筛选剂对铁棍山药再生苗生根的影响
Table 4
| Concentration of Hyg (mg·L-1) | Rooting (%) | Concentration of Kan (mg·L-1) | Rooting (%) | Growth of roots |
|---|---|---|---|---|
| 0 | 100 | 0 | 100 | Strong and flourishing |
| 5 | 100 | 120 | 100 | Well |
| 15 | 3±2.00 | 140 | 1±1.20 | Seldom rooting |
| 20 | 0 | 160 | 0 | Hardly rooting |
| 25 | 0 | 180 | 0 | Hardly rooting, albefaction |
新窗口打开|下载CSV
3.3 农杆菌介导的遗传转化及植株再生
我们利用携带DoSERK2过表达载体或沉默载体的根癌农杆菌侵染铁棍山药微型块茎(图4A), 切片共计400个, 共培养3天后转入抑菌培养基(图4B)。在筛选剂的作用下, 微型块茎切片逐步褐化, 褐化率为100%。按照前期初步建立的再生方法(李明军等, 2004; 王运英, 2016)和本研究中经优化确定的其它条件, 利用再生苗培养基筛选出21个抗性芽(图4C, D), 出芽率为5.25%。抗性芽转入生根培养基后, 11株生根(图4E, F), 生根率为52.38%。过表达载体转化最终获得2株抗性植株, RNAi载体转化获得9株抗性植株。3.4 转基因植株鉴定
3.4.1 PCR检测为了检测抗性植株中外源目的基因是否存在, 我们对转基因植株、野生型对照植株及阳性质粒进行了PCR检测。过表达载体转化植株基因组DNA扩增出的条带长度约为1.9 kb, 与阳性质粒扩增出的条带大小一致, 表明DoSERK2过表达基因已导入该株系, 而野生型对照植株未扩增出相应大小的条带(图4G)。上述结果表明, 外源基因已整合到转基因株系的基因组中。本研究获得1株DoSERK2过表达转基因植株, 抗性植株阳性率为50%, 转化效率为0.5%; 获得9株DoSER-K2 RNAi转基因植株, 抗性植株阳性率为100%, 转化效率为4.5%。
图4
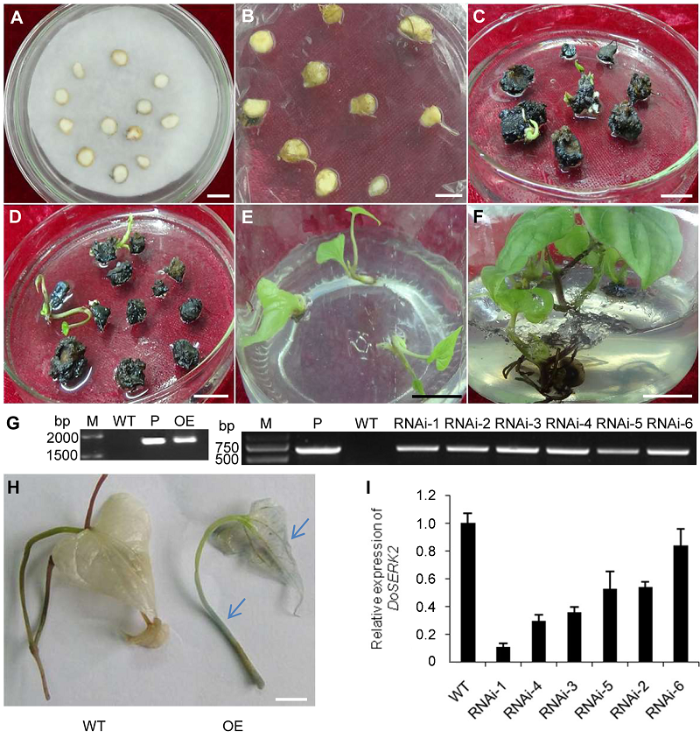 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4铁棍山药微型块茎切片的遗传转化、植株再生及转基因植株的分子鉴定
(A) 农杆菌侵染后的切片; (B) 共培养3天后的切片; (C) 再生苗培养基上培养40天的愈伤组织; (D) 再生苗培养基上培养70天的愈伤组织; (E) 抗性再生苗转入生根培养基; (F) 生根培养基上生长30天的再生苗; (G) 转基因植株基因组DNA的PCR鉴定(M: DNA分子量标记; P: 分别以质粒pCAMBIA1301-DoSERK2 (左)和pART27-DoSERK2 (右)为模板; WT: 以野生型植株的基因组DNA为模板; OE: 以过表达转基因株系基因组DNA为模板; RNAi-1-6: 以沉默载体转基因株系1-6的基因组DNA为模板); (H) 过表达转化叶片及叶柄中的GUS表达情况, 野生型植株(WT)和转基因植株(OE)分别经GUS染色液染色; (I) 内源DoSERK2表达水平的RT-qPCR检测(WT: 以野生型植株的cDNA为模板; RNAi-1-6: 以沉默载体转基因株系1-6 cDNA为模板)。(A)-(F), (H) Bars=1 cm
Figure 4Genetic transformation and regeneration of Dioscorea opposita cv. ‘Tiegun’ microtuber slices and molecular verification of trans- genic plants
(A) Microtuber slices infected by Agrobacterium; (B) Microtuber slices after co-cultivation with Agrobacterium for 3 days; (C) Tissues cultured on regeneration medium for 40 days; (D) Tissues cultured on regeneration medium for 70 days; (E) Antibiotic-resistant regenerated seedlings that had been transferred to rooting medium; (F) Regenerated seedlings that had been cultured on rooting medium for 30 days; (G) PCR assay of genome DNA from transgenic plants (M: DNA marker; P: Plasmid pCAMBIA1301-DoSERK2 (left panel) and pART27-DoSERK2 (right panel) as template; WT: Genome DNA of wild-type plants as template; OE: Genome DNA from overexpression transgenic plants as template; RNAi-1-6: Genome DNA from line 1-6 of transgenic plants of the silencing vector as template); (H) GUS activity assay in the leaf of an overexpression transformant, nodal or leaf segments of a wild-type plant (WT) or transgenic plant (OE) were stained with GUS staining solution; (I) RT-qPCR assay of the endogenous expression levels of DoSERK2 (WT: cDNA of wild-type plants as template; RNAi-1-6: cDNA from line 1-6 of transgenic plants of the silencing vector as template). (A)-(F), (H) Bars=1 cm
3.4.2 GUS组织化学检测
我们通过GUS组织化学染色对过表达转基因植株及野生型对照植株进行检测。结果显示, 经染色后对照植株茎叶脱色后呈白色透明状, 而转基因植株叶片及叶柄上呈现蓝色(图4H)。结合PCR检测结果, 证明导入铁棍山药中的外源基因已在该转基因植株中表达。
3.4.3 RT-qPCR检测
我们利用RT-qPCR对野生型及RNAi转基因植株进行检测, 结果如图4I所示。DoSERK2基因在野生型及RNAi转基因各株系中均有表达, 但在大部分转基因株系中的表达量明显低于野生型。实验结果表明, 沉默载体在一定程度上降低了内源靶基因的表达。
3.5 讨论
3.5.1 抑菌剂Tim对外植体的影响本研究通过对影响遗传转化的抑菌剂等条件进行优化, 建立了一套农杆菌介导的山药遗传转化技术体系。农杆菌介导植物遗传转化具有操作简便、转化效率高及遗传稳定等优点, 因此在植物遗传转化中得到广泛应用(王善平等, 1990; 李卫等, 2000)。外植体经农杆菌侵染后, 必须利用抗生素抑制残留农杆菌的增殖, 以免影响转化苗的生长, 但抗生素在一定程度上也会影响外植体的正常生长。与常见的头孢霉素类抗生素相比, Tim应用较少, 但其抑菌效果好, 对外植体生长影响小(杨亚萍等, 2015)。本研究结果表明, 铁棍山药类原球茎在添加0-500 mg·L-1 Tim的培养基上进行增殖或分化, 均未受到明显影响。因此, 我们选择500 mg·L-1为铁棍山药遗传转化时Tim的抑菌浓度, 以期达到较好的抑菌效果, 从而有利于铁棍山药的遗传转化。
3.5.2 筛选剂对微型块茎再生及生根的影响
筛选剂的选择是影响农杆菌介导的植物遗传转化体系建立的关键因素之一, 常用筛选剂有潮霉素(Hyg) (赵喜亭等, 2016)和卡那霉素(Kan) (付洪冰等, 2010)。本实验中我们分别选用不同浓度的Hyg和Kan作为筛选剂对铁棍山药微型块茎植株再生的影响进行探究, 结果显示, 15 mg·L-1 Hyg和120 mg·L-1 Kan可抑制植株再生, 20 mg·L-1 Hyg和160 mg·L-1 Kan可导致再生植株生根受抑制。由此可知, 铁棍山药对Hyg和Kan敏感。同属的几内亚薯蓣也表现出对Hyg和Kan的敏感性, 二者的适宜筛选浓度分别为10和150 mg·L-1 (Nyaboga et al., 2014)。2个物种的适宜筛选浓度相差较小但也存在差异, 这可能与物种不同或外植体不同有关。
3.5.3 山药微型块茎遗传转化体系的建立
农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(郭利军等, 2013; 廖华兰等, 2016)。我们在参考马铃薯(Solanum tuberosum)试管薯切片转化方法(张宁等, 2004)和本实验室前期建立的铁棍山药再生体系(李明军等, 2004; 王运英, 2016)的基础上, 选择铁棍山药微型块茎切片为外植体, 经过共培养、再生筛选培养和生根筛选培养, 获得了DoSERK2的过表达及沉默转基因植株。微型块茎较愈伤组织具有易诱导形成及便于取材的优点, 但本研究中获得的转化效率偏低。如何进行遗传转化体系的优化, 提高转化效率还需要进一步研究。
综上所述, 本研究以铁棍山药微型块茎为受体材料, 筛选出遗传转化过程中抑菌剂及筛选剂的最佳添加浓度, 成功建立了遗传转化体系, 获得了铁棍山药转基因植株, 为铁棍山药基因功能研究和利用现代生物技术手段进行遗传改良提供了良好的基础, 同时对其它品种山药的遗传转化也具有重要参考价值。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.7666/d.y1394464URL

盾叶薯蓣 (DioscoreazingiberensisC.H.Wright),是我国特有的甾体激素类药源植物,也是世界上薯蓣皂甙元含量最高的资源植物。近 些年,由于人类的过度采挖,野生盾叶薯蓣资源濒临枯竭,而人工栽培种存在皂甙元含量降低,种质退化等问题。细胞和基因工程技术可望为盾叶薯蓣的品种改良提 供一个新的途径。本实验筛选了盾叶薯蓣易组织培养的基因型,并以其三种外植体-幼胚诱导的胚性愈伤,花序愈伤和花序作为转化受体,研究了根癌农杆菌介导的 盾叶薯蓣转化的各种影响因素,获得了转基因植株,初步建立了根癌农杆菌介导的盾叶薯蓣转化体系,为通过转基因技术对其进...
DOI:10.3969/j.issn.1674-3466.2010.04.011URL [本文引用: 1]

以南瓜金辉一号(Cucurbita moschata 'Jinhui 1')为实验材料,利用根癌农杆菌(Agrobacterium tumefaciens)介导转化南瓜子叶节,研究了预培养时间、侵染时间、乙酰丁香酮(AS)浓度和共培养时间,抗生素羧苄青霉素(Carb)、头孢霉 素(Cef)以及筛选剂卡那霉素(Kan)等因素对离体不定芽的影响,建立了南瓜最适遗传转化体系.结果表明:外植体预培养0天,侵染时间30分钟,AS 浓度为100 mg·L-1,共培养5天可获得最高遗传转化效率;最适除菌剂为Cef,其最适浓度为500mg·L-1;最适Kan筛选浓度为100 mg·L-1:在MS培养基上培养抗性芽生根,经PCR和Southern blot检测,证明为转基因植株.
DOI:10.3724/SP.J.1259.2013.00087URL [本文引用: 1]

In this study, we used Eucalyptus grandis clone Eg5 leaves as explants to study the influence of infection time, co-culture pH values and co-culture time on transient expression efficiency. We analyzed the effects of different selection strategies on transgenic plants. Infection time of 45 min, co-culture pH of 5.8, and co-culture time of 3 days achieved the best transient expression efficiency. Screening transgenic plantlets by gradually improving kanamycin concentration increased the selection efficiency to 15% and transformation efficiency was 0.26%. The plantlets were confirmed by GUS staining and PCR analysis.
DOI:10.16366/j.cnki.1000-2367.2016.06.024URL [本文引用: 1]

高效的瞬时表达体系是方便、快捷的研究怀山药基因启动子活性、基因功能和生产重组蛋白的新途径.本研究选取怀山药叶片为受体,以β-葡糖醛酸酶(GUS)和绿色荧光蛋白(GFP)的基因为报告基因,对共培养时间进行分析,得到二者瞬时表达的最初时间以及较佳观察时间,建立根癌农杆菌介导的怀山药瞬时表达技术体系.结果显示:当注射的菌液浓度OD600=0.6,共培养3d时,GUS基因和GFP基因开始有表达,二者适于观察的共培养时间分别为5d和4d.
[本文引用: 1]
DOI:10.3969/j.issn.1000-3142.2004.04.019URL [本文引用: 3]

就不同生长调节剂对怀山药试管苗生长发育的影响进行了系统的研 究.结果表明:(1)NAA、IBA和PP333均能诱导根的生成,但根形成的时间、发生方式及发达程度均不相同.低浓度的NAA(0.1~0.5 mg.L-1)有利于根的生成,但高浓度的NAA(≥2 mg.L-1)则易形成愈伤组织,且随着浓度的升高,愈伤组织化程度变大,根多来源于愈伤组织;IBA(0.1~2 mg.L-1)对根的生成较为有利,其中以IBA 1 mg.L-1的生根效果较好;PP333(0.1~8 mg.L-1)有利于根的生成,根形成的最早、最多,且随着浓度的升高,根更加粗壮发达.(2)PP333抑制试管苗的纵向伸长生长,使株高降低,但却显 著地促进了根系的发育,使试管苗生长健壮,叶色浓绿,叶片增多.这种效应随着PP333浓度的升高而加强.从培养壮苗的角度来看,PP333(2~4 mg.L-1)是最佳浓度.
URL [本文引用: 1]

怀山药脱毒试管苗经诱导可形成脱毒微型块茎,其作为繁殖体比试管苗具有优势。以继代培养的脱毒试管苗带芽茎段为外植体,接种于含60 g·L-1蔗糖的MS液体培养基中,采用黑暗震荡的培养方式进行微型块茎诱导,分别在外植体时期、出芽期、芽伸长期、微型块茎形成期、膨大期和成熟期取材进行相关生理生化指标的测定。结果表明,微型块茎形成过程中可溶性总糖、葡萄糖和果糖含量变化趋势基本一致,均在微型块茎形成期达最大值;蔗糖和淀粉逐渐积累,含量逐步升高;蔗糖合成酶(SS)合成方向活性与蔗糖磷酸合成酶(SPS)活性分别在微型块茎成熟期和膨大期达最大值,共同促进微型块茎内蔗糖的积累;腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)和淀粉合成酶(SSS)分别在酶活性最高时与淀粉合成积累量呈极显著相关;IAA、ABA和ZR含量均与微型块茎形成正相关,JA与微型块茎形成无明显相关。
DOI:10.7501/j.issn.0253-2670.2003.11.2003011567URL [本文引用: 1]

目的探明怀山药病毒病的症状和感染病毒的种类,为脱除怀山药病毒、提高产量、改善品质奠定基础.方法调查怀山药大田感病情况,应用电镜法观察病毒的大小和形状,采用分子生物学方法进一步探明病毒种类.结果怀山药感染病毒后的症状为叶色失绿、花叶、畸形;在透射电镜下,观察到长600~1 200 nm的线状病毒,并初步判断为马铃薯Y病毒PCR扩增后的电泳检测显示出了清晰的马铃薯Y病毒和马铃薯卷叶病毒的电泳条带.结论首次发现怀山药感染的病毒为马铃薯Y病毒和马铃薯卷叶病毒,它是造成怀山药产量下降和品质退化的主要原因.
URL

为提高山药离体繁殖的速度,缩短繁殖周期,以铁棍山药(Dioscorea opposita cv.‘Tiegun’)带腋芽茎段为材料,对类原球茎的诱导、增殖、分化与植株再生进行了研究。结果表明,铁棍山药类原球茎诱导的最适培养基为MS+1.0 mg·L~(–1)TDZ+30 g·L~(–1)蔗糖,增殖的最适培养基为MS+9 mg·L~(–1) 6-BA+30 g·L~(–1)蔗糖,分化的最适培养基为MS+2 mg·L~(–1) KT+0.02mg·L~(–1) NAA+30 g·L~(–1)蔗糖,最适生根培养基为1/4MS+0.05 mg·L~(–1) NAA+1.0 mg·L~(–1) PP333+15 g·L~(–1)蔗糖,生根率达80%,移栽成活率可达85%。类原球茎的诱导形成及植株再生体系的建立为怀山药种苗的快速繁殖提供了一条新途径。
DOI:10.3321/j.issn:0023-074X.2000.08.002URL [本文引用: 1]

综述了根癌农杆菌介导的遗传转化近几年获得的新进展在转化机理方面,对农杆菌自身转录与调控的研究已相当深入,而对有关的植物编码因子的研究也已取得了实质性进展;在转化范围上,对真菌与裸子植物的转化取得了不少进展,单子叶植物尤其是一些有重要经济价值的禾谷类作物应用农杆菌介导相继获得了转化植株;在转化方法方面,发展了新的简单有效的整体植株感染法,并将T-DNA转移和整合原理结合到基因枪等DNA直接转移方法上;细菌人工染色体与农杆菌的联合应用赋予了其大片段DNA转化的功能.针对上述领域,指出了其中仍然存在的一些问题并提出了一些构想.
DOI:10.15886/j.cnki.rdswxb.2016.03.004URL [本文引用: 1]

以木薯腋芽为外植体,通过添加不同含量的2,4-D和picloram摸索诱导体细胞胚及FEC的最佳激素条件;利用优化的再生体系,以木薯脆性胚性愈伤组织(FEC)为受体,对农杆菌侵染FEC的侵染浓度、侵染时间以及侵染后潮霉素抗性筛选浓度进行了研究。结果表明,12 mg·L^-1的picloram能较快诱导出体细胞胚及FEC;农杆菌菌液浓度OD600=0.4并侵染30 min为FEC转化效率及植株再生率的最佳条件;共培养后,通过逐渐增加潮霉素筛选浓度(0,5,8,15 mg·L^-1)能更有效地提高植株的再生率。
URL [本文引用: 1]
URL [本文引用: 3]

怀山药为我国著名的“四大怀药”之一,风味鲜美,药食兼优,是很好的营养品和保健品。脱毒微型块茎是怀山药优质种苗的一个重要来源,它可以解决怀山药长期营养繁殖所造成的病毒病和品质退化等问题。在前期研究工作的基础上,为了能够使不同时期产生的脱毒微型块茎在播种季节统一、高效的萌发,我们对其萌发进行了系统的研究,并重点从植物生长调节剂,体积大小,贮藏温度和时间等方面来探索脱毒微型块茎的萌发条件,以及从形态解剖学、生理机制和内源激素变化等方面来探明其萌发机制,结果如下:1.不同浓度配比的植物生长调节剂(NAA、6-BA、KT)对脱毒微型块茎的管内萌发影响很大,最适于其萌发的植物生长调节剂组合为NAA 0.02 mg·L-1+6-BA 1 mg·L-1,这时脱毒微型块茎的萌发率最高可达77.78%。2.无论在管内还是管外萌发,Ⅱ级脱毒微型块茎(直径0.6-0.8 cm)的萌发率最高(管内84.49%,管外83.47%),其次是Ⅲ级脱毒微型块茎(直径0.4-0.6 cm),最低的是Ⅰ级脱毒微型块茎(直径0.8 cm),体积太大或太小均不利于其萌发。3.不同贮藏温度和贮藏时间对脱毒微型块茎的管内、管外萌发影响很大,无论是管内还是管外,与25℃相比,脱毒微型块茎经4℃贮藏后更容易萌发,且萌发率较高;当脱毒微型块茎在4℃下贮藏6 w后,其萌发率达到最高(管内73.40%,管外78.56%),6 w到12 w之间,脱毒微型块茎的萌发率并没有发生太大变化。4.脱毒微型块茎的内部形态以及淀粉和蛋白质的分布在其萌发过程中都发生了重大变化。成熟脱毒微型块茎最外层是木栓质表皮,其内为周皮,周皮以内是薄壁细胞,中部的薄壁细胞富含淀粉粒和蛋白质。当休眠逐渐解除时,顶端分生组织细胞开始分裂,芽眼开始萌动。随着休眠的彻底解除,细胞分裂速度加快,生长锥变成半球状,最后出现小芽,这时淀粉粒和蛋白质都有所减少。萌发出的小芽不断生长,导致淀粉粒和蛋白质越来越少。5.脱毒微型块茎在采收期、播种期、毛根期以及萌发Ⅰ、Ⅱ、Ⅲ期这六个时期内,萌芽组织和其余组织中的主要有机物及其相关酶活性、内源激素都发生了很大变化。⑴主要有机物的变化脱毒微型块茎在萌发过程中,两种组织中的淀粉含量一直下降;可溶性糖、蔗糖、果糖以及葡萄糖含量在这两种组织中的变化趋势大体是先升高后下降;总酚含量先下降后升高,并且最低值出现的时期是播种期;萌芽组织中的蛋白质含量表现出下降-升高-下降的趋势,而其余组织中的蛋白质含量一直在下降。⑵相关酶活性的变化脱毒微型块茎在萌发过程中,α-淀粉酶、淀粉磷酸化酶(SP)共同完成淀粉的分解,并且萌芽组织中的α-淀粉酶活性在萌发Ⅱ期达到最大,而SP活性在毛根期时出现最大值;蔗糖酶和蔗糖合成酶(SS)共同完成蔗糖的分解,并且毛根期时萌芽组织中的蔗糖酶活性和SS分解方向活性都达到最大值;多酚氧化酶(PPO)活性直接影响着总酚的含量,当总酚含量在播种期达到最低值时,PPO活性达到最高值。另外,抗氧化酶系统通过调节超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性来维持萌发过程中脱毒微型块茎内膜系统的稳定。⑶内源激素的变化脱毒微型块茎处于采收期时,两种组织中的GA、IAA、ZR含量较低,ABA含量较高。进入播种期和毛根期,萌芽组织中的GA、IAA、ZR含量都在升高,而ABA含量下降。进入萌发Ⅰ期,萌芽组织中的GA、ABA含量有所上升,IAA、ZR含量略有下降;进入萌发Ⅱ期,萌芽组织中的GA、ZR、ABA含量都在下降,IAA含量略有上升,其余组织中的GA含量无明显变化,IAA、ABA含量上升,ZR含量下降;进入萌发Ⅲ期,只有IAA含量在萌芽组织中表现出升高趋势,ABA含量在其余组织中表现出下降趋势,其他均无太大变化。总之,GA、IAA、ZR都表现出与脱毒微型块茎的萌发呈正相关,而ABA表现出呈负相关。另外,JA含量在整个过程中呈现出先下降后升高的趋势,它可能与脱毒微型块茎休眠的解除呈负相关,而与芽的后续萌发呈正相关。
URL

大薯(Dioscorea alata Linn.)为薯蓣科薯蓣属藤本植物,是一种药、食、饲兼用的高产高效经济作物;其产量潜力和淀粉含量高,成为能源植物的新选择。由于大薯很少开花或根本不开花、结实率和种子萌发率低、休眠时间长和无性繁殖等生物学特性原因,造成种质资源的退化,产量降低,开展大薯亲缘关系和进行遗传育种的研究报道很少,亟需清楚大薯种质的遗传背景并开展相关育种技术的研究。 本研究应用AFLP分子标记方法对收集于6省不同地区的111份大薯材料进行遗传多样性分析,并选择遗传背景不同的3份种质(Da-56、Da-87、Da-137)的带节茎段为外植体,离体诱导类原球茎并建立大薯类原球茎的再生体系,采用根癌农杆菌侵染法构建遗传转化体系,并进行天山雪莲△9硬脂酰-ACP脱饱和酶基因(sik SAD)的遗传转化。主要研究结果如下: 1、利用AFLP分子标记方法分析了111份大薯材料的遗传多样性。筛选到的8个AFLP引物组合扩增到1291个位点,其中1286个是多态性位点,占99.61%。利用多态性信息含量(PIC)、标记指数(MI)和解析强度(RP)分析不同引物组合的标记效率。获得引物的PIC平均值为0.22,MI平均值为35.67,RP平均值为50.50,表明引物扩增位点的高多态性和对大薯种质资源具有强辨别能力,其中引物E-AAC/CAG-M(PIC0.24.、MI38.56、RP56.32)具有较高的标记效率。111份大薯材料之间的遗传相似系数(GS)在0.30~0.82之间,平均为0.58,表明大薯种质资源的遗传相似性较低。采用UPGMA和PCOA对大薯种质进行聚类分析,在遗传相似系数在0.54时,111份材料划分为4个类群和3个单独的分支,不同地区来源的大薯材料在聚类图中没有明显界限。以此为基础,选择不同遗传背景的Da-56、Da-87和Da-137为后续试验材料。 2、建立了不同种质类原球茎(PLBs)的再生体系。采用正交试验以无菌苗的带节茎段为外植体离体诱导类原球茎并建立大薯类原球茎的再生体系,诱导类原球茎的最适培养基为MS(含3×Ca2+)+1mg/L6-BA+0.2mg/L NAA+0.1%PVP+3%蔗糖,Da.56.Da-87和Da-137类原球茎诱导率最高分别为91.67%、93.33%和90%;类原球茎增殖最适培养基为MS+4mg/L6-BA+80mg/L Ad+0.1%PVP+3%蔗糖,3份种质的增殖系数分别为2.67、2.83、2.52;类原球茎生根最适培养基:1/2MS+0.1mg/L NAA+0.1%PVP+3%蔗糖;3份大薯种质间的类原球茎诱导率、增殖系数和生根率差异不显著。经该途径诱导得到的生根类原球茎植株进行炼苗,炼苗基质珍珠岩:蛭石=2:1,移栽成活率可达到100%。 3、确证了大薯繁殖体(类原球茎)的命名及起源。通过石蜡切片技术进行类原球茎的组织解剖学观察,结果表明大薯类原球茎由表皮、分生组织和大量薄壁组织组成,是产生不定芽与不定根的胚性聚合体,符合类原球茎的描述。其不定芽来源于最外层薄壁细胞脱分化形成的芽原基,属于外起源的器官发生类型。不定芽发生过程涉及到分生组织内部细胞的程序性死亡,在这个过程中芽原基生长点与其周围包裹的鳞片叶分离,而后鳞片叶逐渐脱落或者分开。类原球茎内胚性细胞团分化出维管组织使不定芽与不定根与之相连,从而构成一个完整的个体,具有较强的分化再生能力。 4、建立了根癌农杆菌侵染大薯类原球茎的转化体系。以携带gus报告基因的pCAMBIA1301为载体,采用正交设计实验研究不同的转化参数对类原球茎gus瞬时表达率的影响。结果显示,将类原球茎在OD600为0.6农杆菌菌液中侵染30miN,然后转到含AS200μmol/L的类原球茎诱导培养基上共培养3天,瞬时表达率高达51.25%。 5、验证了大薯类原球茎的遗传转化体系。采用已优化的转化体系通过农杆菌GV3101介导将sik SAD转入大薯Da-87的类原球茎中,通过170mg/L卡那霉素(Kan)的筛选,获得256株抗性植株。对长势较快的50株进行PCR检测,获得10株转基因阳性植株;挑取4株进行RT-PCR和QRT-PCR检测,sik SAD基因在4株转基因株系叶片中均有表达,但各株系之间存在差异,其中DaT09植株表现出最高的目的基因表达效率。
URL [本文引用: 1]

研究了MS培养基中不同浓度头孢噻肟钠(Cefotaxime sodium)、羧苄青霉素(Carbenicillin)和特美汀(Timentin)3种抑菌剂对发根农杆菌的抑制效果及对茶树组培苗丛生芽的影响。结果显示,头孢噻肟钠和特美汀均可以有效抑制农杆菌LBA9402、15834,而15834在羧苄青霉素的板上17 d内长出;对于外植体,头孢噻肟钠和羧苄青霉素都显著降低了茶组培苗的丛生芽增殖率,且畸形苗率高;当特美汀质量浓度在400mg·L-1以下时,对茶组培苗影响较小,与正常对照无显著差异,特美汀具有作为茶树遗传转化体系中抑菌剂的潜力。
DOI:10.3969/j.issn.1672-3635.2004.03.002URL [本文引用: 1]

通过根癌农杆菌介导的遗传转化方法,建立了马铃薯栽培品种“费乌瑞它(Favorita)”茎段和试管薯的遗传转化体系,其转化频率分别可达25.6%和36.8%。实验结果表明,玉米素有助于茎段和试管薯转化再生芽的分化,乙酰丁香酮可以提高茎段的转化率,但对试管薯的转化作用效果不明显。卡那霉素生根筛选和PCR鉴定结果显示,在分化培养基上再生的转化植株假阳性率较高,在遗传转化工作中要加大转基因植株的数量,才有可能获得所期望的转基因植株群体。
DOI:10.11983/CBB15179URL [本文引用: 1]

植物受体再生及遗传转化体系的建立是对植物进行转基因操作时至关重要的一个技术环节。以菊花优良种质怀黄菊(Chrysanthemum morifolium cv.‘Huaihuang’)为试材,探讨胚状体诱导所需的最佳培养基及芽分化和根生长的最适抗生素选择压。在此基础上,将抗病基因Cm TGA1通过同源转化的方法转入怀黄菊,获得再生植株。结果表明,在附加1.5 mg·L-1IAA、0.5 mg·L-1 6-BA和1.0 mg·L-1 2,4-D的MS培养基上诱导培养15天后,再去除2,4-D进行分生培养,并进一步诱导芽再生,最终86%的供试外植体通过胚状体途径获得再生芽;在芽分化时所需潮霉素选择压为5.0 mg·L-1,生根时潮霉素选择压为4.5 mg·L-1。对转化植株进行半定量PCR(semi-quantitative PCR)和实时荧光定量PCR(real-time quantitative PCR)检测,结果表明,Cm TGA1基因成功整合到转化植株基因组中,从而建立了怀黄菊间接体细胞胚途径转基因受体再生体系。该技术的建立为通过转基因手段解决生产中存在的怀黄菊病害感染严重和种质退化等问题奠定了基础。
DOI:10.1093/nar/19.6.1349URLPMID:2030957 [本文引用: 1]

ABSTRACT A method for rapid preparation of plant genomic DNA for PCR analysis was established. A small amount (4~6 mg) of leaf tissue of rice seedling, 200 L of TE buffer, and one tungsten bead were put into a 2 mL microcentrifuge tube. After vigorously shaking in a miller for 5 min, 1L of the solution was directly applied to PCR amplification. This method is simple, rapid, high efficient, low cost, and reliable for PCR analysis, thus is es- pecially suitable for genotyping of large number of samples.
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
DOI:10.1023/A:1006028406641URL

Leaf mesophyll protoplasts from immature leaves of in vitro shoot cultures of a range of cultivars of three species of food yam (Dioscorea alata, D. bulbifera and D. cayenensis-rotundata) were isolated and their responses to culture in agarose-solidified media compared. Leaves at early stages of development (< 1.0 cm in length) proved most suitable for production of active yam protoplasts capable of cell division. Formation of cell colonies to the 50-cell stage was observed in protoplast cultures in five of ten cultivars of D. alata and to the 30-cell stage in two cultivars of D. cayenensis-rotundata but not in cultures of D. bulbifera. Embryogenic cell suspension protoplasts of D. alata cv. Oriental Lisbon were successfully transformed with plasmids pBI 221.2, pBI 221.54, pBSGUS1 and pJT137 using a standard polyethylene glycol-mediated uptake method. Levels of transient expression of the uidA gene varied according to the plasmid used and the cell lines from which yam protoplasts were derived. This is the first report of yam protoplast culture leading to cell regeneration and direct gene transfer into protoplasts of this monocotyledonous genus.
.
DOI:10.1155/2016/3089584URLPMID:4899605 [本文引用: 1]

Quantitative real-time polymerase chain reaction (qRT-PCR) is one of the most common methods for gene expression studies. Data normalization based on reference genes is essential for obtaining reliable results for qRT-PCR assays. This study evaluated potential reference genes of Chinese yam (Dioscorea opposita Thunb.), which is an important tuber crop and medicinal plant in East Asia. The expression of ten candidate reference genes across 20 samples from different organs and development stages was assessed. We identified the most stable genes for qRT-PCR studies using combined samples from different organs. Our results also suggest that different suitable reference genes or combinations of reference genes for normalization should be applied according to different organs and developmental stages. To validate the suitability of the reference genes, we evaluated the relative expression of PE2.1 and PE53, which are two genes that may be associated with microtuber formation. Our results provide the foundation for reference gene(s) selection in D. opposita and will contribute toward more accurate gene analysis studies of the genus Dioscorea.
根癌农杆菌介导的盾叶薯蓣转化体系的建立
0
2008
农杆菌介导南瓜遗传转化体系的建立
1
2010
... 筛选剂的选择是影响农杆菌介导的植物遗传转化体系建立的关键因素之一, 常用筛选剂有潮霉素(Hyg) (
农杆菌介导巨桉Eg5高效遗传转化
1
2013
... 农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(
农杆菌介导的怀山药叶片瞬时表达方法的建立
1
2016
... 目前, 有关薯蓣属植物的遗传转化研究还比较少.T?r等(1993, 1998)曾分别利用基因枪法和PEG介导法转化大薯(D. alata), 实验中均能检测到基因的瞬时表达, 但都未得到转基因植株.许云(2014)在大薯中以类原球茎为材料建立了遗传转化体系.范俊强(2008)分别以胚性愈伤组织、花序诱导的愈伤组织及花序3种材料为受体, 利用农杆菌介导法获得了盾叶薯蓣(D. zingiberensis)转基因植株.Nyaboga等(2014)通过农杆菌介导法获得了圆山药(D. rotundata)转基因植株.我们前期在怀山药中建立了根癌农杆菌介导的瞬时表达技术, 使β-葡糖醛酸酶基因(GUS)和绿色荧光蛋白报告基因(GFP)在山药叶片中瞬时表达(
1
... 铁棍山药(Dioscorea opposita cv. ‘Tiegun’)属薯蓣科薯蓣属, 为多年生缠绕藤本植物, 是四大怀药之一怀山药(D. opposita)的优良品种(
NAA、IBA和PP333对怀山药试管苗生长发育的影响
3
2004
... 在参考本实验室前期建立的铁棍山药微型块茎再生体系(
... 我们利用携带DoSERK2过表达载体或沉默载体的根癌农杆菌侵染铁棍山药微型块茎(
... 农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(
怀山药微型块茎形成过程中的生理生化变化
1
2017
... 微型块茎是指在山药试管苗腋芽处形成的变态块茎(
怀山药病毒病的研究
1
2003
... 铁棍山药(Dioscorea opposita cv. ‘Tiegun’)属薯蓣科薯蓣属, 为多年生缠绕藤本植物, 是四大怀药之一怀山药(D. opposita)的优良品种(
怀山药类原球茎的诱导形成与植株再生
0
2018
根癌农杆菌介导遗传转化研究的若干新进展
1
2000
... 本研究通过对影响遗传转化的抑菌剂等条件进行优化, 建立了一套农杆菌介导的山药遗传转化技术体系.农杆菌介导植物遗传转化具有操作简便、转化效率高及遗传稳定等优点, 因此在植物遗传转化中得到广泛应用(
农杆菌介导的木薯遗传转化体系的优化
1
2016
... 农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(
毛白杨叶外植体的遗传转化
1
1990
... 本研究通过对影响遗传转化的抑菌剂等条件进行优化, 建立了一套农杆菌介导的山药遗传转化技术体系.农杆菌介导植物遗传转化具有操作简便、转化效率高及遗传稳定等优点, 因此在植物遗传转化中得到广泛应用(
怀山药脱毒微型块茎管内管外萌发条件及生理生化机制研究
3
2016
... 在参考本实验室前期建立的铁棍山药微型块茎再生体系(
... 我们利用携带DoSERK2过表达载体或沉默载体的根癌农杆菌侵染铁棍山药微型块茎(
... 农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(
大薯遗传多样性的AFLP分析和类原球茎遗传转化体系的研究
0
2014
发根农杆菌抑菌剂的抑菌效果及对茶组培苗丛生芽的影响
1
2015
... 本研究通过对影响遗传转化的抑菌剂等条件进行优化, 建立了一套农杆菌介导的山药遗传转化技术体系.农杆菌介导植物遗传转化具有操作简便、转化效率高及遗传稳定等优点, 因此在植物遗传转化中得到广泛应用(
根癌农杆菌介导的马铃薯高效遗传转化体系的研究
1
2004
... 农杆菌侵染外植体完成遗传转化是一个多因素控制的复杂过程, 外植体、农杆菌菌株、菌液OD值及侵染时间等都对遗传转化尤为重要(
怀黄菊间接体胚受体再生体系的建立及CmTGA1的遗传转化
1
2016
... 筛选剂的选择是影响农杆菌介导的植物遗传转化体系建立的关键因素之一, 常用筛选剂有潮霉素(Hyg) (
A simple and rapid method for the preparation of plant genomic DNA for PCR analysis
1
1991
...
A simple method for microtuber production in Dioscorea opposita using single nodal segments
1
2015
... 铁棍山药试管苗由河南省道地药材保育及利用工程技术研究中心继代培养, 微型块茎由单节茎段经一步振荡诱导法诱导获得(
1
... 铁棍山药(Dioscorea opposita cv. ‘Tiegun’)属薯蓣科薯蓣属, 为多年生缠绕藤本植物, 是四大怀药之一怀山药(D. opposita)的优良品种(
Agrobacterium-mediated genetic transformation of yam ( Dioscorea rotundata): an important tool for functional study of genes and crop improvement
1
2014
... 筛选剂的选择是影响农杆菌介导的植物遗传转化体系建立的关键因素之一, 常用筛选剂有潮霉素(Hyg) (
Stable transfor-mation of the food yam Dioscorea alata L.by particle bombardment
0
1993
Isolation and culture of protoplasts from immature leaves and embryogenic cell suspensions of Dioscorea yams: tools for transient gene expression studies
0
1998
Identification and validation of reference genes for qRT-PCR studies of gene expression in Dioscorea opposita
1
2016
... 选取对照和Kan抗性植株叶片, 参照植物RNA提取试剂盒说明书提取mRNA, 反转录获得cDNA.以Do- Actin为内参基因进行RT-qPCR检测(
备案号: 京ICP备16067583号-21
版权所有 © 2021 《植物学报》编辑部
地址:北京香山南辛村20号 邮编:100093
电话:010-62836135 010-62836131 E-mail:cbb@ibcas.ac.cn
本系统由北京玛格泰克科技发展有限公司设计开发
