王燕 ,
牟豪杰 ,
吕永平 ,
李海营 ,
汪一婷 ,
陈剑平 * , 浙江省农业科学院病毒与生物技术研究所, 杭州 310021
Wang Yan ,
Mou Haojie ,
Lü Yongping ,
Li Haiying ,
Wang Yiting ,
Chen Jianping * , Institute of Virus and Biotechnology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China 引用本文 王燕 ,
牟豪杰 ,
吕永平 ,
李海营 ,
汪一婷 ,
陈剑平 . 寿锦的离体植株再生及组培产业化增殖. , 2017, 52(3): 331-336
贡献者
* 通讯作者。E-mail: jpchen2001@126.com 基金资助
引进国际先进农业科学技术计划(No.2011-G31)和浙江省农业科学院青年人才培养项目(No.2015R21R08E08) ;
接受日期:2016-08-16接受日期:2017-03-6网络出版日期:2017-05-1
-->Copyright
20172010 《植物学报》编辑部
Contributors
Corresponding * Author for correspondence. E-mail: jpchen2001@126.com History
Received :
Accepted :
Online :
摘要: 以寿锦(Haworthia retusa × cooperi cv. ‘Variegata’)的幼嫩花蕾为外植体, 对其进行了离体植株再生及组培产业化增殖研究。结果显示, 外植体在MS+5.0 mg·L-1 6-BA+0.5 mg·L-1 IBA培养基上诱导产生愈伤组织; 不添加激素的MS基本培养基最适宜寿锦愈伤组织的分化; 再生芽在MS+0.2 mg·L-1 6-BA培养基上增殖时, 不定芽增殖率及斑锦类型不定芽的诱导率最高, 分别为16.7和79.9%。研究结果表明, 通过愈伤组织途径能够诱导寿锦不定芽的再生, 适当浓度的细胞分裂素有利于提高寿锦的诱导率。研究结果对于珍稀斑锦多肉植物种质资源的保护及其产业化应用具有重要的指导意义。 关键词 :
寿 ;
斑锦 ;
离体再生 ;
不定芽 ;
产业化增殖 Abstract :
We performed in vitro plantlet regeneration and multiplication of Haworthia retusa × cooperi cv. ‘Variegata’ for industrial production by taking the young alabastrum as explants. Calli were induced from explants on MS+5.0 mg∙L-1 6-BA+0.5 mg∙L-1 IBA medium. MS medium without 6-BA was found appropriate for the differentiation of calli. The regenerated shoots had the highest multiplication ratio and induction rate of chimeric bud (16.7 and 79.9%, respectively) when propagated on MS+0.2 mg∙L-1 6-BA. Our results show that the plantlet regeneration of H. retusa × cooperi cv. ‘Variegata’, through adventitious bud induction from callus was feasible and an appropriate concentration of cytokinin could improve the induction rate of chimeric buds. This study offers insight into the germplasm protection and industrial production of rare chimeric succulents. Key words :
Haworthia ;
chimera ;
regeneration in vitro ;
adventitious bud ;
industrial multiplication 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 )。大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理。寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 )。寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值。然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 )。因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求。此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广。因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义。目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 )。
从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 )。嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 )。前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 )。本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 )。因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义。
1 植物材料材料为杂交寿在自然条件下发生突变产生的一株寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)。待其抽薹后选取花序上具有嵌合性状的幼嫩花蕾作为外植体。实验材料由浙江省农业科学院组培中心温室 提供。
2 培养基成分与培养条件2.1 外植体的消毒及接种将寿锦花序上闭合花蕾的外苞片去除后, 连同花柄逐个切下进行消毒处理。先用自来水冲洗, 然后浸泡于饱和洗衣粉溶液中, 30分钟后再用自来水冲洗干净, 然后依次在75%乙醇溶液和有效氯浓度为1%的次氯酸钠溶液中分别浸泡40秒和6分钟, 其间摇动几次以彻底消毒, 最后在超净工作台上用无菌蒸馏水冲洗3-5遍。将消毒后的花蕾置于灭菌滤纸上, 吸去水分后接种到初代培养基上进行愈伤组织诱导, 培养基组成为MS+5.0 mg∙L
-1 6-BA+0.5 mg∙L
-1 IBA, 添加3%蔗糖和0.7%琼脂, pH5.8。培养温度为(23±2)°C, 每天12小时光照, 光照强度为40 µmol∙m
-2 ∙s
-1 。
2.2 愈伤组织的分化培养将诱导产生的愈伤组织转接至新鲜的初代培养基上进行继代培养, 然后将增殖的愈伤组织转接至分化培养基上进行不定芽的诱导。分化培养基以MS为基本培养基, 添加3%蔗糖、0.7%琼脂以及不同浓度(0、0.1、0.2和0.5 mg∙L
-1 )的6-BA, pH5.8。接种时尽量选取状态及大小相似的愈伤组织块, 每瓶接种4个, 每组做5瓶重复。培养5周后观察愈伤组织的分化情况并统计不定芽的再生率。培养条件: (23±2)°C, 光照强度为60 μmol∙m
-2 ∙s
-1 , 光照时间为每天12小时。
2.3 不定芽的增殖培养将在最佳分化培养基上诱导出的寿锦接种到增殖培养基上进行不定芽增殖培养。增殖培养基以MS为基本培养基, 添加3%蔗糖、0.7%琼脂以及不同浓度(0.05、0.1和0.2 mg∙L
-1 )的6-BA, pH5.8。接种时挑选斑锦均匀的寿锦不定芽单株, 每瓶接种4个, 每组设5个重复。6周后统计增殖不定芽的类型及数量, 计算并比较斑锦类型的诱导率。培养条件为(23±2)°C, 光照强度为80 μmol∙m
-2 ∙s
-1 , 光照时间为每天16小时。
2.4 壮苗及移栽将在最佳增殖培养基上获得的寿锦不定芽, 在无菌条件下切割成单株后, 转接到MS基本培养基上进行壮苗培养, 培养5周后可长成健壮幼苗。培养温度为(23±2)°C, 光照强度为80 μmol∙m
-2 ∙s
-1 , 光照时间为每天12小时。将寿锦苗从培养瓶中取出并洗掉残留培养基后将根系切除, 然后置于通风避光处晾干, 再移栽至多肉植物颗粒土基质中进行栽培。
2.5 数据处理及分析愈伤组织分化率=(发生分化的愈伤组织块数/接种的愈伤组织总块数)×100%;
不定芽诱导率=(愈伤分化产生的不定芽总数/接种的愈伤组织总块数)×100%;
不定芽增殖率=增殖出的不定芽总数/接种的芽数;
寿锦的诱导率=(增殖出的斑锦类型不定芽数/增殖不定芽总数)×100%。
使用SPSS (SPSS Inc, Chicago, USA)软件包进行统计分析, 并对数据进行差异分析(ANOVA)和差异显著性检验(LSD)。
3 结果与讨论3.1 愈伤组织的诱导及分化初代培养3-4周后, 花蕾基部显著膨大并开始脱分化。培养5-6周后, 有白色或黄绿色愈伤组织形成, 愈伤组织的质地较为松散, 生长速度快(
图1A )。培养7-8周, 将愈伤组织转接至新鲜的初代培养基进行继代增殖培养。随后, 将增殖3周左右的愈伤组织转移到4种分化培养基上进行不定芽诱导。如
图1 所示, 分化培养2-3周后, 愈伤组织表面出现深绿色的小突起(
图1 B), 随后逐渐分化并产生不定芽(
图1 C)。分化培养5周后, 愈伤组织在不同分化培养基的分化情况如
表1 所示。当6-BA浓度为0.5 mg∙L
-1 时, 愈伤组织的分化率仅为35%, 部分不定芽呈玻璃化甚至再次脱分化; 随着6-BA浓度的降低, 愈伤组织的分化率和不定芽的诱导率显著提高; 当6-BA浓度降为0 mg∙L
-1 时, 愈伤组织的分化率为100%, 不定芽诱导率也达到最高(平均每块愈伤组织分化出9.85个不定芽)。可见, 6-BA的添加不利于寿锦愈伤组织的分化, 而不添加激素的MS基本培养基最适合愈伤组织进行不定芽分化。如
图1 D所示, 通过愈伤组织的分化培养我们获得了全绿、全黄和斑锦3种不定芽类型且芽体健康。
图1 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_1.png <b>图1</b> 寿锦愈伤组织的诱导、分化及植株再生<br/>(A) 愈伤组织诱导; (B) 愈伤组织分化; (C), (D) 不定芽诱导; (E) 壮苗和生根; (F) 移栽。Bar=1 mm<br/><b>Figure 1</b> The callus induction, differentiation and plantlet regeneration of <i>Haworthia retusa </i>× <i>cooperi</i> cv. ‘Variegata’<br/>(A) Callus induction; (B) Callus differentiation; (C), (D) The induction of adventitious buds; (E) Seedling and rooting; (F) Transplantation. Bar=1 mm Figure 1 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_1.png <b>图1</b> 寿锦愈伤组织的诱导、分化及植株再生<br/>(A) 愈伤组织诱导; (B) 愈伤组织分化; (C), (D) 不定芽诱导; (E) 壮苗和生根; (F) 移栽。Bar=1 mm<br/><b>Figure 1</b> The callus induction, differentiation and plantlet regeneration of <i>Haworthia retusa </i>× <i>cooperi</i> cv. ‘Variegata’<br/>(A) Callus induction; (B) Callus differentiation; (C), (D) The induction of adventitious buds; (E) Seedling and rooting; (F) Transplantation. Bar=1 mm 在新窗口打开 下载 下载原图ZIP 生成PPT 图1
寿锦愈伤组织的诱导、分化及植株再生
(A) 愈伤组织诱导; (B) 愈伤组织分化; (C), (D) 不定芽诱导; (E) 壮苗和生根; (F) 移栽。Bar=1 mm
Figure 1
The callus induction, differentiation and plantlet regeneration of
Haworthia retusa ×
cooperi cv. ‘Variegata’
(A) Callus induction; (B) Callus differentiation; (C), (D) The induction of adventitious buds; (E) Seedling and rooting; (F) Transplantation. Bar=1 mm
表1 Table 1 表1 表1 不同浓度6-BA对寿锦不定芽诱导的影响
Table 1 Effects of 6-BA on the callus differentiation of
Haworthia retusa ×
cooperi cv. ‘Variegata’
Concentration of 6-BA (mg∙L-1 ) No. of calli No. of differentiated Differentiation rate (%) No. of adventitious Induction rate of 0 20 20 100.0 197 9.85±3.51 a 0.1 20 17 85.0 133 6.65±2.47 b 0.2 20 13 65.0 81 4.05±1.83 c 0.5 20 7 35.0 36 1.80±0.94 d
Values with different lowercase letters in each column mean significant difference at P <0.05. 同列数值间不同小写字母表示差异显著(P <0.05)。 表1
不同浓度6-BA对寿锦不定芽诱导的影响
Table 1
Effects of 6-BA on the callus differentiation of
Haworthia retusa ×
cooperi cv. ‘Variegata’
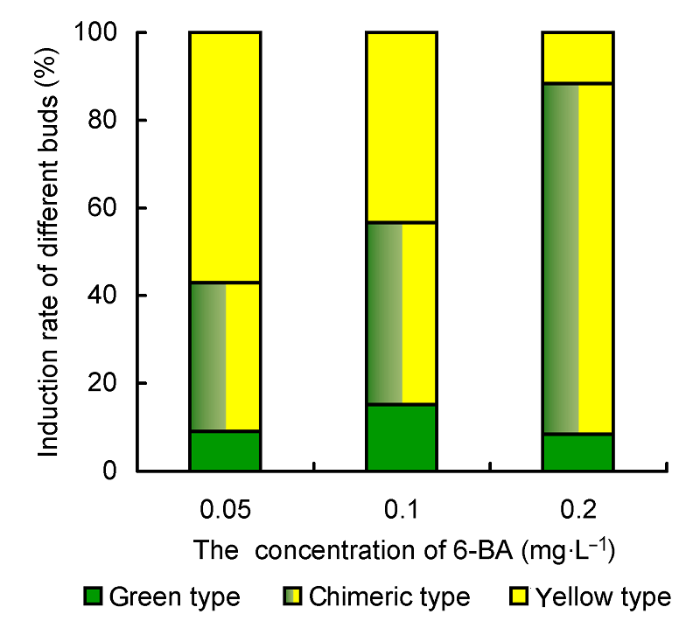
3.2 6-BA浓度对寿锦增殖及性状稳定性的影响寿锦的性状稳定性较差, 在其增殖过程中3种类型的不定芽都会产生, 因此提高斑锦类型(即寿锦)的诱导率是实现其产业化的关键。我们以获得的斑锦类型不定芽为材料, 对其在不同增殖培养基上的增殖情况和稳定性进行了研究。结果如
表2 和
图2 所示。当增殖培养基中6-BA浓度为0.05 mg∙L
-1 时, 不定芽增殖率为3.85。其中, 全黄类型不定芽占主导, 斑锦类型不定芽的诱导率为33.7%, 全绿类型最少。随着6-BA浓度的升高, 不定芽增殖率显著提高, 其中斑锦类型不定芽所占比例显著增加, 而全黄类型占比则显著降低。当增殖培养基中6-BA浓度为0.2 mg∙L
-1 时, 不定芽增殖率增至16.70, 斑锦类型的诱导率达到79.9%。
表2 Table 2 表2 表2 不同浓度6-BA对寿锦增殖稳定性的影响
Table 2 Effects of 6-BA on stability of
Haworthia retusa ×
cooperi cv. ‘Variegata’ during multiplication
Concentration of 6-BA (mg∙L-1 ) No. of buds for multiplication No. of green buds No. of yellow No. of chimeric buds Total No. of Multiplication Induction rate of chimeric bud (%) 0.05 20 7 44 26 77 3.85±0.74 c 33.7±5.63 c 0.10 20 29 90 83 202 9.55±2.28 b 41.4±7.96 b 0.20 20 28 39 267 334 16.70±4.69 a 79.9±8.98 a
Values with different lowercase letters in each column mean significant difference at P <0.05. 同列数值间不同小写字母表示差异显著(P <0.05)。 表2
不同浓度6-BA对寿锦增殖稳定性的影响
Table 2
Effects of 6-BA on stability of
Haworthia retusa ×
cooperi cv. ‘Variegata’ during multiplication
图2 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_2.png <b>图2</b> 不同浓度6-BA对寿锦增殖不定芽诱导率的影响<br/><b>Figure 2</b> Effects of 6-BA concentrations on the induction rates of different adventitious shoots in <i>Haworthia retusa </i>× <i>cooperi </i>cv. ‘Variegata’ Figure 2 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_2.png <b>图2</b> 不同浓度6-BA对寿锦增殖不定芽诱导率的影响<br/><b>Figure 2</b> Effects of 6-BA concentrations on the induction rates of different adventitious shoots in <i>Haworthia retusa </i>× <i>cooperi </i>cv. ‘Variegata’ 在新窗口打开 下载 下载原图ZIP 生成PPT 图2
不同浓度6-BA对寿锦增殖不定芽诱导率的影响
Figure 2
Effects of 6-BA concentrations on the induction rates of different adventitious shoots in
Haworthia retusa ×
cooperi cv. ‘Variegata’
此外, 不同培养基上不定芽的生长状态也存在明显差异。如
图3 所示, 当6-BA浓度为0.05 mg∙L
-1 时, 增殖芽大且有不定根; 随着6-BA浓度的升高, 增殖芽变小且不定根数量也减少; 当6-BA浓度为0.2 mg∙L
-1 时, 增殖芽短小密集且无根。由此可见, 寿锦在MS+ 0.2 mg∙L
-1 6-BA培养基上不定芽增殖率和斑锦类型的诱导率最高, 因而是适合寿锦产业化生产的增殖培养基。但在实际生产过程中需要在增殖后对不定芽进行适当的壮苗培养才能获得健壮的优质种苗。
图3 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_3.png <b>图3</b> 不同条件下寿锦的增殖不定芽丛<br/>(A) 0.05 mg∙L<sup>-1 </sup>6-BA; (B) 0.1 mg∙L<sup>-1 </sup>6-BA; (C) 0.2 mg∙L<sup>-1 </sup>6-BA<br/><b>Figure 3</b> The adventitious buds of <i>Haworthia retusa </i>× <i>cooperi </i>cv. ‘Variegata’ under different multiplication condition<br/>(A) 0.05 mg∙L<sup>-1 </sup>6-BA; (B) 0.1 mg∙L<sup>-1 </sup>6-BA; (C) 0.2 mg∙L<sup>-1 </sup>6-BA Figure 3 https://www.chinbullbotany.com/article/2017/1674-3466/1674-3466-52-3-331/img_3.png <b>图3</b> 不同条件下寿锦的增殖不定芽丛<br/>(A) 0.05 mg∙L<sup>-1 </sup>6-BA; (B) 0.1 mg∙L<sup>-1 </sup>6-BA; (C) 0.2 mg∙L<sup>-1 </sup>6-BA<br/><b>Figure 3</b> The adventitious buds of <i>Haworthia retusa </i>× <i>cooperi </i>cv. ‘Variegata’ under different multiplication condition<br/>(A) 0.05 mg∙L<sup>-1 </sup>6-BA; (B) 0.1 mg∙L<sup>-1 </sup>6-BA; (C) 0.2 mg∙L<sup>-1 </sup>6-BA 在新窗口打开 下载 下载原图ZIP 生成PPT 图3
不同条件下寿锦的增殖不定芽丛
(A) 0.05 mg∙L
-1 6-BA; (B) 0.1 mg∙L
-1 6-BA; (C) 0.2 mg∙L
-1 6-BA
Figure 3
The adventitious buds of
Haworthia retusa ×
cooperi cv. ‘Variegata’ under different multiplication condition
(A) 0.05 mg∙L
-1 6-BA; (B) 0.1 mg∙L
-1 6-BA; (C) 0.2 mg∙L
-1 6-BA
3.3 壮苗及移栽将在MS+0.2 mg∙L
-1 6-BA增殖培养基上获得的寿锦不定芽丛, 分割成单株后转接至MS基本培养基上进行壮苗培养。培养5周后, 寿锦不定芽直径可达2-3 cm, 叶片总数为5-6片并具有一定数量的根(
图1E ), 此时可进行移栽。将苗体从瓶中取出后洗掉残留培养基并切除根系, 然后置于通风避光处晾1周。当苗体微微皱缩后移栽至多肉植物专用颗粒土基质中栽培, 移栽成活率可达95% (
图1F )。
3.4 讨论斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱。通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段。虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少。本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系。众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 )。本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽。这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 )。
嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 )。因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产。虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究。本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 )。有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株。其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 )。而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低。因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口。Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与。而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 )。因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性。研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞。而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低。我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成。因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成。
本研究采用寿锦的幼嫩花序为外植体, 通过愈伤组织途径诱导寿锦不定芽的分化并实现寿锦的植株再生, 确立了适合寿锦产业化增殖的可行条件。研究结果对于提高寿锦斑锦性状的稳定性具有重要意义, 同时在斑锦多肉植物的产业化生产方面也具有指导价值。与传统的分株繁殖方式相比, 利用组织培养技术对寿锦进行快速繁殖, 能够大大提高繁殖系数和速度, 且不受季节和气候等外界环境因素的影响, 全年均可进行繁殖。因此, 通过组织培养对斑锦多肉植物进行产业化生产具有较好的经济效益和市场前景。
The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] 陈亮 , 许鸿源 , 周凤珏 , 韦丽娟 , 唐丽雪 , 伍燕辉 (2008 ). 不同NAA和N6 -BA浓度配比对半夏组织培养的生物效应. 种子 27(8 ), 30 -33 .[2] 兑宝峰 (2010 ). 多肉植物宝典. 贝叶寿与克里克特寿. 园林 7, 66 -66 .[3] 郭清泉 , 陈建荣 (1998 ). 苎麻叶片愈伤组织诱导与植株再生的研究. 中国麻业科学 2, 1 -5 .[4] 宋晓涛 , 沈萌 , 左志宇 , 安晓云 , 尹晓爽 , 孙涛 , 杨雪 , 李德森 (2007 ). 植物西山寿的组织培养与快速繁殖. 植物生理学通讯 43, 883 -884 .[5] 王冬梅 , 黄学林 , 黄上志 (1996 ). 细胞分裂素类物质在植物组织培养中的作用机制. 植物生理学报 32, 373 -377 .[6] 王泉 , 左志宇 , 宋晓涛 , 张耀 , 张昊鹏 , 尹晓爽 , 安晓云 , 杨雪 , 孙涛 (2008 ). 百合科多肉植物美吉寿的组织培养与快速繁殖. 植物生理学通讯 44, 123 -124 .[7] 王燕 , 汪一婷 , 吕永平 , 牟豪杰 , 李海营 , 陈剑平 (2015 ). 组培增殖方式对网纹草嵌合性状稳定性的影响. 植物学报 50, 372 -377 .[8] 王燕 , 徐刚 , 汪一婷 , 牟豪杰 , 吕永平 , 陈志 , 陈剑平 (2013 ). 卧牛锦的组织培养及其种质创新初探. 浙江农业学报 25, 488 -491 .[9] 徐芳芳 , 赵丽莉 , 荀洋 , 杨丽 , 金江山 , 严一字 (2014 ). 6-BA浓度对桔梗胚珠愈伤组织分化率的影响. 安徽农业科学 9, 2552 -2553 .[10] 姚志雄 , 居瑞敬 , 郑伟建 (2004 ). 生石花的变异——畸形与斑锦. 中国花卉盆景 11, 8 -9 .[11] 张昊鹏 , 宋晓涛 , 张耀 , 于明冉 , 田露 , 李昊阳 , 左志宇 , 安晓云 , 杨雪 , 孙涛 (2008 ). 白银寿的组织培养与快速繁殖. 植物生理学通讯 44, 951 -952 .[12] 左志宇 , 李建希 , 安晓云 , 尹晓爽 , 杨雪 (2007 ). 克里克特寿的组织培养与快速繁殖. 植物生理学报 43, 311 -312 .[13] Burge GK Morgan ER Seelye JF 2002 ). Opportunities for synthetic plant chimeral breeding: past and future.Plant Cell Tiss Organ Cult 13 -21 .[14] Burk LG Stewart RN Dermen H 1964 ). Histogenesis and genetics of a plastid-controlled chlorophyll variegation in tobacco.Am J Bot 713 -724 .[15] Fox JE 1966 ). Incorporation of a kinin, N, 6-benzyadenine into soluble RNA.Plant Physiol 75 .[16] Kuppusamy KT Walcher CL Nemhauser JL 2009 ). Cross-regulatory mechanisms in hormone signaling.Plant Mol Biol 375 -381 .[17] Miller CO 1956 ). The relationship of the kinin and red-light promotions of lettuce seed germination. Plant Physiol 115 .[18] Ottoline L Stephen D 2003 ). Mechanism in plant deve- lopment. York: University of York. pp. 30 -40 .[19] Reid JB Howell SH 1995 ). Hormone mutants and plant development. In: Plant Hormones. Berlin: Springer Netherlands. pp. 448 -485 .[20] Tilney-Bassett RAE 1986 ). Plant Chimeras.London: Edward Arnold (Publishers), Ltd. [21] Wang Y Cheng Q Zhu XY Chen LP 2011 ). Studies on reproductive characteristics of an interspecific chimera between Brassica juncea and Brassica oleracea . Plant Cell Tiss Organ Cult 209 -215 .
不同NAA和N
6 -BA浓度配比对半夏组织培养的生物效应
1
2008
... 斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱.通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段.虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少.本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系.众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 ).本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽.这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 ). ...
多肉植物宝典. 贝叶寿与克里克特寿
1
2010
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
苎麻叶片愈伤组织诱导与植株再生的研究
1
1998
... 斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱.通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段.虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少.本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系.众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 ).本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽.这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 ). ...
植物西山寿的组织培养与快速繁殖
1
2007
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
细胞分裂素类物质在植物组织培养中的作用机制
1
1996
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
百合科多肉植物美吉寿的组织培养与快速繁殖
2
2008
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
... ;
王泉等, 2008 ;
王燕等, 2013 ). ...
组培增殖方式对网纹草嵌合性状稳定性的影响
1
2015
... 从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 ).嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
卧牛锦的组织培养及其种质创新初探
2
2013
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
6-BA浓度对桔梗胚珠愈伤组织分化率的影响
1
2014
... 斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱.通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段.虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少.本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系.众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 ).本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽.这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 ). ...
生石花的变异——畸形与斑锦
2
2004
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
... 从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 ).嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
白银寿的组织培养与快速繁殖
1
2008
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
克里克特寿的组织培养与快速繁殖
1
2007
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
5
2002
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
... 从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 ).嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
... ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
... ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
1
1964
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
1
1966
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
1
2009
... 斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱.通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段.虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少.本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系.众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 ).本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽.这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 ). ...
1
1956
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
3
2003
... 从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 ).嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
... ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...
1
1995
... 斑锦多肉植物因具有较高的观赏价值和经济价值而备受消费者和生产者的喜爱.通过组织培养技术对其进行快速繁殖是满足市场需求的重要手段.虽然目前国内对于多肉植物的组织培养研究甚为广泛, 但对于斑锦多肉植物的报道较少.本研究从寿锦的幼嫩花序为外植体, 通过愈伤组织诱导寿锦不定芽的分化并实现寿锦的植株再生, 成功建立了寿锦的组织培养体系.众所周知, 激素对于植物组织和器官的形成具有重要作用, 植物的每一个生理生化过程都直接或间接地受到生长调节物质的调控(
Reid and Howell, 1995 ;
Kuppusamy et al., 2009 ).本研究结果显示, 6-BA浓度对于寿锦愈伤组织的分化有显著的影响; 高浓度的6-BA会使寿锦的愈伤组织保持脱分化状态, 不利于不定芽的分化, 而不添加6-BA有利于愈伤组织进行分化产生不定芽.这与前人在苎麻(
Boehmeria nivea )、半夏(
Pinellia ternata )和桔梗(
Platycodon grandiflorus )等植物上的研究结果一致(
郭清泉和陈建荣, 1998 ;
陈亮等, 2008 ;
徐芳芳等, 2014 ). ...
1
1986
... 从植物发育学的角度而言, 寿锦是由正常细胞发生变异产生叶绿素缺陷型细胞(锦化细胞)与正常细胞谱系共同发育形成的一种嵌合体植物(
姚志雄等, 2004 ).嵌合体通常分为3种类型: 周缘嵌合体、扇形嵌合体和混合嵌合体(
Tilney-Bassett, 1986 ;
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).前人研究发现, 嵌合体植物与普通植物相比稳定性较差, 容易发生改变, 特别是扇形嵌合体和混合嵌合体(
Burge et al., 2002 ;
王燕等, 2015 ).本研究中的寿锦属于扇形嵌合体类型, 其斑锦性状即使在无性繁殖过程中也容易发生变化和丢失, 这是由于构成扇形嵌合体的细胞谱系发育模式比较灵活所致(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ).因此, 寻找有效的组织培养增殖条件对于斑锦多肉植物种苗的产业化具有重要的指导意义. ...
2
2011
... 寿(
Haworthia sp.)是对百合科瓦苇属(十二卷属)有窗、软叶类多年生草本植物的统称, 是深受园艺爱好者喜爱的一类多肉植物(
宋晓涛等, 2007 ;
王泉等, 2008 ;
张昊鹏等, 2008 ;
兑宝峰, 2010 ).大多数寿的原产地为南非, 其株型小巧玲珑, 叶片呈莲座状紧凑排列, 叶窗透明且有绿色纹理.寿锦(
Haworthia retusa ×
cooperi cv. ‘Variegata’)则是由正常寿植株的叶片或茎的部分细胞发生锦化变异而形成的黄(或白)绿交错的斑锦品种(
姚志雄等, 2004 ).寿锦植株叶片鲜艳奇特, 具有很高的观赏价值和经济价值.然而, 寿锦只能通过无性繁殖方式获得, 且繁殖率较低; 播种繁殖方式会导致其斑锦性状丢失(
Burge et al., 2002 ;
Wang et al., 2011 ).因此, 传统的生产繁殖方式无法满足国内外对寿锦种苗的市场需求.此外, 为了保护野生多肉植物免遭掠夺性采集而致灭绝的威胁, 国际多肉植物研究组织(The International Organization for Succulent Plant Study)已将多种多肉植物列入《濒危野生动植物种国际贸易公约》(CITES公约)附录中, 这也在一定程度上限制了珍稀多肉植物的引种和推广.因此, 通过植物组织培养技术实现寿锦的快速繁殖对于名优珍稀斑锦多肉植物的保存、繁育和规模化生产具有重要意义.目前, 虽然国内对多肉植物的组织培养研究已较为广泛, 但对于斑锦多肉植物的植株再生及组培产业化研究较少(
左志宇等, 2007 ;
王泉等, 2008 ;
王燕等, 2013 ). ...
... 嵌合体植物的稳定性比普通植物差, 在组织培养条件下, 优越的离体培养条件以及植物生长调节剂的添加可使其生长旺盛从而更容易发生改变(
Burge et al., 2002 ;
Ottoline and Stephen, 2003 ;
Wang et al., 2011 ).因此, 斑锦多肉植物的组织培养快繁效率较低, 难以实现产业化生产.虽然王燕等(2013)对卧牛锦(
Gasteriea armstrongii )进行了组织培养并得到了再生植株, 但未对后续的产业化增殖进行研究.本研究中, 嵌合体植株的不稳定性在寿锦的增殖过程中表现明显, 全黄、全绿和斑锦3种不定芽类型同时出现(
图1 ,
图3 ).有别于斑锦类型, 全黄和全绿类型不定芽是由寿锦发生分离得到的遗传类型单一的植株.其中, 全部由锦化细胞谱系发育而来的全黄植株虽然能够在提供碳源的条件下维持生长, 但由于其自身叶绿素合成不足、自养能力差, 在自然条件下不能维持正常生长进而死亡, 因此无法移至瓶外进行栽培(
Burk et al., 1964 ;
王燕等, 2013 ).而仅由正常细胞谱系发育来的全绿类型植株观赏价值和经济价值大大降低.因此, 提高斑锦类型不定芽的诱导率能够有效减少 组培操作量并降低组培产业化的生产成本, 是实现 寿锦种苗产业化的关键突破口.Ottoline和Stephen (2003)认为, 斑锦植物的形成和维持需要生长速度相似的细胞谱系的参与.而细胞分裂素具有促进细胞分裂和伸长的作用, 能够有效调控植物细胞的生长速度(
Miller, 1956 ;
Fox, 1966 ;
王冬梅等, 1996 ).因此, 本研究通过调整增殖培养基中6-BA的浓度试图提高寿锦在增殖过程中的稳定性.研究表明, 当6-BA浓度为0.05 mg∙L
-1 时全黄类型增殖不定芽显著高于全绿类型, 可见锦化(黄色)谱系细胞对6-BA的敏感性高于正常(绿色)细胞.而当6-BA浓度为0.2 mg∙L
-1 时, 斑锦类型增殖不定芽的诱导率最高, 全黄和全绿类型较低.我们推测这可能是由于此时黄、绿谱系细胞的分裂和生长速度相近, 有利于嵌合斑锦不定芽的形成.因此, 适当浓度的细胞分裂素有利于斑锦类型不定芽的形成. ...