0 引言
【研究意义】马铃薯是世界上最重要的块茎类粮食作物,在解决全球粮食危机方面发挥着重要的作用。栽培马铃薯主要为同源四倍体,但四倍体遗传的复杂性和薯块繁殖的缺陷制约了马铃薯的遗传改良。因此,越来越多的科学家呼吁进行马铃薯的再驯化,在二倍体水平将马铃薯驯化成种子繁殖的作物[1,2,3]。在自然界中,二倍体马铃薯资源是非常丰富的。马铃薯包含228个野生种和7个栽培种,其中70%的野生种和4个栽培种为二倍体(Solanum ajanhuiri、S. phureja、S. stenotomum subsp. stenotomum和S. stenotomum subsp. goniocalyx)[4]。这些二倍体原始栽培种在品质和抗性方面具有很多优异的等位基因。近年来,不同马铃薯基因组的公布及变异组研究为挖掘这些二倍体栽培种中蕴含的优良等位基因提供了基因组学基础[5,6,7,8,9]。为了克隆二倍体栽培种中的优良等位基因并将其应用于精准育种,有必要建立高效的二倍体马铃薯遗传转化体系。【前人研究进展】四倍体马铃薯的再生和遗传转化体系比较成熟。早在1983年,OOMS等[10]就成功建立了四倍体马铃薯品种“Maris Bard”的遗传转化体系。随后的几十年间,四倍体马铃薯的遗传转化体系被不断优化[11,12,13,14],已经广泛应用到马铃薯重要基因的功能研究中[15,16,17]。另外,通过遗传转化对四倍体马铃薯进行品质和抗病性的改良也取得了很大的进展[18,19]。目前,辛普劳公司已经推出了第二代转基因马铃薯Innate 2,通过转基因技术对4个性状进行了改良:提高了晚疫病抗性、降低了褐化程度、减少了低温储藏过程中产生的还原糖含量以及油炸后丙烯酰胺含量(http://www. simplot.com/)。随着基因组编辑技术的快速发展,利用基因组编辑改良四倍体马铃薯的品质也取得了一系列进展[20,21,22]。【本研究切入点】相比之下,二倍体马铃薯遗传转化的研究较少,仅有少数基因型进行了遗传转化体系的摸索[23,24,25]。【拟解决的关键问题】本研究通过筛选预处理培养时间、诱导再生的激素比例、抗生素浓度等,建立二倍体原始栽培种的遗传转化体系。利用筛选出的最佳体系对其他基因型进行测试,分析不同基因型对转化效率的影响,并分析再生植株的染色体加倍情况。1 材料与方法
1.1 试验材料与培养条件
试验所用的二倍体马铃薯原始栽培种均由国际马铃薯中心(International Potato Center,CIP)提供(表1)。所有的组培苗均于2016年7月于中国农业科学院蔬菜花卉研究所功能基因课题组组培间培养。采用MS培养基(4.43 g·L-1 MS粉末、30 g·L-1 蔗糖和7 g·L-1琼脂,pH=5.8)进行培养。培养条件为温度(19±1)℃,光照强度为2 000—3 000 lx,16 h光照,8 h黑暗。所用根癌农杆菌(Agrobacterium tumefaciens)菌株为EHA 105,内含将pKSE401用EcoRⅠ单酶切插入35S-GFP-Terminal片段的pKSE402质粒(pKSE401质粒由中国农业大学陈其军教授提供),pKSE402质粒上主要携带了GFP和卡那霉素抗性基因。
Table 1
表1
表1试验所用的二倍体马铃薯材料
Table 1The diploid potato clones used in this study
| 编号 Accessions | 种 Species |
|---|---|
| CIP 703308 | 富利亚S. phureja |
| CIP 703541 | 富利亚S. phureja |
| CIP 703548 | 富利亚S. phureja |
| CIP 703581 | 富利亚S. phureja |
| CIP 703594 | 富利亚S. phureja |
| CIP 703601 | 富利亚S. phureja |
| CIP 702961 | 角萼薯S. stenotomum subsp. goniocalyx |
| CIP 703287 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703312 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 701947 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 702588 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 702610 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703433 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703446 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703637 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703703 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 703783 | 窄刀薯S. stenotomum subsp. stenotomum |
| CIP 704811 | 窄刀薯S. stenotomum subsp. stenotomum |
新窗口打开
1.2 菌液的制备
挑取含pKSE402质粒的单个农杆菌菌落,接种于含有50 mg·L-1利福平和50 mg·L-1卡那霉素的液体LB培养基中,置于摇床28℃,220 r/min,黑暗条件下,过夜培养至对数生长期。将农杆菌收集到50 mL离心管中,4 000 r/min离心10 min。弃上清,用液体MS培养基(含40 mg·L-1乙酰丁香酮)(表2)进行重悬,OD600值调整到0.6,用于后续浸染。Table 2
表2
表2遗传转化所用培养基配方
Table 2Mediums used genetic transformation
| 培养基 Medium | 培养基成分 Medium components |
|---|---|
| 液体MS Liquid MS | 4.43 g·L-1 MS粉末+ 30.00 g·L-1蔗糖,pH=5.8 4.43 g·L-1 MS powder+ 30.00 g·L-1 sucrose, pH=5.8 |
| 扩繁培养基 Propagation medium (BMS) | 4.43 g·L-1 MS粉末+ 30.00 g·L-1蔗糖+7.00 g·L-1琼脂,pH=5.8 4.43 g·L-1 MS powder+ 30.00 g·L-1 sucrose+7.00 g·L-1 agar, pH=5.8 |
| 预培养基A1 Pre-culture medium A1 | BMS+1.00 mg·L-1玉米素+2.00 mg·L-1奈乙酸 BMS+1.00 mg·L-1 Zeatin (ZT) +2.00 mg·L-1 naphthylacetic acid (NAA) |
| 共培养基A2 Co-culture medium A2 | BMS+1.00 mg·L-1玉米素+2.00 mg·L-1奈乙酸+40.00 mg·L-1乙酰丁香酮 BMS+1.00 mg·L-1 ZT+2.00 mg·L-1 NAA+40.00 mg·L-1 Acetosyringone (AS) |
| 愈伤诱导培养基 Callus inducing medium (CIM) | CIM1:BMS+1.00 mg·L-1玉米素+0.10 mg·L-1奈乙酸+200.00 mg·L-1特美汀 CIM1:BMS+1.00 mg·L-1 ZT+0.10 mg·L-1 NAA+200.00 mg·L-1 timentin (TMT) CIM2:BMS+2.00 mg·L-1玉米素+0.10 mg·L-1奈乙酸+200.00 mg·L-1特美汀 CIM2:BMS+2.00 mg·L-1 ZT+0.10 mg·L-1 NAA+200.00 mg·L-1 TMT |
| 分化培养基 Shoot inducing medium (SIM) | SIM1:BMS+1.00 mg·L-1玉米素+0.01mg·L-1奈乙酸+200.00 mg·L-1特美汀 SIM1:BMS+1.00 mg·L-1 ZT+0.01mg·L-1 NAA+200.00 mg·L-1 TMT SIM2:BMS+2.00 mg·L-1玉米素+0.01mg·L-1奈乙酸+200.00 mg·L-1特美汀 SIM2:BMS+2.00 mg·L-1 ZT+0.01mg·L-1 NAA+200.00 mg·L-1 TMT |
| 生根培养基 Root inducing medium (RIM) | BMS+200.00 mg·L-1 特美汀 BMS+200.00 mg·L-1 TMT |
新窗口打开
1.3 预培养
取苗龄为4周的无菌苗,切取不带腋芽的茎段,置于A1培养基中进行预培养(表2),预培养时间设置为0、1、2、3和4 d,光照条件同上。每个预培养处理120个外植体,共600个外植体。1.4 菌液浸染与共培养
将经过预培养的茎段收集,在提前备好的农杆菌菌液中浸泡10 min,期间摇晃几次,使农杆菌与茎段充分接触,浸染结束后,用漏勺把菌液沥干,之后将外植体置于三层滤纸上吸干菌液。吸干农杆菌菌液后把外植体转入覆盖了一张无菌滤纸的A2培养基(表2)中于黑暗条件下共培养2 d,培养温度为28℃。1.5 外植体愈伤诱导培养基的筛选
将经过共培养茎段分别置于CIM1、CIM2、SIM1和SIM2中进行培养(表2),2周换一次培养基。培养4周后,CIM1和CIM2都均匀更换为SIM1和SIM2,而最初在SIM1和SIM2上培养的维持不变。每个处理200个外植体,共800个外植体。
1.6 诱导愈伤和分化的抗生素筛选
将共培养2 d的外植体置于含有不同浓度卡那霉素(0、50、75、100和150 mg·L-1)的SIM2上诱导愈伤,2周更换一次培养基直至出芽。每个处理100个外植体,共500个外植体。1.7 生根培养时抗生素浓度的筛选
取未转化的带腋芽的外植体扦插至含有不同浓度卡那霉素(0、50、75、100和150 mg·L-1)的RIM上进行生根处理。每个处理3瓶,每瓶8株。1.8 筛选适宜遗传转化的基因型
利用筛选好的条件:预培养2 d和添加了100 mg·L-1 Kan的筛选再生培养基CIM1+SIM1、CIM1+SIM2、CIM2+SIM1、CIM2+SIM2、SIM1+SIM1以及SIM2+SIM2对其余17份二倍体马铃薯进行遗传转化,每组处理100个外植体,共600个外植体。1.9 生根培养
待获得的再生芽长至1—2 cm时,将再生芽切下,扦插至RIM(50 mg·L-1卡那霉素)上进行生根培养。1.10 转基因植株的PCR检测和倍性检测
设计包含绿色荧光蛋白的外源片段的扩增引物对再生植株进行扩增(引物为F:5′-AAAAGGCCCCTG GGAATCTG-3′和R:5′-AATTGAACGCCGAAGAA CAG-3′),扩增条带大小为320 bp。PCR体系为10 ng模板cDNA、10 µL 2×GoTaq Colorless Master Mix和正反向引物各0.4 µL(10 µmol·L-1),ddH2O补充至20 µL。反应程序为94℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 45 s,35次循环;72℃ 1 min,4℃保存。参照施春晖等[26]方法,利用北京大学凤凰工程高通量流式平台BD Fortessa流式细胞仪检测阳性植株倍性样品。
2 结果
2.1 预培养时间的确定
为了确定最佳的预培养时间,设置5个预培养时间梯度0、1、2、3和4 d。不同预培养时间处理的外植体经过同样的浸染和共培养之后,通过体视荧光显微镜进行荧光采集和统计。当预培养时间在2 d以下时,茎段伤口处荧光团面积会随着预培养时间显著增加,但是随着预培养时间的进一步增加,浸染效率开始减小,直至第4天,只有少数几个外植体上出现荧光小点(表3)。因此确定最佳的预培养时间为2 d。Table 3
表3
表3预培养时间对转化的影响
Table 3The effects of pre-culture time on transformation
| 预培养天数 Pre-culture days (d) | 荧光情况 Fluorescence |
|---|---|
| 0 | + |
| 1 | +++ |
| 2 | ++++ |
| 3 | +++ |
| 4 | – |
新窗口打开
2.2 不同激素配比对诱导愈伤组织和再生的影响
外植体经过2 d的预培养后用菌液进行浸染,共培养2 d后,将外植体分别转移到CIM1、CIM2、SIM1和SIM2中进行培养。培养4周后,观察愈伤组织的状态,SIM2诱导愈伤组织的效率最高,且愈伤组织比较致密,呈深绿色,另外3种培养基诱导的愈伤组织较松散,呈浅绿色(表4)。之后把CIM1和CIM2上的外植体均匀更换至SIM1和SIM2,进行诱芽处理,SIM1和SIM2上的外植体维持原激素比例不变,每2周换一次培养基直至出芽,统计不同激素组合的再生情况(表5)。其中,SIM2+SIM2组合诱导再生芽的能力较强,有些外植体上有多个再生芽,因此,确定SIM2+SIM2为诱导二倍体马铃薯材料CIP 703541的最佳激素配比。Table 4
表4
表4不同激素配比对茎段的愈伤组织诱导情况
Table 4Effects of different hormone ratios on callus induction
| 培养基 Medium | 接种茎段数 Number of explants | 愈伤数 Number of callus | 愈伤率 Rate of callus induction (%) | 愈伤形态特征 Morphology of callus |
|---|---|---|---|---|
| CIM1 | 200 | 115 | 57.5 | 浅绿,组织松散 Light green, loose |
| CIM2 | 200 | 122 | 61.0 | 浅绿,组织松散 Light green, loose |
| SIM1 | 200 | 135 | 67.5 | 浅绿,组织松散 Light green, loose |
| SIM2 | 200 | 189 | 94.5 | 深绿,组织致密成哑铃状 Dark green, compact, dumbbell shape |
新窗口打开
Table 5
表5
表5不同激素配比对愈伤组织分化的影响
Table 5Effects of different hormone ratios on callus regeneration
| 培养基 Medium | 接种愈伤数 Number of explants with callus | 再生植株数 Number of regenerated seedlings | 出芽率 Ratio of regeneration (%) |
|---|---|---|---|
| CIM1 + SIM1 | 57 | 1 | 1.8 |
| CIM1 + SIM2 | 58 | 0 | 0 |
| CIM2 + SIM1 | 61 | 3 | 4.9 |
| CIM2 + SIM2 | 61 | 5 | 8.2 |
| SIM1 + SIM1 | 135 | 37 | 27.4 |
| SIM2 + SIM2 | 189 | 213 | 112.7 |
新窗口打开
2.3 不同抗生素浓度对再生和生根的影响
利用筛选出来的最佳培养基组合SIM2+SIM2,对愈伤诱导和芽再生阶段的抗生素浓度进行筛选。外植体通过2 d预培养,经浸染和共培养后转移至含有不同卡那霉素浓度的SIM2培养基上,8周后进行对再生芽的数目进行统计(表6)。当卡那霉素浓度在100 mg·L-1以下时,对马铃薯的出芽影响并不是很明显。而当卡那霉素浓度为100 mg·L-1的时候,部分外植体的出芽明显被抑制,而且能够出芽的外植体以单芽为主。当卡那霉素浓度达到150 mg·L-1时,外植体经一段时间的培养后,基本趋于死亡状态,没有获得再生芽。因此,选择浓度为100 mg·L-1的卡那霉素作为筛选二倍体马铃薯材料CIP 703541遗传转化的最适浓度。Table 6
表6
表6不同卡那霉素浓度对再生的影响
Table 6Effects of different kanamycin concentrations on regeneration
| 卡那霉素浓度 Concentration of kanamycin (mg·L-1) | 外植体数 Number of explants | 再生芽数 Number of regenerated seedlings | 出芽率 Ratio of regeneration (%) |
|---|---|---|---|
| 0 | 100 | 175 | 175 |
| 50 | 100 | 106 | 106 |
| 75 | 100 | 93 | 93 |
| 100 | 100 | 52 | 52 |
| 150 | 100 | 0 | 0 |
新窗口打开
野生型马铃薯带腋芽的茎段扦插在添加了不同浓度卡那霉素的RIM培养基中进行生根试验,在卡那霉素达到50 mg·L-1时,所有的马铃薯植株已经不能生根。因此,采用50 mg·L-1作为CIP 703541生根阶段的卡那霉素筛选浓度。
2.4 其他二倍体马铃薯材料的遗传转化体系的筛选
根据建立的二倍体马铃薯遗传转化体系的筛选流程,通过对另外17份二倍体原始栽培种进行同样的遗传转化筛选试验。其中,有3份材料(CIP702961、CIP 703308和CIP 703312)能够对设置的激素组合作出响应,但是最适的激素组合不同(表7)。其中,CIP 703308和CIP 703312诱导再生芽效率较高,分别为45%和40%。Table 7
表7
表7另外17份二倍体马铃薯原始栽培种的遗传转化体系筛选
Table 7Screening of optimal genetic transformation system for another 17 diploid landraces
| 编号 Accession | 种 Species | 适宜再生培养基Optimal medium | 出芽率 Ratio of regenerated seedlings (%) |
|---|---|---|---|
| CIP 703308 | 富利亚S. phureja | CIM2+SIM2 | 45 |
| CIP 703548 | 富利亚S. phureja | / | 0 |
| CIP 703581 | 富利亚S. phureja | / | 0 |
| CIP 703594 | 富利亚S. phureja | / | 0 |
| CIP 703601 | 富利亚S. phureja | / | 0 |
| CIP 702961 | 角萼薯S. stenotomum subsp. goniocalyx | SIM2+SIM2 | 3 |
| CIP 703287 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703312 | 窄刀薯S. stenotomum subsp. stenotomum | CIM1+SIM1 | 40 |
| CIP 701947 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 702588 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 702610 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703433 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703446 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703637 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703703 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 703783 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
| CIP 704811 | 窄刀薯S. stenotomum subsp. stenotomum | / | 0 |
新窗口打开
2.5 转基因阳性植株的鉴定
通过不用的激素组合筛选,获得3份再生率较高的二倍体原始栽培种(CIP 703308、CIP 703312和CIP 703541),根据每份材料最适的激素组合分别进行大规模的遗传转化,转化的外植体数分别为1 600、1 300和1 800个。将获得的再生芽在卡那霉素浓度为50 mg·L-1的生根培养基上进行了两轮生根测试(图1-a和图1-b),每一轮生根测试均淘汰一批不能正常生根的再生苗,最终分别获得44、55和96株抗筛阳性植株,转化效率分别为2.8%、4.2%和5.3%。经PCR检测,所有植株均含有外源载体序列。同时利用体视荧光显微镜对阳性植株的GFP荧光进行观察,未转化的植株由于叶绿体自发荧光呈现红色,而阳性植株的叶片呈现红绿相间的颜色,表皮毛的绿色比较明显(图1-c和图1-d)。但是由于GFP在不同株系的表达情况不同,很难通过GFP的颜色准确判断是否是阳性植株,因此,以是否能够经过两轮生根测试作为判断阳性植株的标准。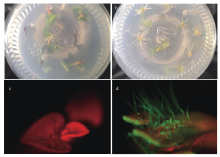 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1转基因阳性植株的检测
a、c:野生型;b、d:阳性植株
-->Fig. 1Assays of the positive regenerated seedlings
a, c: Wild type; b, d: Positive seedlings
-->
2.6 转基因阳性植株的倍性鉴定
马铃薯在经过遗传转化之后容易发生染色体加倍的现象。从转化率较高的3份材料中(CIP 703308、CIP 703312和CIP 703541),分别选择部分阳性转化株进行染色体倍性的检测。结果显示,大多数阳性植株为四倍体,其中CIP 703541的阳性植株中二倍体植株的比例最高,为38.46%(表8)。Table 8
表8
表8阳性植株的倍性检测
Table 8Ploidy of positive transformants
| 编号 Accessions | 检测植株数 Number of tested seedlings | 二倍体植株数 Number of diploid seedlings | 二倍体植株比例 Ratio of diploid seedlings (%) |
|---|---|---|---|
| CIP 703308 | 19 | 1 | 5.26 |
| CIP 703312 | 38 | 4 | 10.53 |
| CIP 703541 | 13 | 5 | 38.46 |
新窗口打开
3 讨论
马铃薯的再生和遗传转化效率受基因型的影响较大。HEERES等[27]对16份四倍体材料进行了遗传转化,发现不同基因型对激素的响应不同,诱导再生芽的效率差异也比较大。本研究利用6个激素组合对18份二倍体原始栽培种进行了筛选,也获得相同的结论。不同二倍体基因型的再生能力差异很大,而且再生能力强的基因型所响应的激素组合也不同。本研究获得3份再生和遗传转化效率较高的二倍体资源。但是,其余大部分二倍体材料对6种激素组合均不响应,因此,有必要对更多的二倍体基因型进行激素配方筛选,然后通过全基因组关联分析或者构建分离群体的方法挖掘马铃薯中控制再生的遗传位点,将有效解决基因型对再生和遗传转化的影响。
无性系变异是植物组织培养中的一个常见现象[28,29],它能在离体培养的细胞、愈伤或组织中发生,从而引起再生植株遗传或者表观遗传的变异。本研究发现二倍体马铃薯经遗传转化得到的再生苗里面染色体加倍的情况比较严重。在检测的3份材料里,四倍体的概率均高于二倍体,其中CIP 703308的阳性转化株中二倍体的概率仅为5.26%。这意味着需要进行大规模的遗传转化才能得到一定数目的二倍体阳性株。因此,在今后的研究中有必要筛选染色体加倍比例较低的二倍体。
二倍体马铃薯原始栽培种在南美洲已经经历了几千年的驯化和改良,除了在外观、产量和适应性方面与现在的四倍体栽培种还存在一些差距,其他很多性状已经接近现在的四倍体栽培种,因此,这些资源可以作为二倍体马铃薯育种的原始材料。通过对外观、产量和适应性等性状进行遗传分析,挖掘控制这些性状的遗传位点,可以对二倍体原始栽培种进行定向改良。本研究建立的高效转化体系将为验证重要基因的功能以及利用生物技术对二倍体原始栽培种进行遗传改良提供有力工具。
4 结论
通过对18份二倍体马铃薯栽培种进行了遗传转化体系的摸索,成功建立了其中3份材料的高效遗传转化体系。证实了二倍体马铃薯的再生能力和遗传转化效率也受基因型的较大影响,此外其再生植株很容易发生染色体加倍的情况。The authors have declared that no competing interests exist.
