0 引言
【研究意义】肌肉干细胞(muscle stem cells)即卫星细胞(satellite cells, SCs)是脊椎动物实体组织再生中最有前景的研究对象之一。动物骨骼肌生长和再生能力取决于肌肉干细胞增殖与分化能力[1,2]。【前人研究进展】肌肉干细胞位于成熟纤维的基底层之下[3,4],是骨骼肌生长、肥大和再生的重要因素,在肌再生中起着关键作用[5,6]。肌肉干细胞起初由MAURO于1961年发现,50多年来一直是骨骼肌细胞生物学的研究热点[7]。【本研究切入点】山羊作为全球性的家畜动物,有着重要的经济效益。目前科研人员已经从大鼠、人、猪和牛等不同物种中分离得到了肌肉干细胞,但在山羊中的研究仍较少[8,9,10,11]。研究数据表明,肌肉干细胞的含量和功能在动物胎儿发育至成年过程中呈逐渐下降的趋势[12],因此,本研究选取4月龄的山羊胎儿背最长肌作为试验材料,以确保能够获得足够数量且活力较好的肌肉干细胞。【拟解决的关键问题】本试验通过体外建立山羊胎儿肌肉干细胞分离培养、鉴定及成肌诱导分化体系,在体外细胞水平模拟山羊胎儿肌肉生长发育过程,并为深入认识调控肌肉发育的分子机制提供试验材料。1 材料与方法
1.1 试验材料
1.1.1 试验动物 所用的3只山羊胎儿来自国家肉羊产业技术体系合肥综合试验站:合肥博大牧业科技开发有限公司羊场。动物配种与饲养于2016年9月至2017年1月进行。采用4月龄的山羊胎儿背最长肌肌肉组织进行肌肉干细胞的分离试验。试验于2017年1—5月在安徽地方畜禽遗传资源保护与生物育种省级实验室完成。1.1.2 主要试剂 DMEM/F12培养基(美国Hyclone公司);胎牛血清和0.25% Try-EDTA (美国Gibco公司);胶原酶Ⅰ和DAPI(美国Sigma公司);青链霉素混合液、4%多聚甲醛及BSA(中国Biosharp公司);TristonX-100和明胶(国药集团化学试剂公司);anti-pax7、anti-MyoD(美国Santa cruz)。anti-MyoG(美国Abcam公司);总RNA提取试剂盒(美国Omega公司)、反转录及PCR试剂(南京Vazyme公司)。
1.2 试验方法
1.2.1 山羊胎儿肌肉干细胞的分离 取背最长肌肌肉组织,在无菌条件下将肌肉置于培养皿中,用含青链霉素的PBS洗4遍,60s/次。尽量去除筋膜、脂肪等组织后,用眼科剪剪成肉糜,静置10min,去除表面漂浮组织。用0.1% Ⅰ型胶原酶,培养箱内放置40min,10min摇一次。离心后加入0.25% Try,37℃消化15min,再加入3倍体积的生长培养基(20% FBS+80%DMEM/F12)终止。悬液分别过200目、400目筛网后离心,沉淀用含青链霉素混合液的生长培养基重悬,接种于培养皿内,37℃、5%CO2培养箱内培养。2h后将上清加到新的皿中,2h后再重复一次。1.2.2 山羊胎儿肌肉干细胞的传代培养及纯化 待细胞生长至70%左右密度时进行传代。PBS洗1遍,0.25%Try消化4min后终止、离心,按比例传到明胶铺过的培养皿中,半小时后将悬液移至新的处理过的皿中培养。每次传代均采用差速贴壁30min的方法纯化肌肉干细胞,共传至第6代。
1.2.3 山羊胎儿肌肉干细胞的免疫荧光鉴定 利用细胞免疫荧光技术对肌肉干细胞标记蛋白Pax7和MyoD1进行鉴定。具体操作步骤为:6代细胞培养1d后,4%多聚甲醛固定15min,DPBS洗4遍;0.5% Tritonx-100通透15min,DPBS洗4次,1%BSA室温封闭1h;加入一抗(1﹕200),4℃条件下孵育过夜,DPBS洗6次;加入二抗(1﹕200),37℃1h后用DPBS洗6次;DAPI染核15min,DPBS洗6遍,利用荧光显微镜拍照。
1.2.4 山羊胎儿肌肉干细胞的诱导分化 细胞生长至70%左右密度时,弃培养基,换为分化培养基(2%FBS+98%DMEM/F12+青链霉素)。诱导0、l、3、5、7d后分别提RNA,并利用倒置显微镜观察细胞的形态学变化。另外,选取诱导分化1d后的细胞,利用免疫荧光染色技术检测Myog蛋白的表达情况,具体步骤同1.2.3。
1.2.5 qPCR检测MyoD1和Myog的表达量 利用Omega总RNA提取试剂盒提取RNA后反转为cDNA,gapdh作为内参基因进行qPCR,引物序列见表1。qPCR标准程序为:95℃预变性10min;95℃变性15s,60℃退火1min,循环40次,然后绘制曲线。以0d为对照,计算各天数的相对表达量。使用2-△△Ct 的方法计算目的基因在不同cDNA模板中的相对表达量,数据以“平均值±标准误”来表示。使用SPSS软件的单因素方差分析进行差异显著性分析,不同字母的数值差异显著(P <0.05)。
Table 1
表1
表1荧光定量检测引物设计
Table 1Fluorescence quantitative detection primer design
| 基因名称 Gene name | 序列(5′→ 3′) Sequence(5′→ 3′) |
|---|---|
| MyoD1 | 上游:GGAGGAACACTCGCACTTCC |
| 下游:CCTTGCAGGCCCACAGTAAA | |
| Myog | 上游:CCAGTACATAGAGCGCCTGC |
| 下游:GCAGATGATCCCCTGGGTTG | |
| gapdh | 上游:CACAGTCAAGGCAGAGAAC |
| 下游:TACTCAGCACCAGCATCA |
新窗口打开
2 结果
2.1 山羊胎儿肌肉干细胞的分离培养
分离得到的原始细胞体积小,呈贴壁生长(图1-A)。随着细胞的传代和纯化,细胞体积开始变大且形态趋于稳定,主要呈长梭形或者纺锤形、折光性强,生长速度逐渐变慢。连续培养6d左右后,显微镜下可观察到细胞开始连成一片且按某一方向平行排列,成典型的肌肉干细胞形态(图1-B)。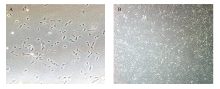 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1分离获得的山羊胎儿肌肉干细胞形态(40×)
A:分离培养1天后的肌肉干细胞;B:分离培养6天的肌肉干细胞
-->Fig. 1The morphology of isolated obtained goat fetal muscle stem cell (40×)
A: Isolated and cultured one day of muscle stem cells; B: Isolated and cultured 6 days of muscle stem cells
-->
2.2 山羊胎儿肌肉干细胞Pax7及MyoD1蛋白的表达分析
免疫荧光染色技术检测结果显示,分离得到的肌肉干细胞中Pax7和MyoD1蛋白均有绿色荧光出现(图2-A-2,图2-B-2),与经DAPI染色后呈蓝色的细胞核(图2-A-1,图2-B-1)重合并散布在整个细胞中,但在核中的表达更为强烈(图2-A-3,图2-B-3)。Pax7在细胞内免疫荧光强度较强,而MyoD1免疫荧光强度较弱,说明在刚分离出的细胞中Pax7表达量可能高于MyoD1。上述结果确认本研究所用的胶原酶、胰酶两步消化法联合差速贴壁成功获得了山羊胎儿肌肉干细胞,且纯度达到90%以上。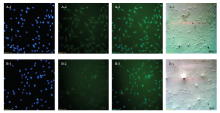 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2山羊胎儿肌肉干细胞Pax7和MyoD1的免疫荧光检测
A:山羊胎儿肌肉干细胞的Pax7 免疫荧光;B:山羊胎儿肌肉干细胞的MyoD1免疫荧光。1:DAPI染核;2:目标蛋白荧光;3:1和2重合;4:光学显微镜图像
-->Fig. 2Immunofluorescence detection of Pax7 and MyoD1 in goat fetal muscle stem cells
A: The immunofluorescence for Pax7 of goat fetal mucle stem cells; B: The immunofluorescence for MyoD1 of goat fetal mucle stem cells. 1: DAPI staining; 2: The fluorescence of target protein; 3: 1 and 2 coincide; 4: Optical microscope image
-->
2.3 肌肉干细胞成肌诱导及Myog蛋白的表达分析
通过减少血清含量来诱导肌肉干细胞的体外成肌分化。在细胞约70%密度时换为分化培养基,利用倒置显微镜观察诱导0、1、3、5、7d细胞的形态学变化。结果显示,诱导天数增加的同时,细胞开始分化、相互融合成肌管且具有方向性(图3)。在对肌肉干细胞诱导1 d后,采取免疫荧光技术检测Myog的表达情况。结果发现,Myog呈明显的阳性表达(图4)。以上结果表明本研究得到的肌肉干细胞有较好的成肌分化潜能。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3山羊胎儿肌肉干细胞诱导不同天数的形态观察
A-E分别为诱导0、1、3、5、7d的山羊胎儿肌肉干细胞
-->Fig. 3Morphological observation of induced different number of days of goat fetal muscle stem cells (40×)
A-E were induced in 0, 1, 3, 5, 7 days of goat fetal muscle stem cells
-->
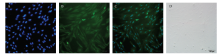 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4山羊胎儿肌肉干细胞Myog的免疫荧光检测
A:DAPI染核;B:目的蛋白荧光;C:A和B重合;D:光学显微镜图像
-->Fig. 4Immunofluorescence detection of Myog in goat fetal muscle stem cells
A: DAPI staining; B: The fluorescence of target protein ; C: A and B coincide; D: Optical microscopy
-->
2.4 MyoD1和Myog表达量检测
诱导分化0、1、3、5、7天的qPCR结果显示,标志基因MyoD1和Myog均有表达,且MyoD1的相对表达量(图5-A)在分化的第1天相比于0天显著升高并维持到第3天,第5、7天相比于第3天开始显著下降但仍显著高于增殖期;Myog在分化不同天数中的相对表达量也具有类似的趋向(图5-B)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5分化标志基因的相对表达
A:MyoD1 mRNA的相对表达量;B:Myog mRNA的相对表达量
-->Fig. 5The relative expression of the differentiation marker gene
A: MyoD1 mRNA relative expression; B: Myog mRNA relative expression
-->
3 讨论
自肌肉干细胞发现以来,海内外****纷纷对其进行了研究,目前肌肉干细胞对骨骼肌再生和肥大的贡献已经被公认。肌肉干细胞具有成肌分化的潜能[13,14,15],其不仅能够维持自身群体数量,还提供了许多肌源细胞,它们通过增殖分化产生新的肌纤维或修复现有肌纤维的受损部分[16,17,18]。但在成年的正常肌肉中,肌肉干细胞的数目很少且存在于肌膜与基底膜中间。因此,成功分离培养获取数量较多且活力较好的肌肉干细胞是肌肉再生与疾病等相关研究的前提。研究表明,肌肉干细胞的数量和功能随年龄的增长而下降[12,19]。动物体胚胎及其幼龄时肌肉干细胞含量较高,刚出生的比例约为总核的32%。年龄的增长使肌肉干细胞所占比例不断下降,在成熟期稳定在1%—4%左右。此外,年龄的增长还影响肌肉干细胞的功能,比如自我更新、活化及增殖能力[12]。要分离出高质量的哺乳动物肌肉干细胞,分离的手段及实验动物的年龄均是该试验的关键。所以本试验选取4月龄的山羊胎儿背最长肌作为试验材料,以确保分离肌肉干细胞的数量及其分离后具有较强的活力。分离肌肉干细胞最常用的有链酶蛋白酶消化法[20]、胶原酶和胰酶联用的两步酶消化法[21]、组织块法[22]和单根肌纤维法[23]。因为肌肉干细胞处于基膜与肌纤维之间,要想将其释放,必须首先将基膜分解[24],普通的单种酶消化法和组织块法不能使其完全的释放出来。而采用胶原酶和胰蛋白酶联用的两步酶消化法则可以充分的分离出细胞并具有较好的活力,能够稳定传代。但采用此方法需要把握好消化时间,过长会损坏细胞,过短则不能使细胞充分分离出来。单根肌纤维法是一种先从肌束中分离出单根的肌纤维,从而获取附着于肌纤维膜上的肌肉干细胞的方法。此方法获取的肌肉干细胞接近于是一种活体研究的办法,但该方法同时存在分离肌肉干细胞所需的时间较长、得到的细胞数少等缺点,而使其应用受到限制。由于肌肉干细胞贴壁慢,可以凭据差速贴壁技术纯化。该方法经济易行且能达到较好的纯化效果,而缺点是需要对细胞进行多次的传代,耗时较长。纯化还可以选用流式仪分选法、Percoll离心法等[25,26]。这些方法能够提供更纯的细胞,但存在设备昂贵、过程繁琐等问题。此外,因考虑到肌肉干细胞较难贴壁,本试验还采用了明胶促进其贴壁[27],结果比较理想。
目前,李俊涛等[28]利用链酶蛋白酶法结合percoll梯度离心法由3日龄的南江黄羊的背最长肌中分离培养了较高纯度的肌肉干细胞。YAMANOUCHI 等[23]采用单根肌纤维法从1岁成年山羊的肋间肌中获取了肌肉干细胞。吴海青等[29]采用两步酶消化法从阿尔巴斯绒山羊90日龄胎羊的腿肌中分离肌肉干细胞,并在细胞接种12 h后进行一次差速贴壁对细胞进行了纯化。与李俊涛及YAMANOUCHI等人的研究相比,本研究在试验动物的选择上选择了年龄较小的4月龄安淮山羊胎羊,分离方法则选择了胶原酶与胰酶联用的两步酶消化法,以确保能分离得到大量活力较强的肌肉干细胞。本研究选取的试验动物的年龄以及分离方法虽然与吴海青等人的研究较为相似,但本研究采用多次差速贴壁的方法,纯化细胞直至第六代,以尽可能的排除杂细胞,确保获得较高纯度的肌肉干细胞。
肌肉干细胞成肌过程中有多种标志基因[30,31]。Pax7在妊娠晚期和出生后肌肉生长中起主导作用[32],并且在静止和激活的肌肉干细胞中表达,被认为是一种通用标记[33,34]。MyoD1是肌肉干细胞激活和分化过程中的重要标志[30,35]。经免疫荧光检测Pax7和MyoD1均呈阳性,证明本试验获得了较高纯度的肌肉干细胞。建立肌肉干细胞诱导分化体系可以体外模拟肌肉生长发育过程。研究发现在低血清培养条件(1%—5%胎牛血清)下,肌肉干细胞开始分化[36,37]。所以本研究采用2%血清的培养基诱导细胞,通过显微镜观察细胞的形态变化、免疫荧光检测肌肉干细胞分化标志基因Myog[31]以及qPCR检测MyoD1和Myog表达情况,从而对诱导结果进行鉴定。试验诱导后的肌肉干细胞能够形成肌管并表达MyoD1和Myog,说明减少血清是肌肉干细胞诱导分化的有效方法之一。
肌肉干细胞的自我更新和分化过程由一系列基因所组成的调控网络所控制,从而能准确的发挥其功能。因此,体外培养肌肉干细胞能够为阐明肌肉干细胞增殖分化的分子机制提供实验材料,进而应用于肌组织工程,为临床治疗肌肉退行性疾病奠定基础[38 ]。
4 结论
本研究成功分离和鉴定了山羊胎儿肌肉干细胞,且获得的肌肉干细胞在体外诱导条件下具有较好的成肌分化能力,为后续开展山羊胎儿肌肉干细胞功能和分子机制的研究提供试验材料。The authors have declared that no competing interests exist.
