0 引言
【研究意义】家蚕(Bombyx mori)既是绢丝产业的支柱,也是鳞翅目昆虫的模式生物,同时还是高效生物反应器的开发主体,其潜在价值的不断挖掘与研究具有重要的产业价值及科学意义。家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)是导致蚕业重大损失的主要病原体之一,因此研究家蚕的抗BmNPV免疫机制,解析抗病毒免疫信号通路,筛选和鉴定抗病毒分子,不仅可以为开发抗病优良品种提供靶标和依据,也将完善昆虫抗病毒免疫的理论体系。【前人研究进展】对昆虫抗病毒免疫应答的研究发现,昆虫通常采用包括RNAi、细胞凋亡、细胞自噬、抑制病毒复制和蛋白质合成等机制予以防御[1,2,3],但这些机制主要在细胞内部,较少涉及到细胞之间的“交流”。已知病毒感染哺乳动物细胞后,可以激活NF-κB等转录因子,从而诱导细胞产生并分泌包括干扰素(interferon,IFN)在内的多种细胞因子[4]。干扰素通过扩散到周边或随循环系统运至机体各部位,结合细胞表面受体激活下游信号通路,进而诱导细胞产生诸如能降解病毒核酸或抑制病毒基因表达的效应蛋白,增强细胞的抗病毒能力。虽然通过同源比对,在昆虫基因组中未检索到IFN的同源分子,但近年来在黑腹果蝇(Drosophila melanogaster)和库蚊(Culex)中鉴定到了一种可能发挥类似于IFN的作用的抗病毒因子Vago[5,6]。Vago为分泌型蛋白质,其表达受到病毒感染的诱导,能激活未被病毒感染的细胞中的Jak-STAT信号通路并诱导这些细胞表达抗病毒基因vir-1(virus-induced RNA 1)从而控制病毒的扩散。Vago基因启动子上有NF-κB类转录因子的结合位点,并且NF-κB类转录因子Relish(在库蚊中被命名为Rel2)被证实参与Vago的诱导表达[7]。Relish的N端具有转录因子活性的Rel同源结构域(Rel homology domain,RHD),C端具有将其锚定于细胞质的Ankyrin重复序列(ANK)。当其活化时,C端ANK被切除,N端暴露出核定位信号从而进入细胞核内发挥转录因子的作用[8]。果蝇relish突变个体在感染蟋蟀麻痹病毒(Cricket Paralysis virus,CrPV)或辛德比斯病毒(Sindbis virus,SINV)后,体内病毒载量远高于正常个体,死亡率升高,说明Relish参与抗病毒免疫;在埃及伊蚊(Aedes aegypti)细胞中还观测到,SINV感染导致Relish的活化[9,10]。而BmRelish通常认为参与抗菌肽表达的调控,在对抗细菌或真菌感染的免疫应答中发挥作用[11,12],但通过转录组测序或全基因组表达谱芯片等方法对家蚕个体或细胞进行检测,发现BmNPV感染并未导致BmRelish表达水平的明显变化[13,14,15]。考虑到mRNA水平(表达水平)的变化可能并不能完全反映其蛋白质水平(活性)的变化,且家蚕细胞在感染BmNPV后,gloverin、lebocin、attacin等抗菌肽基因转录水平升高[13],而抗菌肽基因的转录通常被认为是受到NF-κB类转录因子的调控[16],由此推测BmNPV感染可能导致BmRelish的活化。【本研究切入点】目前,对家蚕细胞被BmNPV病毒感染后是否产生并分泌抗病毒因子还未有相关研究;对BmRelish是否被BmNPV感染所激活也无直接证据;并且抗病毒因子的产生是否受到BmRelish的调控更缺乏探索。【拟解决的关键问题】针对以上问题,本研究首先检测BmNPV感染是否导致BmRelish活化以及BmRelish是否调控抗病毒免疫;然后通过在细胞中表达具有转录活性的BmRelish,利用Transwell细胞共培养等方法确定细胞是否产生并分泌具有抗病毒活性的细胞因子;再通过超滤初步分级分离抗病毒因子并予以质谱分析,为后续鉴定和功能性研究抗病毒因子提供依据。1 材料与方法
试验于2015年9月至2017年4月在西南大学家蚕基因组生物学国家重点实验室完成。1.1 材料与主要试剂
试验所用家蚕胚胎细胞系BmE[17]以及感染细胞所需BmNPV,均由笔者实验室保存;BmNPV-EGFP由浙江大学吴小锋教授馈赠;带有Myc标签的BmRelish-FL和BmRelishact真核表达载体pSLfa1180- Myc-BmRelish-FL,pSLfa1180-Myc-BmRelishact由笔者实验室构建[18]。GAPDH抗体、HRP标记山羊抗小鼠抗体、RIPA细胞裂解液、彩色预染蛋白质分子量标准均购自碧云天公司;Myc标签抗体和C18 Cartridge购自Sigma公司;细胞转染试剂购自Roche公司;Grace昆虫细胞培养基和胎牛血清均购自Gibco公司;ECL化学发光检测试剂盒购自Thermo公司;基因组提取试剂盒和荧光定量PCR相关试剂购自TaKaRa公司;3、10 kD超滤管和Transwell小室购自Merck Millipore。
1.2 细胞转染和Western blot检测
27℃条件下,用含10%胎牛血清的Grace昆虫细胞培养基培养BmE细胞。转染前24 h,将细胞接种至12孔板中(1×105个细胞/孔),按照转染试剂操作说明转染1 μg pSLfa1180-Myc-BmRelish-FL或pSLfa1180-Myc-BmRelishact质粒DNA。转染48 h后收集细胞用于Western blot检测。用细胞裂解液裂解细胞后提取总蛋白,采用BCA蛋白浓度测定法测定蛋白浓度,按等量上样进行12% SDS-PAGE电泳,然后将蛋白转移到PVDF膜上,5%的脱脂奶粉封闭1 h后,用Myc抗体或GAPDH抗体室温孵育1 h,TBST清洗3次后用二抗室温孵育1 h,再用TBST清洗5次,最后用ECL化学发光检测试剂进行显色反应。
1.3 荧光定量PCR检测病毒拷贝数
使用TCID50法测定病毒滴度。将病毒和培养基充分混匀后添加到12孔板中(105 PFU病毒/孔),在感染后不同时间点收集细胞,提取基因组。荧光定量PCR采用相对定量法,以BmNPV-gp64为目标基因,以Bmgapdh为参比基因,引物序列见表1。扩增程序为95℃ 3 s,60℃ 30 s,共40 个循环。在退火/延伸阶段进行荧光信号数据采集,最后对熔解曲线进行分析。依据各样品中的目标基因和内参基因的临界循环数(Ct)值,利用2-△△Ct计算分析。所有的数据均采用平均值±标准偏差(SD)表示,数据显著性分析部分采用Student’s t检验,P<0.05具有显著性差异,P<0.01具有极显著性差异。Table 1
表1
表1引物序列
Table 1Primer sequences
| 基因Gene | 引物序列Primer sequence (5′-3′) |
|---|---|
| BmNPV-gp64 | F: CCATCGTGGAGACGGACTA |
| R: CTCGCACTGCTGCCTGA | |
| Bmgapdh | F: CATTCCGCGTCCCTGTTGCTAAT |
| R: GCTGCCTCCTTGACCTTTTGC |
新窗口打开
1.4 Transwell细胞共培养实验
转染48 h后,在表达BmRelishact的细胞培养板内放置接种有新鲜BmE细胞的Transwell小室(1×105个细胞/小室),共培养6 h后在每个小室内加入105 PFU病毒,在感染24、48和72 h后收集小室中的细胞,进行荧光定量PCR检测病毒拷贝数,试验重复3次。1.5 抗病毒活性物质的超滤筛选
转染48 h后收集细胞上清培养液,使用3或10 kD的超滤管进行超滤离心。将截留液和滤过液分别与完全培养基混匀后添加到新鲜接种的细胞中,培养6 h后在每个细胞培养孔内加入105 PFU病毒,感染48或96 h后收集细胞检测病毒拷贝数。1.6 质谱检测
为避免培养基内的血清、水解乳蛋白等干扰,在转染细胞6 h将培养基换成不含血清、水解乳蛋白、抗生素的Grace培养基,8 h后收集细胞上清,用10 kD超滤管超滤浓缩,所得滤液再用3 kD超滤管超滤,收集滤过液。采用C18 Cartridge对样本进行脱盐,样品冻干后加入40 μL 0.1%甲酸溶液复溶,肽段定量(OD280)。按照定量结果取3 μL样本进行LC-MS/MS分析。采用纳升级流速HPLC液相系统Easy nLC进行分离。肽段经色谱分离后使用Q-Exactive 质谱仪(Thermo Scientific)进行质谱分析。分析时长:120 min;检测方式:正离子;母离子扫描范围:300—1 800 m/z;一级质谱分辨率:70 000 at m/z 200;一级Maximum IT:50 ms。多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描后采集20个碎片图谱(MS2 scan),二级质谱分辨率:17 500 at m/z 200;Microscans:1;Isolation window:2 m/z;二级Maximum IT:60 ms;MS2 Activation Type:HCD;Normalized collision energy:27 eV;Dynamic exclusion:60.0 s;Underfillratio:0.1%。原始文件通过Proteome Discoverver软件采用Mascot 2.2进行数据库检索,数据库为SilkDB(http://silkworm.swu.edu.cn/silkdb/)与NCBI收录的家蚕数据。1.7 质谱检测结果数据分析
利用Blast2Go软件对质谱鉴定到的蛋白进行功能注释,并且利用BGI WEGO(http://wego.genomics.org. cn/cgi-bin/wego/index.pl)进行数据解析及GO注释图型化制作;利用ExPASy(http://web.expasy.org/ compute_pi/)预测蛋白分子量大小;利用SMART(http://smart.embl-heidelberg.de)预测蛋白结构域;利用WoLF PSORT(http://www.genscript.com/wolf- psort.html)对预测蛋白亚细胞定位。2 结果
2.1 BmRelish调节抗病毒免疫
为探究BmRelish的活化是否受到BmNPV感染的诱导,在BmE细胞中转染并表达BmRelish-FL(BmRelish全长形式),经BmNPV感染后,检测是否产生其活性形式BmRelishact。结果表明,BmRelish-FL在病毒感染后部分转变成BmRelishact(图1-A),暗示病毒感染导致了BmRelish的活化。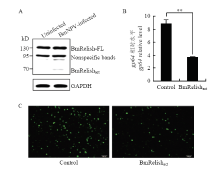 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1BmRelish的Western blot检测及细胞表达BmRelishact后抗病毒免疫水平的定量检测
A:Western blot检测未被病毒感染或被BmNPV感染的细胞中BmRelish-FL和BmRelishact Detection of BmRelish-FL and BmRelishact in uninfected and BmNPV-infected cells by Western blot;B:定量检测过表达BmRelishact的细胞或对照细胞中病毒gp64的相对水平Quantitative analysis of gp64 relative level in BmE cells over-expressing BmRelishact or control cells after BmNPV infection;C:BmNPV-EGFP感染后,荧光观察过表达BmRelishact的细胞或对照细胞 BmNPV-EGFP positive cells detected by fluorescent microscopy. ** P<0.01
-->Fig. 1Western blot detection of BmRelish and quantitative analysis of the antiviral immunity of BmRelishact-expressing cells
-->
为探究BmRelish活化后是否参与抗病毒免疫,用BmNPV或BmNPV-EGFP感染过表达BmRelishact的BmE细胞,并通过qPCR检测病毒DNA在细胞内的相对水平或通过显微镜观测呈现EGFP荧光的细胞。结果显示,过表达BmRelishact的细胞中,病毒DNA的相对水平显著低于作为对照的未表达BmRelishact的细胞(图1-B),且其中呈现EGFP荧光的细胞数,即病毒得以复制的细胞数也明显较对照细胞少(图1-C)。这一结果说明BmRelishact的表达促进了抗病毒免疫。
2.2 BmRelishact促进细胞产生分泌型抗病毒因子
BmRelishact作为转录因子,调控多种基因的转录。为探究这些基因是否编码具有增强细胞抗病毒能力的蛋白质,尤其是分泌型抗病毒因子,采用Transwell细胞共培养实验对过表达BmRelishact的细胞上清培养液予以了检测。结果显示,若下室为过表达BmRelishact的细胞,则其上室细胞在感染BmNPV后,细胞中病毒DNA的相对水平在各检测时间点均明显降低(图2-A)。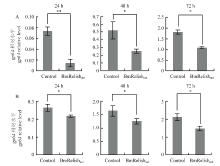 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2表达BmRelishact的细胞培养液抗病毒活性的定量检测
A:Transwell小室内的细胞与过表达BmRelishact的细胞或与对照细胞共培养后,感染BmNPV 24、48或72 h,小室细胞中gp64相对水平的定量检测At 24, 48 or 72 h post BmNVP infection, quantitative analysis of gp64 relative level in cells plated in Transwell insert after co-cultured with BmRelishact-expressing cells or control cells;B:用过表达BmRelishact的细胞上清或对照细胞上清孵育新鲜细胞后,感染BmNPV 24、48或72 h,待测细胞中gp64相对水平的定量检测At 24, 48 or 72 h post BmNVP infection, quantitative analysis of gp64 relative level in cells incubated with supernatant medium harvested from BmRelishact-expressing cells or control cells。* P<0.05,** P<0.01
-->Fig. 2Quantitative analysis of the antiviral activity of supernatant medium of BmRelishact-expressing cells
-->
为进一步确定过表达BmRelishact的细胞上清培养液中存在抗病毒因子,收集上清用于孵育新鲜细胞,在感染BmNPV 24、48和96 h后检测病毒DNA在细胞内的相对水平。结果显示,经过表达BmRelishact的细胞上清培养液孵育后,待测细胞中病毒DNA的相对水平显著低于对照(图2-B)。
上述结果表明当BmRelishact在细胞中表达后,细胞产生并向胞外分泌了具有抗病毒活性的物质。
2.3 抗病毒因子的分级鉴定
为了进一步确定抗病毒因子的性质,采用超滤法对其分子量大小进行了鉴定。结果显示,细胞上清培养液经100 kD超滤管处理后的滤过液能增强细胞的抗病毒免疫,而截留液则无此活性(图3-A),由此推测该抗病毒因子分子量可能<100 kD。经3 kD超滤管处理后的滤过液依然能增强细胞的抗病毒免疫,而截留液则无此活性(图3-B)。结果说明抗病毒因子的分子量应该也<3 kD。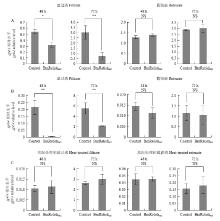 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3表达BmRelishact的细胞培养液经超滤处理后抗病毒活性的定量检测
A:用100 kD超滤管超滤过表达BmRelishact或对照细胞的上清,将滤过液和截留液分别孵育细胞,在BmNPV感染48或72 h后,细胞中gp64相对水平的定量检测At 48 or 72 h post BmNVP infection, quantitative analysis of gp64 relative level in BmE cells incubated with the filtrate or retenate fractions from supernatant medium of BmRelishact-expressing cells or control cells which was fractionated by centrifugal filter with cut-off size of 100 kD;B:用3 kD超滤管超滤过表达BmRelishact或对照细胞的上清,将滤过液和截留液分别孵育细胞,在BmNPV感染48或72 h后,细胞中gp64相对水平的定量检测At 48 or 72 h post BmNVP infection, quantitative analysis of gp64 relative level in BmE cells incubated with the filtrate and retenate fractions from supernatant medium of BmRelishact-expressing cells or control cells which was fractionated by centrifugal filter with cut-off size of 3 kD;C:加热经3 kD超滤管超滤所得的滤过液和截留液后,用其孵育细胞,在BmNPV感染48或72 h后,细胞中gp64相对水平的定量检测At 48 or 72 h post BmNVP infection, quantitative analysis of gp64 relative level in BmE cells incubated with heat-treated filtrate and retenate fractions from supernatant medium of BmRelishact-expressing cells or control cells which was fractionated by centrifugal filter with cut-off size of 3 kD。* P<0.05,** P<0.01,NS:无显著性差异No significant difference
-->Fig. 3Quantitative analysis of the antiviral activity of supernatant medium of BmRelishact-expressing cells after fractionation by ultrafiltration
-->
鉴于分子量<3 kD的物质有可能为核酸、多肽或者小分子化学物质,故使用高温处理这种最直观的方法对其属性进行了分析。小片段核酸和化学小分子具有一定的耐高温性,而多肽则可能因高温处理而失活。结果表明,滤过液经加热处理后无促进细胞抗病毒能力的活性(图3-C)。由此推测抗病毒因子可能为对高温敏感的多肽,而非核酸或者小分子化合物。
2.4 抗病毒因子的质谱鉴定和分析
对经3 kD超滤管处理后的滤过液进行质谱检测,共鉴定出了67个肽段,肽段长度为9—45个氨基酸,富集到32个蛋白质(表2),其中分子量>100 kD的蛋白有9个,分子量为50—100 kD的蛋白有9个,分子量在20—50 kD的蛋白有10个,分子量<20 kD的蛋白有4个,但是并没有分子量<3 kD的蛋白。由此推测该抗病毒细胞因子可能是由某些分子量较大的蛋白质经酶解所产生的小肽。Table 2
表2
表2细胞上清培养液中蛋白质的质谱鉴定
Table 2Proteins in cell culture supernatant identified by LC-MS
| 鉴定到的肽段序列 Sequence of identified peptides | 蛋白质编号 SilkDB or NCBI accession number | 分子量 MW (kD) |
|---|---|---|
| TGCGCGCRGCGCGCGGCGCGCCENFRVCSNSAAPTG | XP_021208710.1 | 13.6 |
| ISGLAGGVL | BGIBMGA004076-PA | 13.8 |
| GGGGFGSGGGGGSGGGGGGSHGGGGGLGSGVGGGSG GGGGGFGSGGGGGSGGGGGGSHGGGGGLGSGVGGGS GGGGFGGGGGKGGYGGGSHGGDSGG GGGGGFGGGGGKGGYGGGSHGGDSG GGFGGGGGGGFGGGGGKGGYGGGSHGGD FGGGGGGGFGGGGGKGGYGGGSHGGDSGGS | BGIBMGA002567-PA | 15.4 |
| VVKAAPIPIIRTAVAPIITAPIIKTVAP | BGIBMGA010968-PA | 17.2 |
| GGGGFGGGGSGGGFGRGGGGRGGGGG GGGGGFGRGGGGGFGRGGGGGFGRGGGG | BGIBMGA006056-PA | 22.5 |
| NAEVAGDSAEEDEDQGmGDANMDGEPQQNGASD | BGIBMGA004302-PA | 37.2 |
| MTGFDGSATGDVNISGGEGGAVGDAQG | BGIBMGA006426-PA | 38.0 |
| GGYGGGYGMGGMGAmGLNGmAPY | BGIBMGA004502-PA | 39.1 |
| GGGGFGASGDGNGGSSGGGLGGGAGGGFGGG GGGFGGGSGHGGSISGGYGSHGGNKGTGN GDGNGGSSGGGLGGGAGGGFGGGSGHGGSISGGYGSHGGNKGTGN | BGIBMGA002566-PA | 41.6 |
| ESFGGSHAAGGFSSSGHDSYGSSGG ESFGGSHAAGGFSSSGHDSYGSSGGHDS | BGIBMGA000662-PA | 41.7 |
| VmSKmHGAAPGGmPGGMPGGMPGGMPGGMPGGMPGYmPGGm | BGIBMGA014618-PA | 42.1 |
| PFCTGDPVGCFALSEPGNGSDAGA | BGIBMGA013140-PA | 44.2 |
| GPCGPCAPCGPCGPCAPCGPCAPCRPC | BGIBMGA014458-PA | 45.3 |
| PmGmGGNGSMGMGPGPGNMGNCGPLAGMSGMAMGG mGGNGSmGmGPGPGNmGNCGPLAGmSGmAmGG AGSMNGPmNGPmGGGGPSmSVPRmNGPmGP PmGmGGNGSmGMGPGPGNMGNCGPLAGMSG PmGmGGNGSmGmGPGPGNMGNCGPLAGMSGmA GPGMGPTSRSMGSPMSPMNSMPMGSPMSSGPmGSPmNmGSMS RSMGSPMSPMNSMPMGSPMSSGPMGSPMNMGSmSGSHmSNS AGSMNGPmNGPMGGGGPSMSVPRMNGPMGPSC AGSMNGPmNGPmGGGGPSmSVPRMNGP mGPGPGNmGNCGPLAGmSGmAMGGPGGQGVGPMGQGMGMFGP AGSMNGPmNGPmGGGGPSmSVPRmNGPmGPSC | BGIBMGA001468-PA | 49.6 |
| ESFGGNPNDITLmGCSAGGV | BGIBMGA007545-PA | 54.9 |
| PGGmPGGmPGGmPGGMSGGmPGGmPGGm PGGmPGGmPGGmSGGMPGGmPGGmPGGm PGGmPGGmSGGmPGGMPGGmPGGmPGGm mPGGMPGGMPGYmPGGMPGGYQMPRNTGPT PGGmPGGmSGGmPGGmPGGMPGGMPGGMPGGmPGYmPG | BGIBMGA004614-PA | 60.3 |
| SGGGGGGGGGGGGGEGEGGDGGGGGGGGGGEDGGGGGGGT CAGDGGNDGGDGGESGEDGGGGGGGGGGGG GDGGNDGGDGGESGEDGGGGGGGGGGGGG CAGDGGNDGGDGGESGEDGGGGGGGGGG | BGIBMGA000185-PA | 64.3 |
| 续表2 Continued table 2 | ||
| 鉴定到的肽段序列 Sequence of identified peptides | 蛋白质编号 SilkDB or NCBI accession number | 分子量 MW (kD) |
| DLSGYQQHCLVGGGGGGGGGGGGGGEG | XP_021204595.1 | 70.4 |
| SSAPSTQAAGLSFGVSSTPSTQTTGLSFGVS | BGIBMGA013791-PA | 74.4 |
| xGSGAGSGAGAGSGAGAGYGAGAGS GSVSYGAGRGYGQGAGSAASSVSS | BGIBMGA005111-PA | 76.9 |
| LMEAGGCTEDAVGVTPPSPF | BGIBMGA011032-PA | 79.4 |
| GDSTmSGGGDSDTESEGGGDPDDGSVSD | BGIBMGA003635-PA | 89.7 |
| MGGNGGMNGmNGmNGmTGmGQMGNAAMNGMNGMNP | BGIBMGA012479-PA | 89.8 |
| xxxCGAAGCAGGGGAGAPCDYVN xxxCGAAGCAGGGGAGAP | BGIBMGA004537-PA | 107.8 |
| AAGGFGGGGGGCLKGGAGGGYMGGNTNE | BGIBMGA000152-PA | 123.0 |
| LCAAPVPGAGVLRGGGGCAARRAGGGGA | BGIBMGA010888-PA | 124.7 |
| PmmGGmGPNGPmGPLGPCGmKGIRGPCGGPDm PmmGGmGPNGPMGPLGPCGMKGIRGPCGG NQMMMMKGGPGQMGQMGPGMGPMDGFPGSTPSCGVmDGLGADG GPGGmGmGHGSMGPNGmmGPNGPmmGGmGPN SmmGGGDFPGDmSLSPKMGGGPMGGPGGGMGPDGMLGARGGKM GGPGGMGmGHGSmGPNGmmGPNGPmmGGMGPN NGPmGGHMGPGGPMGGMGGPGGMGMGHGSMGPNGMm | BGIBMGA005732-PA | 133.1 |
| GGVCAGAGCAAHASCAACRGEPACGWCDDG | XP_021208146.1 | 136.6 |
| ITPmPPAmPGAPPPPGMPGLGPGPPPPPPTGPAP | XP_021203910.1 | 142.3 |
| DNAGAGAGGGmEGSEGGGSGGAEVDm mmREIHDNAGAGAGGGmEGSEGGGSGGAEVDm | BGIBMGA001566-PA | 221.5 |
| GARAGGDEVPAGGDGAPAGGDGG | XP_012545870.1 | 238.2 |
| GSGAGSGAGAGSGAGAGYGV AGVGYGAGAGAGYGAGAGSGAASGAG | NP_001106733.1 | 391.4 |
新窗口打开
对鉴定到的所有蛋白进行结构域预测发现,9个蛋白质具有信号肽(表3)。其中XP_021208710.1还具有Chorion_1结构域,BGIBMGA000185-PA和XP_021204595.1还具有Chitin_bind结构域,BGIBMGA010888-PA还具有糖原脱支酶(GDE)相关结构域,XP_021208146.1还具有EGF和CUB等结构域。
Table 3
表3
表3有信号肽的蛋白质
Table 3Proteins containing signal peptide
| 蛋白质编号 SilkDB or NCBI accession number | 蛋白质名称 Protein description | 其他结构域 Other domains |
|---|---|---|
| XP_021208710.1 | 高半胱氨酸HCB类卵壳蛋白12类似蛋白 Chorion class high-cysteine HCB protein 12-like | Chorion_1 |
| BGIBMGA004076-PA | 功能未知蛋白 Uncharacterized protein | |
| BGIBMGA002567-PA | 表皮蛋白 Putative cuticle protein | |
| BGIBMGA002566-PA | 表皮蛋白CPG32 Putative cuticle protein CPG32 | |
| BGIBMGA000185-PA | 功能未知蛋白 Uncharacterized protein | ChtBD2 |
| XP_021204595.1 | 功能未知蛋白 Uncharacterized protein | ChtBD2 |
| BGIBMGA010888-PA | 糖原脱支酶 Glycogen debranching enzyme | DGE |
| XP_021208146.1 | Attractin类似蛋白1 Attractin-like protein 1-like | EGF, CUB, Kelch_3 |
| NP_001106733.1 | 丝素重链前体 Fibroin heavy chain precursor |
新窗口打开
3 讨论
昆虫依赖于其先天免疫系统抵御病原微生物的感染。在家蚕和其他一些鳞翅目昆虫的肠液、血淋巴等组织液中鉴定了多种具有抗NPV活性的蛋白质,如lipase-1、alkaline trypsin、hemolin等;将病毒与这些蛋白质孵育后再感染昆虫宿主,宿主的死亡率降低[19,20,21]。通过比较BmNPV易感和抗性家蚕品系的基因表达差异,也发现了不少可能参与抗BmNPV免疫应答的基因,例如BmSP-2、BmAquaporin、BmCTP1、BmGRP4等[22,23,24,25]。但这些分子均未涉及细胞之间的相互作用和抗病毒免疫应答的协同调控。本研究从BmNPV感染所激活的转录因子BmRelish出发,鉴定受BmRelish调控的抗病毒细胞因子,探索家蚕抗病毒免疫的新机制。从昆虫到哺乳动物,NF-κB转录因子在免疫应答中都发挥关键性的作用。在哺乳动物中,多种模式识别受体(pattern-recognition receptors,PRRs),如RIG-I-like受体或TLR等结合病毒核酸分子,开启信号通路激活NF-κB转录因子,从而调控IFN等细胞因子的表达[26]。在昆虫中,NF-κB转录因子的激活通常被认为是受到细菌或真菌感染的诱导:免疫信号通过两条经典的通路——Toll和IMD信号通路传递至NF-κB类转录因子,Dorsal/Dif或Relish,并由此启动包括抗菌肽等多种免疫效应分子的表达[16]。而昆虫细胞被病毒感染后,Dicer-2结合病毒dsRNA并将其切割成小的干涉RNAs(small interfering RNAs),通过RNAi方式进行防御[27]。Dicer-2和RIG-I-like受体具有相似的DExD/H-box解旋酶结构域,功能类似[5];但Dicer-2是否参与了昆虫细胞NF-κB类转录因子的激活,仍未可知。
虽然就昆虫中是否存在抗病毒细胞因子还存在争议,但不少研究都先后报道了昆虫细胞被病毒感染后产生参与抗病毒免疫应答的分泌型蛋白质或多肽。例如果蝇抗菌肽基因attacinC和diptericinB 的表达受SINV感染的诱导,用dsRNA降低attacinC和diptericinB的表达水平后,果蝇个体中SINV的复制水平升高[28]。伊蚊细胞被DENV感染后,分泌具有抗病毒活性的Cecropin-like小肽,其分子量仅为3.8 kD;用该多肽孵育细胞后,胞内病毒RNA水平降低[29]。而且,从被DENV感染的伊蚊细胞上清培养液中还鉴定到几种带负电荷的7肽,不仅能降低伊蚊细胞中的病毒载量还能增强猴肾细胞的抗病毒能力[30,31]。本研究所筛选的抗病毒细胞因子,分子量同样较小(<3 kD),且通过质谱分析推测这些抗病毒因子是由分子量较大的蛋白质酶解所产生的。事实上,这种由前体蛋白剪切成具有生物活性的小肽,在昆虫中屡见报道,其中最为典型的是鳞翅目昆虫ENF肽家族成员。这些由23或25个氨基酸组成的多肽,是由无活性的前体经由血淋巴中的丝氨酸蛋白酶剪切所生成的,同样发挥调节免疫功能的作用[32,33,34]。
细胞因子结合细胞表面受体从而开启效应蛋白的表达。在哺乳动物中,IFN与其受体结合后,通过Jak-STAT信号通路调控基因的转录[35]。果蝇和蚊类中鉴定到的Vago,通过细胞表面未知受体同样激活Jak-STAT信号通路。鉴于Jak-STAT在物种间的保守性,家蚕抗病毒细胞因子也可能激活Jak-STAT信号通路而发挥作用。事实上,通过基因芯片也检测到家蚕Jak和STAT在病毒感染后表达量的变化[14,36]。但家蚕基因组中并不存在vir-1同源基因,因此确认家蚕细胞Jak-STAT信号通路是否被激活,可能需要通过检测受Jak-STAT信号通路调控的其他效应基因,例如Socs36E的表达来实现[37]。
通过质谱鉴定到9个具有信号肽的蛋白质,推测这些蛋白或者分泌到细胞外或者以跨膜蛋白的方式存在于细胞膜上。其中Attractin-like蛋白被报道能刺激T细胞和巨噬细胞活化和黏附,参与对HIV的防御过程[38]。其余蛋白虽然不具有信号肽,但并不能排除其自身或经酶切后的产物经其他蛋白转运途径分泌到细胞外,例如Hsp70(heat shock protein 70,BGIBMGA014618-PA)通过囊泡运输到细胞外,激活多个免疫信号通路[39,40],且BmNPV感染6 h后在家蚕肠液中也检测到了Hsp70及其家族成员,但其受BmNPV诱导表达的机制还不明确[41]。为缩小候选多肽数量便于后续检测,对细胞上清培养液还需要通过其他方法进一步分级分离,比如利用离子交换柱予以分离,或联合转录组学数据进行分析。
4 结论
BmNPV感染导致BmRelish的激活,活化的BmRelish通过调控抗病毒细胞因子的表达参与抗病毒免疫。存在于表达BmRelish活化形式的细胞上清培养液中的细胞因子,为分子量<3 kD的多肽。The authors have declared that no competing interests exist.
