0 引言
【研究意义】西番莲(Passiflora edulis)是西番莲科(Passifloraceae)西番莲属(Passiflora)多年生草质藤本植物,原产南美的巴西、阿根廷,广泛分布于热带、亚热带地区,在中国主要分布于台湾、广东、福建、广西、浙江、四川等地区。西番莲营养价值高、风味独特,果实含有130多种芳香类物质,几乎涵盖了热带、亚热带大部分水果的香型,因此又称百香果[1,2,3,4]。西番莲作为一种高级天然饮料作物,在栽培生产过程中,常常受到病虫害的危害,其中病毒病是西番莲生产上的第2大病害,严重影响其产量和品质,在很多地区已成为限制西番莲生产发展的重要因素[5,6,7]。近年来,随着国内消费者对西番莲需求的不断增长,中国西番莲的种植面积逐渐增大,病毒病随之发生、传播和扩散的风险也越来越高。为预防与控制西番莲病毒病,加强病毒的早期检测,明确病毒发生的种类,对于及时制定有效的防治措施,保护西番莲生产安全具有重要意义。【前人研究进展】目前,国内外报道能够侵染西番莲的病毒主要包括马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)的西番莲木质化病毒(Passionfruit woodiness virus,PWV)[8,9]、豇豆蚜传花叶病毒(Cowpea aphid borne mosaic virus,CABMV)[10,11,12]、东亚西番莲病毒(East Asian Passiflora virus,EAPV)[13,14]、西番莲果环斑病毒(Passion fruit ring spot virus,PFRSV)[15]、西番莲Y病毒(Passionfruit virus Y,PaVY)[16,17]、西番莲斑驳病毒(Passionfruit mottle virus,PaMV)[18]、大豆花叶病毒(Soybean mosaic virus,SMV)[19]、马来西亚西番莲病毒(Malaysian Passiflora virus,MPV)[20]、夜来香花叶病毒(Telosma mosaic virus,TeMV)[21],雀麦花叶病毒科(Bramovirida)黄瓜花叶病毒属(Cucumovirus)的黄瓜花叶病毒(Cucumber mosaic virus,CMV)[22,23],双生病毒科(Geminiviridae)菜豆金黄花叶病毒属(Begomovirus)的大戟曲叶病毒(Euphorbia leaf curl virus,ELCV)、广东番木瓜曲叶病毒(Papaya leaf curl Guangdong virus,PaLCuGdV)、西番莲扭叶病毒(Passion fruit leaf distortion virus,PLDV)[24,25],芜菁黄花叶病毒科(Tymoviridae)芜菁黄花叶病毒属(Tymovirus)的西番莲黄花叶病毒(Passion fruit yellow mosaic virus,PFYMV)[26],柑橘粗糙病毒属(Cilevirus)的西番莲绿斑病毒(Passion fruit green spot virus,PFGSV)[27],乙型线状病毒科(Betaflexiviridae)香石竹潜隐病毒属(Carlavirus)的西番莲潜隐病毒(Passiflora latent virus,PLV)[28],帚状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus)的西番莲花叶病毒(Maracuja mosaic virus,MrMV)[29]和豇豆花叶病毒科(Comovirinae)线虫传多面体病毒属(Nepovirus)的番茄环斑病毒(Tomato ring spot virus,ToRSV)等[30]。其中,夜来香花叶病毒(TeMV)是近年来西番莲上新报道的一种Potyvirus病毒,基因组具有典型的Potyvirus结构特征,正义ssRNA,全长9 689 nts,编码一个长的聚合蛋白。TeMV的病毒粒体呈线状,长约750 nm,宽约12 nm。TeMV侵染寄主植物主要引起花叶症状,在越南夜来香、泰国西番莲、印度尼西亚广霍香上已有发生危害的报道,该病毒可通过机械接种传播,但是否通过蚜虫传播尚未明确。由于西番莲在生产上常采用扦插、嫁接育苗,因此TeMV可能通过上述途径大面积或远距离传播。鉴别寄主鉴定、电镜观察、血清学检测、RT-PCR是植物病毒检测诊断的常用方法。CHIEMSOMBAT等[21]通过电镜观察提纯的病毒粒体形态、血清学和RT-PCR方法,检测了泰国西番莲上的TeMV,同时研制了用于该病毒快速检测的免疫胶体金诊断试纸条,最低可检测到稀释640倍的感病西番莲汁液;HA等[31]在圆柱状内含体蛋白(cylindrical protein,CI)和辅助成分-蛋白酶(helper component- proteinase,HC-Pro)编码区域设计2对新的简并引物,从越南夜来香上检测出TeMV,并测定了其全基因组序列。【本研究切入点】关于TeMV,国内种植的西番莲上尚未有该病毒发生的正式文献研究报道,仅GenBank上有中国广西分离物部分基因序列的记录(KJ789129)。福建西番莲种植园内疑似带毒样品上是否携带有TeMV有待进一步明确。【拟解决的关键问题】采用血清学、电镜观察和分子生物学相结合的方法对引起福建西番莲花叶、皱缩症状的病原进行鉴定,明确其具体种类,并建立该病毒的特异性分子快速检测方法,为该病毒的检测及防控提供理论依据。1 材料与方法
试验于2017年在福建省农业科学院果树研究所完成。1.1 材料
供试西番莲样品采自福建西番莲种植园,共56份,保存于-80℃冰箱。供试毒源CMV、BtMV、SMV、OrMV、OYDV、EAPV等由笔者实验室保存。Potyvirus通用抗体检测试剂盒购自Agdia公司;M-MuLV反转录酶、RNasin购自Promega公司;Taq DNA聚合酶、pMD-18T载体购自TaKaRa公司;DNA Marker、胶回收试剂盒购自天根生化科技(北京)有限公司。裂解介质管购自美国MP Biomedicals公司。1.2 血清学检测
采用Indirect-ELISA方法,具体参照试剂盒说明书。试验设置阳性对照、阴性对照和空白对照,3个重复。利用Infinite M200多功能酶标仪测定405 nm下的OD值,样品OD405 nm /阴性对照OD405 nm>2时,判定检测结果为阳性。1.3 电镜观察
采用2%磷钨酸负染色,西番莲样品提取液吸附于铜网支持膜后置于H-7650透射电镜下观察病毒粒体形态。1.4 总RNA提取
称取0.1 g西番莲叶片样品放入2 mL裂解介质管中,加入1 mL TrizoL试剂,在MP FastPrep®-24研磨机上研磨后静置5 min;4℃下12 000 r/min离心10 min,取上清;加入氯仿300 μL,剧烈振荡15 s,室温静置5 min,4℃下12 000 r/min离心15 min,取上层水相;加入等体积的异丙醇,颠倒混匀后室温下静置15 min,4℃下12 000 r/min离心10 min,弃上清;沉淀用1 mL 75%冷乙醇洗涤后4℃下7 500 r/min离心3 min,弃上清;RNA沉淀干燥后,用30 μL经DEPC(焦碳酸二乙酯)处理过的ddH2O溶解,-80℃保存。1.5 引物设计与合成
Potyvirus通用简并引物为正向引物LegpotyF:5′-GCWKCHATGATYGARGCHTGGG-3′,反向引物LegpotyR:5′-AYYTGYTYMTCHCCATCCATC-3′[32];特异性引物根据已报道的TeMV外壳蛋白基因序列设计,正向引物TeMV-CPf:5′-TCAAGTAAGGTGGATG ATGTT-3′,反向引物TeMV-CPr:5′-CTGCACAGAGC CAACCCCAA-3′,均由上海生工生物工程技术服务有限公司合成。1.6 RT-PCR
以提取的西番莲叶片总RNA为模板(3 μL),加入随机引物(10 μmol·L-1)1 μL、ddH2O 7 μL,72℃水浴10 min后迅速冰浴,再依次加入M-MuLV反转录酶缓冲液(5×)5 μL、dNTPs(10 mmol·L-1)2 μL、RNasin(40 U·μL-1)1 μL、M-MuLV反转录酶(200 U·μL-1)1 μL,42℃ 1 h、72℃ 10 min合成cDNA。通用简并引物PCR反应体系(25 μL):2×Taq PCR mix 12.5 μL,LegpotyF(10 μmol·L-1)1 μL,LegpotyR(10 μmol·L-1)1 μL,ddH2O 8.5 μL,cDNA 2 μL;PCR扩增条件:94℃预变性3 min;94℃变性30 s、45℃退火45 s、72℃延伸1 min,35个循环后72℃延伸10 min。特异性引物PCR反应体系(25 μL):PCR Buffer(10×)2.5 μL、MgCl2(25 mmol·L-1)2.5 μL、dNTPs(2.5 mmol·L-1)2 μL、TeMV-CPf(10 μmol·L-1)1 μL、TeMV-CPr(10 μmol·L-1)1 μL,Taq DNA聚合酶(5 U·μL-1)0.2 μL,ddH2O 13.8 μL,cDNA 2 μL;PCR扩增条件:94℃预变性3 min;94℃变性30 s、55℃退火1 min、72℃延伸1 min,35个循环后72℃延伸10 min。PCR扩增产物采用1.5%琼脂糖凝胶(含GelRed染料)电泳,凝胶成像系统观察电泳结果。1.7 PCR产物克隆测序及序列分析
PCR产物经1.5%琼脂糖凝胶电泳后,利用琼脂糖凝胶DNA纯化回收试剂盒回收目的片段,连接于pMD18-T载体,转化大肠杆菌DH5α,然后涂布含氨苄青霉素的LB固体培养基上,筛选阳性克隆,送上海生物工程技术服务有限公司进行测序。序列比对采用BLAST和DNAMAN软件。系统发育树构建采用MrBayes 3.26软件[33]贝叶斯法(Bayesian inference,BI),通过ModelFinder[34]计算获得最佳核苷酸替换模型为HKY+G4,并参照BIC标准设置相关参数,共运行200万代,每隔100代抽样1次,舍弃25%老化样本后,根据剩余的样本树获得50%多数原则一致树(50% majority-rule consensus tree),树各节点的置信度通过计算的后验概率(posterior probability,PP)进行评估。在重建BI树过程中,以大豆花叶病毒分离物(FJ548849)为外群(outgroup)。
1.8 特异性引物RT-PCR的特异性、灵敏度测定
分别以CMV、BtMV、SMV、OrMV和EAPV毒源及感染TeMV的西番莲叶片为样品,同时以健康西番莲叶片为阴性对照,利用引物对TeMV-CPf/ TeMV-CPr进行RT-PCR,测定特异性。将从感染TeMV的西番莲叶片中提取的总RNA,用健康西番莲叶片提取的总RNA作10倍梯度稀释,以引物对TeMV-CPf/TeMV-CPr进行RT-PCR,测定灵敏度。2 结果
2.1 ELISA检测
采用Indirect-ELISA对疑似带毒西番莲样品进行Potyvirus病毒检测,结果发现,一株表现有花叶、皱缩症状的样品(编号为FJ-13,图1)提取液与Potyvirus通用抗体呈阳性反应,样品OD405nm与阴性对照OD405nm的比值>3,表明该样品上可能含有Potyvirus病毒。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1西番莲样品(FJ-13)花叶、皱缩症状
-->Fig. 1Passion fruit sample FJ-13 with mosaic and crinkle symptom
-->
2.2 电镜观察
将ELISA检测为阳性的西番莲样品(FJ-13)提取液进行电镜观察,结果见图2。由图2可以看出,该样品中含有大小约750 nm×12 nm的弯曲线状病毒粒体,与已报道的Potyvirus典型病毒粒体的形态相似。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2西番莲样品(FJ-13)病毒粒体的电镜观察
-->Fig. 2Electron microscopic observation of virus particle of passion fruit sample FJ-13
-->
2.3 通用简并引物RT-PCR检测
利用Potyvirus通用简并引物对西番莲样品FJ-13进行RT-PCR。结果表明,LegpotyF/LegpotyR 能从该样品上扩增到预期大小的目的片段,而从阴性对照和空白对照中未扩增出相应的目的片段(图3)。将PCR目的片段进行克隆测序,共获得680 nts的序列,与预期大小相符,包含核内含体蛋白b(nuclear inclusion body ‘b’ protein,NIb)基因3′末端和CP基因5′末端部分序列。BLAST比对结果显示,该序列与GenBank已报道的夜来香花叶病毒(TeMV)基因序列存在高度一致性,其中与中国广西分离物(KJ789129)序列一致性最高,达98.2%,与越南分离物(DQ851493)序列一致性最低(79.9%)。RT-PCR检测结果表明,样品FJ-13上可能携带有Potyvirus的TeMV。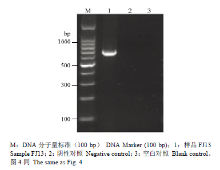 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3样品FJ13的通用简并引物RT-PCR
-->Fig. 3Amplification of RT-PCR for FJ13 using universal degenerate primers
-->
2.4 特异性引物RT-PCR检测
利用设计的TeMV特异性外壳蛋白引物TeMV-CPf/TeMV-CPr对西番莲样品FJ-13进行RT-PCR,结果从该样品上获得了大小约816 bp的目的片段(图4),与预期大小一致。序列测定结果表明,目的片段大小完全相符,序列长度为816 nts(GenBank登录号为MG189584),为完整的CP基因序列,编码272个氨基酸。该分离物(命名为BXGFJ-13)的核苷酸序列和氨基酸序列与中国广西分离物(KJ789129)的一致性最高,分别为98.4%和97.8%;与越南分离物(DQ851493)的一致性最低,分别为86.2%和88.2%;与其他TeMV分离物核苷酸序列一致性在87.9%—92.1%,氨基酸序列一致性在87.9%—93.0%(表1)。此外,在BXGFJ-13 CP基因的氨基酸序列中,第8—10个氨基酸组成与病毒蚜传相关的保守基序DAG(图5)。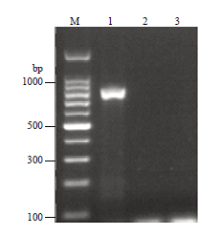 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4样品FJ-13的特异性引物RT-PCR
-->Fig. 4Amplification of RT-PCR for FJ13 using specific primers
-->
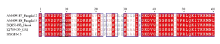 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5BXGFJ-13分离物外壳蛋白基因的氨基酸序列与其他分离物的比对(DAG用黑线框标注)
-->Fig. 5Comparison of amino acid sequence of coat protein gene of BXGFJ-13 isolate with other isolates (DAG labelled with black frame)
-->
Table 1
表1
表1BXGFJ-13分离物与TeMV其他病毒分离物外壳蛋白基因的核苷酸(nt)和氨基酸(aa)序列一致性
Table 1Nucleotide (nt) and amino acid (aa) sequence identities of coat protein gene between BXGFJ-13 isolate and other TeMV isolates
| 登录号 GenBank number | 分离物 Isolate | 寄主 Host | 国家 Country | 一致性Identity (%) | |
|---|---|---|---|---|---|
| nt | aa | ||||
| KJ789129 | GX1 | 西番莲Passiflora edulia | 中国China | 98.4 | 97.8 |
| AB699338 | Garut 1 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 92.1 | / |
| AB699341 | Garut 2 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 91.9 | / |
| AB699131 | Ciamis 1 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 91.9 | / |
| AB699339 | Pasaman 2 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 91.6 | / |
| AB699342 | Ciamis 2 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 91.0 | / |
| AM409188 | Pangda15 | 西番莲Passiflora edulia | 泰国Thailand | 90.8 | 93.0 |
| AB699340 | Manoko 1 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 90.7 | / |
| AB699343 | Bogor 2 | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 90.0 | / |
| AM409187 | Pangda12 | 西番莲Passiflora edulia | 泰国Thailand | 89.3 | 87.9 |
| AB699130 | Pasaman | 广藿香Pogostemon cablin | 印度尼西亚Indonesia | 87.9 | / |
| DQ851493 | Hanoi | 夜来香Telosma cordata | 越南Vietnam | 86.2 | 88.2 |
新窗口打开
2.5 BXGFJ-13分离物与其他分离物的系统发育分析
根据TeMV的CP基因序列构建系统发育树,结果表明,来自不同国家、地区的13个TeMV分离物共形成3个类群(图6)。所有的印度尼西亚分离物以较高的后验概率聚为第1大类群(Group I),本研究获得的BXGFJ-13分离物与中国广西分离物(KJ789129)、两个泰国分离物Pangda15(AM409188)和Pangda12(AM409187)组成第2大类群(Group II),其中BXGFJ-13分离物与中国广西分离物(KJ789129)以较高的后验概率(PP=100%)先聚为一个分支,而后与泰国分离物(AM409188、AM409187)进一步相聚成簇;越南分离物Hanoi(DQ851493)独立一个分支,单独形成第3大类群(Group III)。相同地区或寄主来源的分离物优先相聚成簇,表现出很强的地理和寄主特异性。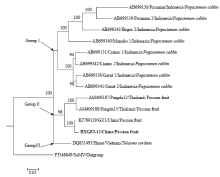 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6基于外壳蛋白基因核苷酸序列的系统发育树
-->Fig. 6Phylogenetic tree of TeMV based on nucleotide sequences of coat protein gene
-->
2.6 特异性引物RT-PCR的特异性、灵敏度测定
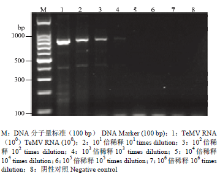
应用建立的特异性引物RT-PCR方法分别对TeMV、CMV、BtMV、SMV、OrMV、OYDV、EAPV及健康西番莲样品进行检测,结果仅从感染TeMV样品上扩增出目的片段,从其他病毒及健康西番莲上均未扩增出目的片段(图7),表明该方法具有良好的特异性。灵敏度测定结果表明,建立的特异性引物RT-PCR具有较高的灵敏度,当TeMV阳性样品总RNA原液稀释102倍时,仍能扩增出清晰的特异性条带,但进一步稀释103倍时,扩增出的特异性条带较淡(图8)。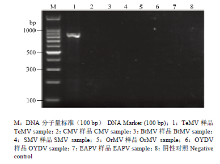 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7特异性测定
-->Fig. 7Specificity of RT-PCR using specific primers
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8灵敏度测定
-->Fig. 8Sensitivity of RT-PCR using specific primers
-->
3 讨论
Potyvirus病毒是西番莲上发生较为严重的一类病毒,对西番莲的产量能够造成较大的影响。其中PWV、CABMV和EAPV等病毒侵染西番莲引起的木质化病,造成的经济损失巨大[35]。夜来香花叶病毒(TeMV)作为近年来西番莲上新报道的病毒,目前仅在泰国西番莲上有明确发生的研究报道[21],其危害程度、传播机制、发生规律等尚不清楚,为避免该病毒传播、扩散和流行后对西番莲的生产造成重大影响,亟需加强对该病毒的检测、监测及控制。本研究采用血清学、电镜观察、RT-PCR及序列测定的方法对福建果园西番莲上的疑似带病样品的毒源进行了检测和鉴定,证实一株具有花叶、皱缩症状的样品携带有TeMV。为实现对TeMV的准确检测,设计了一对扩增该病毒CP基因全长的特异性引物,建立了TeMV的特异性分子检测方法,具有快速、灵敏的优点,同时扩增产物测序结果获得的CP基因完整编码区序列可用于后续的病毒种类判定和系统发育分析。由于西番莲病毒病的防治十分困难,因此选用无毒的健康种苗是一项有效措施,而病毒快速检测技术则是筛选无毒种苗的关键。近年来,已报道的TeMV鉴定方法主要包括电镜观察、血清学检测和RT-PCR检测。利用电镜能够直接观察病毒粒体形态,但无法判定具体病毒种类,仅能作为TeMV的辅助鉴定手段。血清学检测具有操作简便、结果稳定的优点,但TeMV尚未有商品化的ELISA试剂盒,大多采用Potyvirus通用抗体试剂盒来进行初筛。电镜观察、血清学检测结果只能用于TeMV的初步诊断,该病毒的确认须经RT-PCR和序列分析结果。利用Potyvirus通用简并引物进行RT-PCR,然后对获得的序列进行分析,根据序列测定结果判断病毒种类,该方法已被用于该属多种病毒的检测。ZHANG等[36]利用Potyvirus通用简并引物检测方法,在中国野生茄子上首次鉴定出野生番茄花叶病毒(Wild tomato mosaic virus,WTMV);OHSHIMA等[37]以采集的日本水仙为材料,应用Potyvirus通用简并引物检测方法检出水仙迟季黄化病毒(Narcissus late season yellows virus,NLSYV)、水仙黄条病毒(Narcissus yellow stripe virus,NYSV)、水仙退化病毒(Narcissus degeneration virus,NDV)和Cyrtanthus elatus virus A(CyEVA)等多种Potyvirus病毒复合侵染水仙。目前,Potyvirus通用简并引物用于TeMV检测的研究报道较少。NOVERIZA等[38]利用Potyvirus通用简并引物对印度尼西亚广藿香进行了TeMV检测与鉴定。Potyvirus通用简并引物检测具有一定的广谱性,除可以检测TeMV外,同时还可检测到西番莲上可能感染的其他Potyvirus病毒种类,有助于发现复合侵染。但与特异性引物不同,通用简并引物的RT-PCR产物必须要进一步克隆测序,然后根据测序结果来鉴定病毒种类,并且为防止漏筛,应尽可能测定多个克隆子,相对检测成本较高。本研究建立的特异性RT-PCR方法,专用于TeMV的检测,特异性强、灵敏度高,适合于该病毒的针对性检测。因此,在西番莲病毒检测中,可以根据实验要求的不同,分别选用不同的引物来进行RT-PCR检测,在仅检测TeMV时采用特异性引物,若同时检测是否有多个Potyvirus病毒复合侵染则采用通用简并引物。
按照国际病毒分类委员会(ICTV)关于Potyvirus病毒的划分标准,即CP基因氨基酸序列一致性约低于80%;CP基因或整个基因组的核苷酸序列一致性低于76%[39]。本研究测定的BXGFJ-13分离物CP基因氨基酸、核苷酸序列与已报道的TeMV分离物一致性最高分别为97.8%、98.4%,显著高于80%、76%标准,与Potyvirus病毒种的划分标准相符,确认BXGFJ-13为TeMV的一个分离物。CHIEMSOMBAT等[21]研究报道,西番莲上的2个TeMV分离物(AM409188、AM409187)的CP基因氨基酸序列中未发现与病毒蚜传相关的保守基序DAG,DAG被DTG取代,即第9位的氨基酸由A突变为T。本研究从西番莲上获得的BXGFJ-13分离物氨基酸序列中存在DAG,说明BXGFJ-13可能通过蚜虫传播,但在果园内虫害调查时未发现蚜虫,推测这可能受虫害调查次数限制影响未及时发现蚜虫,除此之外,也有可能是不通过蚜传而仅是带毒苗的扦插或嫁接繁殖引起,BXGFJ-13是否可以蚜传及其传播机制有待进一步研究。由于TeMV可能单独或与其他病毒复合侵染西番莲,引起严重的木质化病,若证实能通过蚜虫传播,则极易通过蚜虫在西番莲种植区大面积传播。因此,为防范该病毒暴发流行,应加强西番莲引种苗的检测,及时剔除带毒苗,同时在西番莲生产期间注意防治蚜虫。
系统发育分析结果显示国家(或地区)、寄主来源相同的TeMV分离物优先相聚成簇,表现出很强的地区和寄主特异性,究其原因可能是该病毒的适应性进化同时受地区和寄主所驱动,相似的特征也在Potyvirus的其他病毒中被报道过,比如马铃薯 Y 病毒(Potato virus Y,PVY)和辣椒脉斑驳病毒(Chilli veinal mottle virus,ChiVMV)[40,41]。TeMV分离物与地理(或寄主来源)是否存在关联可以通过贝叶斯标签关联显著性(Bayesian tip-association significance,BaTS)分析进行验证。然而,由于本研究中TeMV的样本量相对有限。因此,后期可能需要更多不同地理或寄主来源的分离物以进一步揭示该病毒的适应性进化特征。
4 结论
采用Indirect-ELISA、电镜观察、通用简并引物RT-PCR、特异性引物RT-PCR及序列测定相结合的方法,从福建西番莲种植园内检出夜来香花叶病毒(TeMV)。针对TeMV,建立了特异性强、灵敏度高的分子快速检测方法,为该病毒的快速检测提供了可靠的技术支持。The authors have declared that no competing interests exist.
