0 引言
【研究意义】生物表面活性剂是微生物代谢产生的一类结构各异且具有表面活性的物质,根据其生化特性和分子量等参数,通常可以分为糖脂、磷脂和脂肪酸、脂肽或脂蛋白、高分子表面活性剂和颗粒表面活性剂等几大类[1]。表面活性剂都具有改变界面状态的作用,在溶剂中加入很少量时,能够显著降低固、液、气界面间的界面张力,从而产生润湿或者反润湿、乳化或者破乳、分散或者凝集、起泡或者消泡、以及增溶等一系列作用[2]。由于日益严重的环境问题,人们将更多的目光投向了生物表面活性剂。因为生物表面活性剂毒性低、易降解,且在强酸、强碱,浓盐,极限温度下仍具有表面活性[3-4]。更重要的是其高效性,具有低临界胶束浓度,却能表现出很高的表面活性[4]。因此生物表面活性剂在石油、采矿、食品、化妆品、造纸、纺织、涂料、节能技术、洗涤保洁、精细化工生产以及陶瓷工业中都有广泛的应用。【前人研究进展】大量的研究表明,生物表面活性剂结构上是一个两性分子,通常含有一个亲水基团和一个疏水基团,疏水部分有很多饱和或不饱和的碳链,亲水部分则是多变的,包括单糖、低糖、多糖、短肽、磷酸基等[3,5]。获得高纯度生物表面活性剂是研究其特性的必要前提。SHANMUGASUNDARAM等[6]采用了HPLC的方法从Pontibacter korlensis SBK-47菌株中纯化出了一种新型的生物表面活性剂,并结合MALDI-TOF和核磁共振的方法将其鉴定为Pointifatin。TOMASZ等[7]从北极的斯瓦尔巴德岛群岛分离获得了一株产生物表面活性剂的恶臭假单胞菌BD2,采用乙酸乙酯萃取法提取了所产生物表面活性剂并结合UPLC-MS方法将其鉴定为鼠李糖脂。INÈS等[8]利用枯草芽孢杆菌所产的表面活性剂来处理被石油污染的土壤并取得了很好的修复效果,而JULIANA等[9]从圆球形假丝酵母分离纯化到了一种生物表面活性剂,将其应用于重金属污染土壤的修复并取得了较好的效果。【本研究切入点】目前,关于生物表面活性剂的纯化与鉴定的报道比较多,但大多数都来源于芽孢杆菌属及假单胞菌属,而关于霍氏肠杆菌生产生物表面活性剂还鲜有报道;另一方面,关于生物表面活性剂的应用,主要集中在石油污染土壤的修复、重金属污染土壤修复以及水污染处理等领域,而关于生物表面活性剂在促进植物吸收叶面肥方面的研究还鲜有报道。【拟解决的关键问题】本研究通过正交试验优化霍氏肠杆菌B4产生物表面活性剂的条件,提高生物表面活性剂的产量,结合萃取和液相色谱技术获得了纯度较高的生物表面活性剂,利用傅里叶红外扫描和HPLC-MS技术,鉴定出了该生物表面活性剂结构。获得霍氏肠杆菌液体发酵产表面活性的最优条件并研究其基本的理化特性,纯化和鉴定出生物表面活性剂主要成分,评估其对作物吸收叶面肥的促进作用。1 材料与方法
1.1 材料
1.1.1 供试菌株 所用菌株B4由江苏省固体有机废弃物资源化高技术研究重点实验室从大庆油田被石油污染的土壤中筛选获得,并鉴定为霍氏肠杆菌(Enterobacter hormaechei),菌株的16S rRNA基因序列在NCBI上的保存号为KF015738.1。1.1.2 培养基 试验所用培养基均在1.05 kg·cm-2、灭菌20 min后使用,培养基如下。
LB培养基:酵母提取物5 g·L-1,氯化钠10 g·L-1,蛋白胨10 g·L-1。原始发酵培养基:NaNO3 4.0 g·L-1,CaCl2·H2O 0.1 g·L-1,Na2HPO4·2H2O 3.0 g·L-1,KH2PO4 3.0 g·L-1,MgSO4·7H2O 0.2 g·L-1;酵母提取物 2.0 g·L-1,甘油3%(v/v),每升发酵培养基含2 mL微量元素溶液;其中微量元素溶液配方:NaMoO4·2H2O 0.05 g·L-1,FeCl3·6H2O 0.08 g·L-1,ZnSO4·7H2O 0.75 g·L-1,CoCl2·6H2O 0.08 g·L-1,FeSO4·7H2O 0.5 g·L-1,CuSO4·5H2O 0.075 g·L-1,MnSO4·H2O 0.75 g·L-1,H3BO3 0.15 g·L-1[9]。
1.2 方法
1.2.1 种子液制备 用250 mL的三角瓶装20%的液体LB培养基。将接好种的三角瓶放入摇床上培养,培养条件为37℃,转数170 r/min,培养24 h左右。1.2.2 表面活性剂的发酵时间优化及正交优化试验
(1)发酵时间的优化 用250 mL的三角瓶盛装50 mL的发酵培养基,接种5%(v/v)种子液,分别发酵24、48、72、96、120和144 h,每个处理设3次重复,35℃、200 r/min条件下培养。取样测定发酵液的pH、OD600。培养结束后,取适量发酵液于50 mL离心管中,10 000×g、4℃条件下离心15 min,取上清液测定表面张力值(表面张力值的测定采用铂金板法,在23℃室温下测量),将离心下来的菌体放入105℃的烘箱烘干24 h至恒重后,每个处理3次重复,测量时取其平均值。
(2)正交优化试验 采用五因素四水平L16(45)进行正交试验,选择碳源、氮源、初始pH、发酵温度和接种量作为5个因素,选择2%、3%、4%、5%(v/v)的甘油作为碳源的4个水平,选择2 g、3 g、4 g、5 g NaNO3作为氮源的4个水平,选择6.0、6.5、7.0、7.5作为pH值的4个水平,选择31℃、35℃、39℃、43℃作为温度的4个水平,选择1%、2%、4%、6%(v/v)作为接种量的4个水平。将发酵液的表面张力值作为参考量,每个处理3次重复并取其平均值。
1.2.3 生物表面活性剂基本性质测定 取上清液1 000 mL,分装于称好重量的8个组培瓶中,放置在-80℃冰箱预冻4—5 h后,转入真空冷冻干燥仪中,冻干后称重。绘制表面张力值随粗生物表面活性剂浓度的关系图,得到所产生物表面活性剂临界约束浓度下的表面张力值[11]。
1.2.4 生物表面活性剂的提纯及特性研究 萃取:参照GHOJAVAND等[12]的方法,将上清液用1 mol·L-1的HCl溶液调节pH至2.0,再用与发酵液等体积的氯仿和甲醇2﹕1(v/v)混合溶剂萃取,再用发酵液1/2体积的混合溶剂萃取。将两次的萃取液混合用旋转蒸发仪在40℃下进行浓缩,得到棕色黏稠固体后将其刮下。
排油圈大小测定按MORIKAWA等[13]的方法作适当的调整:往柴油中滴入几滴尼罗红染色剂并混合均匀。将0.1 g的提纯物溶于入50 mL(含 0.01 g碳酸钠的超纯水作为检测液),在直径15 cm的玻璃平皿中加入40 mL去离子水,加入10 μL柴油使其完全平铺在水面开后,再在中央滴加1 μL生物表面活性剂,并在紫外成像仪下拍照。
1.2.5 傅里叶红外光谱分析 将萃取获得的粗表面活性剂,利用傅里叶变换红外光谱仪NEXUS870(美国NICOLET)分析其中含有的功能团,扫描的分辨率为4 cm-1,扫描波段设置为400—4 000 cm-1。
1.2.6 液相分离 液相色谱分离纯化生物表面活性剂按照LIN等 [14]的方法进行并做适当的调整。采用高效液相色谱法(Agilent 1260)进行分离提纯,试验所用色谱柱为Agilent C18(9.4 mm×150 mm,5 μm)。将萃取过的生物表面活性剂溶于色谱纯甲醇(天津光复化学试剂公司)流动相A为色谱纯乙腈,流动相B为0.1%乙酸水溶液,流动相A梯度增加,40 min内从50%上升到100%,流速0.5 mL·min-1,柱温50℃,进样量为20 μL,检测波长为210 nm。分离过程中收集2—4 min分离出来的洗脱液,进行富集。
1.2.7 液质联用(HPLC-MS) 生物表面活性剂采用HABA等[15]的方法进行HPLC-MS分析,并稍作修改。将粗生物表面活性剂和液相分离样品采用液质联用仪(美国 Thermo Scientific, Q-Exactive),液相部分条件同上,色谱柱流出组份进入质谱仪的流速为10 μL·min-1。毛细管电压3.88 kV,锥孔电压为53 V,离子源温度100℃,脱溶温度150℃。全扫描是在质心模式下,采样周期时间为1 s和扫描时间为0.1 s,m/z范围110—1 000。
1.2.8 高效叶面肥的配制 本研究采用的叶面肥由江阴市联业生物科技有限公司提供,是商品叶面肥的半成品(未添加表面活性剂),是由病死家禽及屠宰场下脚料酸水解而制成的氨基酸叶面肥。
将氨基酸水解液稀释成500倍后,再利用KOH调pH至7左右,一部分氨基酸溶液加入提纯的生物表面活性剂,进一步研究生物表面活性剂提高植物叶片吸收氨基酸水溶肥的效果。
1.2.9 黄瓜试验
(1)水培试验 标准浓度霍格兰培养液:四水硝酸钙945 mg·L-1,硝酸钾506 mg·L-1,硝酸铵80 mg·L-1,磷酸二氢钾136 mg·L-1,七水硫酸镁493 mg·L-1,铁盐溶液2.5 mL,微量元素5 mL,pH=6.0。其中,铁盐溶液:七水硫酸亚铁2.78 g,乙二胺四乙酸二钠3.73 g,蒸馏水500 mL,pH=5.5;微量元素液:碘化钾0.83 mg·L-1,硼酸6.2 mg·L-1,硫酸锰22.3 mg·L-1,硫酸锌8.6 mg·L-1,钼酸钠0.25 mg·L-1,硫酸铜0.025 mg·L-1,氯化钴0.025 mg·L-1。
黄瓜水培试验于2016年8—9月在南京农业大学资环学院人工气候室进行,选用黄瓜品种为津优1号。将种子用去离子水浸泡3—4 h,浸泡完之后用2%的过氧化氢浸泡3—4 min消毒,并放在网格上使其部分淹没水中放到光照室育苗,发芽后长到两叶一心进行移苗。用1/4的浓度的标准霍格兰配方作为基础液,两周后换成1/2浓度的霍格兰营养液,采用1 L的白色塑料容器。等黄瓜苗长出两片真叶后,挑选长势相同的黄瓜进行处理,作CK(喷洒清水)、AA(喷施稀释500倍的氨基酸水解液)、AAB(在AA的基础上加上1.0 g·L-1的生物表面活性剂)3个处理,每个处理作5次重复,每片叶子均反面喷3下,正面喷一下(预计0.75 mL量),每一周换一次霍格兰营养液,2016年8月16移苗,9月20号收获。测量不同处理植株的株高、叶片数、鲜重和干重,鲜重直接用吸水纸擦干根上的液体称量,干重则将植株放入信封,并在105℃条件下烘至恒重,称量植株重量。
(2)盆栽试验 黄瓜盆栽试验于2016年9—10月在南京农业大学资源环境学院温室进行,土壤取自江苏省江阴市联业农场的水稻土。土壤pH、有机碳、铵态氮、硝态氮、总氮、速效磷、速效钾含量均采用常规方法测定[12]。种子前期处理同水培试验,利用营养土和蛭石混合作为育苗基质,长出两叶一心后移苗。
使用4 kg规格的塑料盆,每盆装4 kg(±10 g)供试土样,每盆添加1.75 g硫酸钾、4.00 g过磷酸钙、1.28 g尿素作为基肥(为体现处理差异,供试土壤选尽量贫瘠的)。喷肥处理同水培试验,2016年9月6日第一次喷施,处理同1.2.6.1的叶面肥处理过程,2016年10月14日收获。分别测量株高、叶绿素两个参数。叶绿素测量采用SPAD-502叶绿素仪测量第一片新长成叶,选取叶片上5个点(去除偏差较大的点),取平均值。
1.3 数据分析
采用Excel 2003、SPSS 16.0软件进行数据分析,并利用Excel 2003作图,P≤0.05时为显著相关。2 结果
2.1 表面活性剂生产条件优化
分别选取了pH、发酵液OD600、上清液表面张力值、菌体的干重4个参数,来确定菌株最佳的发酵时间,结果如表1所示。其中pH在前6天变化都不大,第6天以后pH开始呈下降趋势。发酵上清液的表面张力值在第4天先降至一个最低的值,随后逐渐上升。OD600在前5天不断上升,随后逐渐下降;菌体干物重与OD600变化呈正相关关系。菌体的干重和OD600数值都反映了菌体数量,前2天B4的干重和OD600都快速增加,3 d后OD600数值增长速率小于干物重。上清液的表面张力值最低出现在第4天,说明在此发酵时间所产的表面活性剂最多,所以最终选择4天为发酵时间。Table 1
表1
表1E. hormaechei B4产表面活性剂的天数优化
Table 1Optimization on days of biosurfactant production by E.hormaechei B4
| 项目 Item | 时间 Time (d) | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| pH | 5.48 | 5.49 | 5.45 | 5.43 | 5.40 | 5.47 | 4.93 |
| 表面张力值 Surface tension value (mN·m-1) | 55.90±0.26 | 53.92±0.25 | 51.11±0.41 | 49.67±0.09 | 55.29±0.16 | 62.4±0.61 | 56.61±0.12 |
| OD600 | 0.159 | 0.292 | 0.319 | 0.332 | 0.352 | 0.293 | 0.298 |
| 菌体干重 Dry cell weight (g·L-1) | 0.150±0.023 | 0.313±0.056 | 0.347±0.016 | 0.497±0.034 | 0.506±0.054 | 0.475±0.043 | 0.483±0.071 |
新窗口打开
通过正交试验优化了E. hormaechei B4产表面活性剂的条件(因素水平如表2),正交试验结果如表3所示。在所有组合试验中,组合A2B1C2D3E4中的上清液表面张力值降到最低,进一步说明在4%甘油、3 g·L-1 NaNO3、初始pH6.0、6%接种量和35℃条件下,E. hormaechei B4所产的生物表面活性剂最多。鉴于RD>RA>RC>RE>RB,说明碳源的量对表面活性剂的产量影响最大,而pH都选在了中性范围左右所以影响不是很大。温度的K2<K3<K4<K1,表明温度要处于一定的范围内,低于35℃会导致表明活性剂产量降低。pH的波动较小,不需要特殊讨论。在接种量方面K4<K2<K1<K3,该结果表明接种量与生物表面活性剂产量并不存在线性关系。
Table 2
表2
表2L16(45)正交试验因素水平表
Table 2Table of factors and levels during the optimization process
| 水平 Level | 温度(A) Temperature (oC) | pH(B) | NaNO3(C) Sodium nitrate (g) | 甘油(D) Glycerol (%,v/v) | 接种量(E) Inoculation (%,v/v) |
|---|---|---|---|---|---|
| 1 | 31 | 6.0 | 2 | 2 | 1 |
| 2 | 35 | 6.5 | 3 | 3 | 2 |
| 3 | 39 | 7.0 | 4 | 4 | 4 |
| 4 | 43 | 7.5 | 5 | 5 | 6 |
新窗口打开
Table 3
表3
表3E. hormaechei B4产生物表面活性剂正交试验结果
Table 3The orthogonal experiment results of the biosurfacants production by E. hormaechei B4
| 试验标号 Test number | A | B | C | D | E | 表面张力值 Surface tension value (mN·m-1) |
|---|---|---|---|---|---|---|
| ① | 1 | 1 | 1 | 1 | 1 | 60.78±0.49 |
| ② | 1 | 2 | 2 | 2 | 2 | 60.41±0.56 |
| ③ | 1 | 3 | 3 | 3 | 3 | 59.94±0.48 |
| ④ | 1 | 4 | 4 | 4 | 4 | 47.24±0.14 |
| ⑤ | 2 | 1 | 2 | 3 | 4 | 44.10±0.04 |
| ⑥ | 2 | 2 | 1 | 4 | 3 | 50.87±0.42 |
| ⑦ | 2 | 3 | 4 | 1 | 2 | 49.41±0.27 |
| ⑧ | 2 | 4 | 3 | 2 | 1 | 59.01±0.13 |
| ⑨ | 3 | 1 | 3 | 4 | 2 | 54.00±0.64 |
| ⑩ | 3 | 2 | 4 | 3 | 1 | 53.03±0.25 |
| ? | 3 | 3 | 1 | 2 | 4 | 54.78±0.37 |
| ? | 3 | 4 | 2 | 1 | 3 | 60.45±0.68 |
| ? | 4 | 1 | 4 | 2 | 3 | 58.91±0.49 |
| ? | 4 | 2 | 3 | 1 | 4 | 57.36±0.46 |
| ? | 4 | 3 | 2 | 4 | 1 | 54.62±0.64 |
| ? | 4 | 4 | 1 | 3 | 2 | 49.24±0.58 |
| 均值K1 Mean value K1 | 57.093 | 54.832 | 53.480 | 55.970 | 56.140 | |
| 均值K2 Mean value K2 | 50.847 | 55.085 | 53.447 | 58.225 | 53.265 | |
| 均值K3 Mean value K3 | 52.990 | 54.250 | 57.965 | 50.858 | 56.510 | |
| 均值K4 Mean value K4 | 55.805 | 52.568 | 51.813 | 51.683 | 50.820 | |
| 极差R Range value R | 6.246 | 2.517 | 6.125 | 7.367 | 5.690 |
新窗口打开
2.2 生物表面活性产量及其基本性质
在最优条件下,1 L发酵液中粗生物表面活性剂产量可高达12.14 g,表面张力随粗生物表面活性剂浓度的关系如图1所示。在标准测量条件下,纯水的表面张力值为72.25 mN·m-1,粗生物表面活性剂的溶度在达到50 g·L-1时候溶液时达到了最小表面张力值,即生物表面活性剂浓度高于了其临界约束浓度,得到最低表面张力为34.14 mN·m-1,在粗生物表面活性剂浓度为10 mg·L-1时表面张力值就降到47 mN·m-1,充分说明了此表面活性剂的高效性,具有很好的应用前景。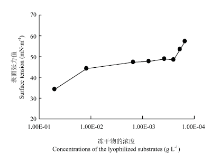 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1粗生物表面活性剂浓度与其溶液表面张力的关系
-->Fig. 1The relationship between the concentration of crude biosurfactant and surface tension value
-->
为了进一步研究菌株生成的生物表面活性剂的特性,利用有机试剂萃取法萃取上清液中的生物表面活性剂,萃取结果表明,1 L上清液经过萃取后可获得2.07 g纯度较高的生物表面活性剂,而且固体比较黏稠。排油圈大小可进一步表明该表面活性剂产物具有很好的表面活性,可以形成显著的排油圈。结果表明,1 μL提纯的生物表面活性剂可以获得直径8 cm的排油圈,结果如图2所示,说明提纯的生物表面活性剂具有很强的表面活性。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2生物表面活性剂排油圈试验
-->Fig. 2The graph of the oil-displaced circle
-->
2.3 液相分离结果
液相分离图谱如图3所示,从液相分离结果可以得出,经过有机试剂萃取过后获得的生物表面活性剂的纯度可观,出峰时间为1.62—2.33 min,说明这一部分为提纯后的生物表面活性剂的主要成分。根据液相色谱分离结果,利用仪器的回收系统回收1.62—2.33 min的液体,用于后续的分析。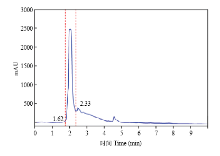 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3生物表面活性剂液相分离图
-->Fig. 3HPLC chromatogram of biosurfactant extracts produced by E. hormaechei B4
-->
2.4 红外扫描结果分析
利用傅里叶红外光谱法分析了提纯的生物表面活性剂,结果如图4所示。由图4可知,在波数1 770 cm-1处有C=C键的伸缩吸收带,这说明在该表面活性剂中含有不饱和碳碳双键;在2 941 cm-1附近显著为CH2和CH3基中C-H键的伸缩振动吸收带;1 045—1 100 cm-1的伸缩振动明显表示有C-O-C的存在,说明该表面活性剂中存在糖苷键;在3 410.8 cm-1处的典型特征峰,说明该化合物中存在大量的不饱和氢;在1 384.6 cm-1处的伸缩振动则表明该表面活性剂中有二甲基的存在。这些都与HEYD[17]等用红外扫描研究鼠李糖脂性质的结果相一致。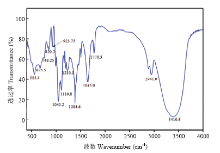 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4萃取后粗表面活性剂红外扫描图
-->Fig. 4FTIR-ATR spectra for biosurfactant extracts produced by E. hormaechei B4
-->
2.5 液质联用鉴定结果
E. hormaechei B4粗生物表面活性剂的总离子色谱如图5所示,结果表明在7—9 min时间段有较多的杂峰,这些杂峰可能是一些蛋白质、核酸、类脂寡糖等。有机试剂萃取后用高效液相色谱分离的物质在7.58 min处出峰,故将7.58 min的出峰物质进行质谱分析,分析结果如图6所示,根据其质谱数据的特征峰,推测m/z 701.54为[M+Na]+, 而m/z 723.74为[M-H+2Na]+,根据文献[18-19]报道的结果,推测该位置结构式为Rha-Rha-C10-C12。在总离子流图中其他没有分离检测出的物质可能是Rha-Rha-C10-C12的一些同系物,有待进一步研究。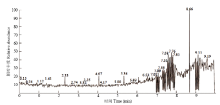 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5粗生物表面活性剂LCMS总离子流图
-->Fig. 5Total ion current diagram of crude biosurfactant
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6纯化的生物表面活性剂质谱图
-->Fig. 6Analysis result of the purified biosurfactant by HPLC-MS
-->
2.6 黄瓜促生试验结果
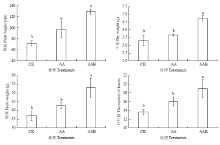
2.6.1 水培试验 黄瓜水培试验结果如图7所示,结果表明AAB处理的株高为(129±2.74)cm,而AA处只有(97.10±8.51)cm,CK则更矮小,只有(71.87±2.80)cm,AAB处理比CK处理增长了79.59%,比AA处理增长了32.90%;叶片数也要很大程度的增长,AAB处理的平均叶片数达到了(19.0±1.15)cm,比CK和AA处理分别增长了39.24%和18.74%。在整个植株的质量方面AAB处理也有很大增长,AAB植株的平均鲜重为52.94 g,AA和CK分别只有42.70 g和37.01 g,AAB与AA和CK相比,分别增长23.98%和43.03%;干重与鲜重很吻合,AAB、AA和CK的平均干重分别为4.73、3.65和3.31 g,AAB比AA和CK分别增长了29.80%和42.86%。生物表面活性剂的加入使得黄瓜的生物量有显著的增加,只喷施氨基酸水溶肥的AA处理长势明显不如添加了生物表面活性剂的AAB处理(图8)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7黄瓜水培结果
-->Fig. 7The hydroponic experiment results of cucumbers
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8水培黄瓜生物量
-->Fig. 8The biomass of hydroponic experiment cucumbers
-->
2.6.2 盆栽试验 利用盆栽试验进一步验证E.hormaechei B4所产生物表面活性剂的对黄瓜叶片吸收叶面肥的效果,所用土壤的基本性质如表4所示。结果表明,供试土壤的有机质含量比较高,而总氮和速效磷和速效钾的含量并不是很高,该土壤比较适合于叶面肥施用效果的研究。
Table 4
表4
表4供试土壤的基本性质
Table 4the basic properties of soil used in this study
| pH | 有机碳 Total organic carbon (g·kg-1) | 硝态氮 Nitrate (mg·kg-1) | 铵态氮 Ammonium (mg·kg-1) | 总氮 Total nitrogen (g·kg-1) | 速效磷 Available phosphorus (mg·kg-1) | 速效钾 Available potassium (mg·kg-1) |
|---|---|---|---|---|---|---|
| 6.35 | 5.51± 0.07 | 251.0±1.1 | 1.32±0.01 | 0.7910±0.011 | 14.72±0.82 | 93.00±0.78 |
新窗口打开
盆栽试验中,分别测定了不同处理中黄瓜的株高、叶绿素含量,结果如图9所示。AAB处理的平均株高为(164.97±0.09)cm,AA与CK处理没有明显差异,AAB却显著高于这两个处理,与AA和CK相比分别增加了26.93%和25.52%。关于叶绿素含量的差异,AAB处理也有类似的趋势,AAB处理的比AA和CK处理的叶绿素含量分别增加了10.69%和11.72%。盆栽试验结果表明,E. hormaechei B4合成的生物表面活性剂对黄瓜叶片吸收氨基酸叶面肥有显著的促进作用。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9盆栽试验结果
-->Fig. 9The pot experiment results of cucumbers
-->
3 讨论
生物表面活性剂种类繁多,能够分泌生物表面活性剂的微生物也多种多样,主要包括假单胞菌[7]、芽孢杆菌[8]、乳酸菌[20]等,但是不同微生物所产生物表面活性剂的量及其特性差异明显。目前,关于生物表面活性剂在食品和农业方面应用的报道比较多,GEORGE等[21]将海洋放线菌Brachybacterium paraconglomeratum中分离得到的糖脂类生物表面活性剂应用到食品加工上时发现,该糖脂不仅可以改善面包的风味,而且对大多数的细菌都具有拮抗作用;SIDDHARTHA等[22]利用从铜绿假单胞菌Pseudomonas aeruginosa SS14纯化出来的鼠李糖脂来防治玉米的穗腐病取得了比较理想的效果,而思斯等[23]从酶学角度研究了生物表面活性剂对提高纤维素高效降解的机制。然而关于生物表面活性剂在促进植物吸收叶面肥效率及其机制的研究还鲜有报道,而关于霍氏肠杆菌(E. hormaechei)产生物表面活性剂的优化及其产物的纯化鉴定更是报道甚少,所以本研究关于霍氏肠杆菌B4生物表面活性剂的纯化鉴定及其应用的研究是非常有意义的,将为新型肥料的研制提供坚实的理论基础。为了使霍氏肠杆菌B4产足够的生物表面活性剂,必须优化菌株产生物表面活性剂的条件,主要包括碳源、氮源及各种培养条件,而C/N是限制菌株产生生物面活性剂的主要因素。生物表面活性剂的产生往往开始于氮源快消耗殆尽的时期[24],当氮源耗尽时生物体内氮依赖型的酶促反应就无法进行,而碳源依旧充足,就会产生很多碳链较长的烃类,从而成为生物表明活性剂的疏水端[25]。在产量与性质方面,E. hormaechei B4菌株所产的生物表面活性剂可使纯水的表面张力值从72.25 mN·m-1降低到34.14 mN·m-1,说明该生物表面活性剂降低水表面张力的效果比较好。到目前为止,最有效的生物表面活性剂在0.005%浓度可以将纯水的表面张力值降低到27 mN·m-1 [26],E. hormaechei B4产的生物表面活性剂和它比起来差距不大,因此该生物表面活性剂具有很好应用潜能。在最优培养条件下,E. hormaechei B4发酵产生的直接粗生物表面活性剂高达12.14 g·L-1,有机萃取后可以得到2.07 g·L-1较纯的生物表面活性剂。EREIRA等 [27]用相同的方法萃取了枯草芽孢杆菌的发酵产物,只获得了1.76 g·L-1的脂肽类表面活性剂,相比之下 E. hormaechei B4有更强的产表面活性剂能力。在10 mg·L-1浓度条件下,霍氏肠杆菌B4分泌的生物表面活性剂可使纯水的表面张力值降低到47 mN·m-1左右,进一步说明该生物表面活性剂在低浓度下就具有良好的表面活性,所拍摄的排油圈结果更加直观的体现了所产生物表面表活性剂的强大功能。
微生物所产生物表面活性剂的表面比较多,主要槐糖脂、鼠李糖脂、海藻糖脂、脂肽和脂蛋白等,在具体研究前,必须对菌株所产的生物表面活性剂进行纯化与鉴定。本研究结合FTIR和HPLC-MS技术,分离纯化了霍氏肠杆菌B4分泌的生物表面活性剂,FTIR检测结果表明,该纯化的生物表面活性剂含有含有-CH2、-CO和C-O等官能团,与鼠李糖脂(Rha- Rha-C10-C12)所含的官能团比较吻合。而HPLC-MS分析结果表明,荷质比为701.54的碎片,与已有文献报道的鼠李糖脂(Rha-Rha-C10-C12)比较吻合,最终确定霍氏肠杆菌B4所产的表面活性剂为鼠李糖脂。该鉴定结果,将为该生物表明活性剂的实际应用提供理论依据。
本研究采用了水培和盆栽试验来验证霍氏肠杆菌B4所产表面活性剂的提高黄瓜叶片吸收养分的效率。叶面肥喷施液在作物叶面的润湿是养分进入叶片内部的前提[28],而覆有蜡质层的叶面具有低能表面的特征,使叶面肥喷施液无法在叶面润湿,不利于作物叶片对养分的吸收,表面活性剂则可以降低叶面肥的表面张力,降低了喷施液与蜡质层之间的界面张力,从而增加叶面肥在叶面的润湿作用。本研究中,黄瓜水培结果显示添加了生物表面活性剂的比没有添加的鲜重增加了23.98%,干重增加了29.80%。盆栽试验中添加了生物表面活性剂的植株比没有添加的叶绿素含量增加了10.69%,进一步说明生物表面活性剂的添加促进了植物对氨基酸叶面肥氮的吸收。总之,E. hormaechei B4 所产的生物表面活性剂对黄瓜吸收叶面肥的促进是显而易见的,这与浙江大学LIU等[29]研究得出鼠李糖脂可以提高氨基酸叶面肥吸收效率的结果是一致。在盆栽试验中喷施氨基酸叶面肥的长势和喷清水的无明显差异。可能原因是水培黄瓜蒸腾量大,气孔张开程度大更易吸收叶面肥。再者是盆栽期间蚜虫危害比较严重,有研究表明部分生物表面活性剂有杀灭蚜虫的功能[30],喷施了生物表面活性剂的叶面肥可能起到驱赶蚜虫和促进吸收的双重功效,使得该处理长势要远远高于其他两个处理,这有待进一步验证,今后也要对粗的生物表面活性剂进一步的提纯,并进行相关的结构鉴定工作。
近年来,环境污染及食品安全问题都受到社会的广为关注,在绿色食品的生产中,考虑到化工生产表面活性剂残留,以及其对环境产生的危害,高效、可降解、无毒害的生物表面活性剂必然会受到广泛推崇。所以,本研究的应用前景比较广阔。
4 结论
霍氏肠杆菌B4在优化后的发酵条件下,生物表面活性产量较高。该菌所产的表面活性剂主要成分为鼠李糖脂类物质,具有很好的表面活力,低浓度情况下能有效降低水的表面张力。霍氏肠杆菌B4所产生物表面活性剂能很好地促进黄瓜对氨基酸叶面肥的吸收,喷施了添加B4菌株所产生物表面活性剂的氨基酸叶面肥的黄瓜植株生物量有明显增长。The authors have declared that no competing interests exist.
