0 引言
【研究意义】杆状病毒是一类以节肢动物为专一性宿主进行感染和传播的、具有囊膜包裹的双链环状DNA病毒,其基因组大小为80—220 kb[1-3]。杆状病毒分为颗粒型病毒属(GV)和核型多角体病毒属(NPV)两个属。根据病毒生活史中具有两种不同的病毒粒子形态,又可分为包埋型的病毒粒子(occlusion-derived virus,ODV)和出芽型的病毒粒子(budded virus,BV),分别介导宿主之间的原发感染和细胞之间的继发感染[4-5]。病毒基因组相对其他生物更为简单,严格的寄生生活使病毒缺乏新陈代谢所必需的结构,所以病毒需要利用宿主的物质和能量才能完成自身生命活动[6-9]。杆状病毒在其生活周期中,基因的表达属于级联模式,按表达时序可分为极早期基因、早期基因、晚期基因和极晚期基因。晚期基因的表达有赖于病毒基因组的复制和转录,同时需要一些特殊的蛋白进行调控,即晚期表达因子(late expression factor,lef)。相关研究证明LEF-11和病毒DNA复制相关,而病毒编码的小分子蛋白在病毒感染宿主过程中往往需要寡聚化,形成不同程度的寡聚体,以行使不同的功能。因此对LEF-11蛋白自身相互作用的研究对于解析杆状病毒复制机制和培育抗病素材具有重要意义。【前人研究进展】迄今为止已经鉴定了至少19种晚期表达基因,统称为lef 基因家族。而此家族基因有些为DNA复制所必需,有些是在转录水平上进行调控,所有lef家族基因均能调控晚期基因的表达,是晚期表达基因的必需因子[10-14]。LEF-11是杆状病毒编码的只有112个氨基酸残基的小分子蛋白,大小为13.1 kD,除库蚊核型多角体病毒(Culex nigripalpus nucleopolyhedrovirus,CuniNPV)之外,所有已发现的杆状病毒基因组中都存在它的同源基因[15-18]。2002年,LIN等[19]通过敲除试验确定苜蓿银纹夜蛾核型多角体病毒(Autographa californica multiple nucleopolyhedrovirus,AcMNPV)lef-11是病毒DNA复制必需基因,能够促进晚期基因转录;2014年,ZHANG等[20]在BmNPV中确定LEF-11具有一个保守的核定位基序,并通过免疫荧光证明LEF-11能够与病毒DNA复制中心标记物BrdU共定位到一起,更进一步确定LEF-11可能在BmNPV DNA复制过程中起重要作用。此外,相关研究表明,LEF-11与细胞核入核受体蛋白importin α-3和定位于核内病毒DNA复制位点的病毒复制因子IE1有相互作用,这都表明LEF-11在病毒复制过程中扮演极其重要的角色。LEF-11能形成寡聚体,其寡聚体形式对其行使生理功能具有决定性作用[21]。【本研究切入点】病毒编码的小分子蛋白LEF-11对于病毒DNA复制非常重要,相关研究表明病毒编码的一些小分子蛋白以寡聚体的形式行使功能,但LEF-11自身相互作用具体机制仍不清楚。因此本研究通过逐步截短,鉴定LEF-11蛋白自身相互作用关键区域。【拟解决的关键问题】通过对LEF-11自身相互作用的鉴定,找出关键的结合区域,为解析LEF-11功能和应用于培育抗病毒品种打下基础。1 材料与方法
试验于2016年在西南大学农业部蚕桑生物学与遗传育种重点实验室完成。1.1 细胞和培养基
BmN-SWU1细胞为西南大学家蚕基因组生物学国家重点实验室保存,用TC-100培养基(United States Biological,Swampscott,MA,USA),添加10%(V/V)胎牛血清(FBS;PAA Laboratories),在27℃条件下恒温培养。1.2 质粒构建
以pIZ/V5-His(Invitrogen,Carlsbad,CA,USA)为空载,通过PCR获得家蚕核型多角体病毒lef-11全长及各个截短片段和EGPP、dsRed片段,先通过酶切、连接,构建pIZ-DsRed和pIZ-EGFP质粒。lef-11截短PCR片段包括N-端基因片段:2—61、12—61、22—61、32—61、42—61、52—61和2—41;C-端基因片段:62—112、72—112、82—112、92—112、72—101、72—91和72—81,全长及所有片段分别通过酶切、连接,构建了带有dsRed标签的质粒,同时lef-11全长构建了带EGFP融合的质粒。pBiFC-VC155质粒和pBiFC-VN173质粒为安徽蚌埠医学院吕合作教授惠赠,笔者实验室保存,相应的BiFC载体构建方法与荧光载体构建方法相同,所有构建质粒都经测序分析,本研究所用引物见表1。Table 1
表1
表1本试验所用引物
Table 1Primers used in this study
| 引物名称 Primer name | 引物序列 Primer sequence |
|---|---|
| EGFP-Hind III/F | 5′ CCCAAGCTTATGGTGAGCAAGGGCGAGGAGCT 3′ |
| EGFP-Kpn I/F | 5′ GGGGTACCCTTGTACAGCTCGTCCATGCC 3′ |
| DsRed-Hind III/F | 5′ CCCAAGCTTATGGCCTCCTCCGAGAACGTCAT 3′ |
| DsRed-Kpn I/F | 5′ GGGGTACCCAGGAACAGGTGGTGGCGG 3′ |
| LEF11 (2-61)-Not I/R | 5′ ATAAGAATGCGGCCGCCTTGTACAGCTCGTCCAT 3′ |
| LEF11 (12-61)-BamH I/F | 5′ CGCGGATCCATGGTGAGCAAGGGCGAG 3′ |
| LEF11 (22-61)-BamH I/F | 5′ CGGGATCCATACAAGCGCTGTTCAGG 3′ |
| LEF11 (32-61)-BamH I/F | 5′ CGGGATCCACGCTCAAGCACACAATG 3′ |
| LEF11 (42-61)-BamH I/F | 5′ CGGGATCCGTCTGCGCGCACATGTT 3′ |
| LEF11 (52-61)-BamH I/F | 5′ CGGGATCCTTTGAGCGTATAAAAGAATAT 3′ |
| LEF11 (2-51)-Not I/R | 5' ATAAGAATGCGGCCGCCGACACGATGTCCAACATG 3′ |
| LEF11 (2-41)-Not I/R | 5′ ATAAGAATGCGGCCGCGTCTTCTGTATTCATTGTGTGCTTG 3′ |
| LEF11 (62-112)-BamH I/F | 5′ CGGGATCCAATTTAGGCCATTTCACAGTAA 3′ |
| LEF11 (72-112)-BamH I/F | 5′ CGGGATCCAAATGTTCTAAGCGTAAGGTGT 3′ |
| LEF11 (82-112)-BamH I/F | 5′ CGGGATCCCACAAACGAATTGCCAG 3′ |
| LEF11 (72-101)-Not I/R | 5′ ATAAGAATGCGGCCGCCCGCTTGTATTCTTGATG 3′ |
| LEF11 (72-91)-Not I/R | 5′ ATAAGAATGCGGCCGCAATGCCCAACAGCCTGG 3′ |
| LEF11 (72-81)-Not I/R | 5′ ATAAGAATGCGGCCGCATGAAGACACACCTTACGC 3′ |
新窗口打开
1.3 转染
将对数期生长的BmN-SWU1细胞平铺到有盖玻片的24孔板中,每孔按单转0.8 μg质粒、共转各0.5 μg质粒转染,将质粒与2.5 μL转染试剂X-tremeGENE HP DNA Transfection Reagent(Roche)分别加到100 μL的无抗生素TC100培养基中,轻柔混匀,室温孵育30 min后将转染复合物逐滴加入到细胞中,于27℃恒温培养箱中继续培养。1.4 免疫荧光
按照1.3所述方法转染48 h后,用1×PBST轻洗细胞3次,每次5 min。加入4%的多聚甲醛溶液,室温固定15 min,1×PBST同上轻洗。由于本试验所构建质粒均融合荧光蛋白标签,能在激光条件下发出荧光,故可不用进行免疫一抗、二抗处理。最后取出盖玻片在Olympus激光共聚焦扫描显微镜下观察拍照。1.5 荧光双分子互补
BiFC载体构建方法与1.2一致,构建的载体分别命名为pBiFC-VN-LEF-11(aa2—61)、pBiFC-VN- LEF-11(aa12—61)、pBiFC-VN-LEF-11(aa22—61)、pBiFC-VN-LEF-11(aa32—61)、pBiFC-VN-LEF-11(aa42—61)、pBiFC-VN-LEF-11(aa52—61)、pBiFC-VN-LEF-11(aa2—51)和pBiFC-VC-LEF-11;表达产物简写为VN-LEF-11(2—61)、VN-LEF-11(12—61)、VN-LEF-11(22—61)、VN-LEF-11(32—61)、VN-LEF-11(42—61)、VN-LEF-11(52—61)、VN-LEF-11(2—51)、 VN-LEF-11(2—41)以及VC-LEF-11。将相应的VN载体分别与VC载体共同转染到细胞中,转染48 h后,通过共聚焦显微观察是否有黄色荧光激发。转染和免疫荧光按1.3与1.4所述操作。2 结果
2.1 LEF-11蛋白N-端、C-端与LEF-11全长的相互作用
为探究LEF-11相互作用及其关键区域,将只有112个氨基酸残基的LEF-11蛋白分为N-端LEF-11(2—61)和C-端LEF-11(62—112),并与DsRed融合表达,分别与pIZ-LEF-11-EGFP共同转入BmN-SWU1细胞,对照分别为pIZ-DsRed和pIZ-DsRed-LEF11。结果显示各荧光标签融合片段均能够在细胞中正常表达,LEF-11分布于细胞核内。对照组DsRed蛋白弥散分布于细胞质与细胞核,与LEF-11-EGFP没有共定位;LEF-11全长与N-端、C-端分别共定位在细胞质和细胞核,表明两段都含有与全长发生共定位的区域,同时N-端缺失核定位信号,无法定位在细胞核(图1)。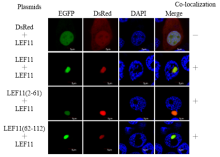 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1LEF-11-EGFP分别与LEF-11蛋白N-端、C-端荧光共定位
-->Fig. 1The fluorescent co-localization of LEF-11-EGFP and C-terminal, N-terminal truncated fragments of LEF-11 protein, respectively
-->
2.2 LEF-11 N-端自身相互作用关键区域
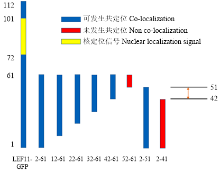
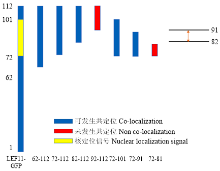
上述试验结果表明LEF-11在N-端具有能与LEF-11全长发生共定位的区域,为找到这个关键区域,将N-端按照每次递减10个氨基酸残基逐步截短,与红色荧光标签DsRed融合,并分别与pIZ-GFP-LEF11共转染BmN-SWU1细胞,在共聚焦显微镜下观察到各个截短片段融合荧光标签后,能在细胞中稳定表达(图2)。2—61、12—61、22—61、32—61、42—61和2—51均能和全长共同定位于细胞质中,52—61和2—41则没有该现象。通过对比发现,没有共定位现象的截短片段缺少42—51区域,弥散分布,说明该区域为N端自我相互作用关键区域(图3)。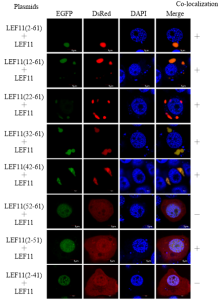 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2LEF-11-EGFP分别与LEF-11 N-端各截短片段荧光共定位
-->Fig. 2The fluorescent co-localization of LEF-11-EGFP and LEF-11 N-terminal truncated fragments
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3N-端截短相互作用示意图
-->Fig. 3The interaction schematic diagram of LEF-11 N-terminal truncated fragments
-->
2.3 LEF-11 C-端自身相互作用关键区域
N-端发生自我相互作用关键区域已经被鉴定,用相同的方法得到C-端截短区段共7个,分别命名为LEF-11(62—112)、LEF-11(72—112)、LEF-11(82—112)、LEF-11(92—112)、LEF-11(72—101)、LEF-11(72—91)和LEF-11(72—81),与DsRed融合后,分别与全长载体pIZ-GFP-LEF11共转染于BmN-SWU1细胞,结果显示各片段均能正常表达,其中能与全长发生共定位的有5个:62—112、72—112、82—112、72—101和72—91,而缺少82—91区域的72—81、92—112却没有发生共聚现象,红色荧光分布整个细胞,呈现弥散状态,说明82—91对于C-端发生自我相互作用极为重要。82—91位于LEF-11核定位信号72—101中,72—91和82—112含有部分核定位信号,共定位在细胞核中,但弥散分布(图4、图5)。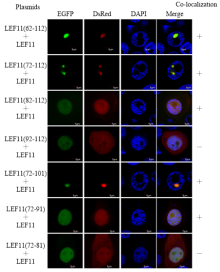 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4LEF-11-EGFP分别与LEF-11 C-端各截短片段荧光共定位
-->Fig. 4The fluorescent co-localization of LEF-11-EGFP and LEF-11 C-terminal truncated fragments
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5C-端截短相互作用示意图
-->Fig. 5The interaction schematic diagram of LEF-11 C-terminal truncated fragments
-->
2.4 BiFC探究LEF-11蛋白N-端自身相互作用关键 区域
为验证LEF-11蛋白共定位现象与自身相互作用关系,采用双分子荧光互补技术(BiFC)对N-端截短各蛋白进行分析,结果如图6所示,LEF-11N-端截短突变体VN-LEF-11(2—61)、VN-LEF-11(12—61)、VN-LEF-11(22—61)、VN-LEF-11(32—61)、VN-LEF-11(42—61)和VN-LEF-11(2—51)均可与VC-LEF-11激发出荧光,VN-LEF-11(52—61)、VN-LEF-11(2—41)与VC-LEF-11则无荧光激发,表明LEF-11N-端截短突变体2—61、12—61、22—61、32—61、42—61、2—51与全长LEF-11可发生相互作用,缺失42—51的2—41、52—61突变体则不能,结果显示N-端截短突变体共定位和相互作用保持一致。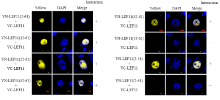 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6LEF-11-GFP分别与LEF-11蛋白N-端截短片段双分子荧光互补
-->Fig. 6The BiFC assays of LEF-11-GFP and LEF-11 N-terminal truncated fragments
-->
3 讨论
本研究主要采用荧光定位和双分子荧光互补技术探究了BmNPV晚期表达因子LEF-11自身相互作用,发现LEF-11蛋白N-端和C-端能够与全长发生共定位,并且通过BiFC试验初步证明,N-端各个截短突变体与LEF-11全长共定位和相互作用是一致的;通过逐步截短,发现了缺少42—51(氨基酸序列:VCAHMLDIVS)和82—91(氨基酸序列:HKRIARLLGI)区域的片段,丧失了与全长发生共定位的能力,说明这两个区域对于LEF-11蛋白自身相互作用具有关键作用。同源比对分析杆状病毒LEF-11的结构域,发现LEF-11自身相互作用关键区域结构域中疏水性氨基酸是非常保守的,先前研究表明一般二聚体结构都是有疏水性氨基酸或二硫键维持,因此笔者认为LEF-11结构域中疏水氨基酸残基对于维持自身相互作用具有关键作用,这些疏水基团的缺失能够使LEF-11丧失了自身相互作用的能力,因而呈弥散分布。对比发现,非自身相互作用关键区域对于LEF-11自身相互作用的稳定也有着重要作用。LEF-11核定位信号在72—101[22],缺失全部或者部分核定位信号的突变体,定位均发生变化,N-端各个突变体缺失全部核定位信号,定位在细胞质中,且不影响自身相互作用;C-端片段中,自身相互作用关键区域为82—91,位于核定位信号中,缺失82—91不仅影响自身相互作用,也影响定位。同时还发现,即使保留82—91,其他区域的缺失对共定位也存在影响,这些区域可能对于自身相互作用的稳定具有一定作用。自身相互作用关键区域结构域和核定位信号是重叠的,根据多聚体功能域疏水性氨基酸和核定位信号分析它们保守氨基酸并不一致,在研究自身相互作用关键区域共定位时,核定位发生变化可能是由于截短突变了核定位信号的缘故。作为杆状病毒极晚期表达因子,LEF-11已被证实对病毒的复制极其重要[22]。相关研究已发现其能够与病毒或宿主关键因子发生相互作用,如LEF-11与细胞核入核受体importin α-3具有相互作用,能够促进其进入细胞核;和IE-1共定位于核内病毒DNA复制位点,可能直接参与了病毒的复制过程;与LEF-3的相互作用,可能是其募集其他因子,对病毒DNA复制进行调控。
杆状病毒LEF-11是一个小分子蛋白,很容易发生多聚化,很多细胞蛋白都会发生多聚化现象,从单体前体到多聚化是蛋白功能特征的进化,也是蛋白质行使不同作用的重要形式[23]。因此很多DNA病毒包括HSV、WSSV和杆状病毒编码多聚化蛋白,并且这些多聚化在病毒复制增殖中都具有很重要的作用。目前研究表明很多杆状病毒蛋白,如IE-1、IE-2、LEF-3、LEF-5、DBP、CG30和HA44都能多聚化,对病毒DNA复制是必要的。另外,AcMNPV LEF-3能够自身发生相互作用形成同源二聚体,在AcMNPV扩散过程中,调控病毒DNA复制所必需[24-25]。LEF-11具有两个独立的自我相互作用位点,可能直接影响其寡聚化,进而影响病毒DNA复制。同时,LEF-11具有核定位信号(NLS),这为其进核及定位在相关位置提供了极为有利的条件,荧光定位显示,LEF-11在缺失核定位信号后,在核内外均有分布。相关试验证明LEF-11和病毒复制中心IE1及宿主DNA复制中心BrdU能够共定位到一起,这不仅说明了LEF-11自身相互作用,同时共定位在核内也是其行使功能不可缺少的条件。
本研究表明LEF-11拥有两个自身相互作用功能域,并且自身相互作用不仅在细胞质中,也发生在细胞核,结合其定位在核内DNA复制关键区域,笔者推测LEF-11的两个相互作用位点能够保证其在胞质合成后寡聚化,说明LEF-11在胞质中具有相应功能,寡聚化可能就是在胞质中行使这个功能所必要的形式,考虑到LEF-11影响DNA复制的功能需要在细胞核中完成,且具有核定位信号,推测LEF-11在胞质中自我相互作用形成寡聚体,同时募集相关物质,在核定位信号和入核受体的作用下进入细胞核,进而影响病毒DNA复制。杆状病毒LEF-11蛋白在病毒复制过程中是必要的,在病毒感染过程中LEF-11同样存在多聚体。这些结果为以后研究LEF-11调控病毒复制以及病毒和宿主相互作用提供了理论依据,为家蚕抗病毒研究提供了基础数据。
有趣的是,具有核定位信号蛋白的相互作用共定位的区域往往因为核定位序列的缺失或突变而改变,这可能是由于蛋白相互作用后被一同转运。笔者已经利用这项技术,探究了一些蛋白之间的相互作用,通过荧光定位,更加直观地了解蛋白质之间的相互关系,为胞内大分子相互作用研究提供了一个新的方法,但其进核机制及其调控过程仍不清晰,还需要更深入地研究。
本研究揭示了杆状病毒晚期表达因子LEF-11能够发生自身相互作用,并且通过一系列截短试验,找到了其在N-端和C-端具有的两个相互作用关键区域。结合相关研究,笔者推测LEF-11在胞质合成后,通过自身相互作用形成寡聚体,募集其他因子,可能在入核受体蛋白importin α-3的作用下进入细胞核,利用自身核定位序列定位于相关区域,并且和LEF-3等蛋白相互作用[20],进而形成一个复合体结构,直接调控病毒DNA合成。当然,这个假设仍有很多问题没有被阐明,如LEF-11寡聚体是否募集了其他因子,这些因子对于病毒感染过程又有什么作用,LEF11-11入核机制和调控病毒DNA复制的模式又是什么,相关问题的研究也是正在探索的方向。
4 结论
通过免疫荧光和双分子荧光互补技术,鉴定了家蚕核型多角体病毒晚期表达蛋白LEF-11 N-端和C-端均具有独立的相互作用区域,同时通过截短确定42—51和82—91为其相互作用关键区域。The authors have declared that no competing interests exist.
