0 引言
【研究意义】苦荞又称鞑靼荞麦(Fagopyrum tataricum),系蓼科荞麦属一年生的双子叶杂粮作物。苦荞是典型的药食同源作物,其籽粒含有的特殊的黄酮类化合物——芦丁(rutin),具有较高的抗氧化活性,有抗癌作用,且可有效降低高血压和高血脂的风险[1-2]。苦荞籽粒中芦丁含量高达2%,其叶、花和茎也均有较高含量芦丁存在[3]。当前,从植物中提取有效的天然药用化合物来代替化学合成的药用化合物或直接供人们食用,从而降低化学合成药物对人体的副作用,已在一些专家****中达到共识。因此,培育高芦丁含量苦荞品种(系)作为天然药用化合物提取的资源库或直接提供给特殊人群食用作为专性功能食品,已成为苦荞育种的一个重要方向。MYB类转录因子在调控植物次生代谢中起到重要的作用,其家族成员庞大(如拟南芥中有196个,白菜中有256个),每个成员担负着调控不同生物代谢过程的功能[4-5]。目前,调控苦荞黄酮醇类化合物的MYB转录因子研究报道较少,因此分离鉴定调控苦荞芦丁生物合成的MYB转录因子,对进一步阐明苦荞植株中芦丁生物合成的分子机制具有重要意义[6]。【前人研究进展】拟南芥中共有125个具有R2R3结构域的MYB转录因子,已证实这些转录因子参与多种生物功能,聚类分析表明这些转录因子被分为25类(S1—S25)。其中AtMYB11、AtMYB12和AtMYB111归为S7类,分别调控不同组织内黄酮类化合物的生物合成,因此,这类基因也称为PFG1-3(production of flavonol glycosides)[7-9]。在柑橘全基因组分析中,获得101个R2R3 MYB转录因子,已被证实参与生长发育调节、非生物胁迫及植物激素响应的过程[10];CZEMMEL等[11]也证实VvMYBF1直接调控葡萄果实黄酮醇的合成。芦丁生物合成途径已经研究较为清楚,参考KEGG(Kyoto Encyclopedia of Genes and Genomes)代谢途径数据库中关于黄酮和黄酮醇类生物合成途径图谱,芦丁生物合成途径中的关键酶包括苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、肉桂酸-4-羟化酶(cinnamate-4- hydroxylase,C4H)、4-香豆酸辅酶A连接酶(4- coumarate coenzyme A ligase,4CL)、查耳酮合成酶(chalcone synthase,CHS)、查耳酮异构酶(chalcone isomerase,CHI)、黄酮醇-3-脱氢酶(flavonol-3- dehydrogenase,F3H)、黄酮醇合成酶(flavonol synthetase,FLS)和黄酮糖基转移酶(UDP-glucoronosyl/UDP- glucosyl transferase,UFGT)。先前从苦荞叶片和花cDNA中克隆到芦丁合成途径中5个关键酶基因Ft4CL、FtCHS、FtF3H、FtFLS-like和FtUFGT[12]。植物中CHS(EC 2.3.1.74)是黄酮类生物合成的第一个关键酶,也是整个合成过程中的第一步限速酶,直接影响下游次生代谢产物的产量[13-14];而4CL(EC 6.2.1.12)是植物苯丙烷类代谢途径转向黄酮类物质代谢的关键酶之一,也是该途径的限速酶[15];F3H(EC1.14.11.9)是黄酮类合成途径分支点的一个核心酶,可将柚皮素转化为二氢黄酮醇,而二氢黄酮醇是黄酮和异黄酮化合物合成的重要底物,因此该酶是类黄酮合成途径上的一个关键中枢,直接影响下游类黄酮产物的合成[16];FLS(EC1.14.11.23)是黄酮醇类化合物合成途径中最重要的下游关键酶基因,同时也是花青素和芦丁合成的一个分支[12,17];UFGT(EC 2.4.1.115)是芦丁合成途径中的最后一步关键酶,其功能为糖基化槲皮素,从而最终转化为芦丁化合物[18]。荞麦中黄酮醇合成途径关键酶基因的表达模式已有相关研究报道,赵海霞等[19]报道了种子不同萌发时间下,苦荞芽期总黄酮含量与2个MYB转录因子的相对表达量呈显著相关,同时黄酮醇合成途径中3个关键酶CHI、PAL和FLS相对表达量也呈显著正相关;GUPTA等[20]报道了苦荞不同生育阶段,PAL、CHS、CHI和FLS表达量与芦丁含量也呈现正相关。以上研究一定程度上揭示了苦荞植株体内芦丁含量的积聚与芦丁生物途径关键酶基因的表达具有正相关性,同时受到MYB转录因子的调控。但针对整个生长周期中苦荞植株中芦丁合成的变化趋势与相关基因的表达是否相关,目前仍需进一步探索研究。最新的研究表明,8个苦荞MYB转录因子受到ABA、NaCl、PEG等不同非生物胁迫的诱导表达,可能在苦荞次生代谢物合成中起到重要的调控作用[21]。【本研究切入点】前人已报道的苦荞MYB转录因子大多与非生物胁迫和花青素代谢调控相关,而与苦荞不同组织中关键黄酮类物质-芦丁代谢调控相关的MYB转录因子研究报道较少。【拟解决的关键问题】通过研究苦荞全生育期不同组织中芦丁含量变化趋势是否与其生物合成途径中5个关键酶基因和2个MYB转录因子表达水平相关性,以期明确2个MYB基因调控芦丁生物合成途径关键酶基因组织特异表达特征。1 材料与方法
1.1 供试植物材料
自繁的高代纯系九江苦荞种子,2015年6月种植于山西农业大学农学院实验站。按苦荞生长时期进行取材,命名为S1—S8。具体取材时期即部位如下:S1为萌发期,即种子播种后6 d萌发的幼苗整株取材;S2为子叶期,即播种10 d后,子叶完全展开,整株取材;S3为真叶期,即播种15 d后,第一片真叶展开,取第一片真叶;S4为盛叶期,即播种35 d后,叶片大量生长,取顶端完全展开叶;S5为现蕾期,即生长45 d后,取第一批出现的幼嫩花蕾;S6为盛花期,即生长55 d后,大量花朵出现,受精的花蕾出现籽粒形态,取受精后花蕾;S7为灌浆期,即生长65 d后,大量的籽粒形成,取幼嫩籽粒;S8为成熟期,籽粒颜色由绿转灰黑,生产上为可采收阶段,取健康饱满籽粒。1.2 总RNA提取及基因克隆
取0.1 g上述苦荞不同生育期不同组织放入预冷的研钵中,液氮研磨成粉末状,使用植物RNA试剂盒提取各组织中RNA(天恩泽基因有限公司,北京),DNase I(宝生物大连有限公司)消化处理1 µg总RNA,微量高精度紫外分光光度计(NanoDrop 2000,美国)检测总RNA浓度及纯度,1.5%琼脂糖凝胶电泳检测总RNA完整度。cDNA第一链合成采用总反应体系10 µL,其中1 µg总RNA(1 µL·µg-1)、5 µL 2×PrimeScript RT Master Mix(包含10 mmol·L-1 dNTP mixture、50 µmol·L-1 Oligo dT primer和200 U PrimeScript RTase),4 µL RNase-free超纯水补足体系。试剂购于宝生物(大连)有限公司。反转录PCR程序为37℃ 15 min;85℃ 5 s。根据苦荞转录组测序数据(未发表),设计FtMYB7和FtMYB9完整CDS区克隆引物(引物名称及序列见表1),采用RT-PCR方法从苦荞叶片cDNA文库中克隆其序列,RT-PCR反应程序为95℃ 5 min;95℃ 30 s,55℃ 45 s,72℃ 90 s,30个循环;72℃ 5 min。样品测序由华大基因(北京)完成。1.3 基因的结构域及系统进化分析
采用T-Coffee Multiple Sequence Alignment Server(http://tcoffee.vital-it.ch/apps/tcoffee/index.html)在线分析工具[22],分析FtMYB7(GenBank登录号:KM588379)、FtMYB9(KM588380)、AtMYB11(NP191820)、AtMYB111(NP199744)和AtMYB12(NP182268)的保守结构域。下载NCBI数据库(https://www.ncbi.nlm.nih.gov)中已公布的17个苦荞MYB转录因子序列和本试验提交的2个序列,以及AtMYB11、AtMYB111和AtMYB12为外类群,共22个氨基酸序列,利用MEGA 6.0软件,采用邻近法(neighbor-joining,NJ)构建系统进化树。1.4 基因表达分析
设计Ft4CL(GenBank登录号:KM362863)、FtCHS(KJ139980)、FtF3H(HM587134)、FtFLS-like(GU388434)、FtUFGT(未提交)、FtMYB7和FtMYB9引物(表1),以九江苦荞的根、茎、叶、花、幼胚cDNA第一链为模板进行qRT-PCR分析,每个样品设置3个生物重复,3个技术重复。荧光定量PCR总反应体系10 µL,包含5 µL 2×SYBR Premix Ex Taq II、1 µL 50 ng·µL-1 cDNA模板、上下游引物各0.5 µL和3 µL RNase-free H2O。扩增程序为95℃ 30 s;95℃ 5 s,58℃ 30 s,40个循环。以内参基因FtHis(JF769134)的Ct值作为对照,采用2-ΔΔCt法计算基因相对表达量[12]。所用荧光定量试剂购置于宝生物(大连)有限公司。Table 1
表1
表1试验所用引物序列
Table 1The primer sequences
| 引物名称 Primer name | 序列 Sequence (5′-3′) |
|---|---|
| FtMYB7 | F: ATGGGAAGACCTCCTTGCTGT R: GCGGCGGTACTAGACAAGATT |
| FtMYB9 | F: ATGGGAAGGGCTCCTTGTT R: TCAGATGACAAAGACTCAG |
| FtCHS-Q | F: GCCGACTACCCCGACTACTAC R: TGAGGATCTCCTCGGTTAGGT |
| FtF3H-Q | F: TAGAGGCACCAATCACCTTTG R: CTTTGCCTTGTCGAGATTCTG |
| Ft4CL-Q | F: GTGAGGTTCCTGTGGCATTT R: TTGCGTGAACGAAGTACACC |
| FtFLS-Q | F: CAAGACTCCGAAGTGGAAGC R: TCCCGTTGCTCATAATCTCC |
| FtUFGT-Q | F: GGTTTTCAACCACGCATATG R: GCCTCTAACTAAGCAGCACAA |
| FtMYB7-Q | F: TGTCACAGCAAGGAGGTCTTC R: TTGCTAGGCTGTCCAAAGTGA |
| FtMYB9-Q | F: TTGCTGAGTCTTTGCTCATCTG R: AGGAAACCATCCAAATCAAAGC |
| FtHis-Q | F: ATTCCAGAGGCTTGTTCGTG R: CATAATGGTGACACGCTTGG |
新窗口打开
1.5 芦丁含量测定
高效液相色谱法检测苦荞不同生长时期试验材料的芦丁含量,具体测定方法参考郭彬等[3]方法。所有测定样品均设置3次生物学重复。1.6 相关性及热图聚类分析
统计上述基因表达值和芦丁含量数据,基于SPSS软件,采用Pearson相关性分析方法,考察8个生长时期7个基因表达值与芦丁含量变化之间的线性相关性,假设t检验值设置P<0.05。使用R语言软件,将上述表达值和芦丁含量值标准化处理后,转化为矩阵,采用欧式距离法绘制层次聚类热图。2 结果
2.1 基因序列特征分析
克隆获得FtMYB7完整CDS序列,其中包含876 bp核苷酸,编码291个氨基酸残基;FtMYB9完整CDS序列,包含912 bp核苷酸,编码303氨基酸。保守结构域(motif)分析表明FtMYB7和FtMYB9与苦荞所提交的其他MYB基因,以及AtMYB11、AtMYB12和AtMYB111的蛋白序列中都含保守R2和R3重复基序结构域,结构域中高度保守的色氨酸(W)残基,代表着DNA结合域的关键位点(图1)。氨基酸序列同源性分析表明,FtMYB7与其他苦荞MYB转录因子氨基酸同源性范围为41%—65%,FtMYB9与其他苦荞MYB转录因子氨基酸同源性范围为42%—71%。系统进化树分析,共获得6个亚类(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ)。其中,第Ⅰ类(FtMYB7、FtMYB10、FtMYB11、FtMYB13和FtMYB21)和第Ⅲ类(FtMYB3和FtMYB17),这些转录因子均与植物非生物胁迫相关;FtMYB9、FtMYB22、2个FtMYB1以及2个FtMYB2聚为一类,这些基因与苯丙烷类代谢调控相关(Ⅴ类);拟南芥AtMYB11、AtMYB12和AtMYB111聚为第Ⅵ类,已证实调控黄酮醇代谢;克隆获得的FtMYB9与FtMYB-like、金荞麦FcMYB-like等序列聚为Ⅳ类,而FtMYB7单独为聚为第Ⅱ类(图2),以上结果表明获得2个新苦荞MYB转录因子。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1FtMYB7和FtMYB9转录因子CDS结构域分析阴影部分表示R2R3结构域中保守的色氨酸(W),*表示高度保守氨基酸
-->Fig. 1Conservative structure domain analysis of FtMYB7 and FtMYB9 Shadows represent the highly conserved tryptophan in R2R3 structure. Other conserved amino acids are labelled with asterisks
-->
2.2 苦荞FtMYB7和FtMYB9表达模式
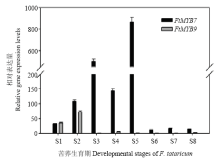
FtMYB7和FtMYB9相对表达量在整个生育期存在明显差异(图3)。FtMYB7相对表达量呈现先升高后下降趋势;在S1—S3时期,基因表达量逐步升高,S4时期(盛叶期)表达量略有下降,而到了S5时期(现蕾期),该基因相对表达量达到最高值(高达867倍),说明FtMYB7花蕾中的表达量最高;随后在花、未成熟籽粒和成熟籽粒中表达量较低。在苦荞生育期的S1和S2时期(萌发期和子叶期),FtMYB9相对表达量较高(达到34和72倍),而其他生育期基因表达量较低,说明该基因在叶中的表达量高于其他组织。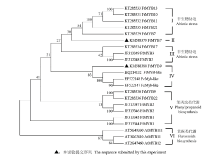 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2苦荞FtMYB7和FtMYB9系统进化树分析
-->Fig. 2The phylogenetic tree of FtMYB7 and FtMYB9 and other MYBs from F. tataricum
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3苦荞全生育期期FtMYB7和FtMYB9相对表达量分析
-->Fig. 3FtMYB7 and FtMYB9 expression levels in 8 developmental stages of F. tataricum
-->
2.3 芦丁含量与基因表达相关性分析
利用高效液相色谱法(HPLC)测定苦荞8个生长时期组织中芦丁含量,结果表明在真叶和花蕾中芦丁含量最高,分别为7.39和12.95 mg·g-1 DW;而在萌发期植株,子叶和盛花组织中芦丁含量较低,分别为2.56、1.46和1.98 mg·g-1 DW;在S8时期,即成熟籽粒中,芦丁含量达到6.77 mg·g-1 DW(图4)。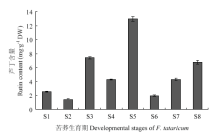 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4九江苦荞全生育期芦丁含量
-->Fig. 4Rutin content in Jiujian variety
-->
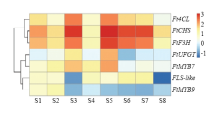
芦丁生物合成途径5个关键酶基因、FtMYB7和FtMYB9表达值相关性分析见表2,FtUFGT、Ft4CL、FtCHS、FtF3H和FtMYB7的表达值与芦丁含量变化显著正相关(相关系数分别为0.890、0.748、0.683、0.704和0.862),而FtFLS-like和FtMYB9表达值与芦丁含量变化显著负相关(相关系数分别为-0.442和-0.501)。基因相对表达量层次聚类分析表明,在苦荞全生育期,Ft4CL、FtCHS和FtF3H表达模式相近聚为一类;而FtUFGT、FtMYB7、FtFLS-like和FtMYB9的表达趋势相近划分为另一类。除FtFLS- like和FtMYB9之外,其余基因在S3和S5期相对表达值均高于其他时期,即在真叶和花蕾中表达量最高(图5)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5苦荞芦丁合成途径相关基因表达量热图
-->Fig. 5Heatmap for correlated with rutin content and gene expression in F. tataricum
-->
Table 2
表2
表2芦丁生物合成途径相关基因表达量与芦丁含量相关性分析
Table 2Correlation analysis of rutin content and rutin-related gene expression
| 基因 Gene | FtUFGT | FtFLS | Ft4CL | FtCHS | FtF3H | FtMYB7 | FtMYB9 | 芦丁含量 Rutin content |
|---|---|---|---|---|---|---|---|---|
| FtUFGT | 1 | -0.316 | 0.803 | 0.792 | 0.863 | 0.959 | -0.243 | 0.890 |
| FtFLS | -0.316 | 1 | -0.346 | 0.112 | 0.136 | -0.427 | -0.194 | -0.442 |
| Ft4CL | 0.803 | -0.346 | 1 | 0.858 | 0.768 | 0.892 | -0.352 | 0.748 |
| FtCHS | 0.792 | 0.112 | 0.858 | 1 | 0.962 | 0.771 | -0.475 | 0.683 |
| FtF3H | 0.863 | 0.136 | 0.768 | 0.962 | 1 | 0.784 | -0.407 | 0.704 |
| FtMYB7 | 0.959 | -0.427 | 0.892 | 0.771 | 0.784 | 1 | -0.203 | 0.862 |
| FtMYB9 | -0.243 | -0.194 | -0.352 | -0.475 | -0.407 | -0.203 | 1 | -0.501 |
| 芦丁含量 Rutin content | 0.890 | -0.442 | 0.748 | 0.683 | 0.704 | 0.862 | -0.501 | 1 |
新窗口打开
3 讨论
苦荞属于小杂粮作物,芦丁作为苦荞中特有的黄酮醇衍生物,其生物合成途径属于植物体内苯丙烷代谢途径下游分支途径之一[23]。尽管该生物合成途径上关键酶基因的研究已在许多植物中有报道[24-25],但由于苦荞以及近缘物种基因组序列信息的缺乏,导致获得这些关键酶基因的序列仍然比较困难。对于芦丁代谢的分子调控机理还有待于进一步深入研究,目前研究较多的转录因子集中在MYB和WD40两类[26-27]。本研究通过二代测序技术获得苦荞叶片转录组数据,根据原始Reads序列拼接去冗余,获得109个MYB转录因子基因序列,采用RT-PCR法获得2个MYB基因的完整CDS序列,暂命名为FtMYB7和FtMYB9。结合先前克隆到芦丁生物合成途径的5个关键酶基因,试图探讨苦荞全生育期芦丁含量变化与这些基因表达之间的关系。GUPTA等[20]研究表明,苦荞发育阶段芦丁含量动态变化与芦丁生物合成途径上游的PAL、CHS、CHI和FLS表达量呈正相关。同样,本研究也发现全生育期中苦荞植株芦丁合成积累的动态变化与芦丁生物合成途径上游的3个关键酶基因(Ft4CL、FtCHS和FtF3H)表达呈正相关。与前者不同的是本研究中克隆到的FtFLS-like表达在真叶和成熟籽粒中降低,而在其他组织中都表现较高的表达趋势,且与芦丁含量的动态变化呈负相关。这可能是因为本研究中的FtFLS-like与前人克隆到FLS为同一基因家族中基因功能发生了分化,负责苦荞植株不同生长时期的芦丁生物合成功能[12]。同时,芦丁合成途径最后一步关键酶UFGT和MYB7表达与芦丁含量动态变化也呈正相关,同样有2个表达量最高的时期,分别是在S3和S5期,即真叶期和现蕾期。而MYB9与其他基因的表达模式具有明显差异,仅在S1和S2期(幼苗期)表达上调。上述结果表明,MYB7和MYB9可能负责调控苦荞不同生长时期的芦丁合成。综上所述,除MYB9以外,其他5个关键酶基因和MYB7均在真叶期和现蕾期有表达峰值。而真叶期为种子萌发转到营养生长期,现蕾期为营养生长转向生殖生长期。这2个时期均属于苦荞生长发育的转折时期,此时芦丁含量增加以及合成途径上关键酶基因上调表达可能是由于植株叶形态和花形态建成过程中受到体内激素极性运输和调节,导致黄酮类物质大量合成。而最近的研究也表明,拟南芥中WRKY23转录因子调节黄酮醇类物质的合成反馈抑制根部生长素的转运最终调控根发育形成[28]。拟南芥中AtMYB11、AtMYB12和AtMYB111负责调控幼苗和成株期中黄酮醇类衍生物合成类型和合成途径关键酶基因的表达[29]。前人研究表明FtMYB1和FtMYB2参与调控原花青素(PAs);FtMYB9和FtMYB22调控苦荞对盐胁迫响应[30]。本研究所克隆的FtMYB9与前人克隆的FtMYB-like聚为一类,这类基因并没有明确的功能划分,推测FtMYB9可能负责调控花青素或者非生物胁迫响应的下游基因,也间接解释了该基因与全生育期苦荞芦丁合成呈负相关性的结果。MYB转录因子调控苦荞黄酮醇合成关键酶基因表达及芦丁合成不同生长时期和组织部位的分子机制仍比较复杂,尚需进一步深入研究。4 结论
揭示了2个MYB类转录因子基因FtMYB7和FtMYB9序列具有保守的R2R3结构域特征,明显区别于前人所克隆到的苦荞MYB基因。这2个基因可能与黄酮类代谢功能相关。不同组织中FtMYB7和FtMYB9表达量与芦丁含量存在明显相关性,推测其可能调控不同生育时期芦丁合成。The authors have declared that no competing interests exist.
