0 引言
【研究意义】由大豆疫霉菌(Phytophthora sojae)侵染引起的大豆疫霉根腐病是世界范围内的土传性病害,严重影响大豆的产量和质量。植物激素乙烯能够响应植物的生物胁迫,对植物的抗病过程发挥作用。因此,挖掘乙烯信号通路中对大豆疫霉根腐病抗性起作用的关键基因,明确其作用机制,对于大豆抗病分子育种意义重大。【前人研究进展】乙烯是植物体内一类十分重要的气体激素,参与植物的生长发育和多个生理过程,如果实成熟、衰老、种子萌发,以及病原菌侵染和胁迫反应等[1]。由乙烯介导的调控过程通过乙烯的生物合成与信号转导两个水平实现。乙烯的生物合成是由Yang cycle来完成的。乙烯的信号转导由乙烯受体及下游一系列调控因子来调控[2]。在拟南芥中,乙烯的感知是通过位于内质网上与膜相结合的乙烯受体来实现的,这些乙烯受体在信号转导过程中起负向调控作用,并且在功能上冗余,其双、三和四突变体都会造成植物体对乙烯的持续性响应[3]。组成型三重反应(CONSTITUTIVE TRIPLE RESPONSE1)基因作为乙烯信号通路中一个负调控因子参与植物的乙烯信号响应和传递。CTR1蛋白与乙烯受体蛋白互作共同负向调控植物乙烯反应。在没有乙烯存在时,拟南芥(Arabidopsis thaliana)的5个乙烯受体协同作用激活CTR1,阻碍乙烯的传递,使植物表现出乙烯响应不敏感;当存在乙烯时,受体通过与乙烯相结合来阻碍CTR1的激活,从而启动下游的乙烯信号传递[4]。CTR1编码的是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应上游MAPKKK家族中Raf亚家族的一个丝氨酸/苏氨酸蛋白激酶,它对于乙烯信号途径受体下游组分的激活和信号传递具有十分关键的作用。在拟南芥中筛选鉴定到了ctr1突变体,它在幼苗期和成熟植株中均表现出持续的乙烯响应,这表明CTR1编码了一个负调控乙烯信号途径的蛋白质[1]。迄今为止,已对较多植物的CTR1进行克隆并进行功能研究。在拟南芥中CTR1是单拷贝的,AtCTR1通过磷酸化过程负调控所有乙烯受体的信号转导[3]。番茄(Solanum lycopersicum)的CTR由多基因家族构成,包含了4个CTR——LeCTR1、LeCTR2、LeCTR3和LeCTR4,它们参与不同的组织发育和生理过程。LeCTR1长度是AtCTR1的2倍,二者的基因结构高度保守,外显子和内含子数目完全一致。在拟南芥ctr1-1突变体中超量表达LeCTR1能恢复正常的乙烯信号传递,表明LeCTR1与AtCTR1功能上具有保守性。此外,LeCTR1能被乙烯诱导而上调表达,并且受果实成熟的诱导[5]。LeCTR2与AtCTR1、AtEDR1同源性较高,在植物生长过程中持续表达而不被乙烯诱导。蛋白互作试验发现LeCTR2与Ⅰ类乙烯受体LeETR1、LeETR2特异性互作。在番茄植株中过表达LeCTR2的N端结构会改变植株的生长特性,影响乙烯响应基因E4、Chitinase B的表达,但不会影响到乙烯的合成。同时,过表达LeCTR2的番茄对灰霉病的感病性增强[6-7];LeCTR3和LeCTR4在叶片中的表达量高于果实,也不受乙烯的诱导表达[8]。利用VIGS技术得到的烟草(Nicotiana tabacum)CTR1沉默植株,在烟草花叶病毒侵染后表现出更强烈的过敏反应,受乙烯诱导的几丁质酶CHIB表达显著上调。与正常烟草相比,受侵染部位病原菌的扩展受到明显抑制。说明烟草植株持续的乙烯响应对于病原菌侵染后的过敏反应(hypersensitive response,HR)具有促进作用[9]。研究发现,CTR1在非生物胁迫和器官发育过程中也发挥重要作用。从小麦(Triticum aestivum)中克隆得到的TaCTR1表达受干旱、盐胁迫和ABA处理的诱导,在烟草中过量表达小麦TaCTR1会造成植株耐盐性明显下降,表明TaCTR1负调控植物耐盐信号转导途径[10]。木瓜的CpCTR1-4介导的乙烯信号传递参与果实的成熟和软化过程。果实成熟后期CpCTR表达上调,而植物生长调节剂1-甲基环丙烯处理后,基因表达水平降低且果实的软化程度减弱。这表明CpCTR在木瓜的成熟过程中起作用[11]。此外,一系列文献报导了黄瓜[2]、西葫芦[12]、月季[13]、猕猴桃[14]、苹果[15]和梨[16]等植物中CTR1的功能,这些CTR1参与植物的花器官分化、发育和果实成熟等生理过程。【本研究切入点】大量的研究表明,CTR1在植物的生长、果实成熟以及逆境胁迫过程中发挥重要的负调控作用。但目前对于CTR1在大豆的生长和生理过程中的作用研究有限,特别是对大豆抗病过程的影响更是所知甚少。因此,探究大豆CTR1在大豆疫霉根腐病抗性过程中所起的作用,进一步明确其抗病机制和信号传递过程,对于大豆抗病分子育种意义重大。【拟解决的关键问题】利用同源克隆的方法从栽培大豆中克隆得到GmCTR1的CDS全长序列,通过GmCTR1的序列比对、系统进化分析和大豆疫霉菌诱导表达分析,应用发根农杆菌介导的遗传转化方法获得大豆发状根,对过表达GmCTR1阳性发状根的抗病性分析开展GmCTR1功能研究,为进一步探究大豆与疫霉菌互作过程的作用机理提供理论依据。1 材料与方法
试验于2015—2016年在南京农业大学农学院完成。1.1 试验材料与处理方法
供试大豆品种Williams 82和Williams由南京农业大学国家大豆改良中心提供。试验所需大豆疫霉菌株P6497由南京农业大学植物保护学院王源超教授提供。植物表达载体pBinGFP2由植物保护学院窦道龙教授提供。发根农杆菌菌株K599由南京农业大学农学院邢邯教授实验室保存。挑选籽粒饱满的大豆Williams 82种子播种于混有蛭石和营养土的塑料杯中,每杯8粒,置于25℃,相对湿度60%,16 h/8 h光周期条件的光照培养箱中培养。待幼苗生长至两片真叶完全展开后,取嫩叶液氮速冻保存用于目的基因的克隆。
将籽粒饱满无病斑的大豆Williams种子在与上述相同条件下培养至两片真叶完全展开后将大豆幼苗拔出并清洗根部蛭石,注意保存植株完整。将V8培养基上暗培养7 d的大豆疫霉菌用注射器吸打成匀浆,用手术刀在大豆根部划出1 cm长的伤口后接种适量疫霉菌,在接种后0、12、24、36、48和72 h后取伤口上下2 cm长的根部组织,用液氮速冻保存于-80℃冰箱备用。
1.2 基因克隆与序列分析
利用植物总RNA提取试剂盒(TIANGEN)提取大豆Williams 82叶片的总RNA,用反转录试剂盒(TaKaRa)进行反转录获得cDNA。以拟南芥AtCTR1(AT5G03730)基因序列为探针在大豆基因组数据库(http://www.phytozome.net)中进行BLAST搜索,选择同源性最高的基因命名为GmCTR1。利用高保真酶(Vazyme)PCR扩增目的片段后切胶回收,胶回收试剂盒(AxyGen)回收扩增产物,连接至pEASY-Blunt(TransGen)克隆载体后转化大肠杆菌感受态DH5α(TransGen),挑选阳性克隆菌液送至南京金斯瑞生物科技有限公司测序。测序结果用BioXM2.6软件进行分析;利用在线软件ExPASy (http://cn.expasy.org/tools/pi_tool.html)分析蛋白质的物理和化学性质;利用NCBI的CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/ docs/cdd_search.html)程序分析氨基酸序列;利用DNAMAN程序进行多重序列比对;利用MEGA 6程序构建系统进化树;利用Primer Premier 5设计特异性引物GmCTR1-1-F/R(表1)。
Table 1
表1
表1试验所用引物序列
Table 1Primers used in this study
| 引物名称 Primer name | 引物序列 Sequence of primer (5'-3') | 引物用途 Function of primer |
|---|---|---|
| GmCTR1-1-F | GGCGAGTTTTAGGGTT | GmCTR1克隆 Cloning of GmCTR1 |
| GmCTR1-1-R | AGCAACTTGGCGTTC | GmCTR1克隆 Cloning of GmCTR1 |
| GmCTR1-2-F | TCCCCCGGGGGCGAGTTTTAGGGTT | GmCTR1克隆 Cloning of GmCTR1 |
| GmCTR1-2-R | GCTCTAGAAGCAACTTGGCGTTC | GmCTR1克隆 Cloning of GmCTR1 |
| GmCTR1-3-F | ATACCAACCCCATTAGCACT | GmCTR1实时荧光定量 qRT-PCR of GmCTR1 |
| GmCTR1-3-R | TCCAAAAGAACCTGACCCTA | GmCTR1实时荧光定量 qRT-PCR of GmCTR1 |
| PsTEF1-F | TGATCGTGCTGAACCACCC | PsTEF1实时荧光定量 qRT-PCR of PsTEF1 |
| PsTEF1-R | CGAGCGACGGTCCATCTT | PsTEF1实时荧光定量 qRT-PCR of PsTEF1 |
| GmBGL2-F | ATGACAACCTCCAAAACC | GmBGL实时荧光定量 qRT-PCR of GmBGL |
| GmBGL2-R | CCAAGACCAGCATTAGAAA | GmBGL实时荧光定量 qRT-PCR of GmBGL |
| GmNPR1-F | GCCTCAAGGTGGTGTT | GmNPR1实时荧光定量 qRT-PCR of GmNPR1 |
| GmNPR1-R | TCTAGTAGATGTCCAGCATT | GmNPR1实时荧光定量 qRT-PCR of GmNPR1 |
| GmPR5-F | AACGGCAACAAGGAC | GmPR5实时荧光定量 qRT-PCR of GmPR5 |
| GmPR5-R | TTCAACGCCAAGCAC | GmPR5实时荧光定量 qRT-PCR of GmPR5 |
| GmPR10-F | AACATCTTCTCACAACAGCATCAC | GmPR10实时荧光定量 qRT-PCR of GmPR10 |
| GmPR10-R | AGGCACAGCAGCAGGGGTAT | GmPR10实时荧光定量 qRT-PCR of GmPR10 |
| pBinGFP2-F | AAGACCCCAACGAGAAGC | pBinGFP2载体引物 Primer of vector |
| pBinGFP2-R | GAACCCTAATTCCCTTATCTG | pBinGFP2载体引物 Primer of vector |
| GmACT11-F | GGTGGTTCTATCTTGGCATC | 实时荧光定量内参 Reference gene in qRT-PCR |
| GmACT11-R | CTTTCGCTTCAATAACCCTA | 实时荧光定量内参 Reference gene in qRT-PCR |
新窗口打开
1.3 植物表达载体的构建
以测序正确的质粒pEASY-GmCTR1为模板,添加酶切位点的特异性引物GmCTR1-2-F/R(表1),利用高保真酶进行PCR扩增。1%琼脂糖凝胶电泳后回收扩增的目的片段。将目的片段与植物表达载体pBinGFP2分别用限制性内切酶SmaⅠ和XbaⅠ双酶切后,连接、转化大肠杆菌DH5α,提取质粒后用pBinGFP2-F和GmCTR1-2-R引物进行PCR筛选阳性克隆,测序验证得到重组质粒。1.4 农杆菌介导的大豆发状根转化与筛选
利用电击法将重组质粒和空载体质粒分别转入发根农杆菌K599。挑取K599的阳性克隆,置于含有卡那霉素(浓度为50 μg·mL-1)的液体LB培养基中,28℃振荡培养24 h,4 000 r/min离心3 min收集菌体,用10 mmol·L-1 MgCl2重悬菌体,并稀释至OD600=0.6备用。挑选籽粒饱满表面无病斑创伤的Williams种子用氯气消毒,灭菌ddH2O浸泡24 h后去种皮种植于含有7%琼脂培养基的组培瓶中,置于25℃,16 h/8 h光周期条件的培养室生长5 d。在超净台中剪下生长良好的大豆子叶,用无菌手术刀在每个子叶背面挖洞,然后平铺于含有头孢和羧苄霉素(浓度均为200 μg·mL-1)的White培养基中,将稀释好的K599菌液滴入挖好的洞内,25℃暗培养20 d。利用体视镜进行GFP荧光筛选获得大豆阳性发状根。1.5 大豆转基因发状根的抗病性鉴定
经GFP荧光筛选后挑选生长状态一致的过表达GmCTR1发状根与对照发状根组织各5个,置于平铺有滤纸的培养皿中。在长满疫霉菌丝的V8培养基边缘处切取1 mm3疫霉菌块接种到发状根组织上,置于24℃暗培养箱中。接种后进行表型观察与病斑测量。将V8培养基上暗培养4 d的疫霉菌边缘切取少量菌块,置于液体V8培养基中,24℃暗培养3 d。用灭菌自来水清洗大豆疫霉菌后,倒入15 mL灭菌自来水进行12 h的暗培养。利用显微镜观察游动孢子的萌发情况后稀释疫霉菌游动孢子悬浮液至浓度为105个/mL。用游动孢子悬浮液侵染大豆发状根组织,于侵染12和24 h后取样,用液氮速冻保存于-80℃冰箱中备用。在大豆基因组数据库(http://www.phytozome.net)中搜索获得大豆β-1,3-葡聚糖酶基因BGL2(Glyma. 19G134700)、病程相关基因非表达子基因NPR1(Glyma.09G064700)、病程相关蛋白基因PR5(Glyma.17G248300)和PR10 (Glyma.09G040500)序列。利用Primer Premier 5设计特异性引物(表1)。
1.6 实时荧光定量PCR分析
参照SYBR Green Master Mix(Vazyme)试剂的说明书进行实时荧光定量PCR。以大豆GmACT11(GenBank登录号为TC204137)作为内参基因,对基因的表达情况进行qRT-PCR分析。采用2-△△Ct法计算相对表达量。利用GraphPad prism 5软件绘图。2 结果
2.1 GmCTR1克隆与序列分析
根据同源序列比对结果,将与拟南芥AtCTR1(AT5G03730)同源性最高(75.3%)的大豆基因Glyma. 13G151100命名为GmCTR1。经PCR扩增获得一个长度在2 500 bp左右的特异性条带(图1)。测序结果显示目的条带与Phytozome 11.0大豆基因组数据库中Glyma.13G151100的序列吻合,证明已成功克隆到了GmCTR1。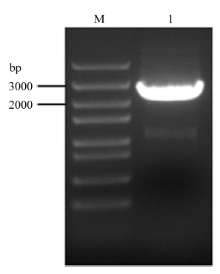 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1GmCTR1的PCR扩增产物
M:DNA Marker;1:PCR产物 PCR products of GmCTR1
-->Fig. 1PCR products of GmCTR1
-->
GmCTR1的CDS序列全长为2 511 bp,编码836个氨基酸的多肽,其蛋白质量为92.35 kD,等电点为6.51。GmCTR1与AtCTR1结构相似,均含有15个外显子和14个内含子。
应用DNAMAN进行多重序列比对显示(图2), GmCTR1的氨基酸序列与拟南芥、番茄、水稻(Oryza sativa)、蒺藜苜蓿(Medicago truncatula)、烟草、小麦的CTR1氨基酸的羧基末端保守性较强,都含有CTR1典型的作用位点基序Ⅰ——ATP binding site和基序Ⅱ——active site。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GmCTR1与其他植物CTR1氨基酸序列多重比对
-->Fig. 2Multiple sequence alignment of amino acids of GmCTR1 proteins from other plants
-->
用MEGA 6对GmCTR1与其他植物的CTR1氨基酸序列构建了系统进化树(图3),结果表明大豆CTR1与菜豆(Phaseolus vulgaris)、蒺藜苜蓿的CTR1在同一分支上,与菜豆CTR1的亲缘关系最近。
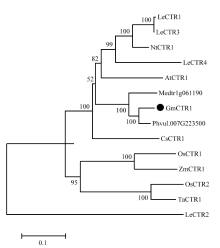 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3大豆GmCTR1与其他植物CTR1蛋白的氨基酸序列系统进化分析
-->Fig. 3Phylogenetic analysis of amino acid sequences of GmCTR1 proteins in soybean and other plant species
-->
2.2 GmCTR1受大豆疫霉侵染诱导表达分析
利用实时荧光定量PCR方法分析接种大豆疫霉菌后GmCTR1的表达模式,发现GmCTR1受疫霉诱导上调表达,相对表达量在48 h达到最高,是对照的5.4倍,而后表达水平下降(图4)。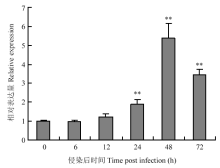 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4大豆疫霉侵染后不同时间GmCTR1的相对表达量
**表示差异极显著(P<0.01)。下同
-->Fig. 4Relative expression of GmCTR1 at different times upon infection by P. sojae
** indicate extremely significant difference at P<0.01 level. The same as below
-->
2.3 大豆发状根转化体系中转基因发状根的获得与鉴定
将重组质粒pBinGFP2:GmCTR1利用电击法转入发根农杆菌K599菌株。通过发根农杆菌介导法在大豆品种Williams中转化。通过GFP荧光筛选获得了大豆转基因发状根(图5-A),说明重组质粒与空质粒成功转入了发状根组织。利用实时荧光定量PCR方法检测过表达阳性发状根(OE:下同)与空质粒对照发状根(EV:下同)中GmCTR1的表达水平,结果显示大豆阳性发状根中GmCTR1的表达水平显著升高,表明通过GFP荧光筛选的大豆发状根中过量表达了GmCTR1(图5-B)。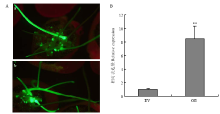 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5发状根中观察绿色荧光蛋白以及GmCTR1的表达水平
A:体视镜下观察大豆转基因发状根的绿色荧光蛋白(GFP);a:过表达发状根(OE);b:空质粒对照发状根(EV)。B:过表达发状根(OE)与对照发状根(EV)中GmCTR1的相对表达量
-->Fig. 5The green fluorescent protein and the relative expression analysis of GmCTR1 in soybean hairy roots
A: The green fluorescent protein in transgenic soybean hairy roots under the Body Mirror. a: Overexpressing soybean hairy roots (OE); b: Empty-vector soybean hairy roots (EV). B: The relative expression of GmCTR1 in OE and EV hairy roots
-->
2.4 大豆过表达GmCTR1发状根对大豆疫霉根腐病的抗性分析
2.4.1 病斑分析 将通过GFP荧光筛选的大豆过表达阳性发状根和对照发状根接种大豆疫霉菌发现,在侵染36 h后发状根出现褐色病斑,过表达发状根的发病程度较重(图6-A),过表达发状根的病斑长度为12.84 mm,对照病斑长度为9.06 mm(图6-B),说明过表达GmCTR1后发状根组织的抗病性减弱。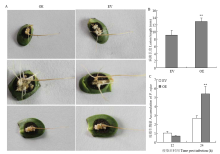 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6大豆发状根中验证GmCTR1在抗病反应中的功能
A:大豆疫霉菌侵染36 h后的病斑表型;B:病斑长度统计结果;C:大豆发状根受疫霉侵染12和24 h后疫霉菌的生物量测定
-->Fig. 6Roles of GmCTR1 in resistance determined by soybean hairy roots
A: Lesion phenotype of infected hairy roots at 36 hpi; B: Statistical measurement of the lesion length; C: Accumulation of P. sojae in OE and EV hairy roots at 12 and 24 hpi
-->
2.4.2 疫霉生物量测定 用浓度为1×105个/mL的大豆疫霉菌游动孢子处理发状根组织,测定12和24 h后大豆发状根中疫霉生物量的相对变化。结果表明,在游动孢子侵染24 h后,对照发状根与过表达GmCTR1的阳性发状根中疫霉生物量的变化差异明显,过表达GmCTR1阳性发状根中疫霉生物量达到对照的2倍(图6-C)。
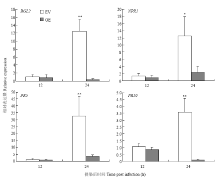
2.4.3 抗性基因表达分析 利用实时荧光定量PCR方法分析过表达阳性发状根和对照发状根在大豆疫霉菌侵染后抗性信号相关基因的转录水平,发现过表达GmCTR1的发状根中BGL2、NPR1、PR5 和PR10的相对表达量与对照相比在侵染12 h后没有显著差异,24 h后基因表达受到明显抑制,BGL2下调40倍,NPR1下调5倍,PR5下调10倍,PR10下调35倍(图7)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7大豆发状根在大豆与疫霉菌互作过程中抗性相关基因的相对表达量
-->Fig. 7Relative expression of the resistance related gene in soybean hairy roots in the interaction between soybean and P. sojae
-->
3 讨论
GmCTR1作为乙烯信号通路中的一个负向调控因子从栽培大豆中分离得到,该基因编码836个氨基酸的丝氨酸/苏氨酸蛋白激酶。GmCTR1与拟南芥[1]、番茄[5]和黄瓜[2]等植物的CTR1结构十分相似,都包含了15个外显子和14个内含子。多重序列比对结果显示,GmCTR1与其他植物的CTR1都含有CTR1蛋白的典型结构域。进化分析表明,GmCTR1属于真核生物CTR1类基因,与菜豆、苜蓿等植物亲缘关系十分相近,属于同一个分支。本研究对GmCTR1表达分析发现,在大豆疫霉菌P6497侵染Williams后GmCTR1上调表达,在侵染48 h GmCTR1的表达量达到最大值,72 h后基因表达水平下降。前人研究显示,Williams在接种P6497疫霉菌3和5 d后,对GmCTR1的表达水平进行分析发现该基因的表达下降。这一结果是对大豆与疫霉菌互作后期GmCTR1表达的分析,本研究探究了疫霉菌侵染早期GmCTR1的表达情况。综上所述,GmCTR1参与了大豆和疫霉菌的互作过程[17]。
过量表达GmCTR1后减弱了对大豆疫霉菌的抗性,大豆过表达GmCTR1的阳性发状根在接种疫霉菌后与对照相比发病程度加重,病斑明显变长,疫霉菌的生物量增加,表明GmCTR1负调控大豆对疫霉菌的抗性。这与烟草和番茄中的研究结果相同。在烟草花叶病毒侵染烟草过程中,NtCTR1沉默植株由于乙烯的持续产生诱导抗病基因表达,受乙烯诱导的几丁质酶CHIB表达显著上调,与野生型相比表现出更强烈的过敏反应[9]。番茄中过表达LeCTR2的N端,能激活植株的乙烯信号转导,当灰霉病菌侵染后LeCTR2过表达植株感病性增强[6]。大豆GmCTR1的N端和C端结构域对于其在调控植物防卫反应中所起的具体作用仍需进一步验证。
当植物遭受病原菌侵染时,乙烯释放量增加,激活抗病物质几丁质酶、PDF1.2、Harpin蛋白产生和积累,同时引发程序性细胞死亡过程[18-20]。大豆疫霉根腐病的抗性与β-1,3-葡聚糖酶活性呈正相关[21],β-1,3-葡聚糖酶通过水解真菌细胞壁的主要成分β-1,3-葡聚糖来抑制真菌生长。NPR1作为调控植物病害抗性的关键基因,对植物系统获得性抗性(SAR)和诱导系统抗性(ISR)起调控作用。NPR1是水杨酸、茉莉酸和乙烯介导的抗病信号途径的交叉节点,与TGA、WRKY转录因子互作调控PR基因表达和植物抗性[22-25]。病程相关蛋白是病原菌侵染后植物产生的一类蛋白质。大豆中PR1a、PR4、PR6和PR10等PR蛋白在机械损伤和大豆疫霉菌侵染过程中诱导表达[26]。PR5属于类甜味蛋白,参与植物病原菌互作过程中相关代谢物的合成过程,对卵菌纲病原菌的侵染具有积极作用[27]。大豆疫霉菌侵染后,BGL2、NPR1、PR5和PR10在过表达GmCTR1的阳性发状根中表达量与对照相比显著下调,这进一步证实大豆发状根受大豆疫霉菌侵染过程中GmCTR1的过表达干扰了正常的抗性反应过程。
4 结论
利用同源克隆方法克隆得到了GmCTR1,该基因的CDS全长2 511 bp,编码836个氨基酸的丝氨酸/苏氨酸蛋白激酶。GmCTR1具有CTR1蛋白的典型结构域和关键位点。GmCTR1在大豆与大豆疫霉菌互作过程中发挥了负向调控功能。The authors have declared that no competing interests exist.
