0 引言
【研究意义】异色瓢虫(Harmonia axyridis)属鞘翅目(Coleptera)瓢虫科(Coccinellidae),对蚜虫、叶螨、介壳虫等重要害虫具有很强的捕食能力,目前在农林业生产实践中被广泛应用[1-2]。从分子水平探讨低温诱导对异色瓢虫抗寒基因表达水平的影响,可揭示昆虫抗寒的机制。同时,也可为异色瓢虫自然种群的越冬保护、人工繁殖种群的冷藏管理和在低温环境中的释放应用提供参考。【前人研究进展】温度在很大程度上影响着昆虫的生长发育、基本行为及进化途径[3]。昆虫在长期进化过程中形成了各种各样的抗寒策略[4],有的昆虫通过迁徙或躲藏等行为避开低温环境,有的昆虫则会通过调节机体代谢,积累抗寒物质来抵御寒冷[5-6]。自然界中,异色瓢虫以成虫滞育越冬,有关异色瓢虫抗寒性、越冬策略、季节性表型等研究已有大量报道[7-11]。热激蛋白(heat shock proteins,HSPs)具有高度保守的氨基酸序列,广泛存在于微生物及高等动植物中,当生物体遭受高温、低温及其他不利的环境胁迫时,HSPs对生物体的预防反应及稳定性起到重要作用[12]。根据分子量的大小,HSPs可以分为HSP100家族、HSP90家族、HSP70家族、HSP60家族以及小分子热激蛋白(small heat shock protein,sHSP)家族[13]。sHSP分子量一般在15—50 kD,sHSP具有分子伴侣的功能,其能够使蛋白质处于有利于折叠的感受态,并且与其他HSPs共同作用使蛋白质有效折叠。研究发现过量表达sHSP能增强细胞对热休克的耐受力[14]。sHSP在对抗细胞凋亡以及生物体生长发育和分化过程中也发挥着重要作用[14]。此外,不同色斑种群的比例呈现出季节性变化,不同色斑种群异色瓢虫成虫的低温存活率可能有所差异[15]。【本研究切入点】有关sHSP和异色瓢虫抗寒性关系的研究还较少,短时低温胁迫能明显提高异色瓢虫抗逆能力,sHSP基因在这个过程中mRNA水平上的变化情况还有待探究。【拟解决的关键问题】通过检测3个sHSP基因在不同发育阶段、短时降温和短时降温后恢复处理、低温储存处理下以及不同色斑种群的表达水平,分析其在异色瓢虫抗寒能力中所起的作用。1 材料与方法
试验于2015—2016年在杭州师范大学完成。1.1 试验昆虫
异色瓢虫实验种群:2014年3月底采集于杭州师范大学校园内。在温度(25±1)℃、相对湿度为(70±5)%和光周期16L:8D条件下,在养虫笼(60目纱网,0.5m×0.5m×0.5m)内放入异色瓢虫集中饲养,笼内放置带有足量豆蚜(Aphis curviness)的蚕豆苗,待取食一段时间后更换一盆新的含足量蚜虫的蚕豆苗。折叠的纸条放入养虫笼内,作为异色瓢虫产卵的基质。待雌虫产卵后,将含有新鲜卵块的蚕豆苗叶或纸条放入塑料培养皿,直至虫卵孵化后转移至养虫笼继续饲养,繁殖3代后的异色瓢虫用于试验。异色瓢虫越冬种群:2014年10月初直接采于中国黑龙江省帽儿山。1.2 仪器与试剂
1.2.1 主要仪器与设备 移液器(德国Eppendorf公司)、冰箱(海尔BCD-290W)、-80℃冰箱(艾本德U410-86)、恒温水浴锅(上海精宏DK-8D)、无菌超净工作台(ESCO)、台式高速离心机(Sigma 1-14)、Eppendorf5424型常温离心机(德国Eppendorf公司)、电子分析天平(梅特勒-托利多AL204)、AG22331型PCR仪(德国Eppendorf公司)、实时荧光定量PCR 仪(BioRAD CFX96)、电泳仪和电泳槽(北京六一仪器厂)、DNP-9272恒温培养箱(上海精密实验设备公司)、NanoDropTM 2000微量测定分光光度计(美国Thermo Scientific公司)、5T4100-1106型紫外凝胶成像系统(美国Tanon公司)、高压蒸汽灭菌锅(SANYO MLS-3750)。1.2.2 主要试剂与药品 DNA Marker DL2000、6×Loading buffer、cDNA一链反转录试剂盒、T载体等购自大连TaKaRa公司;RNA抽提Trizol试剂盒购自美国Invitrogen公司;PCR引物合成和测序由上海Invitrogen公司完成;琼脂糖购自Sigma公司、实时荧光定量PCR试剂盒和八连管等均购自美国Bio-RAD公司;质粒提取试剂盒及凝胶回收试剂盒购买于德国Omega公司;氯仿、异丙醇、无水乙醇、EDTA 均购自杭州米克化工有限公司;DEPC水、氨苄卡那霉素、蛋白胨、酵母粉、氯化钠、琼脂、甘油等常规试剂购自上海生工生物工程有限公司。
1.3 试验方法
1.3.1 总RNA抽提及一链cDNA合成 用Trizol法提取异色瓢虫整虫的总RNA后,用琼脂糖凝胶电泳检测RNA 的纯度及降解情况,再用微量核酸测定仪测定RNA的浓度。在反转录反应中,取1 µg总RNA作为模板,根据反转录试剂盒说明书来完成试验。1.3.2 sHSP全长序列验证 从公司测序得到的异色瓢虫转录组数据库中,找出与HSP基因相近的序列,通过比对找出3条小分子热激蛋白序列。将这些基因序列翻译成蛋白序列并在NCBI库中进行比对,发现这些序列包含完整的cDNA开放阅读框序列。根据已得的序列,分别从两端设计特异性引物(表1),进行PCR扩增。具体PCR条件:94℃预变性5 min,94℃变性30 s,59℃退火30 s,72℃延伸90 s,共30个循环,72℃充分延伸5 min。反应结束,取5 μL PCR产物在1.2%琼脂糖凝胶上电泳。当检测到目的条带后,将目的片段回收纯化,再进行T克隆并连接到T载体中,而后进行菌落PCR验证,送往上海Invitrogen公司测序。
Table 1
表1
表1试验中所用引物
Table 1Primers used in the experiments
| 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) |
|---|---|
| Ha-rp49-QF Ha-rp49-QR HaHSP47.74-F HaHSP47.74-R HaHSP21.53-F HaHSP21.53-R HaHSP21.52-F HaHSP21.52-R | GCGATCGCTATGGAAAACTC TACGATTTTGCATCAACAGT AGGTTCTGCGATTTCAC ACATCTGGCATTTGGTC CCTATCAAACTGGGAGAC GATGTGGTGGTGCTGGT CTCGCTGTTACCAATCCT GAACTTGTCCGTGTCCATA |
新窗口打开
1.3.3 sHSP基因引物设计 以Harp49为内参基因[16]。根据转录组测得的基因序列,利用DNAstar和Perimer 5.0软件设计rp49及3个sHSP基因的特异性引物。
1.3.4 不同发育阶段异色瓢虫sHSP基因的表达 选取实验种群异色瓢虫作为试验材料。不同发育阶段包括第1—4天4龄幼虫、预蛹期、第1—3天蛹期及第1—3天成虫期(蜕皮或羽化2 h后)。根据异色瓢虫sHSP基因序列以及Harp49基因序列设计qRT-PCR特异性检测引物(表1)。每个处理随机抽取3头且每个处理组重复3次,用紫外凝胶电泳检测RNA纯度,用微量测定分光度计测定RNA浓度,取1 μg总RNA进行反转录反应。取1 μL反转录产物用于qRT-PCR,每个样品重复3次。具体荧光定量PCR程序:94℃预变性5 min,94℃变性 15 s,59℃退火30 s,68℃延伸30 s,40个循环,在68℃收集荧光信号[17]。采用2-ΔΔCT法进行数据分析[18]。
1.3.5 短时降温和短时降温后恢复处理条件下异色瓢虫sHSP基因的表达 选取成虫一周后的实验种群异色瓢虫作为试验材料。短时降温处理:将异色瓢虫置于25℃人工智能培养箱存放2 h,之后取出一批试验材料,而后依次将人工智能培养箱温度设定为15、10、5、0和-5℃,每个温度梯度各存放2 h并取出试验材料。
短时降温后恢复处理:将异色瓢虫置于-5℃人工智能培养箱存放2 h,之后取出一批试验材料,而后依次将人工智能培养箱温度设定为0、5、10、15和25℃,每个温度梯度各存放2 h并取出试验材料。重复上述试验3次,每个处理随机选取3头异色瓢虫。用电匀浆器充分研磨异色瓢虫,Trizol法提取总RNA,反转录出cDNA并参照1.3.4的方法进行qRT-PCR,测定异色瓢虫3个sHSP基因的相对表达量,用2-ΔΔCT法进行数据分析。
1.3.6 低温储存条件下实验种群和越冬种群异色瓢虫sHSP基因的表达 在实验种群和越冬种群中分别选取黑底色斑雌性(简称黑雌)和黄底色斑雌性(简称黄雌)成虫一周后异色瓢虫作为实验昆虫,在4℃冰箱中储存,分别在 0、5、10、15和20 d取材,每个取材时间点随机选取5—10头异色瓢虫,试验重复3次。用电匀浆器充分研磨试验昆虫,Trizol法提取总RNA,反转录出cDNA并参照1.3.4的方法进行qRT-PCR,测定异色瓢虫3个sHSP基因的相对表达量,用2-ΔΔCT法进行定量结果数据分析。
1.4 序列分析及数据统计分析
应用DNAStar软件寻找目标基因序列开放阅读框并翻译成蛋白质,等电点及分子量在线分析网址:http://web.expasy.org/compute_pi/,使用SPSS statistics 20对结果进行比较分析,不同处理组间采用单因素方差分析(One-way ANOVA),多重比较采用Tukey-Kramer HSD分析。图1—5中不同小写及大写字母表示经单因素方差分析,Tukey-Kramer HSD检验后存在显著性差异(P<0.05)。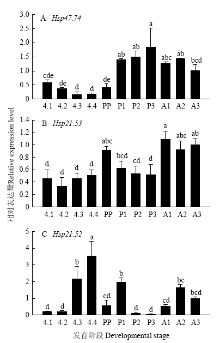 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同发育阶段实验种群异色瓢虫sHSP基因的相对表达水平
数值代表平均数,柱形图上的竖线代表标准误,不同字母表示数据在Tukey’s检验中差异显著(P<0.05)。下同
-->Fig. 1The relative expression level of sHSP genes of H. axyridis of experiment population in different instars
Data were presented as means±SE (n=3). Bars with different letters indicated significant difference (P<0.05) by Tukey’s test. The same as below
-->
2 结果
2.1 异色瓢虫转录组测序数据的筛选
从公司测序得到的异色瓢虫转录组数据库中,找出与HSP基因相近的序列,通过比对找出3条小分子热激蛋白序列。A:HaHSP47.74开放阅读框为1 281 bp,翻译氨基酸数427个,等电点为5.82,预测蛋白分子量为53.88 kD;B:HaHSP21.53开放阅读框为570 bp,翻译氨基酸数190个,等电点为5.24,预测蛋白分子量为21.53 kD;C:HaHSP21.52开放阅读框为576 bp,翻译氨基酸数192个,等电点为5.86,预测蛋白分子量为21.52 kD。2.2 不同发育阶段异色瓢虫sHSP基因的相对表达量
异色瓢虫不同发育阶段:4龄第1—4天幼虫(4.1—4.4)、预蛹(PP)、第1—3天蛹(P1—P3)、第1至3天成虫(A1—A3),其中以羽化后第3天成虫(A3)为对照。在蛹期第3天HaHSP47.74表达量显著高于对照组(图1-A)。HaHSP21.53在成虫第1天表达量较高,但与对照组无显著差异(图1-B)。HaHSP21.52在4龄幼虫末期表达量呈上升趋势,且在4龄幼虫第4天表达量最高显著高于对照组(图1-C)。2.3 短时降温和短时降温后恢复处理条件下异色瓢虫sHSP基因的相对表达量
在短时降温处理中,以25℃时的表达量为参照。HaHSP47.74在0℃和-5℃时表达量与对照组相比显著上调(图2-A)。HaHSP21.53在15—-5℃表达量均显著低于对照组(图2-B)。HaHSP21.52在25℃时表达量最高,在10—-5℃表达量均显著低于对照组(图2-C)。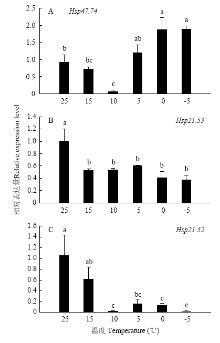 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2短时降温条件下实验种群异色瓢虫成虫sHSP基因的相对表达水平
-->Fig. 2The relative expression level of sHSP genes of adult H. axyridis of experiment population under the treatment of cooling process
-->
在短时降温后恢复处理中,以-5℃时基因表达量为参照。HaHSP47.74在短时升温处理中表达量无显著性差异(图3-A)。HaHSP21.53在15℃时表达量最高,但与对照组无显著性差异(图3-B)。HaHSP21.52在5℃时表达量最低,在5—15℃表达量呈上升趋势,但与对照组均无显著差异(图3-C)。
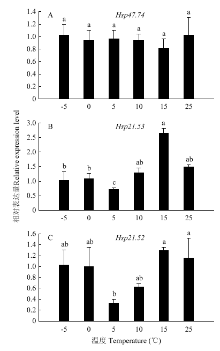 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3短时降温后恢复处理下实验种群异色瓢虫成虫sHSP基因的相对表达水平
-->Fig. 3The relative expression level of sHSP genes of adult H. axyridis of experiment population under the treatment of increasing temperature
-->
2.4 低温储存对实验种群和越冬种群异色瓢虫sHSP基因的相对表达量的影响
低温储存条件下以CK(0 d)为对照。实验种群:黑雌异色瓢虫HaHSP47.74在低温储存5 d时表达量最高且显著高于对照组,黄雌异色瓢虫在低温储存5、10、15 d时的表达量均显著高于对照组(图4-A)。黑雌异色瓢虫HaHSP21.53在5—15 d低温储存条件下表达量呈上升趋势,且都显著高于对照组,黄雌瓢虫在15 d时表达量最高且显著高于对照组(图4-B)。黑雌瓢虫HaHSP21.52在低温储存处理中无显著性高表达,黄雌瓢虫HaHSP21.52在低温储存过程中亦无显著性高表达,且随着储存天数的增加表达量呈下降趋势(图4-C)。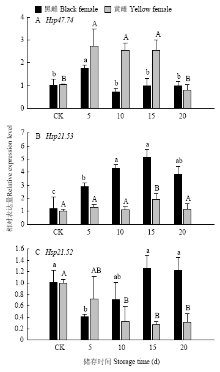 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4低温储存条件下实验种群异色瓢虫成虫sHSP基因相对表达水平
-->Fig. 4The relative expression level of sHSP genes of adult H. axyridis of experiment population under the treatment of low temperature storage
-->
越冬种群:黑雌异色瓢虫HaHSP47.74在低温储存0—10 d时表达量呈上升趋势,在10—40 d时表达量呈下降趋势,但与对照组均无显著差异,黄雌异色瓢虫HaHSP47.74在低温储存条件下表达量亦无显著差异(图5-A)。黑雌异色瓢虫HaHSP21.53在低温储存10 d条件下表达量最高,但与对照组无显著差异,黄雌瓢虫HaHSP21.53表达量与对照组亦无显著差异(图5-B)。黑雌瓢虫HaHSP21.52在低温储存处理60 d时表达量最高,且与对照组无显著差异,黄雌瓢虫HaHSP21.52在低温储存处理中表达量显著低于对照组(图5-C)。
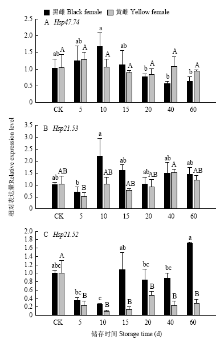 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5低温储存条件下越冬种群异色瓢虫成虫sHSP基因相对表达水平
-->Fig. 5The relative expression level of sHSP genes of adult H. axyridis of overwintering population under the treatment of low temperature storage
-->
3 讨论
HSPs是一类重要的分子伴侣,它参与蛋白质折叠和降解、细胞内物质的运输、靶细胞的活性调节等过程[19]。当生物体细胞发生损害时,蛋白质变性失去原本的空间结构和活性功能。这时产生的HSPs可以促进肽链重新折叠盘旋,恢复蛋白质原有的空间结构和生物活性[20]。自RITOSSA[21]首次从果蝇中发现HSPs以来,有关HSPs的研究报道已经很多。HSPs具有进化上的保守性,对于生物体具有重要意义,其普遍存在于各种微生物和动植物体内[22-23]。在唐斌等[24]的研究中,将7个具有代表性的昆虫HSP90与异色瓢虫HSP90进行对比分析,发现HSP90具有高度保守性,同源性高达81%—90%。异色瓢虫HSP70A在蛹期和成虫期均有高表达,升温处理中HSP70B在0℃时显著性高表达,HSP70表达水平在饥饿处理8 h时达到最高,以上结果表明异色瓢虫HSP70在发育阶段、升温处理和饥饿处理中均可能起到作用[25]。此外,生物体没有受到外界刺激时,HSPs也能发挥相应的作用[26]。sHSP分子量为15—50 kD[27],是一个极具多样性的蛋白质家族,其广泛分布于微生物、高等动植物中。不同组织有不同数目的sHSP,分子量也有相当大的差异[28]。昆虫体内的sHSP与昆虫的生长发育密切相关[14]。研究表明,生物体无论处于正常状态还是应激状态,sHSP均有相应的表达[29]。家蚕(Bombyx mori)sHSP基因在家蚕正常生长发育过程中均有表达,在高温条件下,重组蛋白BmHSP24.3能使底物蛋白免受热刺激胁迫而变性[30]。温度亦能够对中华稻蝗(Oxya chinensis)sHSPs基因的表达产生影响,但是不同温度处理下各基因的表达模式存在差异[31]。正常状态下亦存在表达的sHSP,这表明sHSP在没有外界刺激时也起到一定的作用[28,32]。本研究探索了sHSP在异色瓢虫不同发育阶段的表达量,发现基因在蛹期第3天显著性高表达,在成虫期第1天表达量最高,在4龄幼虫第4天显著性高表达,这与笔者实验室前期研究结果较一致[33]。
自然界的许多昆虫在越冬前经过自然的逐步降温的过程,低温胁迫增强了昆虫的抗寒能力,前人推测在该过程中包括sHSP在内的众多基因都起到了作用。田怡[34]用不同温度处理橘小实蝇(Bactrocera dorsalis)7日龄成虫,结果表明BdHSP20.4和BdHSP21.6的表达量仅在-5℃显著上调,BdHSP23.8、BdHSP20.6和BdHSP18.4在-5℃和40℃胁迫下均显著上调;而Bdhsp17.6的相对表达量不会受温度影响;BdHSP11.1的相对表达量经-5℃和0℃胁迫后显著下降;邬梦静等[35]研究了异色瓢虫低温胁迫下过冷却点变化及抗寒基因表达,发现异色瓢虫小分子热激蛋白HSP21.4高表达以提高其抗寒能力。根据本研究结果,发现短时降温条件下sHSP基因显著性高表达,且不同的sHSP可能在降温胁迫的不同时期发挥作用,与实验室前期研究结果较一致。经过低温储藏处理的异色瓢虫sHSP的表达量显著上升,这表明sHSP具有保护异色瓢虫抵御寒冷的功能[33]。前期试验结果中异色瓢虫HSP21.00、HSP21.62、HSP10.87和HSP21.56在短时降温后恢复处理过程中显著性高表达,这表明sHSP在热激条件下可能发挥着关键作用[33]。在本研究短时降温后恢复处理中,以-5℃时基因表达量为参照,HaHSP21.53在15℃时表达量最高,但与对照组无显著性差异(图3-B),其他基因无显著性高表达,不同sHSP在短时降温后恢复处理条件下的作用还有待进一步研究。
在温带地区,冬季对于节肢动物来说是一种巨大的环境压力[36]。研究显示,冷驯化(特别是0℃和5℃)能显著提高昆虫抗寒性[37]。本研究中实验种群在低温储存条件下,黑雌HaHSP47.74在储存5—15 d时显著性高表达,黄雌HaHSP47.74在储存5 d时显著性高表达,黑雌瓢虫HaHSP21.53在5—20 d时显著性高表达,黄雌瓢虫HaHSP21.53在15 d时显著性高表达。黑雌和黄雌瓢虫HaHSP21.52表达量均无显著性差异。越冬种群异色瓢虫受到自然界气候驯化,所以越冬种群的耐寒性高于夏季种群。在5℃条件下对夏季种群进行驯化,驯化后的夏季种群存活率与越冬种群存活率相接近[38]。随着寒冷冬季的到来,越冬种群的异色瓢虫在生理和行为上都会有所准备,比如滞育,降低机体含水量,降低过冷却点,积累脂肪,寻找躲避场所等[38]。本研究中的3个sHSP在越冬种群的低温储存处理中无显著性高表达,可能这3个sHSP在异色瓢虫遭受短时升温过程中无明显作用。
异色瓢虫鞘翅色斑呈现季节性变化规律,这种变异现象可能与保护色有关[39-40]。由HaHSP47.74可看出实验种群黑雌和黄雌异色瓢虫sHSP基因两者均在第5天显著性高表达,但表达量和趋势都有差异(图4-A)。导致异色瓢虫色斑呈现多样性的因素有很多,可能与性交配选择、避免天敌捕食、不同环境条件下酶活力不同等有关,目前尚无较全面准确的答案,但是所有这些因素都是为了保持种族繁衍而适应环境所作出的改变[8,40-41]。此外,昆虫冷驯化离不开各种内因和外因。昆虫冷驯化机制复杂多样,其具体的抗寒机制和遗传关系还有待进一步探索。
4 结论
在异色瓢虫生长发育过程中HaHSP47.74、HaHSP21.53和HaHSP21.52均显著性高表达,且不同的sHSP可能在不同的发育阶段发挥作用。在短时降温处理中,异色瓢虫HaHSP47.74显著性高表达以提高其抗寒能力。在短时降温恢复处理中,3个sHSP基因无显著性高表达。低温储存条件下实验种群黄雌和黑雌的HaHSP47.74、HaHSP21.53均有显著性高表达,且黄雌和黑雌sHSP基因表达量有所差异。低温储存条件下越冬种群HaHSP47.74、HaHSP21.53、HaHSP21.52无显著性高表达。综上可预测异色瓢虫同一家族sHSP在不同刺激下功能也不尽相同。The authors have declared that no competing interests exist.
