0 引言
【研究意义】茄(Solanum melongena L.)为茄科(Solanaceae)茄属(Solanum)一年生草本植物,是在世界范围内广泛种植的一种重要茄果类蔬菜作物[1]。紫茄富含花色苷,其浓度分别约为葡萄和洋葱的2.34和7.08倍[2]。花色苷是一种天然水溶性类黄酮物质,存在于植物的叶、花和果实中,不仅使各种蔬菜、花卉和果实呈现红色、紫色和蓝色,而且具有一定营养和药理作用,如清除自由基、预防心血管疾病、神经疾病、癌症、糖尿病、炎症等[3-4]。目前,对茄萼花色苷合成的分子调控机理知之甚少。因此,深入开展茄萼花色苷合成关键基因的研究有助于揭示茄萼与果皮花色苷合成分子调控机理的异同,为茄品质育种提供理论依据。【前人研究进展】植物花瓣、组织和果实等颜色主要由植物次生代谢产物花色苷决定,属于类黄酮物质。花色苷需要一系列酶经过3个阶段合成,目前已对如矮牵牛[5](Petunia)、玉米[6](Zea mays)及金鱼草[7](Antirrhinum majus)等花色苷生物合成途径有了较深入的研究。二氢黄酮醇4-还原酶(dihydroflavonol-4-reductase,DFR)是花色苷多酶合成途径中最终形成色素的关键酶,在花色苷生物合成途径的下游发挥重要作用,属于NADPH(nicotinamide adenine dinucleotide phosphate)依赖的短链还原酶家族[8],能够催化二氢黄酮醇类物质,如二氢堪非醇(dihydrokaempferol,DHK)、二氢榭皮素(dihydroquercetin,DHQ)和二氢杨梅素(dihydromyricetin,DHM),在C4位发生立体特异的还原反应,分别生成无色花葵素、无色花青素和无色翠雀素[9]。不同物种的DFR具有较高同源性,存在保守的NADPH结合域和底物特异性结合域,对底物的特异性结合通常是由第134位氨基酸残基决定[8]。在高等植物中,多数花色苷生物合成往往受诸多转录因子在不同时空上的组合调控。如R2R3-MYB转录因子、bHLH转录因子和WD40蛋白等,三者形成转录复合体MYB-bHLH-WD40(MBW)而发挥转录调控作用[10-11]。作为一种关键的转录因子,R2R3-MYB的上调能够激活参与花色苷合成的某个或多个结构基因的表达,从而使植物组织积累花色苷。该基因已从箭叶淫羊藿(Epimedium sagittatum)[12]、梨(Pyrus pyrifolia)[13]和甜樱桃(Prunus avium L.)[14]等物种中克隆,并对其功能进行了解析。苹果中MdMYB10调控花色苷合成途径中所有结构基因的协同表达[15];‘红阳’猕猴桃中MYB促进花色苷积累[16];过表达番茄编码MYB的ANT1,上调CHI、CHS、DFR和UFGT转录水平[17]。【本研究切入点】茄从果萼和果皮颜色上划分,一般有紫色萼紫色果皮、绿色萼紫色果皮和绿色萼白色果皮3种,关于茄果皮花色苷合成分子机制已有较深入研究[18-19]。但是,有关紫萼花色苷合成的分子机制还不清楚。【拟解决的关键问题】以绿萼和紫萼长茄果萼为试验材料,通过RACE方法克隆DFR和MYB,并对其编码的产物进行生物信息学分析,同时运用实时荧光定量PCR技术,分析DFR和MYB在果萼生长过程中的表达模式,为深入阐释茄子果萼中花色苷生物合成的分子机理提供理论基础。1 材料与方法
试验于2014—2016年在东北林业大学生命科学学院进行。1.1 试验材料
以采摘自黑龙江省农业科学研究院园艺分院的绿萼和紫萼长茄果萼为试验材料,于2014年6月将上述两种茄子分别分成初蕾期、盛蕾期、初花期和盛花期4个时期进行取材(图1),液氮冰冻,保存于-80℃冰箱。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同发育阶段的绿萼和紫萼长茄果萼
-->Fig. 1Different developmental stages of calyx in the green calyxes and purple calyx of eggplant
-->
1.2 茄萼花色苷含量测定
参考WROLSTAND等[20]的方法,采用不同pH条件下分光光度计方法测定茄萼花色苷含量。利用公式TA=A×MW×5×100×V/Ɛ;A=[A510nm(pH 1.0)-A700nm(pH 1.0)]-[A510nm(pH 4.5)-A700nm(pH 4.5)]计算花色苷的含量,其中花色苷总含量由TA表示,V代表混合液的体积(mL),摩尔吸收率26900由Ɛ表示,标准分子质量449.2由MW表示,花色苷的总含量单位为mg/100 g。1.3 RNA提取及基因全长克隆
采用TRIzol Plant(全式金公司,北京)试剂盒提取总RNA,利用P19E(表1)和反转录试剂盒(全式金公司,北京)反转录得到cDNA,以此为模板,进行特异性扩增。Table 1
表1
表1绿萼和紫萼长茄果萼DFR和MYB基因克隆引物
Table 1List of primers used for cloning of ouSmDFR, ouSmMYB, dongSmDFR and dongSmMYB
| 引物名称 Primer | 引物序列 Primers sequences (5′-3′) |
|---|---|
| DFR 3′RACE | CCTACGTTTCCACCTAGCTTAAT |
| MYB 3′RACE | CCTTCTGCTGGTCAAACAGATAC |
| P18E | GACTCGAGTGCACATCG |
| P19E | GACTCGAGTGCACATCG(T)17 |
| ouSmDFR-5′RACE GSP1 | CGTCATAGGAGGAGTTCTG |
| ouSmDFR-5′RACE GSP2 | CGTCATAGGAGGAGTTCTG |
| ouSmMYB-5′RACE GSP1 | CGGACATCAGGTCGGAAATA |
| ouSmMYB-5′RACE GSP2 | CGTTTCAGACCAGCAGATTTAG |
| dongSmDFR-5′RACE GSP1 | TGTCCAAGAGAACCAGAAACTC |
| dongSmDFR-5′RACE GSP2 | GCCATTCAAGGCTGTCAGGGAG |
| dongSmMYB-5′RACE GSP1 | CCATCGGAGCCTACAACTTT |
| dongSmMYB-5′RACE GSP2 | CAAACGCCTTCACCATGATTAG |
| 5' RACE锚定引物 Anchor | GGCCACGCGTCGACTAGTAC(T)17 |
| 5' RACE锚定引物 Adaptor | GGCCACGCGTCGACTAGTAC |
新窗口打开
利用cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)法克隆3′-cDNA序列,登陆NCBI(http://www.ncbi.nlm.nih.gov/)参照已发表的马铃薯和番茄等DFR基因序列设计PCR上游引物DFR 3′RACE(表1),同时找到茄科植物与花色苷合成相关MYB基因序列信息,根据番茄、矮牵牛、马铃薯、烟草和辣椒序列,在MYB基因DNA结合域保守区设计PCR上游引物MYB 3′RACE(表1),上述引物设计均使用Primer Premier5.0,下游引物为P18E(表1)。PCR反应体系为20 μL:10×TransTaq HiFi BufferⅡ2 μL,dNTP Mixture 2 μL(2.5 mmol·L-1),模板cDNA 1 μL,上、下游引物各0.4 μL(20 μmol L-1),TransTaq HiFi DNA聚合酶0.2 μL(5 U μL-1),其余用蒸馏水补充。反应程序:95℃预变性5 min;30个循环(94℃变性30 s,56℃(SmDFR)、55℃(SmMYB)退火30 s,72℃延伸1 min);最后72℃延伸7 min。目的条带经胶回收纯化后,连接到pEASY-T5载体(全式金,北京)上,送至北京六合华大基因科技股份有限公司测序。
根据所得的3′-cDNA序列,设计5′RACE特异性引物ouSmDFR-5'RACE GSP1、ouSmDFR-5'RACE GSP2、dongSmDFR-5′RACE GSP1、dongSmDFR-5′RACE GSP2和ouSmMYB-5′RACE GSP1、ouSmMYB-5′RACE GSP2、dongSmMYB-5′RACE GSP2、dongSmMYB- 5′RACE GSP2(表1),用于巢式PCR。利用5′RACE GSP1和锚定引物Anchor(表1)以加dA尾的cDNA为模板进行5′-RACE扩增。为保证克隆片段的特异性,再用引物5′RACE GSP2和接头引物Adaptor(表1)进行第二次5′-RACE扩增,克隆5′-cDNA序列,PCR反应体系、产物的回收纯化、克隆、测序同3′-RACE。
1.4 绿萼和紫萼长茄果萼SmDFR、SmMYB生物信息学分析
用ORF Finder在线工具(http://www.ncbi.nlm.nih. gov/gorf/gorf. html)查找基因开放阅读框(ORF)并推导其氨基酸序列;利用BLAST(http://blast.ncbi. nlm.nih.gov/Blast.cgi)对克隆的目的序列进行同源分析;利用DNAMAN软件进行氨基酸的多序列比对,采用MEGA6.0软件中的邻接法(Neighbor-joining,NJ)构建系统发育树;使用ExPASy网站提供的在线分析软件SOPMA预测蛋白质二级结构。1.5 绿萼和紫萼长茄果萼SmDFR、SmMYB实时荧光定量分析
分别提取绿萼长茄和紫萼长茄果萼4个时期的总RNA,用PrimeScript® RT reagent Kit Perfect Real Time(宝生物,大连)试剂盒反转录合成cDNA备用。用7500 fast型实时荧光定量PCR仪和Power SYBR® Green PCR Master Mix试剂盒以上述cDNA为模板进行实时荧光定量PCR分析,所用引物如表1。20 μL反应体系:8.4 μL稀释的cDNA模板(10 μg cDNA加200 μL水稀释),上、下游引物各0.8 μL(10 μmol L-1),Power SYBR® Green PCR Master Mix(2×)10 μL。反应程序如下:95℃预变性2 min;40个循环(95℃ 10 s,60℃ 45 s)。以Actin表达水平为内参,引物为Actin-F:CACTTAGCACCTTCCAGCAGATGT和Actin-R:CTACAACAGCAGACCTGAGTTCACT。每个样品设3个生物学重复,采用2-ΔΔCT法分析目的基因表达水平。Table 2
表2
表2绿萼和紫萼长茄萼片DFR和MYB基因表达分析引物
Table 2List of primers used for expression analysis of ouSmDFR, ouSmMYB, dongSmDFR and dongSmMYB
| 引物名称 Primer | 引物序列 Primers sequences (5' -3') |
|---|---|
| Actin-F | CACTTAGCACCTTCCAGCAGATGT |
| Actin-R | CTACAACAGCAGACCTGAGTTCACT |
| ouSmDFR-RT-F | CCCACCGTTCAGGATGTT |
| ouSmDFR-RT-R | AGGAGGAGTTCTGGTTCTCTTG |
| ouSmMYB-RT-F | TTGAGCTCCTAAGTGTTCCAATA |
| ouSmMYB-RT-R | TTCATAGGCACCTTCATACATCT |
| dongSmDFR-RT-F | GCACCAGTTGCAAATAGTACAG |
| dongSmDFR-RT-R | AGCCTCAAGCAGATATCAAGAA |
| dongSmMYB-RT-F | TTGTAGGCTCCGATGGCTTA |
| dongSmMYB-RT-R | TGACCACTTGTTTCCCCACT |
新窗口打开
2 结果
2.1 果萼中花色苷含量分析
绿萼和紫萼长茄果萼的4个生长时期见图1,花色苷含量的测定结果见图2。结果表明,绿萼长茄果萼花色苷含量基本保持不变;而紫萼长茄随生长时期的推移而呈现花色苷含量增加的趋势,该变化趋势与茄萼颜色逐渐加深成正相关趋势,且在盛花期,花色苷积累更为明显,并且在该时期紫萼长茄果萼花色苷含量约是绿萼长茄的5倍。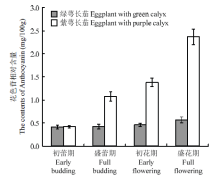 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2绿萼和紫萼长茄果萼花色苷含量变化
-->Fig. 2Variation of contents of anthocyanins in the green calyx and purple calyx of eggplant
-->
2.2 ouSmDFR和dongSmDFR的全长cDNA克隆及序列分析
克隆得到绿萼和紫萼长茄果萼ouSmDFR(GenBank登录号为KX224250)和dongSmDFR(GenBank登录号为KX224251)的cDNA全长序列。ouSmDFR全长1 285 bp,开放阅读框长858 bp,编码285个氨基酸;dongSmDFR全长1 249 bp,开放阅读框长864 bp,编码287个氨基酸。SOPMA预测的DFR蛋白二级结构预测结果(图3-A、B)表明,ouSmDFR和dongSmDFR编码的285和287个氨基酸残基中,α螺旋分别占31.23%和32.06%、β转角分别占11.93%和11.15%、无规则卷曲分别占35.79%和36.59%、延伸链分别占21.05%和20.21%。ouSmDFR和dongSmDFR氨基酸序列比对(图4)发现,与dongSmDFR氨基酸序列相比,ouSmDFR在C末端缺少两个氨基酸,并且在第229位氨基酸位点存在差异,但由于这些差异位点不在功能域内,因而推测不会影响二氢黄酮醇4-还原酶的功能。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3ouSmDFR蛋白质二级结构预测(A)和dongSmDFR蛋白质二级结构预测(B)
-->Fig. 3Prediction of secondary structure of ouSmDFR (A) and Prediction of secondary structure of dongSmDFR (B)
-->
多重氨基酸序列比对结果(图4)表明,ouSmDFR和dongSmDFR基因编码的氨基酸序列一致性高达98%,此外还发现ouSmDFR和dongSmDFR蛋白是NADPH依赖型的还原酶,属于NADB-Rossmann超基因家族(NADB-Rossmann superfamily),该基因家族具有两个高度保守结构域,分别为NADPH结合结构域和底物特异性结合结构域,能将黄烷酮醇还原为无色花色素。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4绿萼长茄ouSmDFR、紫萼长茄domgSmDFR与其他植物DFR氨基酸多序列比对
-->Fig. 4Alignment of the predicted amino acid sequences of ouSmDFR and domgSmDFR in S. melongena and those in several other plants
-->
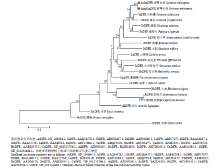
利用Mega6.0通过邻位相连法(Neighbor-joining,NJ)构建系统发育树(图5)。结果表明,绿萼和紫萼长茄果萼DFR蛋白与其他的茄科作物,如矮牵牛(Petunia×hybrida)、马铃薯(Solanum tuberosum)和烟草(Nicotiana tabacum)亲缘关系较近,且与StDFR序列相似性达73%左右,其次是与旋花科和龙胆科植物。绿萼长茄ouSmDFR和紫萼dongSmDFR与StDFR和GtDFR等DFR蛋白聚为一枝。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5ouSmDFR、dongSmDFR与其他植物DFR蛋白的系统进化树
-->Fig. 5Phylogenetic tree analysis of ouSmDFR, dongSmDFR and DFRs from other plants
-->
2.3 ouSmMYB和dongSmMYB的全长cDNA克隆及序列分析
绿萼长茄ouSmMYB(GenBank登录号为KX224253)和紫萼长茄dongSmMYB(GenBank 登录号为KX224254)基因cDNA全长分别为969 bp和959 bp,开放阅读框长均为462 bp,编码153个氨基酸。SOPMA预测的蛋白二级结构预测(图6-A、B)表明,ouSmMYB和dongSmMYB编码的153个氨基酸残基中,α螺旋均占39.22%、β转角均占9.80%、无规则卷曲均占41.83%、延伸链均占9.15%,形成螺旋-螺旋-转角-螺旋结构。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6ouSmMYB蛋白质二级结构预测(A)和dongSmMYB蛋白质二级结构预测(B)
-->Fig. 6Prediction of secondary structure of ouSmMYB (A) and Prediction of secondary structure of dongSmMYB (B)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7绿萼长茄 ouSmMYB、紫萼长茄domgSmMYB与其他植物MYB氨基酸多序列比对
-->Fig. 7Alignment of the predicted amino acid sequences of ouSmMYB and domgSmMYB in S. melongena and those in several other plants
-->
多重氨基酸序列比对结果(图7)表明,ouSmMYB和dongSmMYB基因所编码的氨基酸序列具有两个不完全重复的DNA结合结构域,分别为R2结构域和R3结构域,属于典型的R2R3-MYB转录因子。由于MYB转录因子往往与bHLH蛋白形成复合物发挥作用,因此在R3结构域内还存在一个bHLH结合结构域。
依据与DFR蛋白相同的方法构建MYB转录因子系统发育树(图8),结果表明,绿萼长茄和紫萼长茄与箭叶淫羊藿(Epimedium sagittatum)进化关系最近,与葡萄(Vitis vinifera)、草莓(Fragaria x ananassa)、玉米(Zea mays)和马铃薯(Solanum tuberosum)等亲缘关系也相对较近,与拟南芥进化关系相对较远。此外,ouSmMYB和dongSmMYB与AtMYB1和MdMYB10a等11个MYB蛋白聚为一枝,而AtPAP1和AtPAP2这两个蛋白聚为另一枝。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8ouSmMYB、dongSmMYB与其他植物MYB蛋白的系统发生树
-->Fig. 8Phylogenetic tree analysis of ouSmMYB, dongSmMYB and MYBs from other plants
-->
2.4 ouSmDFR、dongSmDFR、ouSmMYB和dongSmMYB基因的表达分析
实时荧光定量结果(图9)表明,DFR在绿萼长茄果萼中表达量最低,并且随着生长,该基因的相对表达量几乎无变化;而在紫萼长茄果萼中,从初蕾期到盛花期,DFR相对表达量不断增加,尤其是由初花期到盛花期生长时,增幅最为明显,并且在盛花期高峰度表达,远远高于其在绿萼长茄果萼中的表达,相对表达量约是绿萼长茄的10倍。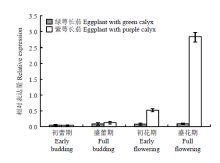 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9ouSmDFR、dongSmDFR相对表达量
-->Fig. 9Relative expression levels of ouSmDFR and dongSmDFR
-->
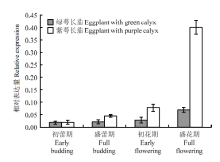
MYB实时荧光定量结果(图10)表明,在绿萼长茄果萼前三个时期表达量几乎无变化,在第4个时期即盛花期出现小幅增加,但整体表达水平仍然较低;紫萼长茄,随着生长,果萼中MYB相对表达量均呈上升趋势,并且从初花期到盛花期生长时,MYB表达陡然增加,盛花期高峰度表达。此外,不论在哪个生长时期,MYB在果萼中表达量均为紫萼长茄高于绿萼长茄,盛花期最为明显,盛花期MYB在紫萼长茄果萼中相对表达量大约是绿萼长茄的8倍。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10ouSmMYB、dongSmMYB相对表达量
-->Fig. 10Relative expression levels of ouSmMYB and dongSmMYB
-->
3 讨论
本研究克隆绿萼长茄果萼ouSmDFR和ouSmMYB和紫萼长茄果萼dongSmDFR和dongSmMYB,对ouSmDFR和dongSmDFR编码氨基酸序列与其他植物DFR进行多重序列比对发现均具有NADPH的结合位点和底物特异性结合位点,且高度保守,属于NADB超基因家族[17]。前人研究发现不同物种中DFR与底物结合区氨基酸序列的改变决定其底物的种类[22-23]。研究者在棉花(Gossypium hirsutum)[24]、玫瑰(Rosa rugosa)[25]和葡萄风信子(Muscari)[26]等物种中克隆到DFR同样具有上述两种结构域。进化分析表明,ouSmDFR和dongSmDFR与StDFR(Solanum tuberosum)和SlDFR(Solanum lycopersicum)具有相对较高的同源性。MYB蛋白序列分析和进化分析表明ouSmMYB和dongSmMYB转录因子与其他植物中花色苷途径相关的MYB蛋白的氨基酸序列具有较高的同源性,在其N端具有2个DNA结合域,分别为R2结合域和R3结合域,属于典型R2R3型MYB转录因子,还存在一个bHLH结合结构域[27-28],为形成MBW复合物提供bHLH转录因子结合位点[29-30]。其结构特征与月季(Rosa hybrida)[31]和大豆(Glycine max)[32]等其他植物的MYB具有相同性。生物信息学分析结果表明,ouSmMYB和dongSmMYB与EsMYB1(Epimedium sagittatum)具有相对较高的同源性,推测在花色苷生物合成过程中具有相同的功能,还需通过生物工程试验深入鉴定ouSmMYB和dongSmMYB的生物学功能。
DFR和MYB表达的实时荧光定量PCR结果表明,4个时期中DFR和MYB在两种茄子的果萼中都有表达,且紫萼长茄高于绿萼长茄。MYB相对表达量与DFR呈正相关的关系,由于MYB转录因子往往是通过调控结构基因表达而影响花色苷合成,所以笔者推测MYB可能与DFR存在相互作用,上调紫萼长茄果萼中DFR表达,使其果萼呈现紫色。但是盛花期ouSmMYB出现小幅增加,推测可能该基因可能还参与其他物质的合成途径。此外,参与花色苷生物合成途径的基因分前期基因和后期基因,前期基因包括PAL(苯丙氨酸裂解酶)、CHI(查尔酮异构酶)、CHS(查耳酮合酶)和F3H(黄烷酮3-羟化酶)等相关基因,后期基因除了DFR还包括ANS /LDOX(花色苷合成酶/无色花色苷双加氧酶)和UFGT(类黄酮3-O-糖基转移酶)等相关基因,两种茄子果萼颜色差异是否仅仅源于MYB转录因子对DFR表达的调控仍需要进一步研究。‘马克斯’红洋梨的出现时因为PyMYB10正调控UFGT的表达[33];苹果MdMYB3参与调控苹果花色苷合成[34];葡萄浆果中VvMYBPA1调控CHI表达,VvMYBA2促进UFGT表达,进而影响葡萄花色苷积累[35-36];芜菁(Raphanus sativus L.)中发现MYB1能够促进花色苷积累[37]。所以后续将克隆参与绿萼长茄和紫萼长茄果萼花色苷合成途径中所有结构基因,并对其表达进行分析,选取与MYB表达趋势一致的结构基因进行酵母单杂交试验,确定MYB转录因子通过调控哪个或是哪几个结构基因来影响果萼中花色苷积累,为阐释绿萼长茄和紫萼长茄果萼颜色差异的分子机理奠定基础。
研究发现,茄果皮花色苷的合成除受转录因子调控外,一定程度上还受光信号的影响,‘蓝山’茄果皮为紫色,而套袋处理后其果皮呈白色,但是,果萼颜色仍为紫色[19],推测存在不同的调控机制分别调控茄果萼和果皮花色苷的生物合成,通过比较二者机制异同,完全理解花色苷合成和调节的因子以及相关酶类相互作用,为提高茄中花色苷含量、选育优质茄品种提供理论基础。
4 结论
成功克隆绿萼和紫萼长茄果萼DFR和MYB的cDNA序列,其中ouSmDFR和dongSmDFR编码的氨基酸序列属于NADB超基因家族,而ouSmMYB和dongSmMYB则具有R2R3型MYB转录因子的典型特征,其N端具有R2、R3两个MYB结构域,C端高度特异。进化分析表明,ouSmDFR和dongSmDFR与马铃薯的DFR同源性较高;ouSmMYB和dongSmMYB与箭叶淫羊藿的MYB同源性较高。DFR和MYB的表达分析推测其可能在绿萼和紫萼长茄果萼颜色差异形成中发挥作用。The authors have declared that no competing interests exist.
