0 引言
【研究意义】骨骼肌是鸡胴体中最主要的组成部分,约占体重的50%,它不仅是运动器官,更是内分泌系统的重要组成部分,参与整个机体代谢的调节[1]。肌纤维是构成肌肉组织的基本单位,根据外观、收缩特性和代谢特征可将鸡骨骼肌纤维分成氧化型纤维(I型和IIa型,色红,进行有氧代谢)和酵解型纤维(IIb型,色白,进行酵解代谢)[2]。研究表明,肉的产量和质量都与肌纤维的生长和组成密切相关,肌纤维类型的差异是直接影响肌肉生长发育和肉品质的重要因素[3],氧化型肌纤维比例高的肌肉肉品质要显著优于酵解型肌纤维比例高的肌肉[4],在鸡上,比目鱼肌以氧化型肌纤维为主,而趾长伸肌和腓肠肌外侧头则以酵解型肌纤维为主。动物骨骼肌纤维类型组成并不是完全固定的,它们会随着骨骼肌对代谢与功能需求的改变而发生改变。因此,研究肌纤维生长发育及类型组成和转换的分子机理,挖掘在肌纤维生成和类型转换中发挥调控作用的关键因子将对鸡肉品质的遗传改良提供新的思路和策略。【前人研究进展】目前,国内外在肌纤维类型形成及其转换相关的分子遗传学方面已开展了一定的研究,并发现IGF-I-钙调磷酸酶-NFAT信号途径可能是调节肌肉生长、决定不同肌纤维类型的主要信号途径[5-6]。然而,肌纤维类型的发生与转换受到许多信号通路、基因与转录因子的调控,是一个非常复杂的调控过程,因此,很有必要在全基因组水平挖掘和筛选与肌纤维生长发育和类型组成相关的基因和信号通路。基因芯片技术由于能够同时检测出某个特定组织中的大量差异表达基因而被广泛应用于生命科学研究等领域[7]。许多****也在转录水平对不同物种中决定氧化型和酵解型肌纤维差异的机理进行了研究。CAMPBELL等采用Affymetrix芯片在雌鼠红肌和白肌中共发现了49个差异表达基因[8]。BAI 等采用猪骨骼肌cDNA芯片对22周龄约克夏猪腰肌(红肌)和背最长肌(白肌)进行了差异表达基因筛选,结果发现了一批在肌纤维类型组成中可能具有重要作用的候选基因[9]。LI等对梅山猪红肌和白肌组织进行转录组分析,结果发现了包括胰岛素信号通路和细胞周期通路在内的与不同肌纤维类型代谢特征相关的28条信号通路[10]。在鸡上,ZHENG等对不同发育时期蛋鸡和肉鸡胸肌的差异表达基因进行了筛选,发现了调控肌肉生长速度的一些关键基因[11]。本课题组前期采用Aligent表达谱芯片对清远麻鸡和科宝肉鸡比目鱼肌进行了差异表达基因和信号通路的筛选,共筛选到差异基因1 318个,主要涉及到肌肉发育、能量代谢、脂质代谢等生物学过程[12]。【本研究切入点】尽管前人在哺乳动物不同类型肌肉组织转录水平上的差异研究取得了阶段性进展,但在全基因组表达水平上对鸡骨骼肌表型差异的分子调控机理研究尚未见相关报道。【拟解决的关键问题】清远麻鸡是中国著名的地方鸡品种,素以皮色金黄、肉质嫩滑、皮脆爽、骨软、风味独特而驰名于粤港澳市场。本研究以清远麻鸡为研究对象,采用Agilent鸡全基因组表达谱芯片(4×44K,Design ID:026441)对比目鱼肌和趾长伸肌进行差异表达基因筛选,通过对差异基因进行GO,KEGG信号通路以及共表达网络分析,确定与肌纤维生长发育及类型组成相关的新候选基因,并进一步通过慢病毒介导的基因干扰技术进行基因功能的验证。研究结果将为优质鸡肉品质性状遗传改良提供理论基础。1 材料与方法
1.1 试验时间、地点
试验于2015年3—12月在江苏省家禽科学研究所下属的江苏省家禽遗传育种重点实验室进行。1.2 试验动物
清远麻鸡来自于广东天农食品有限公司清远麻鸡原种场,在同样的饲养管理条件下饲养至性成熟日龄(112d,平均体重1 330g),随机选择体重相近的全同胞母鸡3只进行屠宰。屠宰后,立即采集两侧趾长伸肌和比目鱼肌,其中右侧比目鱼肌和趾长伸肌中间1 cm×1 cm部分用于肌纤维性状的测定,左侧相同部位样品用于RNA抽提和芯片分析,所有样品均置于液氮速冻,然后转入-80℃冰箱保存。1.3 肌纤维性状组织学测定
在恒温冷冻切片机内进行冰冻切片的制作,每个样品在垂直于肌纤维延展方向做10张连续横切切片,切片厚度12 μm。采用ATPase碱孵育法进行肌纤维类型、肌纤维密度、肌纤维直径和面积的判定,在经典的Guth-Samaha法[13]基础上改良后进行染色,全部试剂均新鲜配制。1.4 RNA提取、质量检测及纯化
采用mirVanaTM RNA提取试剂盒(Applied Biosystemp/n AM1556)提取比目鱼肌、趾长伸肌和成肌细胞总RNA,用Agilent Bioanalyzer 2100(Agilent)对总RNA进行质量检测,合格后使用QIAGEN RNeasy® Mini Kit(QIAGEN)和RNsae-Free DNase Set(QIAGEN)纯化总RNA,采用Agilent Bioanalyzer2100(Agilent Technologies)检测RNA完整性,本试验所有样品RIN值均大于9,符合检测要求。1.5 芯片杂交
基因表达谱芯片采用Agilent公司的鸡全基因组4×44K芯片(Design ID:026441),探针数量为43 803。芯片杂交及数据处理由上海欧易生物医学科技有限公司完成。采用Low Input Quick Amp Labeling Kit, One-Color试剂盒(Agilent)对总RNA进行放大和标记;总RNA经第一链和第二链合成得到cRNA,Cyanine-3-CTP(Cy3)标记cRNA链后,用QIAGEN RNeasy Mini kit(QIAGEN)纯化标记后的cRNA;芯片杂交采用Agilent表达谱芯片配套试剂盒;采用Agilent Microarray Scanner进行扫描,分辨率为5 μm,扫描仪自动以100%和10%PMT各扫描1次,以Agilent自动合并2次结果作为最终结果;采用Feature Extraction Software(version10.7.1.1, Agilent Technologies)读取数据,Genespring Software(version 12.5; Agilent Technologies)进行归一化处理,算法为Quantile。所有操作均按试剂盒说明和Agilent表达谱芯片实验操作和分析手册进行。1.6 荧光定量PCR
为验证芯片的结果,本研究选择了9个差异表达基因,根据GenBank中的基因序列设计引物(表1)。参与芯片杂交的比目鱼肌和趾长伸肌总RNA同样用于荧光定量PCR验证试验。采用SYBR Green I法进行荧光实时定量PCR反应,以GAPDH基因作为内参基因进行数据的标准化处理,反应体系如下:2×SYBR Green Realtime PCR Master Mix 10 μL,上下游引物各0.4 μL(10 μmol·L-1),cDNA 模板1 μL,50×ROX Reference Dye 0.4 μL,加ddH2O 7.8 μL补足20 μL。反应条件为:95 ℃ 2 min;95 ℃ 20 s、60 ℃ 20 s、72 ℃ 60 s,共40个循环,扩增后经熔解曲线检测特异性。每次反应均设空白样品为阴性对照,每个样品设置3个重复。相对定量的结果采用2-△△Ct法进行计算。采用Pearson’s相关检验对基因芯片和qRT-PCR 2种方法的结果进行相关性分析。Table 1
表1
表1荧光定量PCR引物
Table 1Primer sequences used for qRT-PCR
| 基因名称 Gene symbol | 登录号 Accession number | 引物序列 Sequence of primers | 产物大小/bp Product length |
|---|---|---|---|
| PRKAG3 | NM_001031258.2 | F: 5′-GGATGCTCACCATCACTG-3′ R: 5′- TCTCCACGTCTCAATCTTGT-3′ | 104 |
| MYH1E | NM_001013397.2 | F: 5′-TCACCTCAGAATTGTGGAGT-3′ R: 5′- GCTGGATCTCCATTTCGT-3′ | 119 |
| PPP3CA | XM_004935968.1 | F: 5′-ATGGATGTGTTTACCTGGTC-3′ R: 5′- ACCATCTTCTTCTGTCCCTA-3′ | 111 |
| PPP3R1 | NM_204376.2 | F: 5′-CAGACATTCCCACGTACAC-3′TCTGTGAGAGAAATCCAGGT-3′ R: 5′-AAAGTTTGGCAACATTATCGT-3′ | 125 |
| PPARGC1A | NM_001006457.1 | F: 5′-GAAGAGGGAAGAATACCGC-3′ R: 5′- CCCACGTAAATCACACGAC-3′ | 111 |
| SCD5 | XM_004941119.1 | F: 5′-CAAAGAGGAGAAATCAGCCTA-3′ R: 5′- TTGGCCTGTATCTTCAACAC-3′ | 160 |
| FASN | NM_205155.2 | F: 5′-CTATGCTCTCAATGTTCTTGTG-3′ R: 5′-ACATAATGGGTTACAGGGC-3′ | 112 |
| SM | XM_424041.4 | F: 5′-CCAAGAAGGCCATCACTG-3′ R: 5′-GATGGTCTGCTCCATGTT-3′ | 106 |
| FRM | NM_204228 | F: 5′-AACCTCACCAAGTTCCGCAAG-3′ R: 5′-CCATGAAACTCCCGGCTCTT-3′ | 113 |
| MEF2C | XM_004949409 | F: 5′-TTTGGGAATGAACAACCGTA-3′ R: 5′-GGAAACCACTGGAGTAGCC-3′ | 135 |
| CnAα | XM_004935968.1 | F: 5′-ATGGATGTGTTTACCTGGTC-3′ | 111 |
| R: 5′-ACCATCTTCTTCTGTCCCTA-3′ | |||
| NFATC3 | XM_414078 | F: 5′-ACCATGTGCGATTCATCTCC-3′ | 136 |
| R: 5′-GGCTGGTATTCCAGGTCAGA-3′ | |||
| STAT5B | NM_204779.1 | F: 5′-CGCTGAGAGGATGTTCTG-3′ | 101 |
| R: 5′- GAACACGTAGATGAGGTAACTG-3′ | |||
| BMP4 | NM_205237.3 | F: 5′-ATGCTGATGGTCATCCTAC-3′ | 106 |
| R: 5′-CTTGTCCCTGAAGCTCTG-3′ | |||
| GAPDH | NM_204305 | F: 5′-CGATCTGAACTACATGGTTTAC-3′ R: 5′-TCTGCCCATTTGATGTTGC-3′ | 153 |
新窗口打开
1.7 PPARGC1A基因shRNA载体构建、细胞分离培养及转染
根据PPARGC1A基因序列(NM_001006457.1)设计并合成4对shRNA片段,分别为shRNA-563(5′GCAATAAAGCGAAGAGCATTT3′),shRNA-926(5′GGACTTCACCTAAGCCGAAGT3′),shRNA-验1317(5′GCAGGGATCCCAAGGTAATAA3′)and shRNA-1688(5′GCT CTAGATCAAGGTCCTTTC3′),同时设计了NC shRNA作为阴性对照:5′ TTCTCC GAACGTGTCACGTTTC3′,由上海吉玛基因股份有限公司完成。成肌细胞分离自10胚龄的清远麻鸡,分离方法参照LI等[14]。细胞计数后调整浓度至1×106个/mL,接种于6孔板中培养。待细胞生长至70%—80%融合时进行转染,48h后观察细胞转染情况,72h后收集细胞提取RNA进行荧光定量PCR,发现shRNA-1317转染效率最高,故将其用于转染正式试验。转染后96h收集细胞,采用荧光定量PCR检测细胞中与肌纤维生长发育与类型转换相关基因SM,FRM,MEF2C,NFATC3和PPP3CA的表达变化(表1)。
1.8 统计分析
采用SAM3.0软件筛选差异表达基因,筛选标准为P≤0.05,同时变化倍数≥2或≤0.5。采用GOEAST软件对差异表达基因进行基因功能分类(Gene ontology, GO),KEGG数据库(http://www.genome. jp/kegg/),利用Fisher精确检验和卡方检验对差异基因参与的Pathway进行显著性分析,按照P value<0.05进行筛选得到显著性的Pathway。采用cytoscape3.3软件对差异基因进行共表达网络分析。运用SPSS软件(IBM SPSS Statistics 20)中ANOVA统计目的基因在不同类型肌肉之间的表达差异。所有数据以Mean ± SE表示,P<0.05,表示差异显著;P<0.01,表示差异极显著。
2 结果
2.1 清远麻鸡比目鱼肌和趾长伸肌中肌纤维性状比较
比较了清远麻鸡比目鱼肌和趾长伸肌的肌纤维横截面积、直径、密度以及氧化型和酵解型肌纤维的比例,结果见表2。可见,趾长伸肌的肌纤维横截面积、直径以及酵解型纤维比例均显著高于比目鱼肌(P<0.05),而肌纤维密度和氧化型纤维比例则显著低于比目鱼肌(P<0.05)。Table 2
表2
表2清远麻鸡比目鱼肌和趾长伸肌的肌纤维性状比较
Table 2Myofiber characteristics of the SOL and EDL muscles in Qingyuan partridge chickens
| 肌纤维性状 Myofiber characteristics | 比目鱼肌 Soleus | 趾长伸肌 Extensor digitorumlongussides | Sig.1 |
|---|---|---|---|
| 横截面积CSA (μm2) | 1991±112 | 2863±331 | * |
| 直径Diameter (μm) | 47.8±1.3 | 57.9±4.2 | * |
| 密度 Density No./μm2) | 428±23 | 309±43 | * |
| 氧化型纤维比例 Oxidativemyofiber ratio | 0.79±0.02 | 0.15±0.04 | * |
| 酵解型纤维比例 Glycolyticmyofiber ratio | 0.21±0.02 | 0.85±0.04 | * |
新窗口打开
2.2 比目鱼肌和趾长伸肌中差异表达基因筛选及荧光定量PCR验证
采用Agilent鸡全基因组表达谱芯片比较清远麻鸡比目鱼肌和趾长伸肌中基因表达谱差异,共发现差异倍数在2倍及以上的基因1 224个(P<0.05, FC≥2),以趾长伸肌作为参照,比目鱼肌中上调基因为654个,下调基因为570个,差异基因的功能主要涉及收缩结构和细胞骨架、细胞信号、能量代谢、应激、转录调控、脂肪酸合成和代谢等方面。所有芯片数据均已提交至NCBI的GEO数据库(登录号为GSE69918)。采用荧光定量PCR的方法对基因芯片所筛选的差异表达基因进行了验证,随机选取9个基因,其中下调基因6个(MYH1E, PPP3CA, PPP3R1, PRKAG3, FASN和STAT5B),上调基因2个(PPARGC1A, BMP4和SCD5)。除了FASN基因外,其他8个基因在两种肌肉组织中的表达量均表现出显著差异(P<0.05 or P<0.01)(图1)。通过相关分析发现,芯片和荧光定量PCR两种方法所得的结果具有正相关关系,所选基因的表达趋势是一致的,Pearson相关系数为0.85(表3),结果进一步验证了芯片结果的可靠性。
Table 3
表3
表3芯片和荧光定量两种方法基因表达的差异倍数
Table 3Difference of fold change at mRNA level of each gene between microarray and qRT-PCR analysis
| 差异倍数 Fold change | MYH1E | PRKAG3 | FASN | SCD5 | PPP3CA | PPP3R1 | PPARGC1A | STAT5B | BMP4 |
|---|---|---|---|---|---|---|---|---|---|
| 芯片结果 Microarray result | -57.5 | -10.8 | -2.3 | 2.2 | -3.6 | -2.0 | 2.2 | -2.6 | 3.5 |
| qRT -PCR结果 qRT -PCR result | -11.2 | -17.6 | -1.16 | 1.47 | -4.29 | -3.0 | 2.3 | -3.2 | 4.1 |
| 相关系数 R | 0.85 | ||||||||
新窗口打开
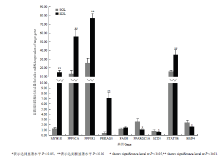 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1荧光定量结果
-->Fig.1qRT-PCR results
-->
2.3 差异表达基因的GO和KEGG信号通路分析
对差异表达基因进行GO(GO ontology)功能分类,共发现了74个显著性GO(P<0.05),主要分为3大类:生物学过程(34个显著性GO)、分子功能(20个显著性GO)和细胞组分(20个显著性GO)。在生物学过程方面,发现差异表达基因主要参与了能量代谢过程(包括小分子代谢过程,碳水化合物代谢过程,糖酵解过程,氧化还原过程,类固醇代谢过程以及丙酮酸代谢过程)。同时,3个与肌肉发育相关的生物学过程也被显著富集,分别为快肌与慢肌纤维的转换过程,胚胎骨骼形态发生过程以及骨骼肌收缩过程,TNNC1, ATP2A2, HOXD11, COL2A1, CHRNA1和TNNI2等6个基因参与了这些生物学过程,这些基因可能在肌纤维发育和类型组成中发挥重要作用。本研究的差异表达基因共被富集到20条显著的KEGG信号通路(P<0.05),其中心肌细胞的肾上腺素信号通路最为显著(图2)。值得关注的是,一些已知的与肌纤维类型转换(Calcium和PPAR信号通路)、肌肉发育(Insulin信号通路)以及脂质代谢(adipocytokine信号通路)相关的信号通路也在两种类型的肌肉中被富集到,共有62个差异表达基因参与到这4条信号通路中,包括ATP2A2, PRKAG3, PPARGC1A和TNNC1。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2两种类型肌肉组织中差异表达基因富集显著的KEGG信号通路
-->Fig. 2Enriched KEGG pathway for all DEGs identified between SOL and EDL muscles
-->
2.4 差异基因共表达调控网络分析
为了进一步了解差异表达基因之间的调控网络关系,笔者从差异表达的基因中选择了一些已知的与肌纤维生长发育和类型组成相关的基因,首先采用Person’s相关分析基因间的相关系数,然后以相关系数r2>0.8且P<0.05为筛选标准,选留了300个基因对,并采用cytoscape3.3软件构建基因共表达网络。结果显示,PPP2CA, PRKAG3, ATP2A2, PPARGC1A 和PPARGC1B为关键节点基因(图3)。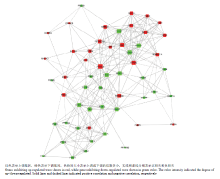 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3差异表达基因构建的共表达网络
-->Fig. 3Coexpressed gene network for the selected DEGs
-->
综合GO,KEGG信号通路以及基因共表达网络分析结果,推测PRKAG3, ATP2A2 以及PPARGC1A可能是与肌纤维类型性状紧密关联的关键基因,且ATP2A2和PPARGC1A在红肌中的mRNA表达水平要高于白肌。因此,笔者选择了其中的PPARGC1A基因进行了后续的功能验证。
2.5 干扰PPARGC1A基因后对肌纤维发育及类型相关基因的影响
本研究设计的4对shRNA片段(shRNA-563, shRNA-926, shRNA-1317和shRNA-1688)的干扰效率分别为11%,26%,46%和37%。因此,选择干扰效率最高的shRNA-1317进行正式试验。在干扰后96h,荧光定量PCR结果显示,PPARGC1A基因的表达被有效抑制(P<0.01)。PPARGC1A基因的敲低,也引起了PPP3CA(P<0.01),MEF2C(P<0.05)以及SM(P<0.01)等慢肌纤维标志基因以及与肌纤维发育与转换相关基因表达水平的显著降低,而快肌纤维标志基因FWM的表达水平则显著上升(P<0.05)(图4)。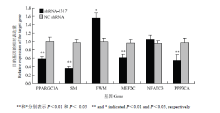 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4干扰PPARGC1A基因后成肌细胞中与肌纤维性状相关基因的表达变化
-->Fig. 4The relative expression changes of myofiber related genes in myoblasts transfected with PPARGC1A shRNA-1317
-->
3 讨论
3.1 两种类型肌肉之间的差异表达基因分析
肌纤维类型的组成可影响肉色、系水力、嫩度、多汁性以及风味等诸多肉品质性状。RENAND等研究表明,肌纤维大小与肉品质性状存在负相关,I型肌纤维含量越高的肌肉,其多汁性和风味越好[15]。本研究发现,清远麻鸡比目鱼肌和趾长伸肌在表型上也存在显著的差异,趾长伸肌中肌纤维横截面积、直径以及白肌纤维的比例均显著高于比目鱼肌,这也与前人报道的比目鱼肌为红肌为主的肌肉,而趾长伸肌为白肌为主的肌肉的事实相符合[4]。因此,本研究以这两种类型肌肉为研究对象,采用安捷伦鸡全基因组表达谱芯片挖掘鸡肌纤维生长发育及类型组成的候选基因。结果在比目鱼肌和趾长伸肌间共发现了1 224个差异表达基因,随机选取其中9个差异表达基因进行荧光定量PCR验证,尽管所选基因在两种方法间的差异倍数并不完全一致,但表达趋势是高度一致的,这也证明本研究芯片分析得出的结果是可信的。通过对差异表达基因的分析和文献检索,发现一些已被报道的在红肌和白肌间差异表达的基因,如PGM1, fibronectin, HMOX1, SM1, MYH1E, PPARGC1A, PPARGC1B, PPP3CA以及PPP3R1[8, 10, 16-18],在本研究中同样被筛选到。值得关注的是,一些能量代谢相关酶基因、胶原蛋白基因以及慢肌蛋白编码基因等可能与优良肉品质相关的基因在氧化型肌肉中的表达量也要显著高于酵解型肌肉。同时,本研究也发现了一些未曾报道的与肌纤维类型相关的重要转录因子如PPARA, HOXA1以及GTF3C6等,在不同类型的肌肉间也表现出显著的差异表达,这些将可能作为对不同肌纤维类型进行调控的新转录因子进行进一步研究。
3.2 GO、KEGG信号通路及共表达网络分析
本研究的GO功能分类结果发现,参与能量代谢相关通路(如小分子代谢过程、碳水化合物代谢过程、糖酵解过程、氧化还原过程、类固醇代谢过程和丙酮酸的代谢过程)和肌肉发育相关通路(如快肌与慢肌纤维的转换过程,胚胎骨骼形态发生过程以及骨骼肌收缩过程)的基因在两种类型的肌肉中具有显著差异,这也与不同肌纤维类型具有不同的能量代谢特征的报道一致[19]。KEGG信号通路分析发现,心肌细胞的肾上腺素信号通路被富集为最显著的通路,该信号通路是心肌细胞中最为重要的蛋白信号系统,能够调节心脏搏动时间、钙离子转运以及收缩强度[22]。同时,一些与肌纤维类型转换相关的通路(如Calcium和 PPAR信号通路)、肌肉发育相关通路(Insulin信号通路)以及脂质代谢相关通路(如adipocytokine信号通路)也被富集为显著的信号通路。Calcium信号通路是迄今发现的唯一受钙离子/钙调素(Calmodulin, CaM)活化的丝/苏氨酸蛋白磷酸酶,可通过去磷酸化作用使某些特异的转录因子如T细胞活化核因子(nuclear factor of activated t cell, NFAT)和核因子kappaB(Nuclear factor kappa B, NFКB)等激活后进入细胞核,对基因转录进行调控,可促使慢肌纤维特异表达的一些基因表达水平上调[23]。PPAR信号通路在肌纤维类型的调控中同样发挥着重要的作用[24]。Insulin信号通路中的IGF-I很早即被证明能够刺激成肌细胞分化速率并影响生肌调节因子家族基因的表达[25-26]。该结果表明与肌肉、脂肪和结缔组织发育相关的信号通路之间可能存在互作,形成了一个复杂的调控网络从而影响肌纤维发育和类型组成。本研究进一步基于GO和KEGG信号通路分析中发现的或者已有文献报道的与肌纤维发育和类型转换相关的基因,进行了基因共表达网络分析。通过共表达网络分析发现了3个可能与鸡肌纤维类型组成相关的重要的节点基因(PRKAG3, ATP2A2 和PPARGC1A),这3个基因彼此之间存在互作关系,这与前人的报道相一致[27]。PRKAG3是编码一磷酸腺苷激活蛋白激酶(a heterotrimeric serine/threonine protein kinase,AMPK)γ3亚基的基因,只在骨骼肌中特异性地表达。CHEN等报道PRKAG3基因中的一个SNP位点对肌纤维密度具有显著的遗传效应[28]。本研究中,PRKAG3基因在趾长伸肌中的mRNA表达量要显著高于比目鱼肌(差异倍数为10.82,P<0.01),这也与趾长伸肌中具有较高的糖原含量的事实相符合,同时也与前人在哺乳动物中的报道结果一致,即PRKAG3基因在快速酵解型肌肉中的表达量要显著高于氧化酵解型肌肉,而在慢速氧化型肌肉中基本检测不到[29]。ATP2A2是ATP2As基因家族的成员,编码肌浆(内质)网钙转运ATP酶中的一种,即SERCA2,在钙离子相关信号通路中发挥着重要作用。WEI等报道ATP2A2能够调控慢肌基因的表达[30],这也与本研究中该基因在氧化型的比目鱼肌中特异性高表达(差异倍数151.9,P<0.001)的结果一致。过氧化物酶体增殖物激活受体γ辅激活因子1A(PPARGC1A或PGC-1α)是一种多功能的辅激活因子,在骨骼肌超表达PGC-1α的转基因小鼠中,快酵解型肌肉股肌和跖肌中I型肌纤维的含量增加;同时,利用快慢肌纤维特异的启动子,发现PGC-1α与MEF2蛋白协同激活慢肌纤维相关基因的转录并能够作为CaN信号通路的靶基因发挥作用[16]。课题组前期研究了PGC-1α基因对鸡肌纤维特性的遗传效应,发现该基因的多态位点及其单倍型与肌纤维类型等性状紧密关联[31],因此,本研究选择PPARGC1A基因作为影响肌纤维类型组成及转换的候选基因进行了进一步的功能研究。
3.3 PPARGC1A基因在肌纤维类型组成和转换中的作用
本研究共构建了4对shRNA片段来研究PPARGC1A基因在肌纤维类型组成和转化中的功能,通过预试验选择了干扰效率最高的shRNA-1317进行正式试验。结果发现,PPARGC1A基因的敲低,引起了PPP3CA,MEF2C以及SM等慢肌纤维标志基因以及与肌纤维发育与转换相关基因表达水平的显著降低,而快肌纤维标志基因FWM的表达水平则显著上升,这一结果也证明了PPARGC1A基因能够与钙离子信号通路相关基因协同从而在鸡肌纤维类型组成和转换中发挥着重要作用,也验证了LIN等的结论,即PPARGC1A可能与MEF2蛋白协同激活慢肌纤维相关基因的转录并能够作为CaN信号通路的靶基因发挥作用[16]。4 结论
首次在全基因组水平上研究了清远麻鸡不同类型肌肉(红肌和白肌)中基因表达差异,发现了PRKAG3, ATP2A2和PPARGC1A基因可能在肌纤维类型组成和转换中发挥重要作用。对PPARGC1A基因进一步的功能验证证实了该基因在鸡肌纤维类型组成和转换中发挥了重要的作用。本研究结果将对中国地方鸡肉品质性状的遗传改良提供重要的理论指导。The authors have declared that no competing interests exist.
