0 引言
【研究意义】农作物的产量会受到生长环境的影响。目前,全球作物产量由于土地缺水和盐渍化受到严重地制约,作物的抗逆性成了育种中需要考虑的重要方面。干旱是目前最普遍的环境胁迫,植物应对干旱通常包括4种机制:避旱性(drought avoidance)、耐旱性(drought tolerance)、逃旱性(drought escape)和复水旱性(drought recovery)。其中最主要的是避旱性,主要表现为以叶片卷曲来减少水分散失、利用发达的根系来提高水分吸收能力和减慢营养生长到生殖生长的转变,以免在干旱时造成减产[1]。当植物受到极端环境胁迫时,会产生应答反应。环境胁迫首先被植物感应,然后通过一系列信号转导途径,诱导植物内源抗逆基因的表达从而影响植物的生长发育。研究植物逆境信号通路,分离和鉴定胁迫相关基因,对作物抗逆育种和利用转基因策略来提高作物的抗逆能力起着十分重要的作用[2]。【前人研究进展】研究表明植物激素在逆境胁迫中起到关键作用,如ABA及乙烯。植物激素ABA信号转导途径在逆境胁迫中的机制已较为清晰[3-4]。转录因子是参与逆境胁迫的一类重要的调节子[5-7],很多与干旱和耐盐相关的转录因子均能够被ABA诱导,如一些bZIP类型转录因子[8-10]。这些转录因子的启动子中含有ABA响应元件,参与ABA介导的逆境信号通路。水稻中OsbZIP23能够被多种非生物胁迫诱导,过表达OsbZIP23明显提高了水稻对干旱、高盐的耐受性和对ABA的敏感性。OsbZIP23能正向调控OsPP2C49和OsNCED4 的表达提高水稻对干旱和高盐的抗性[11-12]。在拟南芥(Arabidopsis thaliana)中,WRKY转录因子家族成员ABO3的突变体植株abo3对ABA极度敏感,相较于野生型,abo3的耐旱能力减弱,分析发现,在abo3中ABA响应转录因子ABF2/AREB1表达明显降低。经ABA处理后,发现在处理早期abo3中ABF2、RD29A 和COR47的表达明显受抑制,表明ABO3与这些ABA诱导基因的表达相关[13]。目前,乙烯在逆境胁迫中的调控通路还不清楚。有研究发现,干旱、高盐、低温、水淹、机械损伤等非生物胁迫都能诱导植物体内乙烯含量的增加[14]。受到干旱胁迫时,植物体内乙烯含量的升高,能促进对干旱的抵抗能力[15]。乙烯参与植物耐旱主要是通过乙烯信号转导通路下游ERF转录因子家族,很多ERF转录因子均参与植物耐旱。在水稻中,ERF家族转录因子TSRF1通过调控MYB、MYC以及脯氨酸合成等相关基因来增强干旱和渗透胁迫的耐受性[16]。OsERF71也具有抗旱的功能[17],在根部过表达OsERF71能够提高水稻干旱耐受性,在干旱胁迫下过表达OsERF71能改变根部的形态结构,并且OsERF71能够直接结合木质素合成基因OsCCR1的启动子,表明OsERF71可能与细胞壁的合成、木质素合成相关基因共同作用来参与水稻耐旱调节。上述转录因子都是受激素调控的下游基因,本文报道一个乙烯合成途径上游基因的功能。在著名的Yang Cycle中[18-19],与Fe2+结合的顺式还原酮加双氧酶(acireductone dioxygenase,ARD)催化顺式还原酮生成KMTB (2-Keto-4-methylthiobutyrate),KMTB进而被催化生成甲硫氨酸(Met)。Met是乙烯合成途径中的重要物质,植物中乙烯的合成是首先通过催化Met形成S-腺苷甲硫氨酸,S-腺苷甲硫氨酸由ACC合成酶催化生成乙烯前体ACC(1-aminocyclopropane- 1-carboxylic acid),ACC被氧化后生成乙烯[18],所以ARD位于乙烯合成的上游。在细菌里,DAI等[20]发现在肺炎克雷伯菌(Klebsiela pneumoniae)中有2种ARD酶,这两种酶的蛋白质构成完全相同,由同一个基因编码,但由于结合的金属离子不同,却行使了完全相反的功能。很多研究表明真核生物中参与甲硫氨酸循环的2个ARD蛋白同样行使完全不同的功能,Fe-ARD催化顺式还原酮生成KMTB进而促进Met的合成;Ni-ARD参与催化顺式还原酮生成甲基丙酸乙酯,顺式还原酮的消耗使Met的合成减少[21]。ARD1在真核生物中高度保守,水稻中ARD家族有2个成员OsARD1和OsARD2(OsARD),OsARD1与Fe2+结合参与甲硫氨酸循环的补救途径催化形成KMTB进而生成Met,OsARD2则与Ni+结合[22-23]。SAUTER等[22]还发现OsARD1的表达受到乙烯和水淹的诱导,表明OsARD1可能与乙烯信号转导相关。【本研究切入点】OsARD1是乙烯合成通路的上游基因,能够催化顺式还原酮形成酮酸促进甲硫氨酸的合成,进而乙烯合成增加,而且它还能被乙烯反馈诱导,然而OsARD1在水稻中的生物学功能仍然未知。【拟解决的关键问题】本研究利用反向遗传学的方法对OsARD1的生物学功能进行探究。利用RT-PCR方法,分析OsARD1在水稻不同组织和器官中的表达特异性。通过构建过表达载体获得过表达转基因植株,通过多种非生物胁迫处理,研究OsARD1的功能,为水稻耐旱机制的研究及耐旱品种的选育提供参考。1 材料与方法
1.1 材料
研究材料为粳稻品种中花11(Oryza sativa L. ssp.Japonica cv. Zhonghua 11)及其转基因植株,田间材料均种植于天津市天津师范大学试验田,保持日常管理。用于处理的材料均种植于人工气候箱中(Climacell MMM,德国)。1.2 OsARD1过表达载体的构建及遗传转化
从60 d的成熟水稻叶片中提取总RNA,用M-MLV反转录酶(Vazyme,南京)反转录合成cDNA,以其为模板,用OsARD1特异性引物(OsARD1-OV-F:5′-TTAggtaccTTCCACCCCGCAATCCACAT-3′和OsARD1-OV-R:5′-GTTgtcgacGTGCAGGAGCCCAA CAAAAC-3′,小写字母部分为酶切位点序列)进行PCR扩增,获得OsARD1完整的ORF(open reading frame)。PCR扩增程序为95℃ 1 min;94℃ 30 s,62℃ 30 s,72℃ 30 s,35个循环。所用DNA聚合酶为高保真特性的酶(Vazyme,南京)。凝胶检测正确后纯化(Promega,上海)回收目的片段,与pCAMBIA2300空载体连接。对重组载体进行酶切及测序验证后转入农杆菌(EHA105)中,通过农杆菌遗传转化法获得OsARD1过表达转基因植株,同时转入pCAMBIA2300空载体作为对照,转化方法参照HIEI等[24]。1.3 转基因植株的分子检测
T0代过表达转基因植株在田间生长到约60 d后,进行转基因分子检测。用CTAB法[25]提取叶片基因组DNA,对pCAMBIA2300载体中特有的新霉素磷酸转移酶基因(NPTⅡ)进行扩增。所用引物为NPTⅡ-F:5′-TTCTCACTGAAGCGGGAAGGG-3′和NPTⅡ-R:5′-GCGATACCGTAAAGCACCAGG-3′,PCR扩增程序为94℃ 4 min;94℃ 30 s,57℃ 30s,72℃ 30 s,30个循环。1.4 OsARD1的表达分析
对于组织特异性表达分析,从水稻不同组织器官(茎顶端分生组织、根、茎、幼叶、叶鞘)和不同时期的幼穗中提取总RNA;对于水稻不同生长时期叶片中目的基因表达分析,从田间不同时期水稻倒二叶中提取总RNA,时期分别为:14 d大小幼苗期、抽穗期及成熟衰老期(叶片已大面积黄化的水稻植株),取样时间均为上午10点;对于过表达转基因植株中目的基因表达分析,从65 d大小的水稻叶片中提取总RNA。提取的总RNA经DNaseⅠ进行去基因组处理后,用M-MLV反转录酶进行反转录获得cDNA,以cDNA为模板进行PCR扩增。所用目的基因引物为OsARD1-F:5′-GCGAGAACCTGAAGAGAATC-3′和OsARD1-R:5′-CCTCCTTTCTTCAGTGCTAT-3′,PCR扩增程序为94℃ 4 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,30个循环。以水稻的OsActin1作为内参基因,所用引物为OsActin1-F:5′-GACTCTGGTGATGGTGT CAGC-3′和OsActin1-R:5′-GGCTGGAAGAGGACCT CAGG-3′,PCR扩增程序为:94℃ 4 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,24个循环。1.5 缺水处理及PEG渗透胁迫处理
缺水处理试验:将催芽后的野生型和OsARD1- OV过表达转基因T1代种子种植在木村营养液(国际水稻所)里生长,12 d后撤去营养液进行缺水处理,观察记录表型,干旱处理后将干旱处理的植株重新放入营养液中培养,复水培养3 d后统计植株的存活率。渗透胁迫试验:将催芽后的野生型和OsARD1- OV过表达转基因种子分别种在含有5% PEG6000(渗透势为-0.05 MPa[26])及无PEG6000的agar培养基中生长,并进行表型观察记录。
1.6 不同非生物胁迫处理及表达分析
机械损伤:将营养液中培养的14 d大小的野生型幼苗用镊子对叶片及茎进行机械损伤,没有进行机械损伤的幼苗作为对照,分别提取处理0、3、6、12和24 h后处理组和对照组幼苗的总RNA进行表达分析。盐胁迫:将营养液中培养的14 d大小的野生型幼苗,转入含有200 mmol·L-1 NaCl营养液中进行处理,以在正常营养液中生长的幼苗作为对照,分别提取处理0、3、6、12和24 h后处理组和对照组幼苗的总RNA进行表达分析。
渗透胁迫:将营养液中培养的14 d大小的野生型幼苗,转入含有20% PEG6000营养液(渗透势为-0.49 MPa[26])中进行处理,以在正常营养液中生长的幼苗作为对照,分别提取处理0、6、12、24、和48 h后处理组和对照组幼苗的总RNA进行表达分析。
非生物胁迫处理后提取总RNA,经DNaseⅠ进行处理,反转录合成cDNA,利用qRT-PCR方法分析不同非生物胁迫处理下目的基因的表达规律,每次试验
设置3个重复。
2 结果
2.1 OsARD1的表达模式分析
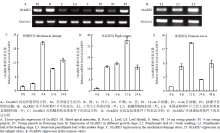
通过研究OsARD1在水稻不同器官中的表达, 发现OsARD1在各个组织器官中均有表达,但在不同器官中的表达量有明显差异。OsARD1在根和已开花的穗(P3)中高表达,在茎顶端分生组织和14 cm长的穗中(P1)表达量较高,在幼叶、叶鞘、茎和4 cm长的幼穗(P2)中表达量较低(图1-A)。进一步分析OsARD1在不同时期水稻叶片中的表达情况,结果表明,OsARD1在幼嫩的叶片(L1)中表达量较低,在成熟的叶片(L2)中表达量较高,而在衰老的叶片(L3)中表达量最高(图1-B),表明OsARD1在植株成熟的组织高表达。上述时空特异性表达结果表明,OsARD1在衰老的叶片中表达明显升高,表明OsARD1的表达可能受某些环境因素的诱导。通过对野生型幼苗进行了多种非生物胁迫处理,结果表明,OsARD1受机械损伤、高盐和渗透胁迫的诱导。机械损伤处理3 h后, OsARD1的表达开始升高,处理6 h后达到峰值(图1-C)。高盐胁迫处理3 h后OsARD1表达量明显上升,处理12 h后达到峰值(图1-D)。PEG渗透胁迫处理6 h后,OsARD1的表达明显升高,处理12 h后达到峰值(图1-E)。上述结果表明OsARD1的表达明显受到非生物胁迫处理的诱导,表明OsARD1可能参与了水稻对非生物胁迫耐受的调节途径。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1OsARD1的表达模式分析
-->Fig. 1The expression pattern of OsARD1
-->
2.2 OsARD1过表达载体的构建
利用RT-PCR的方法获得OsARD1的全长ORF,经琼脂糖凝胶电泳检测后(图2-B)切胶回收。将纯化回收后的目的片段与含有2×35S启动子的空载体pCAMBIA2300经限制性内切酶KpnⅠ和SalⅠ进行双酶切,利用T4 DNA连接酶16℃过夜连接获得重组载体。双酶切后电泳检测,有预期的目的条带(图2-C),表明OsARD1的全长ORF片段已成功与过表达空载体连接(图2-A)。为了进一步确保载体的正确性,将构建好的过表达载体进行测序验证后,转入农杆菌中以备后续转基因试验。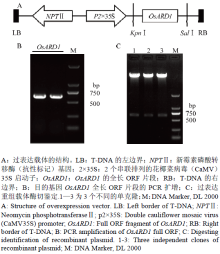 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2OsARD1过表达载体的构建
-->Fig. 2Construction of OsARD1 overexpression vector
-->
2.3 过表达转基因植株的获得及表达分析
利用农杆菌介导的遗传转化方法,将重组载体转入野生型中花11中获得OsARD1过表达转基因植株。通过转化获得6个独立株系共40株T0代转基因植株,经分子检测后发现有37株为转基因阳性植株(图3-A)。田间观察过表达转基因植株与空载体对照转基因植株,二者没有明显生长发育表型差异。用RT-PCR方法分析6个独立株系的18个转基因植株中目的基因OsARD1的表达,结果表明,相较于野生型转基因植株中目的基因的表达均有明显升高(图3-B),说明过表达载体在转基因植株中正常工作。收获T0代转基因植株种子后,选取4个过表达株系第二年在大田里进行种植获得T1代转基因株系,并检测了T1代植株中目的基因的表达情况,发现OsARD1在4个过表达株系中表达量均明显升高(图3-C),表明过表达性状可以稳定遗传。与对照组相比,T1代转基因植株仍未见明显生长发育表型差异(图3-D)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3OsARD1过表达转基因植株的表型及表达分析
-->Fig. 3Phenotype and expression analysis of OsARD1 overexpressing transgenic lines
-->
2.4 过表达OsARD1增强水稻的抗旱能力
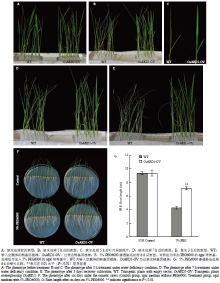
由于OsARD1受机械损伤、高盐及渗透胁迫的诱导,推测OsARD1可能与非生物胁迫相关。用脱水和PEG模拟干旱处理过表达转基因植株及空载体对照转基因植株,观察过表达转基因植株及对照的表型。选取过表达株系中的5号株系(#5),进行干旱和渗透处理试验。将水培生长12 d的水稻幼苗进行缺水处理(图4-A),处理3.5 h后,对照植株叶片开始卷曲,而过表达转基因植株没有明显变化。处理5 h后,对照植株叶片已经完全失水卷曲呈针状,表现出严重的缺水症状,但是此时过表达转基因植株大部分生长正常,叶片仍处于舒展状态(图4-B和图4-C)。处理7 h后对照植株叶片失水严重,而过表达转基因植株仍然有舒展的叶片(图4-D),在缺水处理8 h后开始复水,将缺水处理的幼苗放入营养液中正常培养。培养3 d后,统计植株的存活率,发现野生型植株的存活率仅为10%,而过表达植株的存活率为80%,存活率远远高于野生型(表1)。这一结果表明过量表达OsARD1明显增强了水稻抗旱耐缺水能力。Table 1
表1
表1脱水处理后恢复浇水培养后幼苗存活率
Table 1Survival rate of seedlings after recovery of irrigation in water deficit treatment
| 存活情况 Survival analysis | 野生型 WT | 过表达转基因植株 OsARD1-OV |
|---|---|---|
| 存活率 Survival rate (%) | 10 | 80 |
| 存活株数/总数 Number of survivors / total | 2/20 | 16/20 |
新窗口打开
此外,将催芽后的对照和OsARD1过表达转基因种子分别种在含有5% PEG6000及不含PEG6000的琼脂培养基中。处理6 d后发现,不含PEG的agar培养基中对照和过表达的幼苗生长情况没有明显的差别(图4-F);在PEG处理组中,对照幼苗根的生长受到严重抑制,而过表达植株幼苗根的生长受到的抑制较小,根长明显长于对照植株(图4-F)。对野生型和过表达转基因植株的根长进行了测定,结果表明,过表达转基因植株的根长比野生型植株长近一倍(图4-G)。渗透试验中过表达植株对PEG处理的耐受力更强,表明过量表达OsARD1明显提高了水稻对渗透胁迫的耐受能力。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4缺水及PEG处理情况下表型分析
-->Fig. 4Phenotypic analysis under water deficit and osmotic stress treatment
-->
3 讨论
通过分析OsARD1的时空表达特性,发现OsARD1在根及成熟的组织器官中表达较高,在植株衰老时期的叶片中表达量明显升高。用不同的非生物胁迫处理野生型中花11幼苗,发现OsARD1还受到机械损伤、高盐和渗透胁迫的诱导,这表明OsARD1可能与水稻的非生物胁迫应答有关。因此,进一步构建OsARD1过表达载体,获得了转基因植株,并分析OsARD1在过量表达条件下的功能。研究结果表明,过表达OsARD1可以增加水稻对水分亏缺和渗透胁迫的耐受能力。在植物中,Fe-ARD能参与甲硫氨酸补救途径,促进甲硫氨酸的合成[21],而甲硫氨酸又是乙烯合成途径中的初始底物[27],因此,过表达OsARD1,能够促进KMTB的形成,进而增加甲硫氨酸合成,从而促进下游乙烯的合成,所以在乙烯合成途径中ARD1位于乙烯合成的上游。而水分胁迫初期乙烯含量的升高可以提高植物对干旱的适应,增加植物对干旱的抵抗能力[15],这与本研究结果相吻合。植物受到逆境胁迫并对胁迫信号产生响应,进而引发体内一系列分子水平的变化,相关转录因子会调控逆境胁迫相关基因的表达来提高植物对逆境的耐受能力[3],其中一类重要的转录因子AP2/ERF在乙烯的信号转导途径中具有重要作用。目前很多研究发现,植物AP2/ERF家族中的许多成员均能响应植物逆境胁迫[28]。在水稻中,ERF家族成员OsERF3是乙烯合成的负调控基因,其突变体中乙烯合成基因ACO2、ACS2和ACS6表达量均升高,并且突变体表现出比野生型和过表达植株更强的耐旱能力[29];OsERF3过表达植株中乙烯合成基因表达量及乙烯的合成量均减少,ACC处理后一定程度上恢复了OsERF3过表达植株的耐旱能力[30]。另一个ERF类转录因子OsDERF1是干旱胁迫的负调控因子,与野生型植株相比,过表达OsDERF1后对干旱的耐受能力减弱而OsDERF1的RNAi转基因植株对干旱的耐受能力增强,进一步分析发现OsDERF1过表达转基因植株中乙烯合成相关基因(OsACS2、OsACS6、OsACO2和OsACO3)表达量减少,而RNAi转基因植株中这些基因表达量升高,RNAi转基因植株中乙烯含量高于野生型,过表达植株中乙烯含量低于野生型[30]。DU等[31]发现OsETOL1过表达转基因植株耐旱能力相较于野生型更弱,并且发现OsETOL1能够与乙烯合成相关基因OsACS2相互作用负调控乙烯的合成来影响植株耐旱能力。这些ERF类转录因子均能通过调节水稻中乙烯合成相关基因的表达,从而调控乙烯的合成来影响干旱胁迫耐受能力,说明乙烯在水稻耐旱胁迫机制中起着重要作用。本研究发现OsARD1是水稻耐旱的正调控因子。因为OsARD1位于乙烯合成通路的上游,推测过表达OsARD1可以促进 乙烯的合成,从而提高了过表达转基因植株的抗旱能力。
在拟南芥中,过量表达AP2/ERF类转录因子RAP2.4不仅增强了植株的耐旱能力,并且在长日照下过表达材料相较于野生型早开花,RAP2.4不仅参与了乙烯信号途径还同时参与光信号途径,可能在光信号和乙烯信号通路的下游来共同调节植物的生长和胁迫应答[32]。大量研究表明乙烯信号转导参与了植物非生物胁迫响应调控[33],推测OsARD1可能通过和某些转录因子或胁迫相关基因相互作用来提高水稻对非生物胁迫的耐受能力。因此,后期还要创建OsARD1的RNAi和CRISPR转基因植株,与过表达转基因植株一起进行不同的胁迫处理观察对表型的影响。同时筛选与OsARD1相互作用的基因,从而进一步揭示OsARD1在非生物胁迫方面的精确功能。
4 结论
OsARD1主要在根及成熟的组织器官中表达,在植株衰老时期叶片中表达量较高。OsARD1受机械损伤、高盐和渗透胁迫的强烈诱导,参与多种逆境胁迫应答。过量表达OsARD1水稻转基因植株比野生型表现出更强的对水分胁迫和PEG渗透胁迫的耐受能力。提高了水稻抗旱性能。The authors have declared that no competing interests exist.
