0 引言
【研究意义】镰孢菌是一类重要的植物病原菌,它可侵染诱发多种植物的萎蔫、根腐以及腐烂病等,对人类生产生活影响极大。由于镰孢菌的多型性与易变异等特点,使得其被认为是所有真菌类群中在形态分类上最难鉴定的属之一[1]。而正确识别并鉴定其种类是镰孢菌各个研究领域的基础[2],因此,在形态学鉴定的基础上,选择准确的特异性分子鉴定方法,对镰孢菌的鉴定具有重要的理论和应用价值。【前人研究进展】近年来,传统形态学和分子鉴定相结合的方法已在镰孢菌分类鉴定中得到了广泛应用[3-4],但微乎其微的形态学差异以及单一序列信息的局限性,仍使镰孢菌属种的鉴定面临诸多困难。DIEPENINGEN等[5]曾证实多基因位点联合分析能更准确对物种进行鉴定。所以采取多基因位点联合分析,是解决镰孢菌属种鉴定的有效途径,筛选适合的基因序列片段并明确其在鉴定中的特异性和适用性,是首先需要解决的一个重要的科学问题。目前,有关利用多基因位点联合分析对镰孢菌种进行鉴定的研究有些报道,曾莉莎等[6]评价了ITS、TEF-1α、IGS、histone H3、β-tubulin 等5个基因片段在香蕉枯萎病菌生理小种鉴定上的应用价值,发现TEF-1α、IGS和histone H3等3个基因片段可用于香蕉枯萎病菌生理小种鉴定;王容燕等[7]利用ITS、TEF-1α和β-tubulin 3个基因片段实现了对甘薯镰孢菌腐烂与溃疡病的病原菌鉴定。这些研究主要是用于少量镰孢菌种和生理小种的鉴定,利用多基因位点联合分析方法进行较大范围的镰孢菌种类鉴定和种群分布研究尚无系统详细的报道。【本研究切入点】山西省地形独特,气候特殊,作物种类繁杂,因此镰孢菌引起的病害数量和分布种类亦多。多年来,研究者对山西省多种植物病原镰孢菌做了大量的分类鉴定基础工作[8-12],但往往都只是采用形态学鉴定的方法,针对局部范围或局限在某一类寄主上,有关采用形态学结合分子鉴定方法分析山西省各地区的镰孢菌种群分布情况的研究尚未见报道。【拟解决的关键问题】选取ITS、EF-1α和β-tubulin 3个候选基因,从种内种间差异、遗传距离频率分布和构建系统发育树等方面,对镰孢菌的种内种间遗传变异及系统发育关系进行分析,评价3个候选基因在镰孢菌种类鉴定上的适用性,从中筛选适合镰孢菌种类鉴定的基因序列,对山西镰孢菌进行分子鉴定,并分析山西省镰孢菌种群分布特点和遗传分化情况,为今后开展镰孢菌的分类鉴定、筛选DNA条形码、检验检疫以及病害诊断提供科学依据。1 材料与方法
1.1 供试菌株及序列信息
供试菌株共27种43株,由山西农业大学农学院植物病理重点实验室提供(所提供的菌株采集于2013—2015年间,从山西省11个市共28个县(区)的罹病植物分离获得,分离部位包括果实、种子、茎部、根部、穗部、叶部等,并经过形态学鉴定),以Neonectria ramulariae为外群;供试序列共124条,其中自测序列39条,下载序列85条。供试菌株及序列详细信息见附表1。Table 1
表1
表11 附
Table 1S The information of strains and sequences
| 种 Species | 菌株 Isolate | 寄主来源 Host origin | 地理来源 Geographical origin | GenBank或FUSARIUM-ID数据库序列号 GenBank or FUSARIUM-ID accession number | ||
|---|---|---|---|---|---|---|
| ITS | EF-1α | β-tubulin | ||||
| F. acuminatum | XFFQ-1 | Solanum lycopersicum | 襄汾Xiangfen | |||
| TGFQ-1 | Solanum tuberosum | 太谷Taigu | ||||
| 下载Download | FD_01726 | |||||
| F. aquaeductuum | NWHY-1 | Buxus sinica | 宁武Ningwu | |||
| F. avenaceum | DTCD-2 | Glycine max | 大同Datong | |||
| XZSZ-1 | Triticum aestivum | 忻州Xinzhou | ||||
| 下载Download | AB587016 | AB674293 | AB587064 | |||
| 下载Download | KP170730 | KP170732 | KP170733 | |||
| 下载Download | EU744841 | |||||
| F. camptoceras | LFXM-2 | Triticum aestivum | 临汾Linfen | |||
| 下载Download | GQ915504 | |||||
| F. chlamydosporum | TGCD-1 | Citrullus lanatus | 太谷Taigu | |||
| 下载Download | KM655867 | |||||
| F. coeruleum | DTHM-3 | Linum usitatissimum | 大同Datong | |||
| JKHM-1 | Linum usitatissimum | 交口Jiaokou | ||||
| 下载Download | KC106742 | |||||
| F. culmorum | TGFQ-2 | Solanum lycopersicum | 太谷Taigu | |||
| 下载Download | U85535 | GU370422 | U85569 | |||
| 下载Download | KP265349 | KP674192 | KP710631 | |||
| F. equiseti | LNHD2 | Solanum lycopersicum | 襄汾 Xiangfen | KU939063 | KU939015 | KU938967 |
| CH13 | Solanum melongena | 运城Yuncheng | KU939067 | KU939019 | KU938971 | |
| CH15 | Solanum tuberosum | 运城 Yuncheng | KU939068 | KU939020 | KU938972 | |
| 下载Download | KP008978 | |||||
| F. graminearum | TGHG | Cucumis sativus | 太谷Taigu | KU939070 | KU939022 | KU938974 |
| 下载Download | U34578 | AF212455 | U34436 | |||
| 下载Download | KF022238 | |||||
| F. heterosporum | TGDD-11 | Glycine max | 太谷 Taigu | |||
| 下载Download | EU327338 | |||||
| F. illudens | TGXHL-1 | Cucurbita pepo | 太谷Taigu | |||
| 下载Download | KM231935 | |||||
| F. incarnatum | TGFQ-4 | Solanum lycopersicum | 太谷 Taigu | |||
| TGFQ-3 | Solanum lycopersicum | 太谷 Taigu | ||||
| QXQZ-2 | Citrullus lanatus | 祁县Qixian | ||||
| 下载Download | GQ505696 | GQ915510 | GQ915444 | |||
| 下载Download | KJ572780 | KJ572786 | KJ572785 | |||
| 续附表1 Continued table S1 | ||||||
| 种 Species | 菌株 Isolate | 寄主来源 Host origin | 地理来源 Geographical origin | GenBank或FUSARIUM-ID数据库序列号 GenBank or FUSARIUM-ID accession number | ||
| ITS | EF-1α | β-tubulin | ||||
| F. lateritium | QXFQ-2 | Solanum lycopersicum | 祁县Qixian | |||
| FYMH-1 | Glycine max | 汾阳Fenyang | ||||
| 下载Download | AB587004 | AB674281 | AB587052 | |||
| 下载Download | KJ125582 | KJ126174 | KJ125878 | |||
| 下载Download | JF740854 | |||||
| F. merismoides | WZMLS-3 | Solanum tuberosum | 五寨Wuzhai | |||
| 下载Download | AB674276 | |||||
| F. oxysporum | CH30 | Cucumis sativus | 太谷Taigu | KU939033 | KU938985 | KU938937 |
| XGDBF | Citrullus lanatus | 太原Taiyuan | KU939034 | KU938986 | KU938938 | |
| HGDBF | Cucumis sativus | 夏县Xiaxian | KU939039 | KU938991 | KU938943 | |
| 下载Download | KT323864 | |||||
| F. proliferatum | CH98 | Zea mays | 长治Changzhi | KU939077 | KU939029 | KU938981 |
| CD-1 | Glycine max | 太谷Taigu | KU939072 | KU939024 | KU938976 | |
| CD-3 | Zea mays | 长治Changzhi | KU939073 | KU939025 | KU938977 | |
| 下载Download | KF022239 | |||||
| F. redolens | CZHG-2 | Cucumis sativus | 长治 Changzhi | |||
| FYDD-3 | Glycine max | 汾阳 Fenyang | ||||
| 下载Download | KP265347 | KP674190 | KP710629 | |||
| 下载Download | KP295497 | KP400744 | KP674300 | |||
| 下载Download | FD_01077 | |||||
| F. sambucinum | HMFQ-1 | Solanum lycopersicum | 侯马Houma | |||
| 下载Download | KM231813 | KM231941 | KM232078 | |||
| 下载Download | KP265345 | KP674188 | KP765703 | |||
| F. sambucinum var. coeruleum | WZWD-1 | Pisum sativum | 五寨Wuzhai | |||
| F. solani | CH20 | Solanum tuberosum | 太谷 Taigu | KU939051 | KU939003 | KU938955 |
| QLD-1 | Glycine max | 祁县Qixian | KU939058 | KU939010 | KU938962 | |
| H9 | Solanum lycopersicum | 沁水Qinshui | KU939061 | KU939013 | KU938965 | |
| 下载Download | KP008979 | |||||
| F. sporotrichioides | TGFQ-5 | Solanum lycopersicum | 太谷 Taigu | |||
| 下载Download | AB587025 | AB674303 | AB587074 | |||
| 下载Download | AB587026 | AB674304 | AB587075 | |||
| F. subglutinans | XFCD-2 | Solanum lycopersicum | 襄汾Xiangfen | |||
| TGFQ-16 | Solanum lycopersicum | 太谷 Taigu | ||||
| 下载Download | AB587008 | AB674285 | AB587056 | |||
| 下载Download | U34559 | AF160289 | U34417 | |||
| 下载Download | FD_01160 | |||||
| 续附表1 Continued table S1 | ||||||
| 种 Species | 菌株 Isolate | 寄主来源 Host origin | 地理来源 Geographical origin | GenBank或FUSARIUM-ID数据库序列号 GenBank or FUSARIUM-ID accession number | ||
| ITS | EF-1α | β-tubulin | ||||
| F. trichothecioides | TGMLS-1 | Solanum tuberosum | 太谷 Taigu | |||
| F. tricinctum | LFQZ-1 | Solanum melongena | 临汾 Linfen | |||
| 下载Download | AB587028 | AB674264 | AB587077 | |||
| 下载Download | AB587029 | AB674263 | AB587078 | |||
| F. udum | JKMLS-1 | Solanum tuberosum | 交口 Jiaokou | |||
| 下载Download | AF160275 | |||||
| F. ventricosum | YCFQ-2 | Solanum lycopersicum | 阳城Yangcheng | |||
| 下载Download | KM231942 | |||||
| F. verticillioides | QXQZ-3 | Solanum melongena | 祁县Qixian | |||
| TGCD-1 | Glycine max | 太谷 Taigu | ||||
| JKMLS-2 | Zea mays | 交口Jiaokou | ||||
| 下载Download | KR071630 | AB674287 | AB587058 | |||
| 下载Download | AB587011 | AB674288 | AB587059 | |||
| 下载Download | FD_01388 | |||||
| Neonectria ramulariae | 下载Download | HM054150 | HM054091 | HM054124 | ||
新窗口打开
1.2 模板DNA的制备
菌体获得:将活化后的镰孢菌单孢菌株接种于查彼培养液中[13],于25℃,150—200 r/min,恒温振荡培养5 d后,用真空抽滤泵抽滤菌丝,用无菌超纯水冲洗2遍,置于真空冷冻干燥机内冻干,回收备用。镰孢菌基因组DNA制备:DNA提取采用CTAB法[14],于凝胶成像仪(WD-9413A,ABI)内检测DNA质量,用紫外可见分光光度计(UV-2802S,ABI)检测DNA浓度,贮存于-20℃冰箱中备用。
1.3 PCR扩增及测序
PCR反应在BIO-RAD C1000 PCR仪上进行,所用引物信息见表1,反应体系及条件参考赵鹏等[20],并稍加改动。PCR产物经BigDye Terminator Ready Reaction Mix v3.1(Applied Biosystems,USA)纯化,使用ABI 3730型基因分析仪进行双向测序,由上海生工生物股份有限公司完成。Table 1
表1
表1PCR扩增和测序引物
Table 1Primers used for PCR amplification and sequencing
| 序列名称 Sequence name | 引物 Primer | 序列 Sequence (5′-3′) | 来源 Source |
|---|---|---|---|
| ITS | ITS1 (forward) | TCCGTAGGTGAACCTGCGG | 文献[15] References [15] |
| ITS4 (backward) | TCCTCCGCTTATTGATATGC | 文献[15] References [15] | |
| EF-1α | 728F (forward) | CATCGAGAAGTTCGAGAAGG | 文献[16] References [16] |
| 1567R (backward) | ACHGTRCCRATACCACCRATCTT | 文献[17] References [17] | |
| 1567Ra (backward) | ACHGTRCCRATACCACC | http://www.aftol.org/pdfs/EF1primer.pdf | |
| β-tubulin | T1 (forward) | AACATGCGTGAGATTGTAAGT | 文献[18] References [18] |
| T222 (backward) | GACCGGGGAAACGGAGACAGG | 文献[18] References [18] | |
| Bt2b (backward) | ACCCTCAGTGTAGTGACCCTTGGC | 文献[19] References [19] |
新窗口打开
1.4 序列编辑及比对
用Sequencher 5.2.2(Gene Codes Corp.)对测序结果进行校对拼接,用ClustalX 1.81[21]进行序列比对,GelDoc[22]将比对结果进行编辑。登陆NCBI数据库(http://blast.ncbi.nlm.nih.gov/blast.cgi)及FUSARIUM- ID数据库(http://fusarium.cbio.psu.edu/),将ITS、EF-1α和β-tubulin测序结果与数据库中所有已公布的序列进行BLAST分析。1.5 序列数据分析
下载概念清晰或标准种的相关序列,结合本研究形态学清晰的5种13株菌株,基于ITS、EF-1α和β-tubulin 3个候选基因,共15种34株102条序列,以Neonectria ramulariae为外群,使用MEGA4.0.2[23]软件,分析序列特征,以P-distancs模型计算种内种间遗传距离[24],结合Excel 2010分析种内种间遗传距离的频率分布情况[25],应用DNAstar 7.1.0[26](Lasergene,WI,USA)计算遗传相似性矩阵,将结果输入TaxonGap[27]分析种内种间序列差异情况,分析镰孢菌种内种间遗传变异情况;构建邻接树(NJ树,neighbor-joining tree),采用自展法进行1 000次检测分支支持率,选用K2P(Kimura’s two-parameter)模型,系统树支持率仅显示高于50%的数值,以检验种的单系性[28]。1.6 种的鉴定方法
从形态学鉴定的种中选取一些代表性菌株,进行基于EF-1α基因序列的PCR扩增及测序,将测序结果分别在NCBI数据库和FUSARIUM-ID数据库中进行BLAST比对,并下载同源性较高并来源可靠的序列,构建邻接树。1.7 山西省镰孢菌种群分布分析
根据菌株分离频率情况对山西省镰孢菌优势种进行分析;根据菌株类型和数量情况对不同地区和不同寄主镰孢菌种群结构及种群分布进行分析。2 结果
2.1 ITS、EF-1α和β-tubulin 3个候选基因序列特征
序列经过拼接、编辑、对齐和整理后,ITS序列长度为405—541 bp,EF-1α序列长度为443—509 bp,β-tubulin序列长度为330—550 bp;碱基组成具有一定的G+C含量偏向性;转换/颠换依次为β-tubulin>EF-1α>ITS;变异位点依次为β-tubulin>EF-1α>ITS;保守位点依次为ITS>β-tubulin>EF-1α;简约信息位点依次为EF-1α>β-tubulin>ITS(表2)。Table 2
表2
表2序列碱基组成及变异率
Table 2Base composition and variation rate of sequences
| 序列 Sequence | 序列平均长度 Average length of the sequence (bp) | G+C含量 Content of G+C (%) | 转换/颠换 Convert/ transversion | 变异位点 Variable sites | 保守位点 Conserved sites | 简约信息位点 Parsimony-informative sites |
|---|---|---|---|---|---|---|
| ITS | 405-541 | 50.4 | 0.78 | 132 (23.6%) | 419 (74.96%) | 115 (20.6%) |
| EF-1α | 443-509 | 51.8 | 1.37 | 295 (55.6%) | 230 (43.3%) | 242 (45.6%) |
| β-tubulin | 330-550 | 54.2 | 1.41 | 302 (52.6%) | 260 (45.3%) | 209 (36.4%) |
新窗口打开
2.2 基于遗传相似性的种内种间差异分析
基于EF-1α和β-tubulin基因序列分析的最小种间差异分别为3%和1%左右,均发生在F. graminearum和F. culmorum之间,最大种间差异均发生在与外群之间;基于ITS序列分析的最小种间差异接近于0,发生在F. avenaceum和F. tricinctum之间,最大种间差异发生在F. lateritium和F. solani之间。ITS、EF-1α和β-tubulin 3个候选基因,种内差异小于种间差异的种分别达到供试种的40%(6/15)、73%(11/15)和53%(8/15),而种内差异小于种间差异,有利于区分鉴定物种(图1)。故EF-1α基因序列是3个候选基因中最适合用作区分鉴定镰孢菌的基因序列。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1各基因片段的种内种间差异比较(使用TaxonGap和DNAstar软件)
-->Fig. 1Comparisons of intra- and inter-specific variations of the gene sequence generated by the softwares TaxonGap and DNAstar
-->
2.3 基于遗传距离频率分布的种内种间差异
基于ITS、EF-1α和β-tubulin基因序列分析,遗传距离范围分别为0—0.17、0—0.76和0—0.52,种内平均遗传距离分别为0、0.01和0.01,种间平均遗传距离分别为0.09、0.24和0.18,种间平均遗传距离分别是种内平均遗传距离的9、24和18倍(图2)。故EF-1α基因序列是其中种间差异较种内差异最大的基因序列。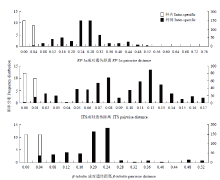 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2各基因序列种内种间遗传距离的频率分布
-->Fig.2Frequency distribution of intra- and inter-specific pairwise distances of the gene sequence generated with MEGA and Excel
-->
2.4 系统发育树的构建
由图3—图5可看出,分别基于EF-1α、β-tubulin和ITS基因序列构建的NJ树均以较高支持率被划分为4个Clade(Clade I-IV)。基于EF-1α和β-tubulin序列分别构建的NJ树的拓扑结构基本一致,与基于ITS序列构建的NJ树存在差异,且在个别种的区分上三者均存在一定差异。在图3中,有13个种表现出单系性,F. verticillioides和F. tricinctum虽未表现出单系性,但也与其他种明显区分开,物种鉴定率达到87%(13/15);在图4中,有11个种表现出单系性,F. tricinctum、F. subglutinans、F. incarnatum和F. lateritium未表现出单系性,物种鉴定率为73%(11/15);在图5中,有10个种表现出单系性,F. verticillioides、F. tricinctum、F. incarnatum、F. graminearum和F. avenaceum未表现出单系性,物种鉴定率为67%(10/15)。综上所述,EF-1α基因序列是3个候选基因中区分鉴定镰孢菌准确率最高的基因序列。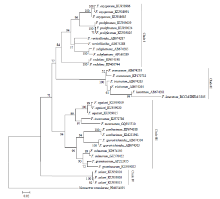 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3构建基于EF-1α序列的邻接系统发育树
-->Fig. 3Neighbor-joining (NJ) phylogenetic tree inferred from EF-1α sequences
-->
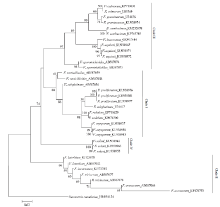 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4构建基于β-tubulin序列的邻接系统发育树
-->Fig. 4Neighbor-joining (NJ) phylogenetic tree inferred from β-tubulin sequences
-->
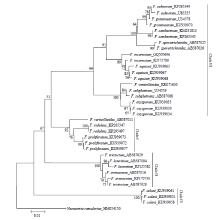 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5构建基于ITS序列的邻接系统发育树
-->Fig. 5Neighbor-joining (NJ) phylogenetic tree inferred from ITS sequences
-->
2.5 山西省镰孢菌种的鉴定
在GenBank和FUSARIUM-ID数据库中的比对结果如表3所示,40株菌株的测序结果与数据库中相关种的EF-1α基因序列同源性均达92%—98%,F. aquaeductuum、F. sambucinum var. coeruleum和F. trichothecioides测序失败,未能进行比对。将获得的40条序列结合下载的24条同源性序列,以Neonectria ramulariae为外群,共65条序列进行比对分析,结果表明,EF-1α序列长度为423—666 bp,碱基组成具有一定的G+C含量偏向性(52.1%);转换/颠换值为1.03;变异位点为551(72.5%);保守位点为193(25.4%);简约信息位点为460(60.5%);自裔位点为90(11.8%)。构建的系统发育树如图6所示,相同种的不同菌株均能聚在一起,除了F. tricinctum和F. acuminatum未聚成独立分支外,其余22种的不同菌株均以较高支持率分别聚成独立分支,表现出单系性。结果说明,系统发育学种的鉴定结果与形态学鉴定结果存在差异。Table 3
表3
表3基于EF-1α基因序列的PCR和分子鉴定结果
Table 3PCR result and molecular identification based on EF-1α sequences
新窗口打开
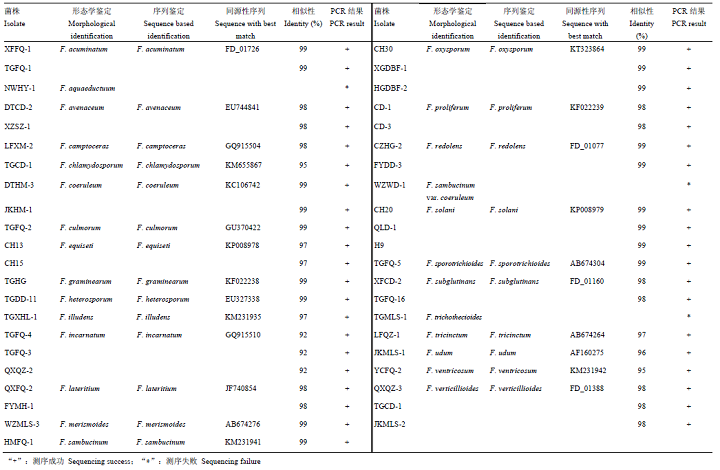
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6基于EF-1α序列构建的山西省镰孢菌邻接系统发育树
-->Fig. 6Neighbor-joining (NJ) phylogenetic tree of Fusarium in Shanxi Province inferred from EF-1α sequences
-->
2.6 山西省镰孢菌种群分布分析
2.6.1 山西省镰孢菌分离频率及地理分布 分离频率>8%的有4种,其中最高的为F. oxysporum(22.1%);其他的依次为F. solani(13.8%)、F. verticillioides(10.1%)、F. incarnatum(8.6%);分离频率>2%的有8种,依次为F. equiseti(6.7%)、F. coeruleum(6.1%)、F. redolens(4.6%)、F. acuminatum(3.4%)、F. lateritium(3.1%)、F. proliferum(2.2%)、F. subglutinans(2.2%)和F. avenaceum(2.1%);分离频率<2%的有15种,其中F. heterosporum和F. trichothecioides均为1.8%,F. sporotrichioides、F. camptoceras、F. ventricosum和F. chlamydosporum均为1.3%,F. udum、F. tricinctum、F. culmorum和F. graminearum均为1%,F. illudens、F. sambucinum和F. aquaeductuum均为0.6%,F. sambucinum var. coeruleum和F. merismoides均为0.3%。故F. oxysporum为山西省镰孢菌的优势种(图7)。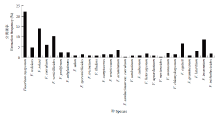 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7山西省镰孢菌菌株分离频率
-->Fig. 7The Fusarium strains extraction frequency in Shanxi Province
-->
以F. oxysporum分布范围最广泛,在23个县(区)均有分布;其次是F. solani和F. incarnatum,分别在14和13个县(区)均有分布;F. sambucinum var. coeruleum和F. graminearum分布范围最小,仅在五寨分离到(图8)。
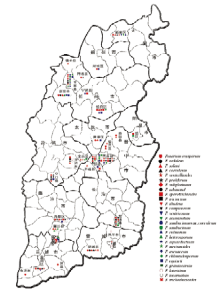 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8山西省28个县(区)镰孢菌种群的地理分布
-->Fig. 8Geological distributions of Fusarium populations in 28 counties (areas) of Shanxi Province
-->
2.6.2 不同地区镰孢菌种群结构及分布 运城(33.3%)、临汾(16.1%)、忻州(18.4%)、长治(27.3%)、吕梁(15.8%)、晋中(23.1%)和太原(46.2%)均以F. oxysporum为主;朔州以F. lateritium为主(60%);大同以F. solani为主(33.3%);晋城以F. verticillioides为主(27.3%);阳泉以F. incarnatum为主(50%)(图9)。晋中市和忻州市分离到镰孢菌种类最多(22种),其他依次为临汾(19种)、吕梁(12种)、长治(11种)、运城和晋城(8种)、大同(7种)、阳泉和太原(3种)和朔州(2种)(图10)。因此,晋中市和忻州市的镰孢菌种类最丰富,临汾市次之,朔州市最少。
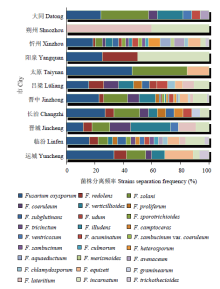 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9山西省11个市镰孢菌菌株分离频率
-->Fig. 9The Fusarium strains extraction frequency in 11 cities of Shanxi Province
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10山西省11个市镰孢菌种类及菌株数量
-->Fig. 10The species and amounts of Fusarium strains in 11 cities of Shanxi Province
-->
2.6.3 不同寄主中镰孢菌种群结构及分布 不同寄主中镰孢菌种群结构及分布分析如表4所示。由表4可看出,在番茄(果实)、黄瓜(茎基、根部)和玉米(茎部、穗部、种子)等10个寄主上均能分离到不同种类的镰孢菌,分离种和菌株数量分别占到全部种和菌株数量的92.6%和71.5%。番茄上分离到的镰孢菌种类最多(15种);其次是马铃薯(13种)、大豆(12种)、黄瓜(6种)和玉米(8种),其余寄主也分离到3—4种。番茄、黄瓜、西瓜、马铃薯、茄子、西葫芦以及甘蓝,均以F. oxysporum为优势种;大豆和玉米以F. verticillioides为优势种,小麦以F. avenaceum和F. graminearum为优势种;F. aquaeductuum和F. sambucinum var. coeruleum在上述几种寄主中未分离到。
Table 4
表4
表4山西省镰孢菌种在不同寄主中的分布
Table 4Distribution of Fusarium species in different hosts in Shanxi Province
| 种 Species | 寄主及菌株数量(株)Host origin and strains count | 合计 Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 番茄 Solanum lycopersicum | 黄瓜 Cucumis sativus | 西瓜 Citrullus lanatus | 马铃薯 Solanum tuberosum | 茄子 Solanum melongena | 西葫芦 Cucurbita pepo | 甘蓝 Brassica oleracea | 大豆 Glycine max | 小麦 Triticum aestivum | 玉米 Zea mays | ||
| F. oxysporum | 12 | 15 | 10 | 13 | 17 | 12 | 7 | 13 | 0 | 2 | 101 |
| F. solani | 9 | 11 | 0 | 11 | 5 | 5 | 0 | 13 | 0 | 0 | 54 |
| F. verticillioides | 0 | 0 | 0 | 6 | 15 | 0 | 0 | 16 | 0 | 26 | 63 |
| F. incarnatum | 6 | 0 | 7 | 0 | 0 | 0 | 0 | 6 | 0 | 16 | 35 |
| F. equiseti | 5 | 0 | 0 | 7 | 7 | 0 | 5 | 6 | 0 | 0 | 30 |
| F. coeruleum | 9 | 0 | 0 | 8 | 0 | 0 | 0 | 10 | 0 | 0 | 27 |
| F. redolens | 7 | 5 | 0 | 4 | 0 | 0 | 1 | 4 | 0 | 0 | 20 |
| F. acuminatum | 6 | 0 | 0 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 17 |
| F. lateritium | 4 | 0 | 0 | 0 | 0 | 0 | 2 | 8 | 0 | 0 | 14 |
| F. proliferum | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 2 | 0 | 9 | 12 |
| F. subglutinans | 7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 7 |
| F. avenaceum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 9 | 2 | 0 | 11 |
| F. heterosporum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 2 |
| F. trichothecioides | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| F. sporotrichioides | 2 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 5 |
| F. camptoceras | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 1 | 1 | 1 | 5 |
| F. ventricosum | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 8 |
| F. chlamydosporum | 2 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 6 |
| F. udum | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 4 |
| F. tricinctum | 0 | 0 | 0 | 0 | 2 | 0 | 0 | 2 | 0 | 0 | 4 |
| F. culmorum | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 3 | 5 |
| F. graminearum | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 1 | 6 |
| F. illudens | 0 | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 0 | 0 | 4 |
| F. sambucinum | 1 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 4 |
| F. aquaeductuum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| F. sambucinum var. coeruleum | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| F. merismoides | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 2 |
| 合计Total | 15 | 6 | 3 | 13 | 4 | 3 | 4 | 12 | 3 | 8 | 447 |
新窗口打开
3 讨论
镰孢菌种内种间遗传变异情况研究显示,ITS基因序列的鉴定能力最差,且反映出的亲缘关系与形态学分类存在差异,这可能与ITS基因序列进化相对保守有关。有****证实EF-1α序列较ITS序列更能正确区分镰孢菌[29-30],WATANABE[31]也曾评价β-tubulin基因序列是识别镰孢菌的有效标记,这些结果与本研究的结果一致。基于EF-1α基因序列的系统发育分析表明,形态学上差异较大的F. tricinctum和F. acuminatum 虽然未表现出单系性,但在系统树中表现较近的亲缘关系。说明形态学上的种和系统发育学种还是存在一定差异的,因此,在镰孢菌鉴定时,在形态学鉴定基础上,应结合分子鉴定才能作出更加准确的判断。
山西省不同地区、不同寄主的镰孢菌种群结构及优势种存在差异,说明山西省镰孢菌种群存在明显的遗传分化,可能与不同地区的耕作制度和气候环境有关。试验结果表明,山西马铃薯以F. oxysporum为优势种,这与黑龙江[32]和新疆[33]的马铃薯干腐病镰孢菌种群调查结果相似,但在优势种上存在差异,这可能与地域和气候差异有关;大豆上以F. verticillioides为优势种,其次为F. oxysporum、F. solani和F. coeruleum,魏巍等[34]也曾报道过上述4种镰孢菌为大豆根际土壤镰孢菌优势种群,与本研究结果一致;黄瓜上分获了6种镰孢菌,以F. oxysporum和F. solani为优势种群,与东北三省[35-36]等地的调查结果一致。
本研究仅从不同地区和不同寄主上的镰孢菌种群结构及分布进行了研究,而且采集的地理范围和寄主范围有限,因此在今后的研究中,需要进一步扩大采样范围,以使其结果更加全面准确,同时应对镰孢菌年度间的种群结构变化加以分析,以便更加准确地了解其变化动态。
4 结论
从基于ITS、EF-1α和β-tubulin 3个基因的序列分析可看出,镰孢菌种内种间存在丰富的遗传变异,其中EF-1α基因序列的遗传变异最适用于镰孢菌种类的鉴定。基于EF-1α基因序列的系统发育分析显示,分子鉴定的结果与形态学鉴定的结果存在差异,所以在镰孢菌种的鉴定中,采用形态学结合EF-1α基因序列分子鉴定的方法,更能提高鉴定结果的准确性。F. oxysporum是山西省镰孢菌的优势种,不同地区、不同寄主上镰孢菌种群存在明显的遗传分化。The authors have declared that no competing interests exist.
