0 引言
【研究意义】百脉根(Lotus japonicus),也称牛角花,是一种优良的豆科牧草。原产地是欧亚温暖地区,由于其营养丰富、适口性好、含皂素低、耐牧性强,目前在世界各地得到广泛种植。同时,作为豆科植物,百脉根的固氮作用能够增加土壤肥力,促进植株的生长发育,所以百脉根在建立人工放牧地、补播改良草场和建立人工草地中得到了广泛的应用。而且在豆科牧草中,百脉根的细胞再生性是最好的,它的遗传转化效率相对较高,所以百脉根是研究生物固氮机理[1-3]、外源基因转化、牧草品质改良的豆科模式植物,也是一种作为生物反应器生产动物疫苗的理想材料[4]。但是,大多数品种百脉根的抗旱性和耐盐性较差,如果种植在荒漠化或盐碱化土地上,是难以获得高产量的。因此,基于传统育种,利用生物技术对百脉根进行遗传改良,从而培育出高产、抗盐、耐旱的新品种,对提高百脉根牧草的产量、利用荒漠化或盐碱化土地进而对荒漠化或盐碱化土地进行改良具有重要意义。【前人研究进展】HD-Zip(homeodomain leucine-zipper)是植物特有的一类编码同源异型域亮氨酸拉链蛋白的转录因子,调控植物生长发育过程。HD-Zip包含一个高度保守的同源异型结构域(homeodomain,HD)和一个亮氨酸拉链结构域(leucine zipper,LZ)。在亮氨酸拉链结构域的作用下,HD-Zip蛋白形成二聚体,它的同源异型结构域能够与特定的DNA序列相结合,从而发挥其转录因子的作用[5-7]。根据HD-Zip蛋白自身氨基酸序列的不同,以及与其结合的DNA序列的特异性,可以将HD-Zip蛋白分为Ⅰ—Ⅳ4个亚类。第Ⅰ类HD-Zip蛋白主要参与植物对逆境胁迫的应答反应以及调控植物衰老、激素信号传导等过程[8-9],例如拟南芥ATHB7和ATHB12受干旱和ABA诱导[10],ATHB6参与ABA信号传导[11]。第Ⅱ类HD-Zip蛋白主要在生长素信号传导和光应激反应中发挥作用[12],例如拟南芥ATHB2能够参与避荫性反应[13]。第Ⅲ类HD-Zip蛋白主要参与侧生器官诱发和分生组织分化等过程[14]。第Ⅳ类HD-Zip蛋白主要参与表皮细胞分化和根发育等过程[15-16],例如拟南芥PDF2和ATML1在表皮细胞分化过程中发挥功能[17]。目前,已在拟南芥中发现42个HD-Zip家族基因,其中17个属于HD-ZipⅠ成员。CHEN等[18]率先在Williams 82大豆(Glycine max)基因组中鉴定到88个HD-Zip 类转录因子,随后BELAMKAR等[19]在大豆基因组中鉴定到101个HD-Zip 类转录因子,其中35个属于HD-Zip I类转录因子。应用RNA-Seq技术筛选出16个盐胁迫应答基因,其中7个属于HD-Zip I类基因。在模式豆科植物蒺藜苜蓿中,HD-ZipⅠ类转录因子HB1受盐胁迫诱导在主根和侧根分生组织中表达量上升。HB1直接识别并结合到LBDI启动子上顺式作用元件CAATAATTG,介导抑制LBDI在侧根形成中的作用,使苜蓿形成合适的根表面积以响应不良的环境胁迫[20]。紫花苜蓿HD-Zip I类基因MsHB2受NaCl和ABA胁迫诱导,抑制转基因拟南芥的生长。该基因可能通过参与ABA信号传导途径从而负调控紫花苜蓿对盐等非生物胁迫的应答反应[21]。将野生大豆谷胱甘肽S-转移酶基因GsGST19导入紫花苜蓿中,盐碱胁迫条件下观察转基因苜蓿的生长状态,测定丙二醛含量、相对质膜透性等生理指标,结果表明,过表达GsGST19能够提高转基因苜蓿的盐碱耐受性[22]。【本研究切入点】目前,由于在非生物胁迫中的关键调控作用,HD-ZipⅠ类转录因子已成为抗逆基因工程应用的新热点。但是应用相关转录因子来改良牧草抗逆性的报道较少。将大豆HD-Zip I类基因转入百脉根,从分子角度对转基因株系进行抗逆分析的研究目前未见报道。【拟解决的关键问题】本文通过克隆得到一个大豆HD-ZipⅠ类盐胁迫应答基因 Glyma01g04890,将其命名为GmHAT5。从基因编码蛋白序列结构、同源蛋白比对等方面进行分析,并构建Ubiquitin启动子调控的植物超表达载体,对转化获得的超表达百脉根转基因株系进行抗盐性及相关生理指标监测,为进一步研究GmHAT5在盐胁迫应答反应中的分子机制奠定了基础,为豆科植物耐逆基因工程改良提供了功能明确的候选基因资源,而且对于充分利用中国盐碱地资源、扩大百脉根种植面积、提高百脉根产量和品质、发展畜牧业等具有重要的研究价值和广阔的开发应用前景。1 材料与方法
1.1 试验材料
栽培大豆Williams82由中国科学院东北地理研究所孔凡江研究员馈赠;百脉根种子(MG-20)、大肠杆菌DH5α、发根农杆菌LBA1334、根癌农杆菌EHA105和植物超表达载体p1301U均由华中农业大学农业微生物国家重点实验室生物固氮分子生物学研究室保存;克隆载体pGEM-T购自Promega公司。1.2 GmHAT5的克隆与植物超表达载体的构建
参照MiniBEST Plant RNA Extraction Kit(TaKaRa)说明书,提取W82大豆总RNA。取0.5 ng总RNA,用FastQuant RT Kit(With dDNase, TIANGEN)合成cDNA第一链。根据NCBI网站公布的GmHAT5序列(GenBank: KRH74761.1),用Primer Premier 5.0软件设计引物F-GmHAT5和R-GmHAT5进行PCR扩增。将目的片段连接到T载体上测序。将克隆得到的GmHAT5插入植物表达载体p1301U中,上下游引物分别引入BamHⅠ和KpnⅠ酶切位点(F-OX和R-OX),构建p1301U-GmHAT5过表达载体,钙转,经酶切和测序验证后,将重组质粒经冻融法转入发根农杆菌菌株LBA1334中,用于百脉根的发状根转化。1.3 GmHAT5的序列及表达分析
利用NCBI网站的BLAST功能对蛋白的结构特征进行分析,用DNAMAN软件进行序列同源性比对分析。从前人转录组数据中[19]调取GmHAT5在不同器官及盐胁迫条件下的表达情况,包括幼叶、花、1 cm豆荚、开花后10 d、14 d荚壳、开花后10 d、14 d、21 d、25d、28 d、35 d、42 d种子、根和根瘤共14个组织以及盐胁迫处理1、6和12 h共3个时间点的差异表达情况。1.4 GmHAT5对百脉根的发状根转化及“复合体”植株的获得
百脉根种子表面消毒,22℃暗培养待种子萌发后移入MS培养基。幼苗胚根长约1 cm时,剪掉胚根,收集子叶部分作为侵染外植体。在发根农杆菌菌悬液中侵染15—30 min,将外植体移入MS平板,暗培养3—5 d。再将外植体转移至含300 mg·L-1羧卞的MS培养基中。2周左右鉴定长出的发状根,将不显蓝的阴性毛根切掉,此时获得的植株即为百脉根“复合体”植株。详细步骤请参照柯丹霞[23]方法。1.5 “复合体”百脉根植株的盐胁迫处理
选取长势一致的“复合体”百脉根植株和空载体对照植株各15株,每隔2 d,用1/8 Hoagland营养液浇灌;经过4周后,用终浓度为200 mmol·L-1 NaCl的1/8 Hoagland营养液对植株进行处理,7 d后观察记录表型并拍照。将“复合体”植株与空载体对照植株阳性发状根分别剪取1 cm长一段放入MS培养基上,各分3组,每组8段发状根,并设置3个重复,暗培养4周后,分别移入0、100和200 mmol·L-1 NaCl的MS培养基上培养14 d,观察记录发状根生长状态。试验结束后拍照并收集MS平板上发状根,置于105℃烘干24 h,称量其干物质量,进行统计学分析。
1.6 GmHAT5对百脉根的稳定转化及再生植株的获得
百脉根MG-20种子表面灭菌;萌发后的幼苗从茎基部横切(带叶柄),再纵切将两片子叶分开;调整农杆菌菌液OD600为0.6,将外植体放置其中浸泡30 min,吸干外植体表面残留菌液,移入培养基暗培养3—5 d后,转入含15—25 μg·mL-1的G418和300 μg·mL-1的cefotaxime再生培养基上培养5 d;外植体转至筛选培养基连续筛选培养5周,每周传代一次;移到芽诱导培养基上传代3周;移到芽生长培养基上培养5 d;移到芽伸长培养基上传代2周;移到根诱导培养基上培养5 d;移到根伸长培养基上培养2周生根成苗。炼苗3—4 d后,移入经过高压灭菌的基质中(由蛭石:珍珠岩:草炭土按1:1:1比例配置),浇灌蒸馏水,放入人工气候箱内培养。详细方法参见《Lotus japonicus Handbook》[24]。1.7 转基因百脉根植株的分子生物学鉴定
以转基因百脉根植株叶DNA为模板,根据筛选标记基因Gus序列设计特异引物(F-GUS,R-GUS)用于PCR检测,目的片段长度为1 081 bp。随后对部分PCR阳性植株进行GmHAT5转录水平分析。总RNA的提取及cDNA第一链的合成方法同1.2。GmHAT5的特异引物(F-RT和R-RT)用于半定量RT-PCR 分析,以百脉根GPDH(F-GPDH和R-GPDH)为内参基因。1.8 稳定转化百脉根植株的盐胁迫处理
将转GmHAT5的T0百脉根植株和空载体对照植株,分别剪取带有2—3个节点的茎段进行扦插扩繁。待茎段生根后,选取生长状态良好且长势一致的扩繁苗,移栽到蛭石:珍珠岩=1:1的花钵中,22℃培养(16 h光照/8 h黑暗);1/8 Hoagland营养液每隔2 d浇灌一次;培养4周后,将生长健壮且长势一致的试验组以及对照组百脉根植株各分成4组,每组8株,并设置3个重复,分别用终浓度为0、50、100和200 mmol·L-1 NaCl的1/8 Hoagland营养液处理14 d后观察记录表型并测定相关生理指标。1.9 转基因植株相关生理指标的检测
1.9.1 丙二醛含量测定 采用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量。根据公式计算MDA含量:MDA浓度C(μmol·L-1)= 6.45(OD532 - OD600)- 0.56 × OD450,MDA含量(μmol·g-1)= C × 提取液体积/样品质量。
1.9.2 叶片质膜透性(相对电导率)测定 取高度一致的叶片0.2 g于锥形瓶中,加20 mL ddH2O并抽气至叶片下沉;将三角瓶放入摇床中,25℃,100 r/min,处理1—2 h;用DDSJ-308A电导率仪测定上述溶液电导率,记录为S1;然后100℃煮10 min,待冷却至室温后再次测定溶液的电导率,记录为S2。根据公式计算相对电导率:相对电导率= (S1 / S2)×100%[25]。
1.9.3 叶绿素含量测定 剪取相同位置的叶片0.2 g放入盛有液氮的研钵中充分研磨;加1 mL预冷80%的丙酮,避光抽提20 min;离心取上清,加入两倍体积80%的丙酮;空白对照为等体积80%的丙酮,通过紫外分光光度计检测反应液在663 nm和645 nm处的OD值。根据公式计算叶绿素含量:Ca=(12.72×OD663 -2.59×OD645)×稀释倍数,Cb=(22.88×OD645- 4.67×OD663)×稀释倍数,叶绿素浓度(ct)= Ca+Cb,叶绿素含量(mg·g-1)=(ct×反应液体积×稀释倍数)/ 样品质量[26]。
1.9.4 根系活力检测 首先制作氯化三苯基四氮唑(TTC)的标准曲线;于试管中放入0.2 g新鲜根组织;加入0.4% TTC溶液和磷酸缓冲液各2 mL,避光,37℃培养箱静置1 h;加入1 mol·L-1硫酸0.8 mL终止反应;取出根,放入盛有2 mL乙酸乙酯和少量石英砂的研钵中研磨;将研钵中的红色液体移入干净试管中,加入乙酸乙酯使终体积为4 mL;以乙酸乙酯为空白对照,用紫外分光光度计测定485 nm处的吸光值,对比制作的标准曲线,可以得到四氮唑还原量。根据公式计算根活力大小:四氮唑还原强度(mg·(g·h) -1)=四氮唑还原量(mg)/根重(g)×时间(h)[27]。
1.9.5 Na+、K+和Ca2+含量测定 分别称取1 g左右根和叶置于烘箱中,80℃烘48 h称取干重;分别将其研磨成粉状放入试管中,加入1 mol·L-1的盐酸浸泡12—16 h;离心,在火焰分光光度计(6400A)上测定根和叶中Na+、K+和Ca2+含量。
2 结果
2.1 GmHAT5序列分析
利用DNAMAN软件分析克隆得到的GmHAT5,该片段包含1个1 038 bp的ORF,编码345个氨基酸。经Protparam程序预测,GmHAT5蛋白的理论分子量和等电点分别为39.17 kD和4.63。利用PSORT软件分析显示GmHAT5蛋白定位于细胞核,与其他HD-Zip家族蛋白一样,属于典型的核蛋白。经过NCBI网站的BLAST分析以及DNAMAN软件,对大豆GmHAT5编码的氨基酸序列进行同源蛋白比对分析发现,GmHAT5与野生大豆GsHAT5(GenBank:KHN01166.1)同源性最高,因此,将该基因命名为GmHAT5,其次与绿豆VrHAT5(GenBank:XP_014521387.1)、鹰嘴豆CaHAT5(GenBank:XP_004489987.1)、木豆CcHAT5(GenBank:KYP43012.1)、枣ZjHAT5(GenBank:XP_015894877.1)、赤豆VaHAT5(GenBank:XP_017411881.1)、莲NnHAT5(GenBank:XP_010242341.1)、可可TcHAT5(GenBank:XP_007044376.2)、苹果MdHAT5(GenBank:XP_008389534.1)、葡萄VvHAT5(GenBank:XP_002269605.2)等几种植物的HAT5蛋白同源性较高,并且都具有2个高度保守的功能结构域,其中第84—142位氨基酸编码一个转录因子特有的功能结构域-同源异型框结构域(Homeobox domain),具有与DNA结合的功能,第141—182位氨基酸编码一个高度保守的功能结构域-同源异型框结合类亮氨酸拉链结构域HALZ(Homeobox associated leucine zipper)(图1)。上述结果充分说明GmHAT5蛋白为大豆HD-Zip转录因子家族的其中一个成员。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1大豆GmHAT5与其他植物中同源蛋白的序列比对
黑线部分为同源异型框结构域序列,虚线部分为同源异型框结合类亮氨酸拉链结构域序列
-->Fig. 1The amino acid sequece alignment analysis of GmHAT5 and some homologous proteins in some other plants
The sequence marked with solid line demonstrates the homeobox domain, and the sequence marked with dotted line demonstrates the homeobox associated leucine zipper domain
-->
2.2 GmHAT5在不同器官及盐胁迫下表达特性分析
从转录组数据中调取GmHAT5在不同器官中的表达情况[19],包括幼叶、花、1 cm豆荚、开花后10 d、14 d荚壳、开花后10 d、14 d、21 d、25d、28 d、35 d、42 d种子以及根和根瘤共14个组织。如图2-A所示,GmHAT5在花中表达量最高,其次是根、1 cm豆荚、开花后10 d、14 d荚壳、幼叶,只在开花后21 d种子中未检测到GmHAT5的表达。由RNA-Seq的差异转录谱数据[24]可知,大豆GmHAT5受盐胁迫诱导上调表达,盐胁迫处理6 h、12 h 2个时间点表达量明显上升(图2-B)。以上结果表明,GmHAT5在大豆植株的各个不同器官中均有表达,是一个受盐诱导上调表达的HD-Zip类转录因子。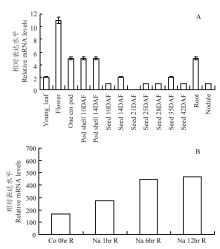 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同器官(A)及盐胁迫下(B)大豆GmHAT5的表达特性
-->Fig. 2Relative expression levels of GmHAT5 in different organs (A) and under saline stress (B)
-->
2.3 “复合体”植株的获得及抗盐表型分析
利用发根转化技术将构建好的过表达载体p1301U-GmHAT5和空载体p1301U(Ct)分别导入百脉根发状根中,用配置好的GUS染液鉴定阳性转基因发状根(图3-A),发状根阳性率为45%,分别获得超表达“复合体”植株25株和空载体对照植株18株,分别选取15株生长一致的植株进行抗盐试验。植株移入花盆中培养4周后,用200 mmol·L-1 NaCl处理7 d,发现在NaCl胁迫下,超表达“复合体”植株均能保持良好的生长状态(图3-B),而对照植株则明显萎蔫、失绿(图3-C)。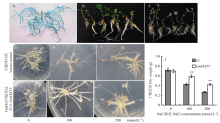 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3“复合体”百脉根植株的抗盐表型分析
A:阳性毛根的GUS鉴定;B:200 mmol·L-1 NaCl处理7 d后超表达植株的表型;C:200 mmol·L-1 NaCl处理7 d后空载体对照植株的表型;D—I:不同盐浓度条件下处理14 d阳性毛根的抗盐表型;J:空载体对照和“组合体”植株每组24个阳性毛根的干物质量统计分析。**代表差异极显著(P<0.01)。下同
-->Fig. 3Salt resistant phenotypes of “composite” plants of Lotus japonicus
A: GUS identification of positive hairy roots; B: The phenotype of over-expression plants after treatment with 200 mmol·L-1 NaCl for 7 d; C: The phenotype of empty vector control plants after treatment with 200 mmol·L-1 NaCl for 7 d; D-I: Salt resistant phenotypes of positive hairy roots under different salt concentrations for 14 d; J: Biomass measured as dry weight of 24 roots each group was measured. ** means extremely significant difference (P<0.01). The same as below
-->
将超表达与空载体对照植株阳性发状根分别剪取1 cm长一段放入MS培养基上,暗培养4周后,移入终浓度分别为0、100和200 mmol·L-1 NaCl的MS培养基上(图3-D—图3-I)。处理14 d后观察发现,正常条件下,超表达和对照植株阳性发状根生长旺盛,分支较多(图3-D和图3-G)。随着盐浓度的升高,如 100 mmol·L-1 NaCl处理后,超表达植株阳性发状根长势良好(图3-H),而对照阳性发状根明显干枯(图3-E);200 mmol·L-1 NaCl处理后,虽然超表达植株阳性发状根也开始出现干枯现象,但是未影响发状根的正常生长(图3-I),而对照阳性发状根不仅严重干枯,而且生长受到明显抑制(图3-F)。对超表达与空载体对照植株阳性发状根干物质量进行数据统计分析发现:经100和200 mmol·L-1 NaCl处理后,空载体对照发状根干物质量明显低于转基因发状根(P<0.01,图3-J)。由此初步获悉过表达GmHAT5显著改善了NaCl条件下毛状根的生长状况,从而提高了百脉根“复合体”植株的耐盐性。
2.4 稳定转化植株的获得及抗盐表型分析
应用根癌农杆菌介导法将载体p1301U-GmHAT5导入百脉根,应用GUS设计的特异引物F-GUS和R-GUS,对卡那霉素筛选得到的抗性植株进行PCR鉴定,获得15株PCR阳性植株(图4-A)。从中挑选4株超表达植株,RT-PCR 数据表明,在超表达百脉根根中均能检测到目的基因的表达,而对照植株根中未出现目的条带(图4-B)。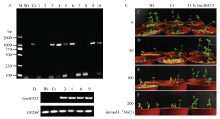 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4转基因百脉根的分子生物学检测及抗盐表型分析
A:PCR检测转基因植株和对照植株中GUS;B:RT-PCR检测转基因植株和对照植株中GmHAT5的表达量;Wt:以野生型百脉根基因组或cDNA为PCR模板,Ct:以空载体对照百脉根基因组或cDNA为PCR模板,M:DL2000 DNA marker;C—F:不同盐浓度处理14 d后转GmHAT5百脉根和对照植株的表型
-->Fig. 4Molecular biology detection and salt stress phenotype analysis of transgenic Lotus japonicus
A: The PCR analysis result of transgenic plants; B: The RT-PCR analysis result of transgenic plants; Wt: The genomic DNA or cDNA of wild type Lotus japonicus was used as the PCR template, Ct: The genomic DNA or cDNA of empty vector control was used as the PCR template, M: DL2000 DNA marker; C-F: Phenotype of transgenic Lotus japonicus with GmHAT5 gene grown in different salt concentration treatment for 14 d
-->
选取扦插扩繁状态一致的T0代转基因百脉根株系和野生型(Wt)及空载体对照(Ct)植株,分成4组,每组8株,并设置3个重复,分别用0、50、100和200 mmol·L-1 NaCl处理14 d。发现在正常条件下,转GmHAT5百脉根株系与野生型及空载体对照的生长状态并无明显差异(图4-C),而在50 mmol·L-1 NaCl处理14 d后,转基因株系的生长状态明显优于2个对照株系(图4-D)。经100、200 mmol·L-1 NaCl处理14 d后,转基因株系能保持良好的生长状态,而2个对照株系明显生长矮小,叶片失绿、萎蔫,甚至整株死亡(图4-E,图4-F)。
分别测量转基因百脉根株系和野生型(Wt)及空载体对照(Ct)的株高和根长变化情况,通过统计学分析发现(图5),在正常条件下,三者株高和根长没有明显差异;经过50 mmol·L-1 NaCl处理14 d 后,转基因株系的株高与2个对照株系差异显著(P<0.05),而三者之间根长没有明显差异;经过100 mmol·L-1 NaCl处理14 d 后,转基因株系的株高与2个对照株系之间差异极显著(P<0.01),根长与2个对照株系之间差异显著(P<0.05);经过200 mmol·L-1 NaCl处理14 d 后,转基因株系的株高与根长与2个对照株系之间差异均为极显著(P<0.01)。以上结果表明,过表达GmHAT5显著改善了高盐胁迫下转基因百脉根的生长状况,从而增强了百脉根的耐盐性。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5盐胁迫对转GmHAT5百脉根株高(A)和根长(B)的影响
*代表差异显著(P<0.05)。下同
-->Fig. 5Changes of shoot height (A) and root length (B) of transgenic Lotus japonicus with GmHAT5 under salt stress
* Significant difference (P<0.05). The same as below
-->
2.5 盐胁迫条件下转基因百脉根相关生理指标分析
2.5.1 丙二醛(MDA)含量分析 在盐胁迫下,植物细胞产生大量活性氧使得膜脂发生过氧化反应从而产生MDA,其含量直接反映植物在胁迫条件下细胞膜受损程度的高低。通过分析转GmHAT5百脉根和两组对照植株的MDA含量(图6-A)发现,在正常条件下,叶片MDA含量在转基因和对照植株间均无明显差异,随着盐浓度的增加,植株叶片MDA含量均随之升高,但转基因株系MDA含量增加的量比对照组少(P<0.05)。上述结果表明,超量表达GmHAT5可减轻盐胁迫对转基因百脉根细胞膜造成的氧化损伤。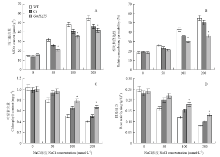 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6转GmHAT5百脉根的生理指标测定
A:丙二醛含量测定;B:相对质膜透性分析;C:叶绿素含量测定;D:根系活力测定
-->Fig.6Analysis on physiological characteristics of transgenic Lotus japonicus with GmHAT5 under salt stress
A: Analysis of MDA content; B: Analysis of relative membrane permeability; C: Analysis of chlorophyll content; D: Analysis of root activity
-->
2.5.2 相对质膜透性分析 相对质膜透性也能够反映植株在非生物胁迫下细胞膜受损程度的高低。在正常条件下,百脉根叶片相对质膜透性在转基因和对照植株间均无显著差异。随着盐浓度的增加,百脉根叶片相对质膜透性也随之升高,但在相同盐浓度下,转基因植株叶片相对质膜透性显著低于对照植株(P<0.05)(图6-B)。上述结果表明,转GmHAT5增强了盐胁迫条件下,百脉根植株细胞膜的生理活性。
2.5.3 叶绿素含量分析 图6-C显示,随着盐浓度的增加,转GmHAT5百脉根株系和对照植株的叶绿素含量均随之降低,但在相同盐浓度条件下,转基因株系的叶绿素含量均显著高于对照植株(P<0.05)。数据显示GmHAT5在百脉根中的超量表达,使得转基因株系在盐胁迫条件下具备较强的光合能力,从而维持良好的生长状态。
2.5.4 根系活力分析 从图6-D可以看出,随着盐浓度的增加,转基因和对照植株的根系活力均随之下降,但与对照相比,转基因株系的根系活力下降的幅度较低。由此可见,GmHAT5在百脉根中的超量表达可以使百脉根根系维持较高的活力,从而维持良好的生长状态。
2.5.5 阳离子含量的分析 为了深入探讨转GmHAT5百脉根植株的抗盐机理,对转基因株系和对照植株叶和根中Na+、K+、Ca2+的含量进行了测定(图7)。从图中可见,在正常条件下,转基因和对照植株Na+、K+、Ca2+含量在叶和根中基本一致。随着NaCl浓度的升高,转基因和对照植株叶和根中Na+和Ca2+含量明显升高,但与对照相比,转基因植株Na+含量增加的幅度较小;而Ca2+增加的幅度较大;反之,转基因和对照植株叶和根中K+含量明显降低,但转基因植株比对照植株下降的要少。以上结果表明转GmHAT5百脉根植株在盐胁迫条件下,通过降低体内Na+的含量,增加K+和Ca2+的含量,维持植株的正常生长,从而使转基因植株具有更好的耐盐性。
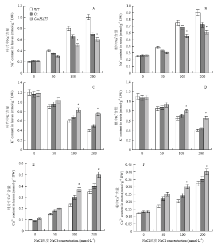 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7转GmHAT5百脉根的阳离子含量测定
A:叶片中Na+含量测定;B:根中Na+含量测定;C:叶片中K +含量测定;D:根中K +含量测定;E:叶片中Ca2+含量测定;F:根中Ca2+含量测定
-->Fig.7Analysis on positive ion content of transgenic Lotus japonicus with GmHAT5 under salt stress
A: Analysis of Na+ content in leaves; B: Analysis of Na + content in roots; C: Analysis of K + content in leaves; D: Analysis of K + content in roots; E: Analysis of Ca2+ content in leaves; F: Analysis of Ca2+ content in roots
-->
3 讨论
高盐胁迫是重要的非生物胁迫因子之一,严重影响植物的正常生长发育甚至减少农作物的产量[28]。因此,揭示植物响应盐胁迫的分子调控机理,通过基因工程手段培育耐盐作物品种对农业的生产大有裨益。大量研究表明,HD-ZipⅠ类转录因子在非生物胁迫应答反应中发挥重要作用,该类转录因子较常规功能基因明显提高了转基因拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)、小麦(Triticum aestivum)、水稻(Oryza sativa)等植物的抗盐能力[29]。利用BLAST和HMM软件在百脉根注释基因组中搜寻到6个HD-ZipⅠ类转录因子,其中4个基因定位于第2染色体,另外2个基因分别定位于第4、第6染色体。EST测序数据显示百脉根中的HD-ZipⅠ类转录因子在整个植株中均有表达,在根和花芽中表达量较高,推测它们可能在非生物胁迫如ABA、干旱、光应答反应中发挥重要作用[30]。本研究从RNA-Seq技术筛选出的大豆盐胁迫应答基因中克隆了一个受盐胁迫诱导表达量明显上升的HD-ZipⅠ类转录因子GmHAT5,该基因在盐胁迫应答反应中的功能及作用机理值得进一步深入探讨。本研究初步获悉超表达GmHAT5“复合体”植株具有一定的抗盐功能后,进一步对获得的稳定转化百脉根株系进行盐胁迫处理。正常条件下,转基因和对照植株生长状态基本一致,而高盐处理的对照植株长势明显较差,植株矮小,叶片失绿、萎蔫。与此同时,转基因株系的丙二醛含量和相对质膜透性均低于对照组,而叶绿素含量以及根系活力均高于对照组。丙二醛含量的高低和相对质膜透性的大小是衡量植物细胞膜受损程度的2个重要指标。在本研究中,高盐胁迫破坏植物细胞膜结构,导致丙二醛含量和相对质膜透性升高。但转基因植株中丙二醛含量和相对质膜透性较对照明显较低,说明盐胁迫对转基因植株质膜破坏程度较小,质膜的稳定性和完整性更好,植物能够维持正常的生理功能。因此,上述结果表明转GmHAT5植株在高盐胁迫下通过减轻质膜的过氧化作用、降低叶绿体结构功能的损伤以及增加根系活力,从而增强其耐盐能力。
为了更好地理解转GmHAT5百脉根植株的耐盐机理,本研究检测了转基因和对照植株叶和根中Na+、K+、Ca2+的含量。在正常生长条件下转基因和对照植株中离子的含量没有明显差异,说明GmHAT5在正常生长条件下不影响植株对3种阳离子的吸收。随着盐浓度逐渐升高,转基因和对照植株叶和根中Na+和Ca2+含量均随之升高,K+含量随之降低,但与对照相比,转基因植株中Na+含量较少,K+和Ca2+含量较多。在高盐胁迫下,细胞内离子浓度超过一定范围后导致酶的失活,蛋白质合成受阻,大量氨基酸转化为胺类物质,使得植物细胞中毒死亡,因此维持一定的离子浓度范围对植物耐盐至关重要。本研究中,GmHAT5在高盐胁迫下通过减少Na+的吸收或是增加Na+的外排,降低转基因植株叶和根中Na+的含量,从而维持植株的正常生理功能。K+在稳定细胞内环境和调节离子平衡过程中发挥功能,Ca2+在植物耐盐性方面也扮演着重要角色,如稳定细胞壁和细胞膜,刺激细胞对钾离子的吸收、调节水分平衡以及充当第二信使等[31]。因此,在盐胁迫下保持较高的细胞质K+和Ca2+浓度能够增强植物的耐盐性。本研究中,在盐胁迫条件下,转基因百脉根叶和根中K+和Ca2+含量均明显高于对照植株,充分说明GmHAT5的超表达有利于细胞对K+和Ca2+的吸收,从而调节细胞内的离子稳态平衡。
综上所述,GmHAT5过量表达显著提高了转基因百脉根的耐盐性,这为培育百脉根抗盐新品系提供了新的育种材料。本研究建立的百脉根发状根转化结合稳定转化技术体系,可以作为一种快速筛选抗盐候选基因的手段。随着对HD-Zip基因的逐渐了解以及对植物耐盐机制的研究和生物技术的不断完善,有望在利用HD-Zip基因改良作物的耐盐性方面取得重要突破。
4 结论
克隆得到大豆盐胁迫应答关键基因GmHAT5,该基因属于HD-Zip家族I类转录因子,编码含346个氨基酸的蛋白,与野生大豆GsHAT5同源性最高,具有典型的同源异型框结构域和亮氨酸拉链结构域;超量表达GmHAT5显著增强了百脉根的耐盐能力,发状根转化法可以作为一种快速有效筛选抗盐候选基因的手段;推测GmHAT5在大豆盐胁迫应激调控过程中发挥重要作用。The authors have declared that no competing interests exist.
