0 引言
【研究意义】菊花(Chrysanthemum morifolium)是中国传统名花,也是世界四大切花之一,其产量和销量均位于世界花卉前列[1],在世界范围内广泛用作切花、盆花及庭园绿化[2]。氮素对菊花的产量和品质至关重要,但施用过量不仅影响菊花的产量和品质,还会由于不能被植株及时吸收利用,而引起肥料资源的大量浪费和地下水环境的严重污染[3]。因此,研究菊花根系响应硝态氮信号的分子机理,选育氮高效利用的菊花新品种具有重要意义。【前人研究进展】迄今为止,国内外对模式植物拟南芥的氮素营养和信号转导进行过大量研究。研究认为[4-5],植物在长期的进化过程中已形成根系养分捕获塑性,形成了感知和捕获NO3-的复杂机制。FITTER等[6]研究发现,鱼尾形分支根系可以吸收更多的营养,以适应营养贫瘠的环境,而叉状分支根系较适合于营养丰富的生境条件。拟南芥根系在土壤低NO3-浓度时,细根直径变小,比根长增加,分枝角减小。刘大同等[7]研究表明,生长在硝态氮富集土壤中的小麦1级侧根明显比生长在缺氮环境中的粗壮。在拟南芥中也观察到氮富集土壤中生长的侧生根中柱直径、中柱细胞数及外皮层细胞数都比缺氮环境中的明显增加[8]。也有研究表明,硝态氮信号被拟南芥根系感知,引起根系内源IAA和CTK水平发生变化,从而促进侧根的生长[9]。XU等[10]研究表明,生长介质中的NO3-能诱导拟南芥根系硝态氮转运蛋白基因AtNRT1.1和AtNRT2.1的表达上调,并与AtNAR2.1蛋白互作,调控下游侧根发育特异转录因子基因AtANR1的表达,从而诱导拟南芥侧根的生长和发育[10]。之前国内外对菊花氮素营养的研究主要集中在氮素水平/形态或施入土壤中硝态氮和铵态氮的比例对菊花体内外氮循环、生理作用及产量和观赏品质的影响上[11-13]。近年来,在菊花中也研究了菊花根系硝酸盐转运蛋白基因CmNRT1.1和CmNRT2.1,并通过转基因技术对其转运蛋白功能进行了验证[14]。【本研究切入点】目前关于硝态氮信号诱导菊花根系形态结构变化的分子机理研究未见报道。【拟解决的关键问题】研究外源硝态氮处理对菊花根系外观形态与解剖结构、NO3-含量、内源激素水平、菊花根系硝态氮转运蛋白基因CmNRTs和侧根发育基因CmANR1表达的影响,旨在揭示菊花响应硝态氮的根系结构发生变化的分子机理,为培育氮高效利用菊花新品种提供理论依据。1 材料与方法
试验于2015年在山东农业大学园艺实验站和园艺科学与工程学院实验中心进行。1.1 试验材料与处理
试验材料采用国内外主栽切花菊品种‘神马’。取生长健壮、大小一致的菊花插穗(高约8 cm,顶部带2—3片幼叶)进行扦插,约3周后扦插生根。3月25日将生根均匀、长势健壮的扦插生根苗转移到人工气候室(光照周期定为日14 h/夜10 h,温度为昼22℃/夜18℃,相对湿度约75%)中装有细砂的方盆中缓冲2 d,然后转入盛有4 L无N元素的Hoagland营养液的黑色方形塑料盆(长48 cm、宽 29 cm、高12 cm)中,幼苗根茎交界处经海绵包裹后用聚乙烯泡沫板固定于塑料盆中,以气泵对营养液进行连续通气,每6 d更换一次营养液。每盆25株,共20盆。根据预试验设计的硝态氮浓度(0、1、10、20、30 mmol·L-1)处理后,菊花的长势调查结果表明,10 mmol·L-1 硝态氮处理下菊花的长势最好[14],因此,本试验KNO3处理浓度设为0和10 mmol·L-1(各10盆)。处理后于第0、1、3、7、14、21、28天分别取不同处理的菊花根系和叶片,根据试验需要分别进行后续观察和分析。每处理3次重复。1.2 测定项目与方法
1.2.1 根系形态构型测定 用根系扫描仪EPSON(G780B,Seiko Epson Corp.,Tokyo,Japan)扫描KNO3处理后第0、1、3、7、14、21、28天时的菊花根系。用WinRHIZO软件(2007年版)分析处理样品图像,计算每个样品的总根长、平均直径、总表面积、总体积和根尖数等参数的平均值。1.2.2 根系解剖结构观察 第28天时,取对照和硝态氮处理的新鲜菊花根系,切取粗细基本一致的距离根茎约1 cm处的1级根(扦插生出的初级根)、距离根茎最近的1 cm处的2级根(第1侧根)和3级根(第2侧根)的横截面制成临时切片,采用带有刻度的生物显微镜观察根系解剖结构,其放大倍数为100×。观察3个视野,取平均值。
1.2.3 硝态氮含量测定 采用任同辉[15]的水杨酸比色法。取根系和叶片各2 g,加去离子水10 mL研磨后移入15 mL离心管,30 min沸水浴,冷却后3 500 r/min离心10 min。将提取液过滤到25 mL容量瓶中并定容,吸取0.1 mL样品液,加入0.4 mL 5%水杨酸试剂,混匀后室温放置20 min,再加入9.5 mL 8% NaOH,摇匀,待冷却至室温后,在410 nm处比色测OD值。每个样品重复3次。
1.2.4 内源激素的提取和测定 采用林贵玉等[16]的方法。称取根系和叶片样品各5 g置于研钵中加入液态氮,研细后加入预冷的80%甲醇60 mL,再均匀研细,转到150 mL锥形瓶中,加塞放入4℃振荡器中,振荡24 h后过滤,滤渣中再加入预冷的80%甲醇20 mL,放置在冰箱里过夜, 再过滤,合并滤液。取10 mL滤液,通过SeppakC18小柱(美国Waters公司),用4 mL乙腈通过小柱,收集洗出液,过0.45 μm滤膜后上机测定。使用Waters201型HPLC(美国Waters公司),NovaparC18(0.5 cm×15 cm)柱,流动相为甲醇-乙腈-水(20:20:60,pH 3.5),UV检测器254 nm。每个样品重复3次。
1.2.5 基因保守序列片段克隆和qPCR检测 采用田素波等[17]的方法。分别取KNO3处理后第0、1、3、7、14、21、28天的根系,放入液氮中迅速冷冻后,转入-80℃超低温冰箱中保存。根系总RNA的提取采用TRNzol法,并用1%琼脂糖凝胶电泳检测总RNA的完整性。逆转录反应采用天根生化科技(北京)有限公司的FastKing RT Kit(With gDNase)(KR116)试剂盒,用实时荧光定量PCR技术检测CmNRT1.1、CmNRT2.1、CmNAR2.1、CmANR1在菊花根系中的表达水平。引物设计从NCBI中引用AtNRT1.1、AtNRT2.1、AtNAR2.1、AtANR1的序列,然后与菊花转录组相关基因进行blast同源性比对,再使用Primer 5.0软件进行设计。每处理3次重复,qPCR引物设计如下(表1)。
Table 1
表1
表1相关基因的实时荧光定量所用PCR扩增引物序列
Table 1Primer sequences used in real time PCR amplification
| 引物 Primers | 序列 Sequences (5′-3′) |
|---|---|
| CmNRT1.1-F | AACAGGGACCGTCAAGAGAA |
| CmNRT1.1-R | AGCAATCAAGAACAGCGAAA |
| CmNRT2.1-F | GTAACACCTCCGAGCAACAC |
| CmNRT2.1-R | TTTCACAATGCAATAGCATG |
| CmNAR2.1-F | AATGGCTGAAAACTCAAGAA |
| CmNAR2.1-R | AATCATGCAATGGCATAAAC |
| CmANR1-F | TTCTCAAAGAGGAGGAGTGGAT |
| CmANR1-R | CCATATTGCAGCTAGTATTCGAG |
| CmACTIN-F | ACAACTGCTGAACGGGAAAT |
| CmACTIN-R | TCATAGACGGCTGGAAAAGG |
新窗口打开
1.3 统计分析
采用Microsoft Excel 2007软件处理数据并作图,采用SPSS 17.0软件的LSD法进行差异显著性检验。2 结果
2.1 菊花根系外观形态
利用根系扫描仪扫描硝态氮处理(图1)和对照的菊花根系,并通过软件计算根系形态相关指标(表2)。结果表明,硝态氮处理的与对照相比,菊花根系总长度、平均直径、总表面积、总体积和根尖数至处理后的第3天为止没有出现明显差异,而第7天时出现明显差异,分别比对照增加了46.94%、6.12%、32.25%、60.94%、76.32%,而且随着处理时间的延长,以上各指标均有不同程度的增加。第28天时,硝态氮处理的菊花根系总长度、平均直径、总表面积、总体积和根尖数与对照相比,分别增加了205.63%、59.80%、129.33%、114.33%、105.04%。说明生长介质中的NO3-会影响菊花根系构型的改变。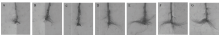 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1硝态氮对菊花根系外观形态的影响
A—G分别表示第0、1、3、7、14、21和28天
-->Fig. 1Effects of NO3- on the root appearance of chrysanthemum
A—G: 0, 1, 3, 7, 14, 21 and 28 day
-->
2.2 菊花根系解剖结构
利用带刻度的生物显微镜观察处理后第28天的菊花根系横切面,并测定各级侧根的维管束大小(表3)。结果表明,硝态氮处理的菊花根系1级根(扦插生出的初级根)的维管束直径为0.103 mm,2级根的维管束直径为0.107 mm,3级根的维管束直径为0.102 mm。硝态氮处理的1级根、2级根和3级根的维管束直径与对照相比分别增加5.10%、13.83%和5.15%;维管束占根横切面直径的比例与对照相比也明显增加,分别增加了15.70%、13.80%和12.42%。从图2可以看出,与对照相比,硝态氮处理的菊花1级根、2级根和3级根的维管束直径以及维管束占根横切面直径的比例均较大。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2硝态氮处理后第28天菊花根系横切面
A:1级根;B:2级根;C:3级根。放大倍数:100×
-->Fig. 2Root cross sections of chrysanthemum on the 28 day
A: 1st roots ; B: 2nd roots ; C: 3rd roots. Magnification: 100×
-->
Table 2
表2
表2硝态氮对菊花总根长、平均直径、总表面积、总体积和根尖数的影响
Table 2Effects of NO3- on the overall lengths, average diameters, total surface areas, total volumes and tips of roots in chrysanthemum
| 处理天数 Time of treatment (d) | 浓度Concentration (mmol·L-1) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 总根长 Root length (cm) | 平均直径 Average diameter (mm) | 总表面积 Surface area (cm2) | 总体积 Volume (cm3) | 根尖数 Root tips | ||||||
| 0 | 10 | 0 | 10 | 0 | 10 | 0 | 10 | 0 | 10 | |
| 0 | 12.213±0.17a | 13.014±0.14a | 1.810±0.11a | 1.798±0.08a | 8.342±0.27a | 8.138±0.24a | 1.362±0.16a | 1.289±0.10a | 32±2.63a | 30±2.37a |
| 1 | 12.204±0.08a | 12.927±0.19a | 1.804±0.13a | 1.802±0.10a | 8.329±0.35a | 8.129±0.51a | 1.359±0.13a | 1.298±0.15a | 35 ±2.36a | 31±2.10a |
| 3 | 12.548±0.09a | 13.591±0.12a | 1.826±0.18a | 1.825±0.14a | 8.916±0.83a | 8.889±0.66a | 1.348±0.21a | 1.364±0.22a | 43±5.51a | 48±5.79a |
| 7 | 28.531±2.13b | 41.923±2.63a | 1.831±0.05b | 1.943±0.02a | 13.462±1.01b | 17.804±1.36a | 1.216±0.08b | 1.957±0.13a | 76±4.38b | 134±9.07a |
| 14 | 33.075±0.15b | 36.762±0.07a | 1.791±0.19b | 2.392±0.05a | 14.563±0.79b | 26.961±1.18a | 0.856±0.03b | 1.652±0.09a | 82±6.53b | 167±10.53a |
| 21 | 31.583±1.80b | 64.102±2.41a | 1.736±0.04b | 3.012±0.10a | 17.467±1.53b | 40.583±2.46a | 0.896±0.07b | 1.504±0.13a | 98±6.92b | 257±11.93a |
| 28 | 20.971±1.79b | 64.093±3.07a | 1.893±0.12b | 3.025±0.04a | 15.094±1.29b | 34.615±2.15a | 0.712±0.02b | 1.526±0.11a | 119±9.14b | 244±14.33a |
新窗口打开
Table 3
表3
表3硝态氮对菊花根维管束直径、维管束和根径比的影响
Table 3Effects of NO3- on the vascular bundle diameters, ratio of vascular bundle diameter and root diameter of the roots in chrysanthemum 28 days after treatments
| 浓度 Concentration (mmol·L-1) | 1级根维管束 1st roots vascule bundle (mm) | 2级根维管束 2nd roots vascule bundle (mm) | 3级根维管束 3rd roots vascule bundle (mm) | 1级根维管束/根径 1st roots vascule/ diameter (%) | 2级根维管束/根径 2nd roots vascule/ diameter (%) | 3级根维管束/根径 3rd roots vascule/ diameter (%) | |
|---|---|---|---|---|---|---|---|
| 0 | 0.098±0.02b | 0.094±0.01b | 0.097±0.00b | 20.268b | 20.593b | 19.627b | |
| 10 | 0.103±0.00a | 0.107±0.03a | 0.102±0.01a | 23.451a | 23.435a | 22.064a |
新窗口打开
2.3 菊花根系和叶片中的NO3-含量
硝态氮处理的菊花根系NO3-含量随着处理时间的延长逐渐增加,在处理第7天时达到高峰(图3),峰值为0.45 mg·g-1FW,之后有所下降,然后保持在0.39—0.41 mg·g-1FW,但对照的菊花根系NO3-含量在整个试验期间保持在0.17—0.27 mg·g-1FW。硝态氮处理的菊花叶片NO3-含量随着处理时间的延长也有所增加,在处理第14天时达到高峰,峰值为0.35 mg·g-1FW,之后有所下降,然后保持在0.29—0.32 mg·g-1FW,而对照的菊花叶片NO3-含量在整个试验期间均显著少于处理组,保持在0.16—0.22 mg·g-1FW。比较根系和叶片中NO3-含量,对照的菊花根系NO3-含量早期比叶片多,但后期含量明显比叶片少,而硝态氮处理的菊花根系NO3-含量始终比叶片中的含量高。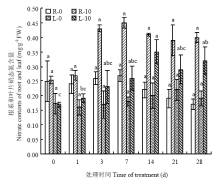 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3硝态氮对菊花根系和叶片NO3-含量的影响
R:根系;L:叶片;0:0 mmol·L-1;10:10 mmol·L-1。图中不同小写字母表示差异显著(P<0.05)。下同
-->Fig. 3Effects of NO3- on the nitrate contents of the roots and leaves of chrysanthemum
R: Root; L: Leaf ; 0: 0 mmol·L-1; 10: 10 mmol·L-1. Different small letters mean significant differences at 5% level. The same as below
-->
2.4 根系和叶片中IAA和CTK的含量
从图4可以看出,硝态氮处理的菊花根系中IAA含量随着时间延长逐渐增加,在处理第7天时达到最大值0.83 ng·g-1FW,稍有下降后保持在0.68—0.75 ng·g-1FW,而对照的根系中IAA含量变化幅度较小,保持在0.56—0.67 ng·g-1FW(图4-A)。叶片中IAA 含量的变化趋势基本与根系中的变化趋势相似,但叶片IAA含量比根系的高,而且硝态氮处理的叶片IAA含量高峰出现在处理第14天时,比根系的高峰出现时期晚7 d(图4-B)。根系和叶片CTK含量的变化趋势与IAA的变化趋势也有相似之处,硝态氮处理的根系中CTK含量在第7天出现高峰,峰值为0.19 ng·g-1FW,而对照的根系中CTK含量保持在0.11—0.14 ng·g-1FW(图4-C)。叶片中CTK含量与根系中的变化趋势相似,但叶片中CTK含量整体水平比根系中的高,且硝态氮处理的叶片CTK含量峰值也出现在处理第14天时(图4-D),虽然变化趋势相似,但叶片和根系中IAA和CTK含量差异明显。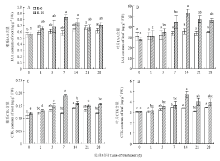 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4硝态氮对菊花根系和叶片中IAA和CTK含量的影响
-->Fig. 4Effects of NO3- on the contents of IAA and CTK of the roots and leaves of chrysanthemum
-->
2.5 根系中硝态氮转运蛋白基因CmNRT1.1、CmNRT2.1、CmNAR2.1和侧根发育基因CmANR1的表达
从图5可以看出,硝态氮处理的CmNRT1.1的相对表达量与对照相比差异显著,处理第1天时CmNRT1.1表达量达到高峰,之后逐渐下降并保持平稳状态(图5-A)。CmNRT2.1的相对表达量在处理第3天时达到高峰,之后有所下降,但与对照相比始终处于较高水平(图5-B),CmNAR2.1的相对表达量在第3天达到高峰,第7天时下降,第14天时又回升,随后逐渐下降(图5-C)。菊花侧根发育特异基因CmANR1的相对表达量在第7天时达到高峰,第21天后稍微回落,但与对照相比始终处于较高水平(图5-D)。总体来看,CmNRT1.1最早出现表达上调高峰,CmNRT2.1和CmNAR2.1延后出现高峰,CmANR1最晚达到表达高峰。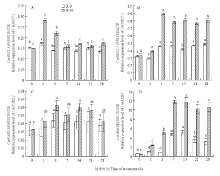 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5硝态氮对菊花根系CmNRT1.1、CmNRT2.1、CmNAR2.1和CmANR1相对表达量的影响
-->Fig. 5Effects of NO3- on the relative expression of CmNRT1.1, CmNRT2.1, CmNAR2.1, and CmANR1 in roots of chrysanthemum
-->
3 讨论
3.1 硝态氮对菊花根系构型和解剖结构的影响
植物根系形态构型是决定植物获取养分的重要因素,而根系形态建成过程受自身遗传因素和生长介质养分供应状况的影响[18]。植物能感受生长介质中氮、磷、硫和铁等元素的养分有效性并形成可识别的信号,从而调节植物细胞的分裂和分化,影响根毛的形 成、主根的生长和侧根的发育,最终导致根构型的变化[19]。根尖是根系吸收水分和养分的重要部位,根尖数越多,根长越长,根系表面积越大,越有利于养分的有效捕获[20]。DATTA等[21]研究表明,较高浓度的NO3-处理促进拟南芥侧根的伸长,是通过增加分生组织细胞的数量来实现的,而且这一生理过程是由具有硝态氮感应和转运功能的AtNRT1.1调控侧根发育特异基因AtANR1的表达而实现的[22]。本研究结果表明,与对照相比,10 mmol·L-1浓度硝态氮处理的菊花根总长、平均直径、总表面积、总体积和根尖数均显著增加,而且随着处理时间的延长,增加幅度越大。同时,观察根系维管束和根横切面发现,硝态氮处理的1级根、2级根和3级根的维管束直径及维管束占根横切面直径的比例与对照相比均明显增加。硝态氮处理影响了菊花的根系构型和解剖结构,这说明菊花根系能响应生长介质中的硝态氮信号,而响应这种信号是通过诸多基因的表达调控和改变自身根系组织结构及外部形态构型来实现的[19]。但如果生长介质中NO3-浓度过高,则会抑制侧根的生长,其原因可能是根系中IAA的过多累积,也可能是IAA信号途径发生了改变而引起侧根生长的抑制[7]。本研究前期预试验中也发现硝态氮浓度过高(20、30 mmol·L-1)时菊花根系生长均受到不同程度的抑制,侧根发生较少或不能生长,说明适宜的硝态氮浓度是植物根系正常发育的必要条件。3.2 硝态氮对菊花根系和叶片中NO3-含量的影响
已有研究表明,施用硝态氮肥能促进菊花对硝酸盐的吸收,提高菊花中硝酸盐的含量,但其产量不会以相应的比例增加,过多施用氮肥时产量甚至降低[23]。本研究结果表明,硝态氮处理的菊花根系和叶片中硝态氮含量均有所提高,且对照的菊花根系NO3-含量早期比叶片多,后期含量明显比叶片少,而硝态氮处理的菊花根系NO3-含量始终比叶片中的含量高。这说明菊花植株不同部位的硝酸盐含量有很大差异,氮的供应水平对植物体硝酸盐含量有显著的影响。当外界N水平较高时,菊花对硝酸盐的吸收转运主要是受低亲和转运蛋白NRT1影响,NRT1表达量高,菊花根系和叶片的硝酸盐含量也高。3.3 菊花响应硝态氮根系形态结构改变与内源IAA和CTK水平的关系
BOUGUYON等[24]研究认为,拟南芥NO3-信号同时诱导ANR1在根部的表达和IAA向根部的转导,并引起侧根的伸长,而且侧根生长期间细胞发生一系列大小和形态上的变化,以及组织中IAA和CTK水平的动态变化[10]。另外,局部NO3-处理对拟南芥侧根伸长的刺激作用主要是由于侧根分生组织分裂产生了更多的细胞[20]。玉米侧根分生组织中CTK的产生也具有NO3-依赖性变化,在玉米缺氮的根部重新供给NO3-时,能够快速刺激根系CTK的生物合成及其向根尖的转运[25-26]。本研究结果表明,与对照相比,硝态氮处理的菊花根系和叶片中IAA和CTK含量均显著提高,而根系中IAA和CTK含量与叶片中的相比整体水平相对减少,说明根系NO3-信号能使少量的IAA向根部转导,也能使根系合成CTK引起菊花侧根的形成和伸长[16]。有研究报道表明,高浓度硝态氮抑制侧根的生长发育[27],本研究结果也发现,无论IAA还是CTK在根系中的分布量都比叶片中的量少,这可能是因为根系响应NO3-信号,并引起侧根的生长发育需要较少量的IAA和CTK,这也解释了植物根系中IAA和CTK浓度过高会抑制根系生长及高浓度硝态氮抑制侧根生长的事实[27-28]。但高浓度NO3-对侧根的抑制作用不仅是IAA或CTK的变化所致,还可能存在其他的调节机制,这方面机理还有待进一步深入研究。3.4 菊花响应硝态氮根系形态结构改变与相关基因表达的关系
在通气良好的土壤中,硝态氮是植物吸收的主要氮源,其不仅是氮同化的代谢底物,而且还可作为信号分子调节相关基因的表达来影响植物的生长和发育[29]。硝态氮可以调节许多基因的变化,如编码硝酸盐转运蛋白及与硝酸盐吸收、还原、同化作用相关酶的基因等,来最大限度地捕获、吸收、利用氮素,从而满足自身正常生命活动的需要。这些基因通常可受到硝酸盐的迅速诱导,且不依赖蛋白质的从头合成,因此被称为硝酸盐初级响应基因,总数多达1 000个[29]。NRT1.1是硝态氮信号转导中的感受蛋白,也是低亲和型硝酸盐转运蛋白,且具有在细胞之间运输IAA的功能[20],而NRT2.1是高亲和型硝酸盐转运蛋白,它们共同与NAR2.1蛋白互作,调控侧根发育特异基因ANR1的表达[27]。ANR1是一个编码NO3-诱导的根特异表达的转录因子MADS box的家族成员[22]。ANR1被阻遏的转基因拟南芥植株中,培养基中富含NO3-的区域内侧根不再优先生长[30]。本研究结果表明,硝态氮处理的菊花根系中这4个基因的表达量与对照相比均显著增加,说明这4个基因均受硝态氮信号诱导。不同的是,硝态氮处理的根系中CmNRT1.1在处理第1天达到表达高峰,CmNRT2.1、CmNAR2.1在处理第3天达到高峰,而CmANR1在第7天出现高峰,且CmNAR2.1的表达量变化幅度没有其他3个基因明显。由此推测CmNRT1.1和CmNRT2.1虽然调控下游侧根发育特异基因CmANR1的表达,但可能不是持续调控,只是在前期诱导启动CmANR1的表达,后期则由CmANR1自身持续表达,或者还可能受到内源激素等其他通路基因的调控[29]。4 结论
硝态氮处理改变了菊花根系形态结构,促进了侧根的生长发育。在这个过程中,根系维管束结构、硝态氮含量、内源激素水平和相关基因的表达也发生了相应改变。说明菊花根系能够通过硝态氮转运蛋白基因和侧根发育基因的表达来响应生长介质中的硝态氮信号,进而调控根系构型的改变,从而提高菊花根系对硝态氮的吸收和利用。菊花根系的这种捕获硝态氮信号的机制为植株的正常生命活动提供了营养物质基础。The authors have declared that no competing interests exist.
