0 引言
【研究意义】番茄(Solanum lycopersicon cv. Ailsa Craig)作为一种世界性的蔬菜,具有营养丰富、产量高以及口感佳等特点。但是番茄产量及质量一直受到番茄病毒病这一重要因素的限制,随着番茄大面积的种植,番茄病毒病的危害也愈发严重,对番茄生产造成巨大的影响。烟草花叶病毒(Tobacco mosaic virus,TMV)属于烟草花叶病毒属(Tobamovirus),寄主范围十分广泛,茄科、十字花科、禾本科、藜科、豆科等许多植物都能被其侵染,番茄也是其寄主之一。选育抗病品种是控制该病的主要措施之一,但对其相关抗病基因的分离鉴定和功能挖掘应用仍需加强研究。HIN1(harpin-induced gene 1)是Harpin诱导表达的蛋白之一,在多种植物防卫反应、生长发育、衰老以及抗逆过程中都发挥着重要功能,明确该基因在番茄抗病毒的功能对于防治病毒病有重要的理论和实际意义。【前人研究进展】植物在生长发育和逆境过程中,非亲和植株与外来病原菌互作后,会激发植株短时间内产生细胞迅速坏死的现象以防止病原菌继续侵染,称之为过敏性坏死反应(hypersensitive reaction,HR)。GOPALAN等[1]在研究烟草抗病相关基因过程中,分离得到一种能够激发植株HR反应的基因Hin1,该基因受Harpins蛋白和Pseudomonas syringae细菌所诱导后产生。以Hin1 cDNA作为基因探针进行Genomic Southern分析发现了两个相似基因Hin9和Hin18,并且该基因有一个至少含有4—5个可以交叉混合基因成员的多基因家族[2]。因具有相似的基因序列,Hin1与拟南芥基因NDR(nonrace-specific disease resistance gene)统称为NHL(NDR1/HIN1-Like)家族,并且NDR以及大多数NDR同源基因都对细菌和真菌病原体表现出敏感性[3]。1996年,首次分离出烟草NtHin1[1],发现其在Hrp[4]和avrPto[5]两条信号途径中都有参与并且在信号通路中属于下游基因,这暗示着烟草NtHin1可能在植物过敏性坏死反应中有着重要功能。在拟南芥的衰老叶片中,AtHin1有着更高的表达水平[6],暗示该基因可能在植物防卫以及细胞衰老过程中发挥一定作用。RAKWAL等[7]在研究中发现当水稻受稻瘟病菌(Magnaporthe grisea)侵染后,水稻OsHin1只在抗性品种中有所表达。而且在非生物胁迫(机械损伤)时,可诱导其大量表达。葡萄VvNHL1(NDR1/Hin1-Like 1)在拟南芥突变体中的过表达可通过增强细胞坏死提高突变体对灰葡萄孢(Botrytis cinerea)的抗性[8]。通过黄瓜花叶病毒(Cucumber mosaic virus,CMV)处理后,拟南芥NHL10的表达明显提高,暗示该基因在植物抗性方面或许有一定作用[9]。LEE等[10]在菜豆的研究中发现,细胞外的Ca2+并不会影响HIN1的积累,但却受到MAPK激活的影响。拟南芥基因组中的AtNHL3和AtNHL25在与病原物互作后都有较高的应答水平,并且AtNHL3影响丁香假单胞菌(Pseudomonas syringae)的衍生信号从而产生防御反应[11]。【本研究切入点】前人研究表明Hin1在作物抗细菌和真菌过程中起重要作用,但其是否具有抗植物病毒的功能,尚未有报道。茄科植物中烟草、辣椒(Capsicum annuum)及马铃薯(Solanum tuberosum)的Hin1虽然已被克隆并在GenBank提交序列,但仍未有其组织定位和抗病毒特性的研究报道。番茄作为重要的茄科作物,其体内是否也存在Hin1同源基因,是否具有抗病毒功能?这一问题需开展相应研究。【拟解决的关键问题】克隆得到番茄SlHin1,对比分析其与其他作物中同源性,预测其蛋白质的理化性质及其他生物信息并明确其亚细胞定位。通过SlHin1瞬时表达对烟草花叶病毒侵染移动的影响,分析其在番茄抗病毒过程的潜能,为番茄抗病毒育种提供可参考利用的抗病基因。1 材料与方法
试验于2015—2016年在西南大学植物保护学院植物病毒研究室完成。1.1 材料
1.1.1 菌株和质粒 供试大肠杆菌DH5α购自北京全式金生物技术有限公司;根癌土壤农杆菌株EHA105由笔者实验室保存;烟草花叶病毒荧光标记载体TMV-GFP(pSPDK661)[12]由清华大学刘玉乐教授实验室馈赠;植物表达载体pCV-mGFP-C1[13]由浙江省农业科学院陈剑平研究员实验室馈赠;植物过表达载体pFGC5941[14]由美国纽约城市大学郑志亮教授实验室馈赠;供试本氏烟(Nicotiana benthamiana)、辣椒、马铃薯及番茄,在温室育苗盆中播种,培养至4—6叶期备用。1.1.2 试剂和引物 DNA纯化回收试剂盒和质粒提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒、高保真ExTaqTM DNA聚合酶、T4 DNA连接酶购自大连TaKaRa公司;T-载体试剂盒购自普洛麦格(北京)生物技术有限公司;实时荧光试剂盒使用QuantiNovaTM SYBR Green PCR Kit(QLAGEN,GER);限制性内切酶购自NEB公司;蛋白转膜试剂盒购自BIO-RAD公司;抗体购自巴傲得生物科技有限公司。
1.2 方法
1.2.1 植物总RNA提取和cDNA合成 参照CHOMCZYNSKI等[15]的方法,各取50—150 mg的烟草、辣椒、马铃薯及番茄叶片在液氮中充分研磨,用TRIzol Reagent提取总RNA,根据Prime-ScriptTM RT Reagent试剂盒方法合成cDNA。1.2.2 基因克隆与载体构建 以烟草NtHin1(AF212183)、辣椒CaHin1(AB162221)及马铃薯StHin1(NM_001288038)的cDNA序列作为参考,用Primer 5.0软件分别设计引物(表1)。以烟草、辣椒和马铃薯各自cDNA作为模板,对应引物进行PCR扩增。并以番茄cDNA作为模板,用烟草、辣椒和马铃薯的引物分别PCR扩增番茄SlHin1基因片段。PCR体系:10×Ex Buffer 2.5 μL,dNTP 2 μL,MgCl2(25 mmol·L-1)2 μL,ExTaq酶0.25 μL,上下游引物(10 μmol·L-1)各0.5 μL,cDNA 1.25 μL,ddH2O补齐至25 μL。反应条件:94℃ 3 min;94℃ 30 s,57℃ 30 s,72℃ 50 s,30个循环;72℃ 10 min。经1.5%琼脂糖凝胶电泳,回收目标片段,克隆至pGEM-T Essy载体,转化大肠杆菌DH5α,筛选出阳性克隆由华大基因公司测序。根据分析测序结果,设计番茄SlHin1基因特异性引物(表1),PCR进行扩增后构建至植物绿色荧光蛋白融合表达载体pCV-mGFP-C1 [13]以及植物过表达载体pFGC5941[14],成功的重组质粒分别命名为pCV-SlHin1和pFGC-SlHin1。
Table 1
表1
表1本研究所用引物序列
Table 1Primers used in this study
| 引物名称 Primers name | 引物序列 Primers sequence | 物种 Species | |
|---|---|---|---|
| RT-PCR | NtHin1-F NtHin1-R CaHin1-F CaHin1-R StHin1-F StHin1-R | 5′-ATGCCGGAATCCAATTTG-3′ 5′-CCAATCAAGATGGCATCTG-3′ 5′-ATGCCTGAATCGAACTTG-3′ 5′-CCAATCAAGATGACATCTAG-3′ 5′-ATGTCCAACTTGAACGGAG-3′ 5′-CCAATCAAGATGGCACCTAG-3′ | 烟草 Tobacco 辣椒 Pepper 马铃薯 Potato |
| Real-time PCR | SlHin1-qPCR-F SlHin1-qPCR-R | 5′-TCCAACTTGAACGGAGCCTA-3′ 5′-ATGACTCCGAGGACGATGAG-3′ | 番茄 Tomato |
| Actin-qPCR-F Actin-qPCR-R | 5′-AGGCAGGATTTGCTGGTGATGATGCT-3′ 5′-ATACGCATCCTTCTGTCCCATTCCGA-3′ | 番茄 Tomato | |
| pCV-mGFP-C1 | 5′SlHin1-Sal I 3′SlHin1-BamH I | 5′-CGCGTCGACATGTCCAACTTGAACGGAG-3′ 5′-CGCGGATCCCTACCAATCAAGATGGCACCTAG-3′ | 番茄 Tomato |
| pFGC5941 | 5′SlHin1- Nco I 3′SlHin1-His-BamH I | 5′-CATGCCATGGATGTCCAACTTGAACGGAG-3′ 5′-CGCGGATCCCTAATGGTGATGGTGATGATGCCAATCAAGATGGCACCTAG-3′ | 番茄 Tomato |
新窗口打开
1.2.3 番茄SlHin1序列的生物信息学分析 利用DNA STAR对测序得到的基因序列结果进行编辑及序列拼接,上传至NCBI数据库;利用NCBI(http://ncbi.nlm.nih.gov/)的BLAST在线分析工具分别对GenBank的非冗余蛋白数据库序列进行比对分析;利用DNA STAR和Mega 6.0软件[16]分别进行氨基酸序列同源性比对和进化树分析,其中进化树为1 000次自展测试后(Bootstrap test)的邻接树(neighbor- joining tree);利用ExPASy ProtParam(http://expasy. org/tools/pi_tool.html)对SlHIN1蛋白理化性质进行预测;利用在线CBS生物信息学分析工具(http://www.cbs.dtu.dk/services/)[17]中的TMHMM 2.0对SlHIN1跨膜结构进行预测;PSORT Prediction(http://psort.hgc.jp/form.html)[18]对蛋白亚细胞定位进行预测;在线预测软件Phyre2(http://www.sbg.bio.ic.ac. uk/phyre2/html/)预测SlHIN1蛋白三维空间结构。
1.2.4 番茄SlHIN1的亚细胞定位 重组质粒pCV-SlHin1及质膜Marker pRFP-AtRop10利用热激法转化至土壤农杆菌EHA105,瞬时表达方法参照邱礽等[19-20]的方法,用新鲜配置的缓冲液(10 mmol·L-1 MgCl2;10 mmol·L-1 MES以及0.1 mmol·L-1 AS)重悬菌体,分光光度计调至OD600值为1.0室温静置3 h。选取培养至4—6叶期健康的本氏烟幼苗,用无菌注射器共注射上述土壤农杆菌悬浮液。接种后的本氏烟置于25℃培养箱培养。72 h后,取下注射的本氏烟叶片,制作临时玻片,在蔡司激光扫描共聚焦显微镜(LSM780)下观察该叶片注射孔的附近的荧光表达情况,以健康本氏烟作为对照。
1.2.5 基因表达分析 采用real-time PCR分析番茄不同组织的表达情况,以番茄根、茎、叶的cDNA为模板,反应引物见表1。应用Bio-Rad CFX实时定量PCR仪器,每个样品设3次重复,Ct值取平均值。按照QuantiNovaTM SYBR Green PCR Kit使用说明进行,real-time PCR体系:2×Green PCR Master Mix 10 μL,上下游引物(10 μmol·L-1)各1 μL,cDNA 1 μL,ddH2O补齐至20 μL。反应条件:95℃ 3 min;95℃ 10 s,57℃ 30 s,72℃ 40 s,40个循环。利用2-△△CT法[21]计算各个时间点SlHin1对Actin的相对表达量。
1.2.6 异源表达番茄SlHIN1及抗病毒试验 按照方法1.2.4转化重组质粒pFGC-SlHin1,重悬液注射本氏烟叶片进行预处理,以注射表达载体pFGC5941[14]作为空白对照。48 h后再在原接种叶注射含有pSPDK661[12](TMV-GFP)的重悬液。注射48 h后,在紫外灯下观察TMV-GFP的移动情况,拍照记录并收集接种叶片,连续观察4—7 d。利用间接ELISA法检测病毒的含量,包被液研磨叶片,上清加入ELISA板包被,洗涤后依次加入一抗、二抗,各在37℃孵育2 h,最后加入含有邻苯二胺的底物缓冲液在37℃恒温箱避光显色,显色结束用浓硫酸终止反应。用酶标仪测定OD492值,当OD492相对比值>2时待测样品为阳性,所得数据应用Excel 进行标准差和方差分析之后作图。
1.2.7 蛋白提取和Western blot分析 本氏烟被处理72 h后,收集接种叶,植物总蛋白用蛋白抽提液(100 mmol·L-1 Tris-HCl,pH 8.0;6% SDS;2% β-巯基乙醇)进行抽提纯化,沸水煮变性5 min,冰浴5 min,用12% SDS-PAGE胶电泳,分离后做Western blot分析。将凝胶、转移缓冲液浸泡过的硝酸纤维素膜以及滤纸依次叠放利用半干转印仪(Bio-Rad)快速转膜。用封闭液将硝酸纤维素膜室温封闭2 h,TBST洗涤3次,加入按比例稀释后的一抗,室温摇床孵育2 h,洗涤后加入稀释的二抗,室温摇床上孵育2 h,洗涤3次后用碱性磷酸酶底物5-溴-4氯-3吲哚磷酸/氮蓝四唑(BCIP/ NBT),在避光条件下进行显色反应。待颜色达到要求后用水洗去显色液终止反应。
2 结果
2.1 Hin1克隆与分析
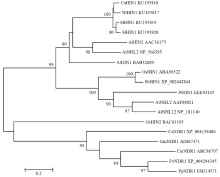
序列分析结果显示,从烟草、辣椒及马铃薯总RNA的cDNA中均扩增出Hin1目的条带,长度分别为687、684和675 bp。将序列分别提交至GenBank,得到序列号分别为烟草NtHin1(KU195817)、辣椒CaHin1(KU195818)、马铃薯StHin1(KU195819)。以番茄cDNA作为模板,以烟草、辣椒和马铃薯的引物分别PCR扩增番茄SlHin1基因片段,均扩增到片段(图1)。将红色框内片段连接到pGEM-T Essy载体上并进行测序,得到的序列经NCBI BLAST分析表明,烟草和辣椒引物自番茄cDNA中扩增到的片段均是位于叶绿体上的基因片段,只有马铃薯引物扩增的目的片段(675 bp)则与茄科Hin1相似度非常高。DNA STAR软件W聚类分析表明,番茄SlHin1与烟草NtHin1、辣椒CaHin1及马铃薯StHin1核苷酸序列的同源性分别为83.7%、89.9%和95.6%;氨基酸序列的同源性分别为88.9%、91.1%和96.0%。将获得的番茄Hin1序列与番茄基因组数据库(ITAG release 2.40)进行比对,发现有96.1%(649/675)的相似性,并且在10号染色体上(Solyc10g081980)。因此推测此目的片段为番茄Hin1基因片段,命名为SlHin1。将序列提交至GenBank得到序列号KU195820。从NCBI下载其他物种HIN1氨基酸序列,应用DNA STAR和Mega 6.0软件对茄科HIN1和其他物种HIN1蛋白进行多重氨基酸序列比较和进化树(图2、图3),结果表明茄科植物之间亲缘关系最近,拟南芥次之,与水稻、高粱单子叶植物的亲缘关系较远。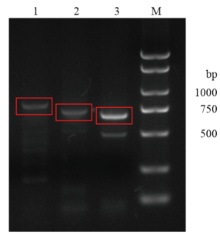 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1番茄SlHin1 PCR扩增
-->Fig. 1PCR productions of SlHin1 from tomato cDNA
1:烟草引物(NtHin1-F&R)扩增条带 Fragment amplified with NtHin1 primers;2:辣椒引物(CaHin1-F&R)扩增条带 Fragment amplified with CaHin1 primers;3:马铃薯引物(StHin1-F&R)扩增条带 Fragment amplified with StHin1 primers;M:低分子量核酸Marker Low molecular DNA Marker
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2茄科4种植物的HIN1氨基酸对比
黑点表示与烟草NtHIN1氨基酸一致的序列;下划线为预测保守结构域
-->Fig. 2Comparison of amino acids in HIN1 from four species of Solanaceae
Black spots indicated the sequences that match the protein sequence of N. benthamiana; The underlines were the predicted conserved domains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3番茄SlHIN1与其他植物NHL和NDR的进化树分析
-->Fig. 3Phylogenetic tree analysis of SlHIN1 with NHL&NDR from other plants
Ca:辣椒Capsicum annuum;Nt:烟草Nicotiana tabacum;St:马铃薯Solanum tuberosum;Sl:番茄Solanum lycopersicon;At:拟南芥Arabidopsis thaliana;Os:水稻Oryza sativa;Sb:高粱Sorghum bicolor;Pt:毛果杨Populus trichocarpa;Cs:黄瓜Cucumis sativus;Gm:大豆Glycine max;Car:咖啡Coffea arabica;Fv:草莓Fragaria vesca subsp. Vesca;Pp:碧桃Prunus persica。分支上的数值表示自展值 The numbers on the branches represented the values of Bootstrap test
-->
2.2 番茄SlHIN1蛋白生物信息学分析
根据ProtParam显示,SlHIN1蛋白的理论分子量为26.1 kD,理论等电点为9.35,分子式为C1180H1829N321O323S14,带正电荷氨基酸残基总数为29,带负电荷氨基酸残基总数为17,脂肪系数为84.89,平均亲水性为-0.313,不稳定指数为42.77,预测该蛋白为不稳定蛋白。Inteproscan预测蛋白具有保守结构域LEA-14(99—201位氨基酸)。TMHMM 2.0分析结果显示SlHIN1蛋白序列中并不具备跨膜区段。用PSORT Prediction对SlHIN1蛋白的亚细胞定位预测结果表明,该蛋白有60.0%的可能是位于细胞质膜,40.0%的可能性为高尔基体,30.0%的可能性是内质网膜,10.0%的可能性是线粒体内膜。SlHIN1在软件Phyre2中自动氨基酸序列比对后参照2个模型(c1yycA,d1xo8a)进行构建三维图。经分析其中SlHIN1中有99个氨基酸残基是参照ab initio模型,模型中有56%的覆盖率可信度是大于90%。从三维图中可以发现包括无规则卷曲(30%)、α螺旋(19%)、β折叠(46%),结果相差较大的可能是无规则卷曲,但需注意的是Phyre2软件是不能够描绘β转角,因此将β转角也归类在无规则卷曲类别中。2.3 番茄SlHIN1的亚细胞定位
为明确SlHIN1蛋白在细胞中的定位,构建了亚细胞荧光定位重组质粒pCV-SlHin1,pRFP-AtRop10作为质膜Marker,并用热击法导入农杆菌EHA105,利用农杆菌侵染转化的表达方法使其在本氏烟叶片中瞬时表达,48—72 h后在蔡司LSM780激光共聚焦显微镜下观察。结果显示,融合SlHIN1的GFP荧光分布于细胞膜上(图4),结果与PSORT Prediction预测的亚细胞定位最高概率一致。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4番茄SlHIN1亚细胞定位
-->Fig. 4Subcellular localization of SlHIN1 protein in the epidermal cells of N. benthamiana leaves
-->
2.4 基因组织表达分析
qRT-PCR用于分析SlHin1在番茄根、茎、叶组织中的表达模式,结果显示SlHin1在根、茎、叶中均有表达,在茎及叶中表达量较低(0.17和0.36),在根中表达量高(1.15)。各组间达到显著水平(P<0.05),表明表达水平有组织特异性(图5)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5SlHin1在不同番茄器官中的表达模式
-->Fig. 5Expression pattern of SlHin1 in different tomato organs
-->
2.5 异源瞬时表达番茄SlHIN1蛋白在本氏烟中对TMV的抑制作用
为明确在本氏烟中异源瞬时表达SlHIN1蛋白是否会对TMV有抑制作用,先对本氏烟进行预处理,利用重组质粒pFGC-SlHin1瞬时表达48 h后,再接种TMV-GFP,在紫外灯下观察TMV-GFP的移动情况。结果显示,处理组本氏烟在接种TMV-GFP 4 d后没有任何荧光出现并且叶片没有明显坏死现象,而对照组出现绿色荧光。5 d后处理组开始出现零星荧光,而对照组的绿色荧光开始扩散,在接种7 d后,处理组叶片上零星荧光有略微的扩大,而对照组的绿色荧光已经扩散至心叶(图6-a),说明异源瞬时表达番茄SlHin1蛋白对TMV侵染移动具有一定的抑制作用。随后采用间接ELISA法进一步验证,结果显示,注射TMV-GFP 4 d后,处理组的OD492值为2.05,而对照组的已经达到10.87,随后对照组OD492值上升迅速,在接种7 d后达到处理组的7倍(图6-b)。同时,在第3天提取叶片注射部位植物总蛋白提取后,用12% SDS-PAGE胶电泳,分离后用HIS标签抗体做Western blot分析。结果表明,显色后的硝酸纤维素膜上约在26 kD处有一特异条带,与预期大小一致,而空载体的对照无相应条带,说明SlHIN1蛋白在注射部位成功表达(图6-c),病毒复制速率降低和长距离移动延迟是SlHIN1蛋白作用的结果。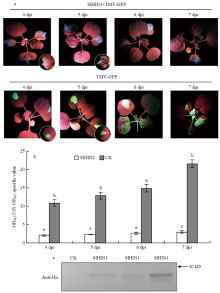 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6SlHIN1在本氏烟中表达对TMV的抑制作用
-->Fig. 6The effect of SlHIN1 on inhibiting TMV in N. benthamiana
a:瞬时表达SlHIN1的本氏烟草叶片侵染TMV-GFP后的症状 Symptoms of TMV-GFP infected N. benthamina leaves with or without transient expression of SlHIN1;b:ELISA检测TMV含量 Detection of TMV virus content by indirect-ELISA;c:蛋白免疫印迹验证番茄SlHIN1蛋白表达水平 Analyses of the levels of SlHIN1 by Western blot
-->
3 讨论
在拟南芥、烟草、水稻、葡萄等植物中,Hin1均参与了植物的抗病和抗逆过程[1,6-9,22]。据此,通过RT-PCR得到番茄Hin1基因序列长为675 bp,编码225个氨基酸,命名为SlHin1。蛋白质生物学预测发现SlHIN1可能为不稳定蛋白而且不具有跨膜结构,保守结构域为LEA-14,在小麦TaHin1和芹菜AgNHL的研究过程中也发现了相类似的结构域[23-24]。LEA家族蛋白是生物体中广泛存在与渗透调节有关的一类家族蛋白,编码该蛋白的基因在种子胚胎发育晚期表达量丰富,在干旱、低温等环境胁迫下也大量表达[25],因此该保守结构域的存在间接证明SlHin1与抗性防御功能相关。进化树分析结果表明SlHin1在茄科植物之间亲缘关系最近,拟南芥次之,与单子叶植物的亲缘关系较远。而这些来自其他物种的NHL家族蛋白能受多种非生物胁迫诱导表达且在提高植物对环境逆境耐性中起到积极的作用,并在植物的防御反应中同样扮演着重要的角色[11],由此推测番茄SlHIN1蛋白或许在植物防御反应中也具有重要作用。通过亚细胞定位技术观察到该基因定位在细胞膜上,与蛋白预测结果相一致,也与NHL家族中的一些基因的亚细胞定位试验结果一致[26-27]。但是,NHL家族中由于一些基因有类肌质蛋白(sarcolipin-like)序列的存在,可以导致基因滞留在内质网上[22]。拟南芥NDR1抗病蛋白研究发现,该蛋白定位在细胞膜上并且易形成局部的高浓度,容易与病原菌快速识别,从而提高反应敏感性[27-28]。由此推测SlHIN1蛋白可能参与识别病原体,快速引发防御反应有关,其具体识别机制需要进一步研究。本研究中SlHin1在根茎叶中均有表达,具有组织特异性,这一特性与NHL家族相似[29]。
在对瞬时过表达SlHIN1烟草叶片接种TMV以后,由图6-a可以看出烟草花叶病毒的扩展受到明显抑制,而对照组已经扩展到心叶。间接ELISA的结果也验证了对照组中的病毒含量是实验组的数倍。PONTIER等[6]通过观察标记的Hin1发现,Hin1是植物产生HR的标记,从而能够诱导植物发生过敏性反应。而本研究中SlHIN1瞬时表达对烟草叶片没有产生明显的表观影响,但却可以明显抑制病毒复制和移动,推测过表达SlHIN1以后植株产生防御信号,SlHin1则在此过程中作为标记物诱导了植株发生过敏反应,提高了植株的抗性能力。
本研究通过克隆SlHin1并与植物病毒互作后发现其在应对生物挑战过程中发挥重要作用,但具体作用机制还有待于深入研究。后期将通过转基因过表达[30]和基因编辑(CRISPR/Cas)[31-32]等技术,进一步分析和验证该基因参与的信号途径来深入解析其功能。
4 结论
通过基因克隆的方法获得番茄Hin1,该基因其编码225个氨基酸。蛋白质生物学预测发现可能为不稳定蛋白而且不具有跨膜结构,具有LEA-14保守结构域。亚细胞定位在细胞膜上。该基因在不同组织中表达量不同,根>叶>茎。在本氏烟中瞬时过表达后,阳性烟草叶片对烟草花叶病毒具有一定的抗性,病毒的扩散情况得到抑制,间接ELISA检测病毒含量较对照组低。The authors have declared that no competing interests exist.
