0 引言
【研究意义】红葡萄酒酿造过程主要包括由酵母菌完成的酒精发酵(alcoholic fermentation,AF)和由乳酸菌完成的苹果酸-乳酸发酵(malolactic fermentation,MLF)两大部分[1-2]。乳酸菌可以利用葡萄酒中的苹果酸将其转化为乳酸,使酸度降低[3],还可以通过糖苷酶水解糖苷类物质及其自身的代谢活动释放挥发性香气,从而改善葡萄酒的风味,提高葡萄酒的质量[4-9]。目前国内外尚无应用于葡萄酒发酵的商业植物乳杆菌苹果酸-乳酸发酵剂,本试验比较了4株由新疆葡萄酒中筛选出的植物乳杆菌在葡萄酒苹乳发酵过程中的生长情况、降酸能力及其对葡萄酒香气组分的影响,研究的开展对新型苹乳启动剂的开发具有重要意义。【前人研究进展】关于乳酸菌在葡萄酒MLF中的应用研究多集中于酒酒球菌(Oenococcus oeni)[10-12],但有****发现植物乳杆菌(Lactobacillus plantarum)同样具有潜在启动MLF的能力。LERM等[13]对从南非葡萄酒中分离出的23株O. oeni和19株L. plantarum进行MLF,其中L. plantarum 14.1、56、107和O. oeni S5、S6、E53都成功完成了对Pinotage葡萄酒的苹果酸-乳酸发酵。BRAVO等[14]从Patagonian红葡萄酒中分离出53株L. plantarum,8株菌对酒精的耐受性较强,其中UNQLp 97和UNQLp 133具有较强的降酸能力,能够很好的完成MLF。并且作为苹果酸-乳酸发酵菌株,L. plantarum具有不同于O. oeni的两大优势,一是L. plantarum含有与O. oeni同源性不相同的苹果酸-乳酸酶编码基因,且L. plantarum比O. oeni含有更多的酶编码基因,如对葡萄酒增香起重要作用的糖苷酶、蛋白酶、酯酶、酚酸脱羧酶等;二是产细菌素,植物乳杆菌素可以防止乳酸菌的腐败[15]。【本研究切入点】目前,国内外已有利用L. plantarum对葡萄酒或果酒进行降酸的报道,但其对葡萄酒香气的影响却鲜有报道。【拟解决的关键问题】以从新疆赤霞珠葡萄酒中筛选出的4株L. plantarum CS-1、XJ-14、XJ-25和XJA-2为研究对象,对未经MLF的新疆玛纳斯地区赤霞珠干红分别进行MLF,通过测定接种L. plantarum后菌株生长情况、苹果酸含量及MLF前后的香气成分的变化,全面衡量其MLF能力,旨在为植物乳杆菌成为新一代启动葡萄酒苹果酸-乳酸发酵的发酵剂提供数据支持。1 材料与方法
试验于2015年在西北农林科技大学葡萄酒学院进行。1.1 供试菌株及酒样
植物乳杆菌菌株CS-1、XJ-14、XJ-25和XJA-2由实验室从新疆赤霞珠葡萄酒中筛选得到,并保藏于西北农林科技大学葡萄酒学院微生物实验室[16]。将-80℃条件下保存的菌株活化至第二代,然后以5%接种量将其接种至MRS培养基中,37℃培养至对数末期备用。MRS培养基:葡萄糖20 g,酵母浸粉4 g,MgSO4·7H2O 0.2 g,MnSO4·4H2O 0.05 g,胰蛋白胨15 g,醋酸钠5 g,牛肉膏5 g,柠檬酸铵2 g,吐温-80 1 mL,加水至l L,调节pH至4.8左右,121℃灭菌20 min。
适应性培养基:无菌水﹕无菌葡萄酒=1﹕1,葡萄糖2%,酵母浸粉0.4%[17]。
试验酒样,选用新疆玛纳斯地区酒精发酵结束、未启动苹果酸-乳酸发酵的赤霞珠干红葡萄酒(理化指标见表1)。
Table 1
表1
表1酒样基本理化指标
Table 1The basic physical and chemical indexes of wine sample
| 酒度 Alcohol content (%) (v/v) | 还原糖 Reducing sugar (g·L-1) | 总酸(酒石酸计) Total acid (Count by tartaric acid, g·L-1) | 挥发酸 Volatile acid (g·L-1) | pH | 总SO2 Total SO2 (g·L-1) | 游离SO2 Free SO2 (g·L-1) | 苹果酸 Malic acid (g·L-1) |
|---|---|---|---|---|---|---|---|
| 12.03 | 1.24 | 7.21 | 0.14 | 3.47 | 18.63 | 11.75 | 2.30 |
新窗口打开
1.2 仪器与试剂
气相色谱-质谱联用仪GCMS-QP2010,紫外分光光度计UV-2450,日本岛津公司;雷磁pH计(PHS-3C),上海仪电科学仪器股份有限公司;DH-420型电热恒温培养箱,北京科伟永兴仪器有限公司。苹果酸试剂盒购于爱尔兰Megazyme公司。
1.3 试验方法
1.3.1 苹果酸-乳酸发酵试验 将4株来源于葡萄酒中的植物乳杆菌(CS-1、XJ-14、XJ-25、XJA-2)分别在MRS培养基中培养至对数末期,以5%(v/v)的接种量接种于适应性培养基中,30℃下培养24 h,离心(5 000×g,4℃,10 min),用无菌水调整细胞浓度为1.2×107 CFU·mL-1,将4 L赤霞珠葡萄酒酒样分装在4个1 L的玻璃瓶中,以5%(v/v)接种量分别接种于1 L葡萄酒中,未经MLF(加入60 mg·L-1 SO2且不添加菌体)的相同葡萄酒作为对照组,均做2个重复。满瓶密封放置于20℃恒温培养箱中,每3 d取样,用平板计数法测定葡萄酒中各菌株菌落总数,用苹果酸试剂盒(Megazyme)检测苹果酸含量,苹果酸含量趋于稳定后用GC-MS测定各酒样的香气成分。1.3.2 香气物质的提取 采用顶空固相微萃取结合气质联用仪(HS-SPME-GC-MS)对香气物质进行提取分析。将50/30 μm DVB/CAR/PDMS(Supelco,Bellefonte,PA)萃取头在270℃条件下老化1 h。取5 mL酒样加入到15 mL的样品瓶中,再分别向瓶中加入氯化钠1 g和2-辛醇内标液50 μL(0.234 g·L-1),并盖好瓶盖。40℃平衡30 min后将萃取头插入样品瓶,40℃恒温萃取30 min后将萃取头在GC-MS进样口250℃解吸8 min,不分流进样。
1.3.3 香气成分GC-MS分析 GC条件:色谱柱为HP-INNOWAX Polyethyene Glycol(60 m×0.25 mm×0.25 μm(J&W scientific,USA)),以氦气(He)为载气,流速设为1 mL·min-1。柱温升温程序:80℃条件下保持1 min,然后升至220℃(速度为25℃·min-1),再升至250℃(速度为5℃·min-1),此温度下保持20 min;进样口温度为250℃,进样口压力为13.56 psi,吹扫流量为55.9 mL·min-1,吹扫时间为0.75 min,质
谱接口温度为280℃[18]。
MS条件:扫描范围为20—350 m/z,以EI+为电离源,离子源温度为230℃,电子能量为70 eV,灯丝流量为0.2 mA,检测器电压350 V[18]。
1.4 数据处理及分析
各菌株菌落总数及苹果酸含量变化用Excel 2010软件分析。香气物质数据分析采用NIST02图谱库检索对检出的物质进行定性和内标法半定量分析。数据结果用SPSS23.0进行主成分分析,差异显著性分析采用Ducan检验,P<0.05。
2 结果
2.1 葡萄酒中菌落总数
如图1所示,将4株菌分别经过适应性培养基培养后接入葡萄酒中,菌落总数均呈持续下降的状态,且下降幅度基本保持一致。从接种后到第6天,菌密度有较大幅度的下降,而接种6 d后,菌密度的下降趋势开始放缓。接种至第9天时,菌落总数仍保持在106 CFU·mL-1。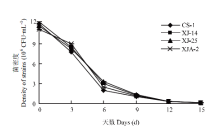 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同菌株在葡萄酒中的生长量变化
-->Fig. 1Changes of different strains growth in wine
-->
2.2 葡萄酒中L-苹果酸含量
如图2所示,4株植物乳杆菌接入酒样后L-苹果酸浓度的变化可以看出,接入植物乳杆菌的葡萄酒中L-苹果酸浓度都有所下降。接菌15 d后,活菌数已经降到很低的水平,此时酒样中的L-苹果酸浓度仍保持在1.0 g·L-1左右,4株菌均不能对苹果酸进行完全降解,说明发酵未完成,但4株菌均表现出了良好的降酸能力。菌株XJA-2处理组能够将2.3 g·L-1的L-苹果酸在15 d内降至1.0 g·L-1,降酸效率略高于菌株XJ-14处理组和菌株XJ-25处理组,菌株CS-1处理组的降酸效率相对较低。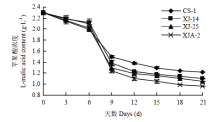 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2葡萄酒中L-苹果酸含量变化
-->Fig. 2Changes of L-malic acid content in wine
-->
2.3 葡萄酒中香气成分
为分析4株植物乳杆菌进行MLF对葡萄酒香气的影响,将5种不同处理的酒样经GC-MS分析,香气分析结果详见表2。Table 2
表2
表2葡萄酒香气成分的GC-MS分析结果
Table 2Results of wine aroma components by GC-MS analysis
| 香气化合物 Aroma compounds | 保留 指数 RI | 阈值 Odor thresholds | 浓度Concentration | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 对照 Control | CS-1 | XJ-14 | XJ-25 | XJA-2 | |||||||
| 乙酸乙酯 Ethyl acetate (mg·L-1) | 895 | 7.5[19] | 6.17±0.01e | 10.69±0.04c | 15.43±0.02d | 18.01±0.04a | 15.89±0.02b | ||||
| 乙酸异戊酯 Isopentyl acetate (mg·L-1) | 1122 | 0.16[20] | 1.35±0.10a | 0.11±0.02d | 0.15±0.01d | 0.89±0.13b | 0.47±0.05c | ||||
| 乙酸己酯 Hexyl acetate (μg·L-1) | 1273 | 1500[21] | 10.23±1.41a | 3.15±0.98c | 1.35±0.63d | 5.17±1.01b | 1.38±0.96d | ||||
| 乙酸苯乙酯 Phenylethyl acetate (μg·L-1) | 1830 | 1800[20] | 33.21±6.07a | 7.14±0.93c | 8.22±1.02c | 14.36±3.12b | 6.27±0.83c | ||||
| 丁酸乙酯 Ethyl butanoate (mg·L-1) | 1047 | 0.4[20] | 0.28±0.02ab | 0.24±0.01c | 0.25±0.02c | 0.28±0.03ab | 0.32±0.02a | ||||
| 己酸乙酯 Ethyl caproate (mg·L-1) | 1232 | 0.08[19] | 0.86±0.13a | 0.68±0.1b | 0.48±0.02d | 0.59±0.06bc | 0.65±0.03b | ||||
| 2-己烯酸乙酯 Ethyl 2-hexenoate (μg·L-1) | 1346 | 2.38±0.71b | 4.06±0.65a | 1.48±0.75b | 1.38±0.52b | 1.98±0.75b | |||||
| 庚酸乙酯 Ethyl heptanoate (μg·L-1) | 1334 | 160[22] | 3.57±0.83a | 3.43±1.01a | 1.45±0.55b | 1.28±0.32b | 1.11±0.57b | ||||
| 辛酸乙酯 Etheyl Octanoate (mg·L-1) | 1437 | 0.58[19] | 1.04±0.17a | 1.08±0.16a | 0.79±0.05b | 0.70±0.09b | 1.07±0.02a | ||||
| 壬酸乙酯 Ethyl nonanoate (μg·L-1) | 1535 | 1500[23] | 6.04±0.87a | 5.37±0.83ab | 3.95±0.56bc | 3.12±0.34d | 2.88±0.64d | ||||
| 癸酸乙酯 Ethyl caprate (mg·L-1) | 1639 | 0.2[21] | 1.09±0.13a | 0.90±0.04ab | 0.95±0.20ab | 0.79±0.06bc | 0.64±0.07c | ||||
| 3-羟基丁酸乙酯 Ethyl 3-Hydroxybutyrate (μg·L-1) | 1522 | 20000[24] | 7.04±0.82ab | 9.13±2.01a | 7.36±0.57ab | 9.27±2.34a | 6.27±1.20b | ||||
| 乳酸乙酯 Ethyl lactate (mg·L-1) | 1350 | 154.6[24] | 2.31±0.11d | 22.30±2.01c | 25.36±0.61b | 34.68±2.02a | 23.05±2.76c | ||||
| 乳酸苯乙酯 Ethyl phenylacetate (μg·L-1) | 1798 | 2.08±0.35b | 4.27±0.72a | 1.07±0.63b | 1.05±0.95b | 1.28±0.35b | |||||
| 水杨酸乙酯 Ethyl Salicylate (μg·L-1) | 1826 | 3.17±0.62a | 3.08±0.72a | 1.34±0.27b | 0.83±0.25b | 2.08±0.38ab | |||||
| 月桂酸乙酯 Ethyl laurate (mg·L-1) | 1848 | 2[22] | 0.89±0.04a | 0.71±0.06b | 0.97±0.06a | 0.52±0.06c | 0.65±0.06b | ||||
| 丁二酸二乙酯 Diethyl succinate (mg·L-1) | 1682 | 200[21] | 0.05±0.01c | 3.23±0.58a | 0.43±0.01c | 0.58±0.04c | 1.73±0.27b | ||||
| 辛酸甲酯 Methyl octanoate (μg·L-1) | 1390 | 200[22] | 4.42±0.69a | 4.13±0.83a | 2.35±0.54bc | 1.28±0.67c | 3.38±0.34ab | ||||
| 己酸异戊酯 Isoamyl caproate (μg·L-1) | 1458 | 15.17±1.96a | 12.12±0.84b | 8.67±1.28c | 5.45±1.38d | 7.95±0.56c | |||||
| 辛酸异戊酯 Isoamyl caprylate (mg·L-1) | 1659 | 0.125[22] | 0.13±0.01c | 0.13±0.01c | 0.14±0.01b | 0.15±0.03a | 0.12±0.01d | ||||
| 水杨酸甲酯 Methyl salicylate (μg·L-1) | 1792 | 7.39±0.36ab | 8.76±2.14a | 3.82±1.05c | 5.31±0.75bc | 7.22±0.81ab | |||||
| 酯类合计 Esters (mg·L-1) | 14.25±0.73d | 40.13±3.03c | 44.95±1.01b | 57.19±2.56a | 44.59±3.31b | ||||||
| 己醇 1-Hexanol (mg·L-1) | 1353 | 1.1[25] | 2.04±0.17a | 1.84±0.06bc | 1.95±0.06ab | 1.94±0.07c | 1.71±0.09ab | ||||
| 反式-3-己烯醇 (E)-3-hexen-1-ol (μg·L-1) | 1365 | 1000[25] | 60.24±6.66a | 42.16±8.27ab | 53.08±4.23ab | 48.69±6.25b | 51.28±8.65ab | ||||
| 顺式-3-己烯醇 (Z)-3-hexen-1-ol (μg·L-1) | 1387 | 1000[25] | 54.07±4.04a | 56.38±5.86a | 57.24±1.27a | 54.17±3.80a | 55.06±3.28a | ||||
| 香气化合物 Aroma compounds | 保留 指数 RI | 阈值 Odor thresholds | 浓度Concentration | ||||||||
| 对照 Control | CS-1 | XJ-14 | XJ-25 | XJA-2 | |||||||
| 反式-2-己烯醇 (E)-2-hexen-1-ol (μg·L-1) | 1409 | 15000[22] | 16.23±0.94a | 14.36±1.57ab | 133.27±1.31ab | 12.35±2.03b | 11.68±2.06b | ||||
| 丙醇 1-Propanol (mg·L-1) | 1057 | 306[20] | 22.18±0.12a | 21.50±0.13a | 20.49±1.93a | 20.96±1.06a | 21.06±0.11a | ||||
| 丁醇 1-Butanol (mg·L-1) | 1158 | 150[21] | 1.67±0.01a | 1.72±0.04a | 1.85±0.15a | 1.77±0.23a | 1.66±0.02a | ||||
| 异丁醇 Isobutanol (mg·L-1) | 1111 | 75[25] | 107.81±1.06b | 73.68±2.77c | 150.14±1.32a | 147.95±7.37a | 110.97±6.07b | ||||
| 戊醇 1-Pentanol (μg·L-1) | 1256 | 64000[23] | 62.15±3.23b | 89.31±8.54a | 61.35±4.38b | 64.35±7.06b | 70.08±3.12b | ||||
| 异戊醇 Isopentanol (mg·L-1) | 1220 | 60[25] | 116.48±7.38b | 106.44±9.58c | 97.34±4.04a | 83.36±6.12a | 109.43±11.42b | ||||
| 3-甲基-3-丁烯醇 3-Methyl-3-buteneol (μg·L-1) | 1258 | 600[22] | 37.29±4.07a | 37.67±3.47a | 35.47±1.18a | 32.68±4.22a | 38.11±2.06a | ||||
| 3-甲基戊醇 3-Methyl-1-pentanol (mg·L-1) | 1328 | 0.5[23] | 0.58±0.02a | 0.54±0.02a | 0.56±0.02a | 0.55±0.04a | 0.60±0.05a | ||||
| 4-甲基戊醇 4-Methyl-1-pentanol (μg·L-1) | 1316 | 50000[23] | 40.21±3.26a | 35.87±3.27ab | 32.03±3.39b | 34.33±3.66ab | 37.25±4.31ab | ||||
| 辛醇 1-Octanol (μg·L-1) | 1557 | 800[26] | 12.14±3.25a | 9.24±2.36a | 4.21±0.97b | 4.37±0.62b | 4.90±0.52b | ||||
| 1-辛烯-3-醇 1-Octen-3-ol (μg·L-1) | 1451 | 20[22] | 14.20±2.11a | 13.41±1.25a | 12.31±1.04a | 12.27±1.64a | 13.12±1.34a | ||||
| 苯甲醇 Benzyl alcohol (mg·L-1) | 1892 | 900[26] | 0.23±0.05b | 0.57±0.19a | 0.31±0.02b | 0.37±0.12b | 0.33±0.04b | ||||
| 苯乙醇 2-Phenylethyl alcohol (mg·L-1) | 1928 | 14[23] | 15.25±2.43ab | 12.19±1.16ab | 14.64±2.05ab | 17.35±4.75a | 13.55±1.87b | ||||
| 2,3-丁二醇 2,3-Butanediol (mg·L-1) | 1542 | 150[26] | 570.03±63.01d | 793.04±104.86c | 1040.48±281.07b | 1273.03±400.65a | 697.38±83.24cd | ||||
| 醇类合计 Alcohols (mg·L-1) | 836.29±74.25c | 1011.76±118.81bc | 1328.06±290.66ab | 1547.48±420.41a | 956.89±102.91bc | ||||||
| 丙酸 Propionic Acid (mg·L-1) | 1551 | 8.1[23] | 1.36±0.25a | 1.37±0.28a | 1.12±0.04a | 1.55±0.52a | 1.28±0.22a | ||||
| 异丁酸 Isobutyric acid (mg·L-1) | 1590 | 2.3[23] | 1.67±0.10ab | 2.02±0.39a | 1.04±0.02b | 1.51±0.49ab | 1.85±0.52a | ||||
| 异戊酸 Isovaleric acid (mg·L-1) | 1683 | 3[22] | 0.73±0.07ab | 0.83±0.04a | 0.49±0.01c | 0.58±0.16bc | 0.55±0.08c | ||||
| 己酸 Caproic acid (mg·L-1) | 1860 | 0.42[21] | 0.64±0.08ab | 0.76±0.18a | 0.52±0.02b | 0.69±0.11ab | 0.68±0.07ab | ||||
| 辛酸 Octanoic acid (mg·L-1) | 2075 | 0.5[23] | 0.31±0.03a | 0.34±0.07a | 0.25±0.02a | 0.34±0.06a | 0.26±0.03a | ||||
| 癸酸 Decanoic acid (mg·L-1) | 2292 | 1[23] | 0.21±0.01ab | 0.22±0.01a | 0.20±0.01b | 0.22±0.01a | 0.21±0.05ab | ||||
| 脂肪酸类合计 Fatty acids (mg·L-1) | 4.92±0.54ab | 5.54±0.97a | 3.62±0.12b | 4.89±1.35ab | 4.83±0.97ab | ||||||
| 香茅醇 Citronellol (μg·L-1) | 1770 | 100[22] | 7.26±1.25ab | 8.31±1.04a | 6.21±0.83bc | 5.34±1.25c | 6.07±0.87bc | ||||
| γ-香叶醇 γ-Geraniol (μg·L-1) | 1793 | 6.24±1.04a | 6.07±0.93a | 4.32±0.63b | 3.47±0.82bc | 2.15±0.88c | |||||
| 橙花醇 Neral (μg·L-1) | 1805 | 500[26] | 4.24±1.02a | 4.35±0.87a | 2.35±0.69b | 3.22±0.83ab | 3.45±0.74ab | ||||
| 香叶醇 Geraniol (μg·L-1) | 1855 | 20[22] | 23.47±2.12a | 21.28±2.57ab | 20.11±1.26ab | 18.22±1.34b | 16.17±2.47c | ||||
| β-大马士酮 β-Damascenone (μg·L-1) | 1833 | 0.14[22] | 0.22±0.06b | 0.32±0.08b | 0.24±0.08b | 0.52±0.12a | 0.31±0.07b | ||||
| β-紫罗兰酮 β-Ionone (μg·L-1) | 1952 | 0. 09[22] | 0.18±0.08c | 0.21±0.07c | 0.34±0.09b | 0.52±0.14a | 0.33±0.12b | ||||
| 萜烯类合计 Terpenes (μg·L-1) | 41.63±5.57a | 40.54±5.56ab | 33.27±3.58b | 31.29±4.50bc | 28.48±5.15c | ||||||
| 苯酚 Phenol (μg·L-1) | 2102 | 14.01±0.87ab | 18.36±4.61a | 12.25±1.21b | 15.20±3.87ab | 11.21±1.33b | |||||
| 4-乙基苯酚 4-Ethylphenol (μg·L-1) | 2276 | 3.07±0.68b | 3.05±0.34b | 2.38±0.93b | 10.47±2.15a | 1.24±0.85b | |||||
| 苯乙醛 Benzenacetaldehyde (μg·L-1) | 1561 | 1[22] | 3.42±0.62b | 3.28±0.73b | 5.39±0.87a | 4.24±0.27ab | 3.83±0.53ab | ||||
| γ-丁内酯 γ-Butyrolactone (μg·L-1) | 1645 | 20000[25] | 28.36±3.47bc | 38.93±5.85a | 29.76±4.12b | 24.35±0.57bc | 21.24±0.68c | ||||
| 其他化合物合计 Others (μg·L-1) | 48.86±5.64c | 63.62±11.53a | 50.23±7.13bc | 54.26±6.86ab | 37.52±3.39d | ||||||
新窗口打开
如表2所示,酒样中共检出香气化合物54种,其中酯类21种,醇类17种,脂肪酸类6种,萜烯类6种,其他化合物4种。这些物质在各组中均检出,各组总香气含量在发酵过程中均表现出一定的差异:未进行MLF的对照组中香气物质总含量为855.55 mg·L-1;用菌株CS-1、XJ-14、XJ-25和XJA-2进行MLF后,香气物质总含量分别为1 057.53 mg·L-1、1 376.71 mg·L-1、1 609.65 mg·L-1和1 006.38 mg·L-1。说明植物乳杆菌对葡萄酒的MLF过程对香气种类的影响较小,而对其含量影响显著。将香气分析结果按酯类、醇类、脂肪酸类、萜烯类和其他化合物进行统计,由于不同类别含量差距较大,因此分析结果用不同的单位来表示(表2)。经过4株植物乳杆菌MLF的酒样中酯类物质含量均显著高于未经过MLF的酒样,其中乙醇酯类物质含量有较大幅度的提升,主要包括乙酸乙酯和乳酸乙酯,其中菌株XJ-25处理组显著高于其余处理组。醇类物质的含量在MLF后均有增加,其中2,3-丁二醇的浓度显著增加,而一些醇类物质如异戊醇、己醇等,经过MLF后含量降低。萜烯类物质含量在MLF后均有所降低。
2.4 特征香气的主成分分析
超过阈值的香气化合物会对葡萄酒的特征香气产生较大影响[19],将检出的香气化合物中超过阈值的香气物质进行描述并分类(表3)。为了评价各香气化合物对总香气的贡献,通过香气浓度除以香气阈值(OT)来计算各香气化合物的香气值(OAV),香气阈值根据以往文献获得[19-26]。OAV值大于1的说明其香气活动能够被人所感知,小于1则不能被人感知。从理论上来说,香气值小于1的化合物被认为对整体香气没有直接贡献。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3香气指标在前两个主成分上的载荷及样品分布图
-->Fig. 3Loadings of aroma indicators and distribution of sample in the first two PCs
-->
Table 3
表3
表3香气值、香气描述及香气系列
Table 3Odor active values, odor description and aromatic series
新窗口打开
为了进一步挖掘香气数据中的差异,对超过阈值的香气数据进行主成分分析(图3),共提取两个主成分。两个主成分占总体方差的76.82%,主成分1(PC1)和主成分2(PC2)分别解释总方差的52.04%和24.78%。XJ-25和XJ-14处于PC1的正向端;对照组处于PC1负向端,PC2的正向端;CS-1处于PC1负向端;XJA-2处于PC1和PC2的负向端。XJ-25的PC1正向载荷高,PC2的正向载荷低,而β-紫罗兰酮、辛酸异戊酯、乙酸乙酯、2,3-丁二醇、异丁醇等具有较高的PC1正向载荷,因此,XJ-25处理组具有果香和清新花香的香气特征(表3)。XJ-14在PC1和PC2的正向载荷均较弱,因此较低含量的β-紫罗兰酮、辛酸异戊酯、2,3-丁二醇、苯乙醛及较低含量的己醇、癸酸乙酯反应了XJ-14处理组的香气特点,以花香和果香为主,生青味相对较弱(表3)。对照组在PC1和PC2的负向载荷均较强,较高含量的己醇、癸酸乙酯和异戊醇可以反应其香气特点,表现出生青味及果香(表3)。CS-1在PC1负向端的载荷,较低含量的异戊醇、辛酸乙酯及己酸乙酯能够反应其香气特点,因此CS-1处理组表现出果香,化学味及酒精味(表3)。而XJA-2的PC1负向载荷低,PC2负向载荷高,表现出一定的奶酪或化学味(表3)。综上所述,XJ-25处理组能够显著降低葡萄酒中的生青味,并带来较为浓郁的花香和果香;XJ-14处理组同样能够降低葡萄酒的生青味,但花香、果香相对XJ-25较弱;CS-1处理组及XJA-2处理组使葡萄酒的花香和水果香气变弱,化学味及植物味变得相对突出。
3 讨论
3.1 葡萄酒中菌落总数的变化
4株菌接入葡萄酒中后,菌落总数均呈持续下降的状态,且下降幅度基本保持一致。LERM等[13]将植物乳杆菌以107 CFU·mL-1接入Pinotage葡萄酒中后,2 d后菌密度有所下降,但仍在107 CFU·mL-1,接菌后第6天菌落数下降至106 CFU·mL-1。试验结果与何志刚等[31]将植物乳杆菌R23接入枇杷酒中进行MLF时测得的菌落总数持续下降的趋势也较一致,这主要是由于葡萄酒中苛刻的环境导致植物乳杆菌的生长速率低于死亡速率,从而导致活菌的数量下降。3.2 葡萄酒中L-苹果酸含量的变化
在接菌3 d内,L-苹果酸浓度呈现小幅度的下降趋势,而6—9 d内,L-苹果酸浓度大幅下降,其原因可能是由于死亡菌体的大量裂解释放出了胞内的苹果酸-乳酸酶,将葡萄酒中的L-苹果酸转化为乳酸[31]。15 d后L-苹果酸浓度已趋于平稳但仍有下降的趋势,说明残余的植物乳杆菌使细胞裂解释放出的苹果酸-乳酸酶仍能进一步作用于葡萄酒中的L-苹果酸,导致酒中L-苹果酸浓度缓慢降低[17]。菌株XJA-2处理组降酸效率略高于菌株XJ-14处理组和菌株XJ-25处理组,菌株CS-1处理组的降酸效率相对较低,这与李静等[32]用植物乳杆菌对猕猴桃酒进行降酸处理的结果一致。3.3 葡萄酒中香气成分的差异
酯类通常具有类似苹果、香蕉或菠萝等果香,是对葡萄酒香气质量贡献较大的一类香气物质[33]。经过MLF,4株植物乳杆菌对葡萄酒中乙醇酯类物质含量均有显著提升,其中菌株XJ-25处理组显著高于其余处理组。周安玲等[34]在做乳酸菌对干红葡萄酒挥发性成分影响的试验中也发现,来源于泡菜中的植物乳杆菌C5由于其酯酶活性较高,从而促进了酯类物质的形成。醇类是葡萄酒中含量最大的香气物质,葡萄酒中的高级醇主要是由氨基酸或己糖通过丙酮酸途径产生的,不同乳酸菌菌株代谢过程及酶活之间的差异,导致其代谢产物不同[34]。C6醇通常含有植物类的香气,对葡萄酒香气没有积极的贡献[35],4个处理组中己醇的浓度均低于对照,苯乙醇和2,3-丁二醇具有非常浓的花香和果香气味且阈值相对较低[23,26]。4个处理组中,菌株XJ-25处理组的苯乙醇及2,3-丁二醇含量显著增加,这与周安玲等[34]的研究结果一致。而一些醇类物质如异戊醇、己醇等,经过MLF后含量降低,从而降低了酒中的化学味和生青味[25]。
脂肪酸类物质如己酸、异丁酸等具有腐败味、酸苦味和脂肪气味[21,23],通常会对葡萄酒的感官品质造成负面影响。由本研究可知,菌株CS-1处理组脂肪酸类物质的含量略高于对照组,而其余处理组均低于对照组。萜烯类物质是葡萄酒品种香气的主要贡献者[36-38],它们在葡萄酒中香气阈值非常低,但即使浓度很低也很容易被人感知,其同样对葡萄酒特征香气的形成起到至关重要的作用。
4 结论
来源于葡萄酒中的4株植物乳杆菌(CS-1、XJ-14、XJ-25、XJA-2)均表现出良好的降酸能力和苹果酸-乳酸发酵潜力,启动发酵15 d内降酸约1.1 g·L-1,但均未完成苹果酸-乳酸发酵。4株菌启动苹果酸-乳酸发酵所形成的香气物质类别具有显著差异。菌株XJ-25处理能够显著降低原酒中的生青味等不愉悦的香气并带来更加浓郁的花香及果香;XJ-14处理同样能够降低葡萄酒的生青味,但花香果香相对XJ-25较弱;菌株CS-1处理和菌株XJA-2处理均略微降低了原酒中的生青味,但化学味和植物味浓度的提升,掩盖了原酒本身的花香和果香。整体来看,植物乳杆菌XJ-25处理所形成的香气物质的增量及风味影响较好,且以品种香气为主,因而具有开发为商业发酵剂的潜能。在今后的研究中,可对具有较好苹果酸-乳酸发酵潜力的菌株进行基因工程上的改造,使其能够开发为商业发酵剂。The authors have declared that no competing interests exist.
