0 引言
【研究意义】发芽糙米含有丰富的维生素、矿物质、膳食纤维等营养物质以及γ-氨基丁酸、肌醇六磷酸、谷维素等多种功能活性物质,是新一代的功能性食品[1-2]。但是,糙米糠层中含有的纤维素以及蜡质层的阻碍,使得糙米食用风味和蒸煮性差,不利于人体正常的消化吸收。金针菇富含蛋白质、氨基酸、维生素、核苷类等多种营养成分,同时还含有多种生物活性成分如金针菇多糖、免疫调节蛋白、膳食纤维等,具有较高的食用和药用价值,是世界上著名的食药两用菌[2-4]。通过将金针菇与发芽糙米复配,制备蛋白含量高、氨基酸丰富,且富含膳食纤维的复合型产品,达到营养价值互补的作用,有利于进一步丰富金针菇和发芽糙米产品类型。然而,若将两者简单复配,金针菇、发芽糙米中丰富的膳食纤维和复杂的组分将导致其复配产品难以被人体消化。因此,利用挤压膨化技术的优势,开发易消化、营养丰富的复合型功能休闲食品具有重要意义。本文主要从淀粉和蛋白质方面初步研究挤压膨化工艺对金针菇-发芽糙米复配粉消化特性的影响,并研究挤压膨化工艺对金针菇-发芽糙米复配粉挥发性物质的影响,为膨化产品的消化特性及风味分析提供参考。【前人研究进展】挤压膨化技术是集混合、搅拌、破碎、加热、蒸煮、杀菌、膨化及成型等为一体的高新技术[5-6]。物料在挤压机的高温、高压和高剪切力作用下,会发生一系列的物理、化学和生物变化,如微观结构的改变、营养物质的变化、风味的变化等。淀粉和蛋白质是糙米的主要营养成分,其在挤压膨化过程中发生的变化会直接影响产品的品质。研究表明,高温、高压和高剪切力作用会使淀粉发生糊化和降解、蛋白质发生变性等。淀粉发生糊化时,结晶区的氢键被破坏,淀粉颗粒开始水合和吸水膨胀,结晶区消失,双折射现象消失[7]。此外,结晶直链淀粉和结晶支链淀粉分子被加热后,会由有序状态转变为无定形状态,淀粉分子的这些变化也会使其微观结构发生变化。淀粉在较低的水分和温度范围内,并未完全糊化,随着挤压温度的升高和剪切作用的加强,淀粉结晶部分发生熔融,形成具有粘弹性的熔融体[8]。在挤压过程中,淀粉发生糊化的同时还会伴随发生降解反应,淀粉在机械力的作用下,氢键断裂,淀粉链被部分打断,大分子降解为小分子寡糖[9]。淀粉的糊化和降解都会提高淀粉的消化率。蛋白质在挤压膨化的高温、高压和高剪切力作用下,分子间氢键、二硫键等部分断裂,导致蛋白质变性[10]。研究发现,蛋白质经过挤压以后,部分高分子蛋白亚基消失并有新亚基生成,表明挤压导致蛋白质发生降解和聚合[11]。蛋白质变性和蛋白质的降解,都能提高蛋白质的消化率。而谷物在挤压膨化过程中风味的改善主要是由美拉德反应以及脂类物质的氧化分解引起的[12]。【本研究切入点】挤压膨化不仅会使产品的结构和营养物质等发生变化,还对产品的消化特性及风味等产生影响。本研究在方勇等[2]对金针菇复配发芽糙米挤压膨化优化工艺及产品品质分析的基础上,从淀粉和蛋白质的角度对金针菇-发芽糙米膨化产品的消化特性及风味成分进行深入研究,旨在阐明金针菇-发芽糙米在挤压条件下消化特性的改善及挥发性物质的变化规律。【拟解决的关键问题】利用扫描电镜对淀粉和蛋白质的颗粒微观结构进行观察,利用聚丙烯酰胺凝胶电泳(SDS-PAGE)和红外光谱对蛋白质分子量和二级结构的变化进行分析,采用体外消化法对淀粉和蛋白质的消化率进行探讨,通过淀粉和蛋白质性质的变化探讨其对金针菇复配发芽糙米膨化产品消化特性的影响,并通过气相色谱-质谱联用法(GC-MS)对风味成分的分析,阐明金针菇-发芽糙米复配粉膨化前后挥发性物质的变化规律。1 材料与方法
试验于2015年5月至2016年1月在南京财经大学食品科学与工程学院进行。1.1 试验材料
发芽糙米,南京远望富硒农产品有限责任公司;金针菇,上海雪榕生物科技股份有限公司。1.2 仪器与设备
DSE-29/40D型双螺杆挤压膨化机(德国Brabender公司);7890A-5975C气相色谱质谱联用仪(美国Agilent公司);50/30 µm DVB/CAR/PDMS固相微萃取头(美国Supelco公司);TENSOR 27型傅里叶变换红外光谱仪(德国Bruker公司);日立TM3000台式扫描电镜(日本Hitachi公司);RVA快速黏度分析仪(澳大利亚Newport Scientific仪器公司);BIO-RAD电泳仪(美国Bio-rad公司);BIO-RAD ChemiDoc XRS+成像系统(美国Bio-rad公司);769YP-15A粉末压片机(天津市科器高新技术公司);K-436快速消解仪(瑞士Buchi公司); K-360自动凯氏定氮仪(瑞士Buchi公司);Allegra 64R离心机(美国Beckman Coulter公司);LABCONCO冷冻干燥机(美国Labconco公司);FW100型高速万能粉碎机(天津泰斯特仪器有限公司);HH-2数显恒温水浴锅(国华电器有限公司);101-3AS型电热鼓风干燥箱(上海苏进仪器设备厂); U-3900型紫外可见光光度计(日本Hitachi公司);HJ-3控温磁力搅拌器(江苏金坛市金城国胜实验仪器厂);SHA-B水浴恒温振荡器(金坛市荣华仪器制造有限公司)。1.3 试验方法
1.3.1 材料准备及挤压试验 参照方勇等[2]的方法。根据优化后的工艺参数条件,发芽糙米和烘干的金针菇粉碎后,过60目筛。将发芽糙米与金针菇复配粉按94﹕6的比例混合均匀,调节混合物料水分含量至17.0%左右,置于塑料自封袋中调质过夜。利用双螺杆挤压膨化机对复配粉进行膨化处理,挤压机参数为:挤压机Ⅰ区温度60℃、Ⅱ区温度90℃、Ⅲ区温度130℃、Ⅳ区温度130℃、Ⅴ区温度140℃,喂料速度为16 r/min,螺杆转速150 r/min。挤出样品一部分进行挥发性成分分析,其余样品于40℃烘箱干燥24 h后置于4℃冰箱保存。1.3.2 基本成分测定 淀粉含量测定:GB/T 5009.9—2008[13];还原糖含量测定:DNS比色法[14];可溶性糖含量测定:苯酚-硫酸法[15];蛋白质含量测定:BCA试剂盒法[16]
1.3.3 挤压前后淀粉性质的变化
1.3.3.1 淀粉和蛋白质的提取 参考FANG等[17]的方法并略作修改。称取50 g样品,以1﹕5(w/v)加入正己烷,室温下搅拌脱脂3 h后静置0.5 h,将上层黄色液体倒出,重复上述操作,直到上层液体呈无色为止。抽滤后于通风橱内通风干燥24 h。
称取20 g脱脂样品,加入0.05 mol·L-1的NaOH溶液400 mL,搅拌均匀后放入恒温振荡器,振荡提取4 h,15 000 r/min离心15 min,收集上清液,沉淀加NaOH溶液重复上述步骤再次提取,合并两次所得的上清液,沉淀水洗3次,刮去沉淀上层黄色部分,下层沉淀冷冻干燥得粗淀粉,上清液用0.01 mol·L-1的HCl溶液调pH至4.6—4.8,15 000 r/min离心15 min,弃掉上清液,沉淀水洗3次后冷冻干燥得粗蛋白,蛋白质分析备用。
1.3.3.2 淀粉和蛋白质形态观察 样品处理参照MIAO等[18]的方法。将样品用导电双面胶固定在金属样品平台上,喷金后置于台式扫描电镜中观察,拍摄有代表性的颗粒的形貌照片。
1.3.3.3 挤压产品的糊化性质 参考AACC 76-21,样品量根据水分含量查表校正[19]。
1.3.3.4 淀粉体外消化试验 参照陈建宝等[20]的方法并略作修改。准确称取0.2 g样品,溶于15 mL醋酸钠缓冲液(0.2 mol·L-1,pH 5.2)并混合均匀,加入10 mL混合酶液(290 U·mL-1胰α-淀粉酶,15 U·mL-1糖化酶),置于37℃恒温水浴锅中振荡2 h,用DNS比色法测定样液中葡萄糖含量,按照下式计算体外消化率:

式中,DS表示2 h内样品水解产生的葡萄糖质量(mg),TS表示样品中总淀粉含量(mg)。
1.3.4 挤压前后蛋白质性质的变化
1.3.4.1 蛋白质电泳 称取一定量的蛋白样品溶于1 mL蛋白上样缓冲液中(使蛋白浓度达到3.0 mg·mL-1),混合均匀后,100℃水浴加热3—5 min,13 000 r/min离心5 min,取10—15 μL上清液直接上样电泳。
电泳条件:分离胶浓度为13%,浓缩胶浓度为5%。电泳过程采用恒定电压,浓缩胶100 V,分离胶120 V。电泳结束后取出凝胶,放入含0.1%考马斯亮蓝R-250的染色液中,37℃恒温摇床染色0.5 h;而后用含10%甲醇-10%冰乙酸的脱色液脱色4 h;最后将脱色后的凝胶置于化学发光成像系统进行拍照和分析。
1.3.4.2 蛋白质红外光谱 参照YANG等[21]报道的KBr压片法进行蛋白质红外分析。称取样品5.0 mg,以1﹕50(w/w)加入烘干至恒重的KBr,在玛瑙研钵中研磨成细粉,用压片机压成透明的薄片,在波长范围400—4 000 cm-1,用分辨率2 cm-1、扫描次数32次的傅立叶变换红外光谱仪进行测定,使用Omnic V6.2软件对红外图谱进行处理。
1.3.4.3 蛋白质体外消化 称取0.2 g样品蛋白,加入25 mL含有1.5 g·L-1胃蛋白酶的磷酸盐缓冲液(0.1 mol·L-1,pH 1.5),37℃水浴振荡2 h。再加入10 mL含有0.5 g·L-1胰蛋白酶的磷酸盐缓冲液(0.2 mol·L-1,pH 7.0),37℃水浴振荡4 h,振荡结束后10 000 r/min离心10 min,弃掉上清液,用20 mL磷酸盐缓冲液(0.2 mol·L-1,pH 7.0)洗涤沉淀物两次,相同条件下再次离心,凯氏定氮法测定残渣中未消化的蛋白质含量。按下式计算蛋白质体外消化率:
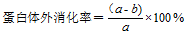
式中,a表示样品中蛋白质量分数(%),b表示消化后残渣中蛋白质量分数(%)。
1.3.5 GC-MS分析膨化产品挥发成分 膨化产品的挥发性风味物质的测定采用固相微萃取结合气相色谱-质谱联用法(HS-SPME-GC-MS)测定,参考YANG等[22]的方法。
HS-SPME提取挥发成分:称取磨碎成粉的样品3.0 g,置于25 mL的顶空进样瓶中,加入3—5滴超纯水,密封后于60℃恒温水浴锅中平衡10 min,然后插入老化好的50/30 µm DVB/CAR/PDMS复合萃取头顶空吸附45 min(保持60℃水浴),将萃取头取出后立即插入GC进样口,解析5 min,同时进行数据采集分析。
色谱条件:色谱柱为HP-5MS毛细管柱(30 m×250 µm×0.25 µm);载气:高纯氦气;柱流速:0.8 mL·min-1;进样口温度:250℃;进样方式:手动无分流进样;程序升温:40℃保持2 min,以6℃·min-1升至180℃,再以10℃·min-1升至250℃,保持3 min。
质谱条件:离子源温度为230℃;四极杆温度为150℃;接口温度为280℃;离子源EI;电子能量70 eV;全扫描质量参数25—450 amu。
1.4 数据处理
每组试验重复3次,所得结果以平均值±标准差的形式表示,采用Excel绘图,数据分析采用SPSS Statistics 17.0软件,差异显著性采用Duncan检验法,显著差异选用P<0.05。2 结果
2.1 金针菇-发芽糙米复配粉挤压前后淀粉和蛋白质含量及消化率的变化
食品在挤压膨化的高温、高压、高剪切力作用下,淀粉、蛋白质等会发生复杂的物理变化和化学变化,最直观的表现是化学成分的变化。从表1中可以看出,与膨化前物料相比,金针菇-发芽糙米膨化产品的淀粉和蛋白质含量显著降低(P<0.05),分别下降了8.26%和1.00%;还原糖和可溶性糖含量显著升高,分别上升了1.35倍和18.45%;淀粉体外消化率提高了30.68%,蛋白质体外消化率提高了约25.57%。而与未添加金针菇的发芽糙米膨化产品相比,金针菇-发芽糙米膨化产品的淀粉含量降低了6.24%,蛋白质和可溶性糖含量分别升高了1.96%和2.28%,还原糖含量变化不显著,而淀粉体外消化率和蛋白质体外消化率分别提高了9.72%和5.13%。Table 1
表1
表1挤压膨化对淀粉和蛋白质含量及其消化率的影响
Table 1The effect of extrusion on the starch and protein content and their digestibility (%)
| 指标 Index | 金针菇-发芽糙米粉 Un-extruded powder of germinated brown rice compounded of Flammulina velutipes | 金针菇-发芽糙米膨化产品 Extruded products of germinated brown rice compounded of Flammulina velutipes | 发芽糙米膨化产品 Extruded products of germinated brown rice |
|---|---|---|---|
| 淀粉 Starch | 67.78±0.21a | 62.18±0.35c | 66.32±0.33b |
| 蛋白质 Protein | 10.00±0.02a | 9.90±0.03b | 9.71±0.03c |
| 还原糖 Reduced sugar | 2.52±0.13b | 5.92±0.18a | 6.01±0.16a |
| 可溶性糖 Soluble sugar | 38.97±0.17c | 46.16±0.20a | 45.13±0.24b |
| 淀粉体外消化率 Starch digestibility | 66.50±2.11c | 86.90±3.74a | 79.20±2.80b |
| 蛋白质体外消化率 Protein digestibility | 61.80±0.56c | 77.60±0.81a | 73.81±0.70b |
新窗口打开
2.2 金针菇-发芽糙米复配粉挤压前后淀粉性质的变化
2.2.1 淀粉颗粒外形 图1分别是金针菇-发芽糙米粉淀粉颗粒(A)、金针菇-发芽糙米膨化后淀粉颗粒(B)和发芽糙米膨化产品淀粉颗粒(C)的扫描电镜图。从图1-A中可以看出,金针菇-发芽糙米膨化前淀粉颗粒呈棱角尖锐的多面体形,典型颗粒形貌与大米类似,只是颗粒多边形平面中心有明显凹陷,淀粉颗粒尺寸较小且分散相对均匀。从图1-B中可以看出,经过挤压膨化后,金针菇-发芽糙米膨化产品淀粉颗粒体积变大,颗粒大小不均匀,并且颗粒表面为断裂性多边形平面。从图1-C中可以看出,与添加金针菇的发芽糙米膨化后的淀粉颗粒相比,挤压膨化后的发芽糙米淀粉颗粒没有固定形状。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1金针菇-发芽糙米复配粉挤压膨化前后淀粉颗粒扫描电镜图
-->Fig. 1Scanning electron photomicrographs of starch from extruded and un-extruded germinated brown rice compounded of F. velutipes
-->
2.2.2 淀粉糊化性质 由表2可知,与膨化前相比,金针菇-发芽糙米粉膨化后,除回生值稍有升高,其余各项指标均降低,其中峰值黏度、最低黏度、衰减值和最终黏度分别下降了63.12%、81.89%、44.10%和52.74%。与未添加金针菇的发芽糙米膨化产品相比,添加金针菇的发芽糙米膨化产品的峰值黏度、最低黏度、衰减值和最终黏度分别下降了58.44%、80.47%、34.02%和46.23%,回生值升高35.56%。
Table 2
表2
表2金针菇-发芽糙米复配粉挤压膨化前后淀粉糊化性质
Table 2The gelatinization characteristics of starch from extruded and un-extruded germinated brown rice compounded of F. velutipes
| 指标 Index | 膨化前 Un-extruded | 膨化后 Extruded | |
|---|---|---|---|
| 金针菇-发芽糙米粉 Un-extruded powder of germinated brown rice compounded of Flammulina velutipes | 金针菇-发芽糙米膨化产品 Extruded products of germinated brown rice compounded of Flammulina velutipes | 发芽糙米膨化产品 Extruded products of germinated brown rice | |
| 峰值黏度Peak viscosity (cP) | 461 | 170 | 409 |
| 最低黏度Minimum viscosity (cP) | 232 | 42 | 215 |
| 衰减值Break-down (cP) | 229 | 128 | 194 |
| 最终黏度Final viscosity (cP) | 347 | 164 | 305 |
| 回生值Setback (cP) | 115 | 122 | 90 |
| 峰值时间Peak Time (min) | 5.2 | 9.4 | 2.1 |
| 糊化温度Pasting temperature (℃) | 63.45 | — | — |
新窗口打开
2.3 金针菇-发芽糙米复配粉挤压前后蛋白质性质的变化
2.3.1 蛋白质微观结构的变化 图2分别是金针菇-发芽糙米粉蛋白质(A)、金针菇-发芽糙米膨化产品蛋白质(B)和发芽糙米膨化产品蛋白质(C)的扫描电镜图。从图2-A中可以看出,典型的蛋白质颗粒是棱角圆滑的多面体型,部分颗粒沿棱角分布着许多凹陷小坑。图2-B和图2-C是挤压膨化后的蛋白质。经过挤压膨化的高温、高压和高剪切力作用,大部分淀粉发生糊化,导致蛋白质提取液中含有大量的糊化淀粉,蛋白质较难分离,因此,提取的蛋白质实际上是糊化淀粉与蛋白的复合物。从图2-B中可以看出经过高温、高压和高剪切力的作用,蛋白质组织结构被破坏,导致蛋白质成为无规则的形状。从图2-C中可以看出,膨化发芽糙米蛋白质表面呈多孔状并且由许多小颗粒紧密结合。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2金针菇-发芽糙米复配粉挤压膨化前后蛋白质扫描电镜图
-->Fig. 2Scanning electron photomicrographs of starch from extruded and un-extruded germinated brown rice compounded of F. velutipes
-->
2.3.2 蛋白质凝胶电泳分析 金针菇-发芽糙米挤压膨化前后与发芽糙米膨化产品蛋白质SDS-PAGE电泳图谱见图3。由于挤压膨化后,蛋白质中含有大量的糊化淀粉,使得蛋白质较难分离,因此,只对总蛋白进行电泳分析。图中清晰的显示出蛋白质的相对分子量分布情况。从A1和A2可以看出,金针菇-发芽糙米挤压膨化前,蛋白质分子量主要分布在50、36、33、22、19和13 kD左右。从B1和B2可以看出,经过挤压膨化后,金针菇-发芽糙米蛋白质分子量50 kD左右的谱带消失了,而分子量36 kD以下的蛋白质谱带没有明显变化。较多****对挤压前后蛋白质的电泳分析也发现,部分高分子蛋白亚基在挤压后有消失的现象。从C1和C2可以看出,发芽糙米挤压膨化后的蛋白质分子量分布与膨化的金针菇-发芽糙米蛋白基本一致。
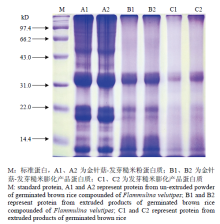 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3金针菇-发芽糙米复配粉挤压膨化前后蛋白质SDS- PAGE电泳图谱
-->Fig. 3SDS-PAGE profile of protein from extruded and un- extruded germinated brown rice compounded of F. velutipes
-->
2.3.3 蛋白质红外光谱分析 由图4可以看出,金针菇-发芽糙米粉膨化前后及发芽糙米膨化产品蛋白质光谱整体相似,在波数3 400、2 929、1 645、1 544、1 410、1 340、1 302、1 240、1 203、1 155、1 080、1 022、933、856、762、707、606、576附近有明显的红外吸收峰。其中3 400 cm-1附近产生的较宽吸收峰为N-H伸缩振动,1 645 cm-1为蛋白质酰胺I带C=O伸缩振动,1 544 cm-1为蛋白质酰胺II带N-H弯曲和C-N伸缩振动[23-24]。由于挤压膨化后的蛋白质中含有糊化的淀粉,因此在1 410、1 340、1 155、1 080、1 022、933、856和762 cm-1等处出现了淀粉的吸收峰[25]。虽然金针菇-发芽糙米粉膨化前后及发芽糙米膨化产品蛋白质红外光谱吸收峰相似,但在1 645和1 544 cm-1处的吸收峰强度差别较大。
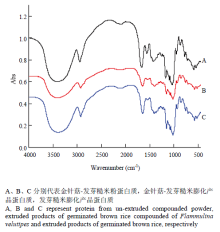 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4金针菇-发芽糙米复配粉挤压膨化前后蛋白质红外光谱
-->Fig. 4Infrared spectrum of protein from extruded and un- extruded germinated brown rice compounded of F. velutipes
-->
2.4 GC-MS分析金针菇-发芽糙米膨化产品挥发性物质
利用固相微萃取结合气相色谱-质谱联用法对添加金针菇与未添加金针菇的发芽糙米挤压膨化前后的挥发性物质进行分析,结果见表3。添加金针菇与未添加金针菇的发芽糙米挤压膨化前后共检测出62种挥发性风味成分。其中,发芽糙米原料中检测出的挥发性化合物的种类最少,只有24种;而发芽糙米膨化产品与添加金针菇的发芽糙米膨化产品检测出的挥发性成分较多,分别为43种和42种,添加金针菇的发芽糙米膨化前挥发性成分有37种。与膨化前物料相比,金针菇-发芽糙米膨化产品中醛类、醇类、吡嗪类和酮类物质分别增加了18.93%、44.17%、77.64%和1.56倍,而与发芽糙米膨化产品相比,金针菇-发芽糙米膨化产品中醛类和酮类物质分别增加了10.41%和7.89%,吡嗪类和呋喃类物质分别降低了50.43%和55.01%。其中乙醛、戊醛、反式-2-庚醛、反式-2-壬醛、癸醛、1-辛烯-3-醇、苯甲酸乙酯等物质经过挤压膨化后逐渐生成,壬醛、3,5-辛二烯-2-醇、2,6-二甲基吡嗪、2-乙基-3,5-二甲基吡嗪、3,5-辛二烯-2-酮等物质经过挤压膨化后含量显著升高,而正己醇、1-庚烯-3-酮等物质经过挤压膨化后含量显著降低。发芽糙米原料经挤压膨化后,己醛、庚醛、苯甲醛、乙醇等物质含量降低,而添加金针菇的发芽糙米经挤压膨化后,这些物质的含量均表现出升高趋势,这说明添加金针菇对风味有增强作用。Table 3
表3
表3添加金针菇与未添加金针菇的发芽糙米粉膨化前后挥发性物质的变化
Table 3Changes of volatile flavor compounds in extruded and un-extruded materials from germinated brown rice compounded of Flammulina velutipes and non-supplemented germinated brown rice
| 序号No | 化合物类别Component species | 化合物名称 Component name | 相对百分含量Relative content (%) | |||
|---|---|---|---|---|---|---|
| 膨化前 Un-extruded | 膨化后 Extruded | |||||
| 发芽糙米粉Germinated brown rice powder | 金针菇-发芽糙米粉 Un-extruded powder of germinated brown rice compounded of Flammulina velutipes | 发芽糙米膨化 产品 Extruded products of germinated brown rice | 金针菇-发芽糙米膨化产品 Extruded products of germinated brown rice compounded of Flammulina velutipes | |||
| 醛类 Aldehydes | 醛类总含量 Total content of aldehydes | 52.48 | 41.48 | 44.68 | 49.33 | |
| 1 | 乙醛 Acetaldehyde | — | — | 0.41 | 0.59 | |
| 2 | 异戊醛 Isovaleraldehyde | 0.61 | 1.11 | 0.27 | 0.80 | |
| 3 | 戊醛Pentanal | — | — | 0.22 | 0.20 | |
| 4 | 3-羟基丁醛 3-hydroxy-Butanal | — | 0.24 | — | — | |
| 5 | 己醛 Hexanal | 13.31 | 5.66 | 11.22 | 7.75 | |
| 6 | 庚醛 Heptanal | 1.90 | 0.50 | 0.83 | 0.89 | |
| 7 | 反式-2-庚醛 (E)-2-Heptenal | — | — | 4.41 | 2.47 | |
| 8 | 苯甲醛 Benzaldehyde | 19.59 | 11.74 | 7.84 | 12.81 | |
| 9 | 辛醛 Octanal | 2.24 | — | — | — | |
| 10 | 苯乙醛 Benzeneacetaldehyde | — | 3.82 | 1.08 | 2.06 | |
| 11 | 苯甲醛二甲缩醛 Benzaldehyde dimethyl acetal | 3.59 | — | — | — | |
| 12 | 壬醛 Decanal | 10.85 | 16.78 | 15.46 | 19.41 | |
| 13 | 十一醛 Undecanal | 0.38 | — | — | — | |
| 14 | 反式-2-壬醛 (2E)-2-Nonenal | — | — | 0.83 | 1.06 | |
| 15 | 癸醛 Decanal | — | — | 1.29 | 1.29 | |
| 16 | 2,4-壬二烯醛 2,4-Nonadienal | — | — | 0.83 | — | |
| 17 | 2-苯基巴豆醛 2-Phenylcrotonaldehyde | — | 1.62 | — | — | |
| 烃类 Hydrocarbons | 烃类总含量 Total content of hydrocarbons | 22.61 | 36.58 | 13.53 | 18.74 | |
| 42 | 柠檬烯 D-Limonene | 2.13 | 1.69 | 2.09 | 2.53 | |
| 43 | 松油烯 Terpinene | — | 1.31 | 2.24 | 1.85 | |
| 44 | 十一烷 Undecane | 9.56 | 21.46 | 3.95 | 7.37 | |
| 45 | 环庚烷 Cycloheptane | 2.04 | 1.47 | 0.72 | 1.05 | |
| 46 | 萘 Naphthalene | 2.63 | 0.64 | 0.65 | 0.65 | |
| 47 | 1,2,3-三甲基环己烷 1,2,3-Trimethylcyclohexane | — | 0.71 | — | 0.32 | |
| 48 | 十二烷 Dodecane | 2.82 | 6.45 | 1.12 | 1.98 | |
| 49 | 环十二烷 Cyclododecane | 0.51 | 0.49 | — | — | |
| 50 | 十三烷 Tridecane | 0.63 | — | 0.93 | 0.89 | |
| 51 | 癸烷 Decane | 0.61 | 1.13 | — | 0.11 | |
| 52 | 1-甲基萘 1-Methylnaphthalene | — | 0.54 | 0.38 | 0.47 | |
| 53 | 十四烷 Tetradecane | 1.07 | — | 1.06 | 1.19 | |
| 54 | 长叶烯 Junipene | 0.60 | 0.70 | 0.39 | 0.32 | |
| 醇类 Alcohols | 醇类总含量 Total content of alcohols | 20.61 | 11.32 | 16.71 | 16.32 | |
| 18 | 乙醇 Ethanol | 17.26 | 8.76 | 4.06 | 9.47 | |
| 序号No | 化合物类别Component species | 化合物名称 Component name | 相对百分含量Relative content (%) | |||
| 膨化前 Un-extruded | 膨化后 Extruded | |||||
| 发芽糙米粉Germinated brown rice powder | 金针菇-发芽糙米粉 Un-extruded powder of germinated brown rice compounded of Flammulina velutipes | 发芽糙米膨化 产品 Extruded products of germinated brown rice | 金针菇-发芽糙米膨化产品 Extruded products of germinated brown rice compounded of Flammulina velutipes | |||
| 19 | 正戊醇 1-Pentanol | — | 0.39 | 0.31 | 0.33 | |
| 20 | 2-甲基丁醇 2-Methyl-1-butanol | — | 0.15 | — | — | |
| 21 | 2-己醇 2-Hexanol | — | 0.65 | — | — | |
| 22 | 正己醇 1-Hexanol | 1.78 | 1.09 | — | 0.33 | |
| 23 | 1-辛烯-3-醇 1-Octen-3-ol | — | — | 4.00 | 3.49 | |
| 24 | 3,5-辛二烯-2-醇 3,5-Octadien-2-ol | 0.29 | 8.05 | 2.24 | ||
| 25 | 苯甲醇 Benzyl Alcohol | 1.57 | — | — | — | |
| 26 | 2-环己烯醇 2-Cyclohexen-1-ol | — | — | 0.08 | 0.14 | |
| 27 | 叶绿醇 Phytol | — | — | 0.21 | — | |
| 28 | 法尼醇 Farnesol | — | — | — | 0.32 | |
| 吡嗪类 Pyrazines | 吡嗪类总含量 Total content of pyrazines | — | 3.89 | 13.94 | 6.91 | |
| 29 | 吡嗪 Pyrazine | — | — | 0.32 | — | |
| 30 | 2-甲基吡嗪 Methyl-Pyrazine | — | — | 3.48 | — | |
| 31 | 2,6-二甲基吡嗪 2,6-Dimethylpyrazine | — | 0.62 | 7.04 | 2.87 | |
| 32 | 2-乙基-6-甲基吡嗪 2-ethenyl-6-methylpyrazine | — | — | 1.46 | — | |
| 33 | 2-乙基-3,5-二甲基吡嗪2-Ethyl-3,5-dimethylpyrazine | — | 0.62 | 1.63 | 1.57 | |
| 34 | 2,3,5,6-四甲基吡嗪 Tetramethylpyrazine | — | 2.66 | — | 2.47 | |
| 酮类 Ketones | 酮类总含量 Total content of ketones | 0.78 | 2.35 | 5.58 | 6.02 | |
| 35 | 3-羟基-2-丁酮 3-Hydroxy-2-butanone | — | — | — | 0.42 | |
| 36 | 2-庚酮 2-Heptanone | — | — | 0.11 | — | |
| 37 | 甲基庚烯酮 6-Methyl-5-hepten-2-one | — | 0.98 | 0.97 | 0.86 | |
| 38 | 3,5-辛二烯-2-酮 3,5-Octadien-2-one | — | 0.15 | 4.31 | 4.74 | |
| 39 | 2,2-二甲基己酮 2,2-Dimethyl-3-hexanone | — | 0.95 | — | — | |
| 40 | 六氢假紫罗酮 6,10-Dimethyl-2-undecanone | — | — | 0.14 | — | |
| 41 | 1-庚烯-3-酮 1-Hepten-3-one | 0.78 | 0.26 | 0.06 | — | |
| 呋喃类 Furans | 呋喃类总含量 Total content of furans | 2.76 | 2.89 | 4.69 | 2.11 | |
| 55 | 2,3-二氢呋喃 2,3-Dihydrofuran | — | 0.12 | — | — | |
| 56 | 糠醛 Furfural | — | — | 4.25 | 0.02 | |
| 57 | 2-正戊基呋喃 2-Pentylfuran | 2.76 | 2.77 | 0.45 | 2.09 | |
| 酯类 Esters | 酯类总含量 Total content of esters | — | 0.48 | 0.36 | 0.34 | |
| 58 | 苯甲酸乙酯 Benzoic acid, ethyl ester | — | — | 0.36 | 0.34 | |
| 59 | 十六酸乙酯 Hexadecanoic acid, ethyl ester | — | 0.48 | — | — | |
| 酸类 Acids | 酸类总含量 Total content of acids | — | 0.76 | 0.36 | 0.15 | |
| 60 | 棕榈酸 Nonahexacontanoic acid | — | 0.76 | 0.36 | 0.15 | |
| 其他 Others | 其他总含量 Total content of others | 0.76 | 0.27 | 0.14 | 0.09 | |
| 61 | 二甲基二硫 Dimethyldisulfane | — | — | — | 0.04 | |
| 62 | 癸醚 1,1'-oxybis-Decane | 0.76 | 0.27 | 0.14 | 0.05 | |
新窗口打开
3 讨论
3.1 挤压膨化对金针菇-发芽糙米复配粉消化特性的影响
在挤压膨化的高温、高压和高剪切力作用下,淀粉结构会发生变化,从而影响产品的消化性。本研究发现,经过挤压膨化后,金针菇-发芽糙米淀粉颗粒由规则的多面体形结构变为无规则多边形结构。相关研究表明,经过挤压膨化作用,淀粉发生糊化,淀粉颗粒宏观分子与组织结构之间的微晶结构破裂,表现为淀粉分子的排列不规则[26]。表征淀粉糊化特性的参数有峰值黏度、最低黏度、衰减值、最终黏度、回生值和糊化温度等,这些参数反映出淀粉糊化程度的高低[27]。糊化的淀粉更易被淀粉酶等分解,从而导致消化率的提高。此外,在挤压膨化加工过程中的挤压和剪切等机械力的作用下,淀粉分子间氢键断裂,大分子发生降解,部分生成麦芽糊精和寡糖,从而提高淀粉的可消化性[28],本研究中金针菇-发芽糙米膨化后的淀粉体外消化率较膨化前提高了30.68%,也可证明挤压膨化可提高淀粉的消化特性。挤压膨化加工过程中蛋白质的变化也会影响产品的消化性。在高温、高压和高剪切力的作用下,蛋白质发生变性,使得蛋白质分子空间结构从有序逐渐向无序转化,这可能是金针菇-发芽糙米膨化前后蛋白质微观结构发生变化的原因。而适度的挤压条件引起蛋白质变性后,可增加对蛋白酶的敏感性,蛋白质在蛋白酶的作用下,部分肽键和二硫键被打断,从而提高蛋白质的消化率 [29-30]。SHUTOV等[31]认为谷蛋白和球蛋白的稳定性以及对蛋白酶的抵抗能力都较弱,因此谷蛋白和球蛋白的亚基分子量变化较大,这可能是导致金针菇-发芽糙米挤压膨化后大分子量蛋白质亚基消失的原因。经过挤压膨化的高温、高压和高剪切力作用,淀粉发生糊化和降解程度增加,此时与淀粉紧密结合的蛋白质脱离出来,蛋白质分子结构伸展、重组,分子间氢键、二硫键等部分断裂,原先封闭在分子内的疏水性氨基酸残基暴露出来,增加了蛋白酶与蛋白质的接触机会及接触面积,进而提高蛋白质的消化率[32]。本研究中金针菇-发芽糙米膨化后的蛋白质体外消化率较膨化前提高了25.57%,也可证明挤压膨化可提高蛋白质的消化特性。综合以上分析可知,挤压膨化通过影响淀粉的糊化特性及改变蛋白质的结构,可提高
金针菇-发芽糙米的消化特性
3.2 挤压膨化对金针菇-发芽糙米复配粉挥发性物质的影响
GC-MS结果显示,发芽糙米原料中挥发性物质主要以醛类、烃类和醇类化合物为主,而金针菇-发芽糙米原料中挥发性物质则多了吡嗪类、酸类和酯类化合物,这些物质可能来源于烘干后的金针菇[33-34]。发芽糙米原料和金针菇-发芽糙米原料中挥发性物质较少,经过挤压膨化后,发芽糙米膨化产品和金针菇-发芽糙米膨化产品中的乙醛、戊醛、反式-2-庚醛、反式-2-壬醛、癸醛、1-辛烯-3-醇、苯甲酸乙酯等物质逐渐生成,壬醛、3,5-辛二烯-2-醇、2,6-二甲基吡嗪、2-乙基-3,5-二甲基吡嗪、3,5-辛二烯-2-酮等物质含量升高。醛类物质在发芽糙米膨化产品和金针菇-发芽糙米膨化产品中的含量均超过40%,C5—C9的醛类是由脂肪的氧化和降解产生的,醛类物质风味阈值低,与其他化合物能够产生重叠效应[34],因此对膨化产品风味贡献较大。1-辛烯-3-醇具有蘑菇特有的香气,被认为是多种食用菌的主要呈香物质[35],而吡嗪类化合物是美拉德反应和焦糖化反应的重要产物[36]。挤压膨化加工对醛类和醇类等挥发性物质的损失有直接影响[37]。发芽糙米原料中含量较高的醛类如己醛、庚醛、苯甲醛等和醇类如乙醇、正己醇等物质经过挤压加工后均呈现出降低趋势,而在金针菇-发芽糙米原料中这些物质经挤压加工后均表现出升高趋势,这说明添加金针菇对膨化产品风味有增强作用。此外,含量较高的烷烃类物质虽然香味阈值较高,对膨化产品风味的直接贡献不大,但风味独特的D-柠檬烯(新鲜橙子香气和柠檬香气)和松油烯(柑橘香气)等烯烃类物质对膨化产品的整体风味有一定影响。4 结论
挤压膨化技术通过影响淀粉的糊化特性和改变蛋白质的结构,可提高金针菇-发芽糙米膨化产品的消化特性。挤压膨化加工会对产品的醛类和醇类等挥发性物质造成损失,而添加金针菇能够丰富和增强膨化产品的风味。(责任编辑 赵伶俐)
The authors have declared that no competing interests exist.
