0 引言
【研究意义】香蕉(Musa spp.)是一种重要的热带水果和粮食作物。近年来,随着病虫害对香蕉产业威胁的加剧,迫切需要培育新的抗性品种,因此,了解香蕉基因组信息及其功能成为重要前提。香蕉A基因组序列测定的完成,为香蕉基因组改造提供了至关重要的基础[1],对香蕉基因功能的研究起到了极大的推动作用。但香蕉多为三倍体,高度不育,基因功能的研究存在诸多技术困难。新的技术手段如CRISPR/Cas9基因编辑技术体系的快速发展,为开展香蕉基因功能研究和香蕉育种工作开辟了一条新的路径,在香蕉上建立CRISPR/Cas9技术体系,实现高效的香蕉基因突变,对香蕉的遗传改良研究具有重要意义。【前人研究进展】基因组编辑技术是新近发展起来的对基因组进行定向精确修饰的一种技术,主要包括人工核酸酶介导的锌指核酸酶(zinc-finger nucleases,ZFN)[2]、转录激活样效应因子核酸酶(transcription activator-like effector nucleases,TALEN)[3]及RNA引导的CRISPR/Cas核酸酶(clustered regularly interspaced short palindromic repeat,CRISPR)技术[4]。基因组编辑技术在基础研究和作物遗传改良等方面展示出了巨大的潜力,其中最新发展起来的CRISPR/Cas9技术,有着其他基因编辑技术无可比拟的优势,该系统只需设计和目标核酸对应的RNA序列,操作手段简单,效率高,成本低,为基因组编辑提供了新的平台[4]。目前,CRISPR/Cas9系统作为一种高效的基因定点编辑技术,已成功应用于拟南芥[5]、水稻[4,6-10]、玉米[11-12]、小麦[13]、大豆[14-15]、烟草[16-18]以及杨树[19-20]等植物,实现了基因组编辑。【本研究切入点】目前,尚未有CRISPR/Cas9技术在果树上的报道。本研究拟以CRISPR/Cas9技术为切入点,以香蕉主栽品种为研究对象,利用一套改良的CRISPR/Cas9多靶点载体系统[21],在香蕉体内同时表达Cas9蛋白和针对八氢番茄红素脱氢酶(phytoene dehydrogenase,PDS)基因的sgRNA,在香蕉体内实现对内源基因的高效定点敲除。【拟解决的关键问题】建立香蕉CRISPR/Cas9基因编辑技术体系,获得突变体香蕉株系。为进一步利用基因编辑技术在香蕉遗传改良上的应用奠定基础。1 材料与方法
试验于2015年在广东省农业科学院果树研究所进行。1.1 试验材料
香蕉品种巴西蕉(Musa spp. AAA Cavendish group cv‘Boxi’)胚性细胞悬浮系为HU等[22]通过雄花序途径诱导获得。胚性悬浮细胞系继代保持在M2液体培养基中[23],27℃黑暗培养,每2个星期继代一次。根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105由本实验室保存。pYLCRISPR/Cas9-DH植物表达载体系统由华南农业大学刘耀光教授惠赠。1.2 试验方法
1.2.1 Cas9靶点设计及pYLCRISPR/Cas9-gRNA植物表达载体构建 根据香蕉A基因组八氢番茄红素脱氢酶(phytoene dehydrogenase,PDS)基因组序列(JQ762260.1),利用在线工具ZiFiT Targeter Version 4.2[24]选择合适的Cas9靶点序列T1:cctctgaaggttgtcatagc,依据靶位点及sgRNA构建方法设计原则来设计引物:U-F:ctccgttttacctgtggaatcg;U6aTpds1-:gctatgacaaccttcagaggcggcagccaagccagca;gRTpds1+:cctctgaaggttgtcatagcgttttagagctagaaat;gR-R:cggaggaaaattccatccac。以pYLgRNA-LacZ-U6a质粒[21]为模版,利用Overlapping PCR往sgRNA表达盒导入靶序列,在一个反应中使用4种引物:U-F和gRTpds1+各0.2 μmol·L-1,U6aTpds1-和gR-R各0.1 mol·L-1。25个循环:94℃ 10 s,58℃ 15 s,68℃ 20 s。本sgRNA由水稻来源的RNA启动子U6a驱动,双元载体pYLCRISPR/Cas9-DH与sgRNA表达盒载体采用Golden Gate Cloning方法[21]构建。构建好的pYLCRISPR/Cas9-gRNA质粒经测序验证正确后转入农杆菌EHA105中。1.2.2 香蕉遗传转化 采用农杆菌介导法转化巴西蕉性细胞悬浮系,香蕉的遗传转化参照刘凯等[23]的方法进行。以未转化巴西蕉的胚性细胞悬浮系再生植株为对照。
1.2.3 转基因香蕉检测 取再生香蕉苗叶片,采用CTAB法提取对照和抗性再生香蕉苗叶片基因组DNA。为确认外源DNA是否插入至香蕉基因组中,根据潮霉素(hygromycin B)抗性基因序列设计特异性引物:5′-gacgattgcgtcgcatcgac-3′;5′-gtcc tgcgggtaaatagctg-3′,PCR扩增片段长度为740 bp。确认外源DNA片段插入到香蕉基因组后,为了检测目标基因是否发生突变,设计包含香蕉内源MaPDS靶点序列在内的PCR引物。PCR引物如下:PDS1F:5′-caagaagccaagacatggtgc-3′;PDST1R:5′-ggacatctct agcctccaagac-3′。扩增长度大约为550 bp,PCR扩增产物经胶回收后连接到pMD19-T(宝生物工程(大连)有限公司)载体上,挑选单克隆进行测序,并对测序结果进行分析。
2 结果
2.1 pYLCRISPR/Cas9-gRNA植物表达载体构建
以pYLgRNA-LacZ-U6a质粒为模版,用Overlapping PCR法获得大小约830 bp的条带,与预期大小相符(图1),回收PCR产物,利用Golden Gate Cloning方法将其克隆到pYLCRISPR/Cas9的Bsa I位点,用Mlu I酶切进行鉴定,切出预期大小的目的片段(图2)。构建好的质粒最后经测序验证完全正确,说明pYLCRISPR/Cas9-gRNA敲除载体构建成功。构建好的质粒含Cas9p和gRNA表达盒,其中Cas9p由PUbi启动子驱动,sgRNA由水稻来源的RNA启动子U6a驱动,植物筛选以抗生素为潮霉素,图谱如图3。将构建好的质粒利用冻融法转入至根癌农杆菌菌株EHA105。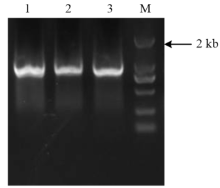 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1gRNA Overlapping PCR扩增片段的电泳检测
1—3: gRNA PCR扩增;M:DL 2000 DNA marker
-->Fig. 1PCR of the gRNA with the specific primers
1-3: PCR products of gRNA; M: 2000 bp DNA marker
-->
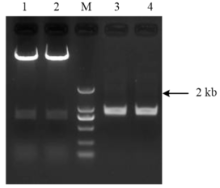 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2pYLCRISPR/Cas9-gRNA酶切鉴定
1—2:pYLCRISPR/Cas9-gRNAM Mlu I酶切;M:DL 2000 DNA marker;3—4:gRNA PCR产物
-->Fig. 2Identification of pYLCRISPR/Cas9-gRNA plasmid with Mlu I digestion
1-2: plasmid restricted by Mlu I; M: 2000 bp DNA marker; 3-4: gRNA PCR products
-->
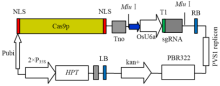 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3pYLCRISPR/Cas9-gRNA载体图谱
-->Fig. 3Construction of the pYLCRISPR/Cas9-gRNA vector
-->
2.2 转MaPDS基因敲除香蕉的获得
采用农杆菌介导法进行pYLCRISPR/Cas9-gRNA转化巴西香蕉胚性细胞悬浮系,共进行6次遗传转化。巴西香蕉胚性细胞悬浮细胞经侵染、筛选、抗性胚诱导、萌发和生根等过程(图4),获得129个抗性株系。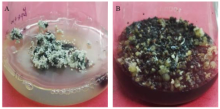 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4转基因香蕉的再生
A:成熟抗性胚;B:抗性胚萌发
-->Fig. 4Somatic embryos germination and regeneration
A: Mature resistance embryos; B: Germination of resistance embryos
-->
2.3 pYLCRISPR/Cas9-gRNA转基因香蕉的检测
通过构建MaPDS的pYLCRISPR/Cas9-gRNA敲除载体和对巴西蕉胚性细胞的遗传转化,获得了具有潮霉素抗性的阳性转化苗。为检测外源基因是否整合至香蕉基因组中,任取阳性再生苗白化型和正常表型各15个株系,以未转化的经过相同再生过程获得的再生植株为对照,提取再生香蕉叶片基因组DNA,以潮霉素抗性基因为检测基因,进行PCR扩增,以检测外源插入DNA片段。电泳结果如图5所示,表明阳性材料的叶片DNA均扩增出大小为740 bp目的片段,未转化香蕉则无,初步表明在抗性培养基上生长的香蕉苗,其基因组内均插入敲除载体序列,即MaPDS敲除载体已成功转入到香蕉植株中。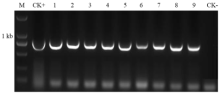 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5部分转基因植株的PCR检测
M:DL 2000 DNA marker; CK+: PCR product of pYLCRISPR/Cas9-gRNA; 1—9: 转基因植株的PCR扩增 CK-: 非转基因植株的PCR扩增
-->Fig. 5PCR identification of the transgenic plants
M: 2000 bp DNA marker; CK+: PCR product of pYLCRISPR/Cas9-gRNA; 1-9: PCR product of transformed plants; CK-: PCR product of non- transformed
-->
2.4 CRISPR/Cas9系统敲除效率分析
对获得的129个抗性再生组培幼苗株系分单株进行2代组培快繁,统计单株表型,发现71个株系出现白化表型,白化率达到61.2%,其中出现花白叶嵌合体表型株系40个。其他58个株系均为正常的绿色(图6-A、B、C)。未经转化的对照再生后代植株中未发现白化表型的单株。为进一步确认白化表型与CRISPR/Cas9相关,在获得的129株抗性植株中,任取其中的33个白化表型和14个表型正常的植株,提取其叶片基因组DNA,以其为模板,用PDS1F和PDST1R引物扩增含有PDS的靶位点片段。测序后序列比对结果表明,在33株白化苗中,所测得的MaPDS靶位点序列均出现不同形式的突变,第1种是在靶位点附近增加1个碱基T或者A,第2种是在靶位点附近或下游发生碱基颠换或转换(图7),出现非靶标位点突变。这2种突变形式均能导致MaPDS蛋白翻译错误,从而使MaPDS蛋白丧失功能,表现为白化。对14个表型正常的植株检测结果表明,其MaPDS靶位点序列与野生型一致,未检测到变异。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6转基因植株表型
A:叶色正常的转基因香蕉苗;B:呈花白叶嵌合体转基因香蕉苗;C:呈白化转基因香蕉苗
-->Fig. 6Phenotypes of the mutants generated from the CRISPR/Cas9 targeting
A: Normal phenotype of the transformed plants; B: Chimerism phenotype in regenerated plants; C: Albino phenotype of the regenerated plants
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7转基因香蕉突变体内源MuPDS序列分析
-->Fig. 7Sequence analysis of MuPDS from mutation plants
-->
3 讨论
CRISPR/Cas9作为新近发展起来的基因编辑技术,在植物中已经有较多的关于该系统验证以及应用的报道。本研究利用一套改良的CRISPR/Cas9多靶点载体系统[21],以香蕉MaPDS作为靶标基因,成功地在香蕉体内实现了对内源基因的定点敲除,获得了MaPDS定点敲除的白化突变体株系,白化表型与已报道的类似[19-21,25-27]。CRISPR/Cas9技术在水稻[21]、杨树[19-20]、烟草[25]、番茄[26]、苹果[27]等植物基因功能研究中,PDS被选择作为靶标目的基因,均成功获得了基因定点编辑突变体。但在不同植物中编辑效率存在较大差异,这可能是由于sgRNA设计时,对目标DNA的靶标位点不同而引起,或者与sgRNA对目标DNA结合力及染色体的结构、染色体的甲基化等遗传特性有关。目前尚没有利用CRISPR/Cas9技术对三倍体植物进行基因编辑的报道,本研究以三倍体香蕉主栽品种巴西蕉为材料,MaPDS作为CRISPR/Cas9编辑的靶标基因。与二倍体植物相比,靶标基因在香蕉基因组中虽然只有一个拷贝,但存在3个等位基因,若能利用CRISPR/Cas9技术对香蕉基因成功编辑获得突变体,将会为其他三倍体或多倍体植物应用该技术提供重要参考。本研究结果表明,CRISPR/Cas9系统在香蕉体内引起的突变,主要在基因靶位点引起碱基颠换、转换、插入,从而导致目标蛋白翻译错误,使其功能丧失。获得的白化表型突变率达 到55%,突变率高于拟南芥[25]等其他植物,说明CRISPR/Cas9系统同样能应用于三倍体香蕉的基因编辑,在本研究中,出现了花白叶表型的嵌合体,在利用CRISPR/Cas9编辑的报道中,也存在这一现象[10,20-21]。对三倍体香蕉而言,可能是MaPDS 3个等位基因的其中1个或2个被编辑,转基因材料以杂合形式存在,表型上出现花白叶现象。本试验在对抗性芽快繁过程中,发现刚再生出来的表型正常的株系中,有部分株系在快繁过程中出现了白化表型的分离现象,产生该现象的可能原因是,表型正常的转基因香蕉体内存在的Cas9蛋白和含靶标基因片段的sgRNA,在新芽的分化过程中,仍能对其基因组中的靶标基因进行编辑,从而产生白化表型的新芽。
脱靶现象普遍存在于CRISPR/Cas9系统中,本研究中,在靶位点之外同样也检测到了非靶位点的突变。由于该系统引起基因组非靶位点的突变, 增加了研究结果的不确定性,要实现该技术的更广泛的应用,在未来的研究中,需要进一步改进和完善。
随着人类对多种植物基因组测序的完成,现在的生物研究已进入到功能基因组时代,突变体是功能基因组学非常重要的研究材料,因此创建突变体库是研究功能基因组的重要技术平台[28]。香蕉A基因组序列测定的完成,对香蕉基因功能的研究起到了极大的推动作用。但长期以来,因为缺乏突变体,又由于香蕉多为三倍体,高度不育,同时也由于香蕉的遗传转化体系还不完善,香蕉的功能基因组研究相对落后,对香蕉基因功能的研究主要还是采用异源表达的方式,其结果的可靠性常受到质疑。本研究在前期建立的高效香蕉遗传转化技术体系的基础上[29],率先在香蕉上建立了CRISPR/Cas9基因编辑技术体系,成功获得了香蕉MaPDS突变体,在此基础上选择敲除香蕉中具有重要功能的基因,建立了香蕉功能基因的突变体库,对于深入研究香蕉基因的生物学功能和其调控机理都具有重要的意义。
随着商业化转基因植物新品种的不断出现,其所带来的生物安全性问题极大地限制了作物新品种的市场推广和应用。利用CRISPR/Cas9技术系统,可以方便地获得靶基因突变植物材料,然后通过一代杂交或自交,将转基因成分与突变靶基因分离,从而获得无转基因成分的突变新材料,而且突变基因及其相应性状也能够像突变体一样稳定遗传。最近,WOO等[30]将纯化的Cas9蛋白和sgRNA直接导入到拟南芥、烟草及水稻的原生质体中,并获得了相应基因编辑的再生突变体,利用该方法获得的突变体不含任何转基因成分,这为利用CRISPR/Cas9技术获得非转基因突变体提供了新的选择。由于香蕉高度不育,无法通过杂交或自交获得无转基因成分的突变新材料,但香蕉的原生质体再生已有成功的报道[31],参照WOO等[30]的方法,同样有望获得非转基因突变体应用于生产。
4 结论
本研究利用一套改良的CRISPR/Cas9多靶点载体系统,构建了针对香蕉MaPDS的pYLCRISPR/Cas9- gRNA基因编辑载体。以巴西蕉的胚性细胞悬浮系为受体,利用农杆菌介导,获得了129个独立的抗潮霉素的抗性再生株系,其中71个株系出现白化表型,产生白化表型几率达55%。被检测的白化株系的MaPDS靶位点及下游附近发生了碱基插入或碱基颠换及转换。本研究成功地在香蕉体内实现了对内源MaPDS的定点敲除,获得了基因定点敲除的突变体株系,为进一步利用基因编辑技术在香蕉上的遗传改良应用奠定了基础。The authors have declared that no competing interests exist.
