0 引言
【研究意义】土壤微生物是土壤物质循环的重要推动者[1],土壤中已存在的或人为施入的营养物质都需要通过微生物的加工才能为植物所利用。同时,它也是土壤环境的重要监测者,对土壤环境质量的变化十分敏感[2],其种群、数量、活性和群落结构受到多种因素的影响[3-9]。此外,微生物活动直接影响土壤的理化性质[10],与土壤养分的固定与释放紧密相关[11],现已作为评价土壤肥力的重要标志之一[2]。施肥作为重要的农业生产措施,会对土壤类型、土壤肥力产生深刻的影响[12],氮肥进入土壤后的一系列转化离不开与氮素转化相关的微生物的参与。氨氧化细菌和反硝化细菌分别是硝化作用和反硝化作用的限制性步骤[13-14],两者的变化直接影响农田生态系统土壤氮素的转化利用和氮损失[15],其中,amoA为氨氧化细菌的调控酶AMO的活性中心,常作为研究环境中氨氧化微生物的分子标记[16],而含有nirS基因的细菌以假单胞菌占优势,在不同的菌株中分子大小相似、形态结构保守[17]常作为反硝化细菌的研究对象。间套作在不增加耕地面积的前提下,显著增加了播种面积,提高粮食产出,同时豆-禾间套作不仅有增产效应[9, 18-21],还提高养分利用率[9, 21-23],降低氮素损失[24],实现保肥、改善农田生态系统功能[25]。因此,研究套作和施氮水平对氨氧化细菌和反硝化细菌群落变化及其与作物氮素吸收的关系对于解析土壤氮素循环、提高间套作系统氮肥利用率具有十分重要的意义。【前人研究进展】玉米/大豆带状套作作为中国南方旱地农业的一种主要种植模式,在增产[26]、提高养分利用方面效果显著[27],前期研究表明减量施氮可以促进该模式增产节肥[28],显著提高作物产量和养分吸收,套作大豆根系可分泌更多的质子和有机酸,活化难溶性磷,促进作物磷吸收[29];大豆通过根瘤菌固氮满足对氮需求的同时促进了玉米对氮素的吸收,有利于系统增产[26]。由此推测系统养分高效利用和增产效应与作物地下根系吸收能力及土壤环境有关,尤其是与土壤中微生物的变化情况密切相关。雍太文等[4]研究表明,麦/玉/豆套作提高了各作物根际细菌、真菌、放线菌数量。张向前等[5]证实间作在不同施肥条件下可显著提高土壤中细菌、放线菌和固氮菌数量。涂勇等[8]表明,考烟-大豆带状套作显著增加了作物根际细菌、放线菌数量,减少了真菌数量,与氮素代谢相关微生物数量显著增加。宋亚娜等[30]研究表明,在短期定位试验中氮肥能够显著提高稻田土壤反硝化细菌的丰度。武传东等[31]基于氨单加氧酶基因的研究表明,长期施用氮肥和磷肥对土壤氨氧化古菌多样性有较大影响。刘骁蒨等[32]通过秸秆还田和施肥对稻田土壤中固氮菌群落结构的影响进行了研究,发现秸秆还田配施足量氮磷钾肥后土壤中固氮菌多样性最为丰富。【本研究切入点】国内外****围绕施肥对单作作物的根际生态环境、微生物数量及群落多样性影响等做了大量研究,对揭示单作体系下作物养分高效利用的根际微生态机理做出了较大贡献;但尚未对玉米/大豆套作系统的土壤细菌多样性及其与套作系统中作物氮素高效吸收的关系进行报道。【拟解决的关键问题】本研究通过比较玉米、大豆单套作及不同施氮水平下作物氮素吸收及根际土壤细菌群落多样性的差异,明确减量施氮对玉米/大豆套作系统根际土壤氨氧化细菌、反硝化细菌多样性的调节作用及其与植株氮素高效吸收的关系,优化玉米/大豆套作体系施肥方法,为禾/豆间(套)作减肥增效生产提供理论和技术支撑。1 材料与方法
1.1 试验时间、地点及材料
试验于2013年3月至2015年10月在四川省现代粮食产业(仁寿)示范基地(30°07′N、104°18′E)进行。试验地土壤类型为紫色土,供试玉米品种为登海605,由山东登海种业股份有限公司提供;大豆品种为南豆12,由四川省南充市农业科学研究所提供。供试土壤2013年基础肥力为pH 6.6,有机质29.8 g·kg-1,全氮1.6 g·kg-1,全磷1.28 g·kg-1,全钾16.3 g·kg-1,速效氮317 mg·kg-1,速效磷42.2 mg·kg-1,速效钾382 mg·kg-1。1.2 试验设计
采用二因素裂区设计,主因素为种植方式:玉米单作(MM)、大豆单作(SS)、玉米/大豆套作(IMS);副因素为玉米、大豆施氮总量(玉米、大豆施氮比例为3:1):不施氮(NN:0)、减量施氮(RN:180 kg·hm-2,根据当地玉米施氮量确定)、常量施氮(CN:240 kg·hm-2,根据当地玉米与大豆的总施氮量确定)。重复3次。每处理连续种3带,带长6 m、带宽2 m。玉米、大豆种植模式如图1,单作采用等行距种植,玉米行距 100 cm、大豆行距 50 cm,玉米、大豆穴距 17 cm,穴留 1 株;玉米/大豆套作采用宽窄行种植,套作玉米(IM)宽行 160 cm,窄行 40 cm,在玉米大喇叭口期将两行大豆播种于玉米宽行内,套作大豆(IS)行距 40 cm,玉米与大豆间距 60 cm,穴距均为 17 cm,玉米穴留 1 株,密度 5.85万株/hm2,大豆穴留2株,密度11.7万株/hm2 ,玉米、大豆单作与套作的种植密度相同。玉米氮肥分两次施用,即玉米底肥和大喇叭口期追肥,大豆氮肥一次性作底肥施用(表1)。玉米、大豆单作按株间穴施方式施肥,玉米/大豆套作按玉米、大豆一体化施肥方式,即玉米底肥统一施72 kg N·hm-2,玉米大喇叭口期追肥与大豆氮磷钾肥混合施用,在玉米、大豆之间,距玉米25 cm处开沟施肥,各作物氮肥施用方式及施用量见表1;单、套作玉米及单作大豆的磷钾肥随底肥施用,玉米施用量为105 kg P2O5·hm-2、112.5 kg K2O·hm-2,大豆施用量为63 kg P2O5·hm-2、52.5 kg K2O·hm-2。玉米/大豆套作系统的共生期为玉米大喇叭口期至玉米收获(大豆出苗至分枝期),2013年,玉米4月3日播种,8月1日收获;大豆6月11日播种,10月29日收获;2014年,玉米3月29日播种,7月26日收获;大豆6月9日播种,10月28日收获;2015年,玉米3月27日播种,7月25日收获;大豆6月7日播种,10月25日收获。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同种植模式示意图MM:玉米单作;SS:大豆单作;IMS:玉米/大豆套作。下同
-->Fig. 1Diagram of different planting patterns MM: Maize monoculture; SS: Soybean monoculture; IMS: Maize/soybean relay strip intercropping. The same as below
-->
Table 1
表1
表1不同种植模式的氮肥施用量
Table 1N fertilization rates in different planting patterns
| 种植模式 Planting pattern | 施氮处理 N application | 施氮总量 Total N-application (kg·hm-2) | 底肥 Base fertilizer(kg·hm-2) | 追肥 Top fertilizer(kg·hm-2) |
|---|---|---|---|---|
| MM | RN | 135 | 72 | 63 |
| CN | 180 | 72 | 108 | |
| SS | RN | 45 | 45 | 0 |
| CN | 60 | 60 | 0 | |
| IMS | RN | 180 | 72 | 108 |
| CN | 240 | 72 | 168 |
新窗口打开
1.3 测定项目和方法
1.3.1 植株样品的采集 于作物成熟期采集植株样品,单套作下玉米、大豆取样方法相同,在每小区随机选取长势一致的两段,每段取对称2行的连续2穴,玉米单套作均为4株,大豆单套作均为8株。1.3.2 土壤样品的采集 土壤样品于玉米大喇叭口期(V12)、抽雄期(VT)和成熟期(R6),大豆五节期(V5)、盛花期(R2)、初荚期(R5)和成熟期(R8),采用挖掘法取土壤样品。每小区随机取长势一致样段两段,每段取对称2行的连续2穴,将植株根系从土壤中整体挖出(40 cm深),抖掉与根系松散结合的土体(非根土),然后用经火焰灭菌的镊子刮取附在根系上的一薄层(<10 mm)土壤作为根际土壤。并将取得的两段植株根际土样整碎混匀按4分法取样,取后立即放入冰盒中保存,带回实验室后,迅速过2 mm土筛,除去可见根系、动植物残体和石块等杂物,并保存到-20℃条件下用于指标测定。
1.3.3 植株和土壤样品测定 植株吸氮量:将成熟期植株样地上部茎叶和籽粒分装,105℃下杀青30 min后,75℃烘至恒重,测定干物质重量;随后将样品粉碎并过60目筛,采用凯氏定氮法测定总氮含量,植株各器官吸氮量(kg·hm-2)=植株各器官干物质重量(kg·hm-2)×植株各器官氮浓度(g·g-1);土壤总氮含量:将成熟期非根际土壤风干后研磨过60目筛,采用凯氏定氮法测定土壤总氮;土壤细菌数量:用牛肉膏蛋白胨琼脂培养基进行选择性培养[33],通过平板计数法测定玉米、大豆各取样时期下根际土壤中细菌数量。
土壤总DNA提取、PCR扩增及克隆文库的构建:称取玉米或大豆根际土壤样品0.5 g(-20℃保存),按E.Z.N.A Soil DNA Kit试剂盒说明,提取土壤微生物总DNA,用1%的琼脂糖凝胶电泳检测后DNA样品于-20℃保存备用。以提取的DNA为模板,用特异引物(表2)进行PCR扩增,基因PCR扩增体系为:2×Power Taq PCR Master Mix 25µL,上下游引物各1 µL,DNA模板2 µL,ddH2O 21 µL,总共50 µL。并用1%琼脂糖凝胶电泳检测,用Axygen DNA 回收试剂盒回收和纯化PCR产物,反应条件为:95℃预变性5 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,40个循环;72℃延伸10 min。将回收片段与bluntsimple载体连接反应,转入大肠杆菌DH5α中,采样蓝白斑筛选方法筛选阳性克隆并送样测序。将所测序列在NCBI上进行同源性比对,利用mothur软件分别将相似性≥97%的amoA和相似性≥90%的nirS基因序列归为同一个操作分类单元(Operational TaxonomicUnits,OTUs),并估算每个克隆文库aomA和nirS基因多样性指数Shannon-Weiner(H′)和Simpson(D)、Evenness J,覆盖百分率(Coverage,C)。
Table 2
表2
表2 amoA和nirS基因引物序列及限制性内切酶[
Table 2amoA and nirS gene sequences of primers and restriction enzymes
| 基因 名称 Gene | 引物序列 Primer sequence | 内切酶 Restriction enzymes |
|---|---|---|
| aomA | amoA-1F(5′-GGGGTTTCTACTGGTGGT-3′) | Taq Ⅰ |
| amoA-2R(5′-CCCCTCKGSAAAGCCTTCTTC-3′) | ||
| nirS | nirS-1F(5′-CCTAYTGGCCGCCRCART-3′) | MspⅠ |
| nirS-6R(5′-CGTTGAACTTRCCGGT-3′) |
新窗口打开
文库多样性指数计算公式:
Shannon-Wiener H= -Σ (Pi)(ln Pi),
Simpson D=1-Σ Pi2,
Evenness J=H/ Hmax
式中,Pi表示第i个种占总数的比例;H为香农指数,Hmax为H的最大值。
1.3.4 实时荧光定量PCR(Q-PCR) 吸取10 μL阳性克隆菌液于1 mL含氨苄青霉素LB培养基中37℃摇床培养10 h,提取质粒并测定浓度,进一步换算成拷贝数。10梯度倍稀释构建amoA、nirS基因的标准曲线,标准曲线范围在103—107。
质粒浓度换算公式:拷贝数(µL)= 质粒浓度(ng·µL-1)×6.02×1014/分子量每个样品重复3次进行荧光定量PCR,引物参见表2。反应体系为:SybrGreen qPCR Master Mix 12.5 µL,引物F(10 µmol·L-1) 0.5 µL,引物R(10 µmol·L-1)0.5 µL,ddH2O 9.5 µL,Template(cDNA)2 µL,共25 µL。反应程序为:95℃ 10 min;95℃ 15 s,60℃ 1 min,40个循环;最后加上溶解曲线过程(95℃ 15 s,60℃ 15 s,95℃ 15 s)。
1.4 数据处理
采用Microsoft Excel 2007进行数据整理计算,基因序列利用mothur软件进行分类后再通过Gene Marker软件计算多样性指数,并利用SPSS 18.0软件对试验数据进行方差分析、LSD显著性检测和相关性分析。2 结果
2.1 土壤总氮含量与植株氮素吸收
2.1.1 土壤总氮含量 套作下减量施氮促进了玉米、大豆土壤总氮含量的增加(表3),减氮处理下的IMS土壤总氮含量最高,与MM(SS)相比,IM土壤总氮含量增加13.39%,而IS土壤总氮含量降低了5.81%。施氮与不施氮相比,除2015年大豆的土壤总氮含量呈降低趋势外,施氮显著提高了玉米大豆的土壤总氮含量;各施氮水平间,IMS的土壤总氮含量均以RN 的最高,与NN和CN相比,IM下分别高出9.84%和5.34%,IS下分别高出5.57%和5.02%;MM/SS下,玉米土壤总氮含量随施氮量的增加而增加,以CN最高,CN和RN比NN分别高17.15%和11.06%,大豆的则以RN最高,比CN和NN的分别高16.15%和18.98%。2.1.2 植株吸氮量 种植模式对玉米、大豆地上部植株吸氮量影响显著(表4),且年际间变化规律一致。与MM相比,IM的玉米植株吸氮量呈增加趋势,但差异不显著,3年平均提高2.10%。各施氮水平之间,MM下玉米植株吸氮量随施氮量的增加而增加,IM下则以RN的最高,分别比NN和CN的高91.35%和9.88%。套作显著降低了大豆植株吸氮量,IS的比SS 的平均低3.24%。各施氮水平间,单套作下大豆植株吸氮量均以RN的最高,SS下分别比NN和CN的高15.24%和14.97%,IS下分别比NN和CN的高26.24%和11.90%。
Table 3
表3
表3不同种植模式与施氮量下玉米大豆土壤总氮含量
Table 3The soil total N content under different planting patterns and N fertilization rates (kg·hm-2)
| 氮处理 N treatment | 2013 | 2014 | 2015 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 玉米 Maize | 大豆 Soybean | 玉米 Maize | 大豆 Soybean | 玉米 Maize | 大豆 Soybean | |||||||
| MM | IM | SS | IS | MM | IM | SS | IS | MM | IM | SS | IS | |
| NN | 0.807b | 0.979a | 1.005b | 0.920b | 0.775b | 0.949a | 0.934b | 0.993a | 0.836a | 0.936a | 1.016a | 0.942a |
| RN | 0.851ab | 1.069a | 1.136a | 1.068a | 0.965a | 1.082a | 1.139a | 0.999a | 0.868a | 0.995a | 1.040a | 0.948a |
| CN | 0.936a | 1.025a | 1.045ab | 0.993ab | 0.974a | 0.977a | 1.064ab | 0.989a | 0.918a | 0.977a | 0.918b | 0.890a |
| Mean | 0.865 | 1.025* | 1.062 | 0.994* | 0.904 | 1.003* | 1.046 | 0.994 | 0.874 | 0.969* | 0.989 | 0.927 |
新窗口打开
Table 4
表4
表4不同种植模式与施氮量下作物地上部植株吸氮量
Table 4Crops shoot N uptake under different planting patterns and N fertilization rates (kg·hm-2)
| 氮处理 N treatment | 2013 | 2014 | 2015 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 玉米 Maize | 大豆 Soybean | 玉米 Maize | 大豆 Soybean | 玉米 Maize | 大豆 Soybean | |||||||||
| MM | IM | SS | IS | MM | IM | SS | IS | MM | IM | SS | IS | |||
| NN | 119.2b | 105.99c | 164.27b | 147.03b | 62.83b | 64.59c | 188.98b | 163.63c | 62.67c | 70.04b | 195.38b | 179.77a | ||
| RN | 167.27a | 179.19a | 195.98a | 200.00a | 122.67a | 140.08a | 224.74a | 206.03a | 123.3b | 141.16a | 234.56a | 213.06a | ||
| CN | 171.26a | 159.98b | 174.72ab | 176.01ab | 131.83a | 127.55b | 194.76a | 185.21b | 136.08a | 131.51a | 200.5ab | 192.07a | ||
| Mean | 152.58 | 148.39 | 178.32 | 174.34 | 105.77 | 110.76 | 202.82* | 185.21 | 107.35 | 114.24 | 210.15* | 194.96 | ||
新窗口打开
2.2 根际土壤细菌数量
玉米、大豆根际土壤细菌达到106数量级(表5),施氮增加了土壤中营养物质含量,对微生物生长、活动起到一定促进作用。玉米根际土壤细菌数量随生育期的推进而降低,在大喇叭口期(V12)达到最大;种植模式显著影响玉米细菌数量,玉米大豆共生前的大喇叭口期(V12)为MM>IMS,共生后IMS的玉米根际土壤细菌数量较MM高2.6%。施氮有利于提高玉米根际土壤细菌数量,以RN的最高,R6期RN比NN和CN分别高9.6%和9.8%。与单作相比,套作能较显著提高大豆根际土壤细菌数量,以V5期最高,该时期下IMS比SS提高12.9%。各施氮水平间,大豆细菌数量均以RN的最高,RN分别比NN和CN高11.7%和11.0%。Table 5
表5
表5不同种植模式与施氮量下玉米大豆根际土壤细菌数量
Table 5The soil bacteria number of rhizosphere under different planting patterns and N fertilization rates (×106cfu/g)
| 种植模式 Plant pattern | N处理 N treatment | 玉米 Maize | 大豆Soybean | |||||
|---|---|---|---|---|---|---|---|---|
| V12 | VT | R6 | V5 | R2 | R5 | R8 | ||
| 2013 | ||||||||
| MM/SS | NN | 22.74ab | 14.46a | 10.19a | 13.39c | 10.43c | 7.70b | 11.73b |
| RN | 23.85a | 14.99a | 10.27a | 16.53a | 14.29a | 10.27a | 13.46a | |
| CN | 19.10c | 14.58a | 10.19a | 14.58b | 11.92b | 8.57b | 10.42c | |
| Mean | 21.89 | 14.68 | 10.22 | 14.83 | 12.21 | 8.85 | 11.87 | |
| IMS | NN | 19.05c | 15.83a | 10.58a | 13.57c | 11.79b | 9.64b | 13.93b |
| RN | 23.20a | 16.49a | 10.62a | 17.08a | 14.72a | 10.48a | 15.08a | |
| CN | 20.39b | 15.90a | 10.48b | 16.01b | 12.33b | 9.91ab | 14.06b | |
| Mean | 20.88 | 16.07 | 10.56 | 15.55 | 12.95 | 10.01 | 14.35 | |
| 2014 | ||||||||
| MM/SS | NN | 12.63b | 12.20b | 11.06a | 13.09a | 11.99a | 13.67a | 11.79b |
| RN | 14.88a | 13.51a | 11.64a | 11.92b | 11.27b | 12.56b | 13.50a | |
| CN | 12.77b | 11.83b | 11.22a | 11.79b | 11.64ab | 10.97c | 11.31b | |
| Mean | 13.43 | 12.51 | 11.31 | 11.70 | 11.47 | 11.44 | 12.20 | |
| IMS | NN | 11.32b | 12.24b | 10.20b | 13.82b | 12.26b | 11.96a | 13.34b |
| RN | 12.79a | 14.20a | 12.43a | 14.87a | 14.11a | 11.61ab | 15.08a | |
| CN | 12.28ab | 12.52b | 11.76a | 14.52a | 11.97b | 10.67b | 13.38b | |
| Mean | 12.12 | 12.99 | 11.46 | 14.40 | 12.97 | 11.65 | 13.93 | |
新窗口打开
2.3 根际土壤氨氧化细菌amoA基因多样性分析
2.3.1 文库多样性指数 由表6可知,克隆文库库容值C在88.2%—98%,能够比较完整的反映土壤中氨氧化细菌群落结构。玉米土壤中的OTUs数量为MM<IMS,多样性指数H、D和均一度指数J均为MM>IMS,减量施氮提高了玉米土壤中amoA基因文库的多样性指数,单套作下各指标均以RN的最高。大豆的OTUs数为SS>IMS,SS下多样性指数H比IMS的低17.2%,但D和J为SS>IMS,分别比IMS的高93.6%和45.1%;IMS下大豆的多样性指数H、D、J和SS的H、J指数均在RN下达到最高。Table 6
表6
表6玉豆套作系统下amoA基因文库多样性指数分析(2015年)
Table 6Diversity indices of amoA gene clone libraries in maize/soybean relay strip intercropping system (2015)
| 作物 Crop | 种植模式 Plant pattern | 氮处理 N treatment | amoA克隆数 Colonies | OTUs | C (%) | H’ | D | J | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 玉米 Maize | MM | NN | 53 | 7 | 96.2 | 1.3 | 0.62 | 0.32 | ||||
| RN | 51 | 12 | 88.2 | 1.6 | 0.63 | 0.40 | ||||||
| CN | 50 | 6 | 96 | 1.2 | 0.54 | 0.30 | ||||||
| IMS | NN | 49 | 8 | 93.8 | 1.2 | 0.51 | 0.31 | |||||
| RN | 52 | 11 | 96.1 | 1.3 | 0.52 | 0.33 | ||||||
| CN | 54 | 10 | 90.7 | 1.0 | 0.46 | 0.25 | ||||||
| 大豆 Soybean | SS | NN | 51 | 3 | 98 | 0.3 | 1.0 | 0.08 | ||||
| RN | 54 | 13 | 90.7 | 1.9 | 0.75 | 0.48 | ||||||
| CN | 49 | 6 | 95.9 | 0.7 | 0.38 | 0.18 | ||||||
| IMS | NN | 50 | 4 | 96 | 0.4 | 0.21 | 0.10 | |||||
| RN | 52 | 5 | 96.1 | 1.1 | 0.49 | 0.28 | ||||||
| CN | 49 | 6 | 93.8 | 0.9 | 0.4 | 0.23 | ||||||
新窗口打开
2.3.2 基因丰度 由图2可知,种植模式对玉米根际土壤的amoA基因丰度影响显著,玉米大豆共生前(V12期)为MM>IMS,平均高15.3%;玉米大豆共生后(R6期)则为IMS>MM,平均高38.5%。施氮(图3)显著增加了玉米土壤中amoA的丰度,V12时,RN的高于CN;R6时,随施氮量增加而增加,以CN的最高,但与RN差异不显著。
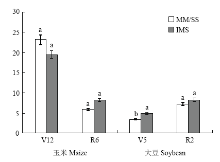 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同种植模式下根际土中amoA型氨氧化细菌群落丰度
-->Fig. 2Abundances of amoA-type denitrifiers in rhizosphere soil under different planting patterns (107copies/µL)
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同施氮量下根际土中amoA型氨氧化细菌群落丰度
-->Fig. 3Abundances of amoA-type denitrifiers in rhizosphere under different N fertilization rates (107copies/µL)
-->
大豆的aomA基因丰度随生育进程的推进而增加,与V5相比,R2期下SS、IMS的分别增加107.2%和64.8%;与SS相比,IMS促进了amoA基因丰度增加,V5和R2期下,IMS的分别增加44.5%和14.9%。各施氮水平间,玉米大豆共生(V5期)时,大豆amoA基因丰度以RN的最高;玉米收获后的R2期,amoA基因丰度则随施氮量的增加而增加,施氮比不施氮的平均高108.9%。
2.4 根际土壤反硝化细菌nirS基因丰度多样性分析
2.4.1 文库多样性 与MM(SS)相比,IMS提高了玉米的OTUs数与多样性指数H,但大豆的则相对降低(表7)。各种植模式下,施氮对玉米、大豆nirS基因的OTUs数量与多样性指数的影响规律一致,RN提高了MM下玉米根际土壤nirS基因的OTUs数和多样性指数,IMS下的OTUs数量和多样性指数则呈降低趋势;大豆在MM与IMS下均表现为RN的nirS基因文库的多样性指数低于CN。Table 7
表7
表7玉豆套作系统下nirS基因文库多样性指数分析(2015年)
Table 7Diversity indices of nirS gene clone libraries in maize/soybean relay strip intercropping system (2015)
| 作物 Crop | 模式 Plant pattern | 施氮 N-application | nirS克隆数 Colonies | OTUs | C (%) | H’ | D | J | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 玉米 Maize | MM | NN | 41 | 18 | 67.7 | 2.7 | 0.92 | 0.73 | ||||
| RN | 46 | 24 | 63.0 | 3.1 | 0.95 | 0.81 | ||||||
| CN | 42 | 20 | 80.9 | 2.9 | 0.93 | 0.78 | ||||||
| IMS | NN | 45 | 29 | 61.8 | 3.2 | 0.96 | 0.84 | |||||
| RN | 43 | 27 | 62.0 | 3.1 | 0.94 | 0.83 | ||||||
| CN | 50 | 32 | 60.3 | 3.3 | 0.95 | 0.84 | ||||||
| 大豆 Soybean | SS | NN | 50 | 26 | 67.8 | 3.2 | 0.95 | 0.82 | ||||
| RN | 42 | 21 | 68.0 | 3.0 | 0.94 | 0.80 | ||||||
| CN | 43 | 29 | 60.4 | 3.3 | 0.94 | 0.88 | ||||||
| IMS | NN | 44 | 23 | 66.7 | 3.0 | 0.94 | 0.79 | |||||
| RN | 46 | 25 | 63.6 | 2.7 | 0.95 | 0.71 | ||||||
| CN | 41 | 27 | 61.0 | 3.2 | 0.95 | 0.86 | ||||||
新窗口打开
2.4.2 基因丰度 玉米根际土壤反硝化基因(nirS)丰度在共生前后均表现为IMS>MM,V12期,IMS的比MM的高25.0%;R6期,IMS的比MM的高84.8%;且随生育时期的推进而增加,MM与IMS下,R6期的比V12期的分别高21.2%和79.25%(图4)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同种植模式下根际土中nirS型反硝化细菌群落丰度
-->Fig. 4Abundances of nirS-type denitrifiers in rhizosphere under different planting patterns (108copies/µL)
-->
玉米大豆共生前后,各施氮处理间的nirS基因丰度随施氮量的增加而增加,以CN最高;玉豆共生后的R6,RN的比NN和CN的分别低7.5%和30.7%(图5)。各模式下大豆根际土壤nirS基因丰度随生育时期的推进而降低,与V5相比,R2期的nirS基因丰度降低了72.8%和65.7%。玉米大豆共生前后,施氮显著提高了大豆根际土壤中反硝化细菌nirS基因丰度,以CN最高;玉豆共生后的R2期,RN的nirS基因丰度比NN和CN的分别降低13.7%和74.0%。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5不同施氮量下根际土中nirS型反硝化细菌群落丰度
-->Fig. 5Abundances of nirS -type denitrifiers in rhizosphere under different N fertilization rates (108copies/µL)
-->
2.5 植株吸氮量、土壤含氮量与基因多样性指数的相关性分析
对玉米、大豆土壤总氮含量、植株吸氮量与根际土壤细菌多样性指标进行相关分析,结果表明(表8),玉米土壤总氮含量、植株吸氮量与amoA和nirS基因的物种丰度呈正相关,玉米土壤amoA基因多样性参数H、D、J与土壤总氮含量呈负相关关系,与植株吸氮量为正相关,二者均达到显著水平。玉米土壤nirS基因的H、D、J与土壤总氮含量、植株吸氮量正相关,其中与土壤氮含量达到显著或极显著水平。Table 8
表8
表8土壤氮含量、植株地上部吸氮量和aomA和nirS基因相关性
Table 8Correlation coefficients between soil total N content, shoot N uptake and aomA, nirS gene
| 基因类型 Gene type | 氮处理 N treatments | S | H | D | J | ||||
|---|---|---|---|---|---|---|---|---|---|
| Maize | Soybean | Maize | Soybean | Maize | Soybean | Maize | Soybean | ||
| amoA | 土壤氮含量 Soil N content | 0.286 | -0.474 | -0.190 | -0.948* | -0.051 | -0.771 | -0.203 | -0.987** |
| 植株吸氮量 Shoot N uptake | 0.582 | -0.404 | 0.181 | -0.729 | 0.539 | -0.943** | 0.010 | -0.673 | |
| nirS | 土壤氮含量 Soil N content | 0.786 | -0.137 | 0.926** | 0.876* | 0.917* | 0.921** | 0.881* | 0.863* |
| 植株吸氮量 Shoot N uptake | 0.548 | -0.419 | 0.593 | 0.515 | 0.600 | 0.556 | 0.644 | 0.489 | |
新窗口打开
大豆土壤中总氮含量、植株吸氮量与amoA、nirS基因物种丰度呈负相关关系。大豆的amoA基因的H、D、J与土壤氮含量、植株吸氮量为显著或极显著负相关关系。nirS基因的H、D、J指标与土壤氮含量为显著或极显著正相关,与植株吸氮量相关不显著。
3 讨论
3.1 不同种植模式和施氮水平对根际土壤细菌数量的影响
土壤微生物是土壤肥力的重要参考依据,其数量、丰度与作物生长和土壤养分循环有紧密联系,但其影响因素众多。雍太文等[4]研究表明,套作和大豆茬口效应提高了土壤中微生物数量。孟庆英等[11]发现,施用控释肥可以增加土壤中微生物数量;张向前等[5]的研究表明无论施肥与否,间作可以显著增加土壤中细菌、真菌、放线菌数量。本研究中,套作与施氮提高了玉米、大豆微生物数量。与MM(SS)相比,IMS土壤中细菌在各施氮水平下有增加,总体为IMS>MM(SS),施氮>不施氮。玉米、大豆土壤中各微生物在共生期受套作影响较大。其中,玉米与大豆共生前根际土壤中的细菌数量为MM(SS)>IMS,共生后为MM(SS)<IMS;大豆在共生期土壤中细菌呈降低趋势,到成熟期解除共生关系后有所增加。分析其原因一是玉米、大豆自身各时期根系分布和分泌物不同[35],在单套作和施氮水平下受到土壤硝化-反硝化作用影响程度不同;二是套作下作物根系的交互作用[36]。套作能促进作物根系生长和活力,增强对土壤中养分和水分的吸收[4],刺激根系分泌物增加[4],调节微生物生长环境,从而提高IMS下玉米细菌和大豆细菌数量;另外,施氮增加了土壤中氮营养,满足微生物生长所需要的氮源,促进微生物数量增加,并增强土壤有机氮向无机氮的转化,加剧玉米、大豆共生期间的养分竞争,降低土壤氮浓度,促进大豆根瘤固氮。3.2 氨氧化细菌和反硝化细菌对套作系统氮高效利用的调控机理
土壤中的氮需要转化成无机态氮才能为作物所吸收,经过长期的定位研究,前期结果发现[24],减量施氮能够提高套作体系玉米、大豆土壤的硝化作用,降低氨化作用强度,保证作物对NO3--N离子的吸收,减轻NH4+-N挥发,还能提高玉米、大豆土壤的固氮作用强度,并指出土壤中氮素转化受土壤微生物的调控。本研究中通过施氮量和套作来影响玉米、大豆土壤中参与土壤氮转化的氨氧化细菌和反硝化细菌的多样性因子来调节各个作物土壤氮素转化过程,即协调土壤氮素转化相关细菌的关键基因表达,使土壤氮素转化向更有利于作物氮素吸收的方向进行。氨氧化细菌作为硝化作用的起始步骤,经氨单加氧酶催化将氨氧化成羟胺使土壤中NH4+和NO3-的相对含量发生改变,影响土壤中氮素含量和作物氮素吸收[14],玉米在硝化作用起始阶段始终占据优势地位[37]。研究中套作和减量施氮对玉米、大豆作物根际土壤中amoA基因多样性具有促进作用,玉米大豆共生后文库多样性和基因丰度均显著提高,IMS>MM(SS),施氮>不施氮,以RN下达到最高,这与前人研究[38]结果相似。减量施氮通过提高玉米、大豆土壤中AOB细菌多样性的增加,增强硝化作用强度,调节土壤中无机态氮相对含量,使植株吸氮量得到增加,从而促进作物氮素的吸收;但是由于大豆受套作系统内部玉米对氮素竞争的影响,导致大豆植株吸氮量出现降低。
套作和增加施氮能提高玉米、大豆土壤中反硝化细菌多样性,促进土壤中反硝化细菌的生长,增强土壤反硝化作用强度[39]。本研究中减量施氮提高了单作玉米nirS基因多样性指数,降低了大豆和套作玉米nirS基因的多样性指数;基因丰度均以套作的较高,且R6期玉米的nirS基因丰度增长速度比单作的快;套作大豆在共生阶段V5期的nirS基因丰度降低,但在R2期则为IS>SS。推测其原因可能是套作系统中土壤中硝酸盐、亚硝酸盐含量增加,刺激、促进了反硝化细菌的生长,使土壤中nirS基因拷贝数较单作增加。此外,玉米大豆共生时,作物间的竞争关系、生态位差异[27]及根系分泌物主导的选择性压力调节等也对nirS基因丰度产生调控作用;玉米、大豆共生前,玉米根际土壤nirS基因丰度随施氮量的增加而增加,共生后,减量施氮进一步调节玉米、大豆根际土壤中反硝化细菌生长环境,降低基因丰度,成熟期以减量施氮处理下基因丰度达到最低。玉米大豆套作系统土壤中反硝化细菌多样性变化对土壤氮素的影响表现为,一方面亚硝酸还原酶将硝酸盐降解为NO和NH3,会造成土壤氮素损失,这与前期研究发现施氮增加土壤中反硝化作用强度,提高土壤氮损失规律一致[24]。另一方面,土壤中亚硝态氮的积累减少可以减轻对植物体的自身毒害,降低土壤因高浓度氮对大豆根瘤固氮的遏制作用,并有利于大豆固氮向玉米转移,促进玉米植株吸氮量的增加。
4 结论
种植模式和施氮水平对玉米/大豆套作系统下作物氮素吸收及根际土壤氮素转化细菌多样性影响显著。套作相对单作提高了玉米植株吸氮量和玉米土壤总氮含量,降低了大豆植株吸氮量和大豆土壤总氮含量;套作体系上的玉米和大豆根际土壤细菌数量显著增加,并提高了玉米根际土壤中氨氧化细菌、反硝化细菌的多样性指数和基因丰度,降低大豆根际土壤中反硝化细菌物种多样性。与常量施氮相比,减量施氮有利于提高玉米、大豆植株和土壤总氮含量,增强玉米、大豆共生期间的土壤硝化作用,减弱土壤反硝化作用,促进玉米-大豆套作系统下作物对氮素的吸收利用,减少土壤氮素损失。The authors have declared that no competing interests exist.
