0 引言
【研究意义】黑素体成熟需要经历四个连续的形态变化时期(I期,II期,III期和IV期),它是参与黑色素合成、储存和运输特有的膜包围细胞器。黑色素合成包含一系列的氧化转化过程,酪氨酸经过几种醌中间体成为一个复杂的生物聚合物[1],这种聚合物由真黑素(黑色和棕色)和褐黑素(红色和黄色)组成。到目前为止,有150多个色素沉着相关的基因已经被确定,TYR、TYRP1 和TYRP2这些酶在黑素体中合成被人所熟知[2],然而在黑素体生物合成中其它一些结构蛋白的作用还不清楚,其中包括黑素体特异性结构蛋白GPNMB[1]。研究GPNMB在黑色素细胞对MITF下游相关毛色基因的影响,可为进一步弄清GPNMB对黑色素生成的机制奠定基础。【前人研究进展】GPNMB最初从低转移性黑素瘤细胞中克隆而来[3],是被定位于细胞表面和溶酶体膜的一种I型跨膜糖蛋白。相关资料报道,GPNMB也被命名为树突状细胞乙酰肝素整合素配体(DC-HIL)[4],骨激活素(OA)[5]以及造血生长因子诱导的神经激肽I型(HGFIN)[6]。它由三个结构域组成, 包括一个长的胞外结构域(ECD)、一个单独的跨膜结构域和一个相对较短的胞质尾区[7]。其中ECD具有GPNMB粘附所需的精氨酸-甘氨酸-天冬氨酸(RGD)结构域[4,8]和多囊肾(PKD)结构域,其功能在GPNMB是未知的[9]。TOMIHARI等[8]发现GPNMB与黑素体蛋白PMEL-17(也称PMEL[9])重要的氨基酸同源,它的胞外结构域包含结合整合素的RGD结构域,以及它的胞内结构域有一个公认的内涵体和/或黑素体分选结构域,这些特性有助于黑色素细胞与角质形成细胞粘附。有趣的是SELIM 等[10]也发现GPNMB作为细胞粘附分子、细胞表面受体、黑素体蛋白以及可溶性配体起作用。MITF是碱性螺旋-环-螺旋亮氨酸拉链蛋白家族的成员,除了与CACGTG序列的E-盒子结合外,还优先与CATGTG序列5′或3′有T碱基的E-box结合[11]。它直接调控相关色素基因的转录,包括TYR、TYRP1[12]、TYRP2(DCT)、QNR-71[13] (也称GPNMB[3])、PMEL-17[14]、AIM1[15]和OA1[16]等。GPNMB和Tyrp1基因突变可以引起DBA/2J小鼠的脱色素虹膜疾病[17]。RIPOLL等[18]认为,GPNMB启动子上MITF-结合位点(M-盒子)在不同哺乳动物物种是保守的,并且MITF过表达增加了基底层细胞和破骨细胞分化期间的GPNMB表达。最新研究报道,ZHANG等[19]在MITF无关的条件下发现,沉默GPNMB可抑制黑色素细胞中黑色素体的形成。GUTKNECHT等[20]利用MITF活性小分子抑制剂处理单核细胞源性树突状细胞降低了GPNMB 的mRNA和蛋白水平,表明GPNMB的表达由MITF激活促进。ONO等[21]发现Na +/ K+-ATP(NKA)是GPNMB胞外结构域的一种新型受体,通过NKA酶激活PI3K/ Akt和MEK / ERK信号通路,对神经有一定的保护作用。【本研究切入点】有研究表明,GPNMB是独特的黑素体蛋白,未表明与任何形式的白化病相关[22]。GPNMB对PMEL和TYR等的表达也有一定的影响[19]。迄今为止GPNMB在小鼠黑色素细胞调控MITF下游相关毛色基因影响色素生成的相关研究未见报道。那么GPNMB的表达如何调控MITF下游基因影响色素的生成以及产生什么样的变化目前尚不清楚。【拟解决的关键问题】利用细胞转染技术在小鼠黑色素细胞中过量表达GPNMB,研究GPNMB过量表达后对MITF下游相关毛色基因表达及对色素生成的影响。1 材料与方法
试验于2015年6月至2016年2月在山西农业大学羊驼生物工程实验室完成。1.1 试剂
黑色素细胞培养基(ScienCell,美国)、0.25%胰酶(solarbio,北京)、 RIPA裂解液(碧云天)、TRIZOL(Invitrogen,美国)、反转录 PCR试剂盒(TaKaRa,大连)、qRT- PCR kit(TaKaRa,大连)、GPNMB、MITF兔多克隆抗体(三鹰,武汉)TYR、TYRP1、TYRP2兔多克隆抗体(abcam,艾博抗上海)、OA1兔多克隆抗体(Santa Cruz)、eECL Western Blot Kit(康为世纪公司)。T-Vector pMDTM19 (Simple)、T4 DNA Ligase(TaKaRa,大连)。1.2 材料
C57BL/6J小鼠黑色素细胞5代,慢病毒载体pLV.Des3d.P/Puro(山西农业大学羊驼生物工程实验室提供)。
1.3 试验方法
1.3.1 小鼠GPNMB核酸序列检索和目的基因克隆 在NCBI中找出小鼠GPNMB mRNA的CDS区的核酸序列。利用Premier 5.0软件设计全长引物(华大基因合成),并进行PCR扩增,产物电泳结束后切下目的条带,送华大基因公司进行测序。1.3.2 小鼠GPNMB克隆载体和真核表达载体构建 GPNMB克隆载体构建:取Enzyme Solution(Solution I)5 μL,目的基因PCR胶回收产物4 μL,T-Vector pMD19(Simple)1 μL。混匀后在PCR仪中16℃过夜连接。冰浴上融化DH5α感受态细胞,取50 μL,将10 μL连接液加入其中,冰浴后金属浴热击处理进行转化。将AMP 40 μL、X-gal 40 μL、IPTG 32 μL加到LB固体培养基板表面,均匀涂布并晾干,每板涂转化后的感受态细胞80 μL,37℃培养12—16h。次日进行挑菌,37℃摇床200 r/min中培养12—16h后提取质粒,送华大基因公司测序确定克隆载体是否构建成功。
真核表达载体构建:载体双酶切后回收的目的基因产物5 μL;表达载体产物4 μL;T4 DNA Ligase 1 μL。混匀后PCR仪中16℃过夜连接;其余操作同克隆载体链接。
1.3.3 黑色素细胞转染 黑色素细胞复苏后,待细胞生长到占六孔板面积60%—80%且为正常细胞,进行转染,设置1.0、3.0、5.0 μg DNA组(每孔的量)和空载组。首先,将200 μL不含血清双抗的培养基稀释7.5 μL转染试剂(X-tremeGENE HP DNA Transfection Reagent),混匀,室温静置5 min。其次,将1.0、3.0、5.0 μg DNA组分别加入上混合液中,混匀,室温静置15 min。最后,将上述混合物加到含有1 mL新鲜培养基的培养板中且补足2 mL。37℃培养56 h,提取总蛋白和RNA进行测定。
1.3.4 黑色素含量测定 每组黑色素细胞用0.25%胰酶消化后收集,PBS冲洗2—3次,细胞计数后用0.2 mol·L-1 NaOH溶解黑色素细胞,使用475 nm波长的分光光度计进行检测,每组至少重复3次。
1.3.5 Real-time PCR检测 根据Genebank上小鼠的GPNMB、MITF、OA1、TYR、TYRP1、TYRP2和PMEL序列并利用Premier 5.0软件设计Real-time PCR扩增引物,并通过NCBI初步检测引物的特异性。引物由北京华大基因公司合成。引物序列和产物长度如表1。
Table 1
表1
表1目的基因引物序列及 PCR 扩增条件
Table 1Sequence of premiers and conditions for PCR amplification
| 基因 Gene | 引物序列 Sequence of premier (5′-3′) | PCR产物 PCR production (bp) | 温度 Temperature (℃) |
|---|---|---|---|
| GPNMB MITF OA1 TYR TYRP1 TYRP2 PMEL β-Actin | F:GGGCATACATTCCCATCTCG R:AGTGTTGTCCCCAAAGTTCCA F:AGGACCTTGAAAACCGACAG R:GTGGATGGGATAAGGGAAAG F:ATCAGGGCGTCGATCTGTTG R:AGCAGGCCAAATGTCTGTTG F:ACTTACTCAGCCCAGCATCC R:AGTGGTCCCTCAGGTGTTCC F: CTTGGAGGTCCGTGTATTTG R: GACCGCATCAGTGAAAGTGT F: CCAACGCTGATTAGTCGGA R:GAAGAAGGGAGGGCTGTCA F:GCTTGTAGGTATCTTGCTGGTG R: AGGAGCGGGCTGTTTTCT F: TTGCTGACAGGATGCAGAAG R: ACATCTGCTGGAAGGTGGAC | 215 115 193 109 223 213 171 140 | 58 58 58 58 58 58 58 58 |
新窗口打开
按照TAKARA公司荧光定量试剂盒以cDNA为模板进行扩增,待反应结束后通过2-ΔΔCT法计算GPNMB、MITF、OA1、TYR、TYRP1、TYRP2和PMEL在不同试验组小鼠黑色素细胞的相对mRNA表达水平。计算得出的Real-time PCR结果均用平均值±标准误(Means±SE)表示,试验组基因的表达量所示结果均由内参基因β-actin表达量进行校正,所有数据都使用SPSS软件进行统计学单因素方差分析检验。
1.3.6 蛋白免疫印迹试验方法 用蛋白裂解液提取黑色素细胞的总蛋白,检测蛋白的浓度,每孔上样总蛋白为300 ng进行SDS-PAGE电泳,电泳转移至NC膜,NC膜经5%脱脂奶粉于室温封闭1 h;用TBST稀释一抗MITF、TYR、TYRP1、TYRP2(1﹕1000)以及OA1(1﹕500)、β-Actin(1﹕2000),4℃过夜。次日用TBST洗膜后,二抗孵育,37℃水平摇床孵育1 h;用TBST洗膜。康为世纪公司eECL发光液(A液﹕B液=1﹕1),显色后暗室曝光,扫描分析获得的胶片。用Image-Pro Plus 6.0对目的条带进行灰度值分析,β-actin作为内参,目的蛋白半定量值=目的蛋白含量/β-actin蛋白含量(蛋白含量=目的条带面积×平均灰度),数据均用(Means±SE)表示,用SPSS软件进行统计学单因素方差分析。
2 结果
2.1 小鼠GPNMB核酸序列获取和真核表达载体构建
在NCBI中获取目的基因的CDS区,成功构建真核表达载体(图1)。表达载体构建成功后,为确保载体连接的准确性,对质粒进行了测序。在NCBI对测序结果进行BLAST,结果显示:序列为小鼠GPNMB的CDS区,大小为1 725 bp,与目的序列完全一致。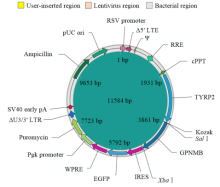 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1GPNMB真核表达载体结构
-->Fig. 1Structure of over-expressing GPNMB
-->
2.2 GPNMB在小鼠黑色素细胞的转染
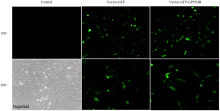
2.2.1 过表达GPNMB后黑色素细胞的形态特征 黑色素细胞接种6 h呈现贴壁伸展状态,次日呈树突状,培养时间越长突起越明显。待培养24 h后,细胞可达到75%—80%汇合,即可进行转染试验,此时细胞密集且无其他细胞污染。空载组(Vector- GFP)、试验组(Vector-GFP-GPNMB)与正常组(Control)相比形态和体积基本一致,树突无明显变化(图2)。2.2.2 黑色素细胞转染效率观察 在黑色素细胞对数生长期进行转染,结果表明,5 μg DNA/孔转染效率最高,此浓度作为转染试验选用浓度(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GPNMB对黑色素细胞形态的影响
A 为正常培养的黑色素细胞(Control)(100×);B 为正常培养的黑色素细胞(Control)(200×);C 为只转染空载体的黑色素细胞(Vector-GFP)(200×);D 为转染GPNMB的黑色素细胞(Vector-GFP-GPNMB)(200×)
-->Fig. 2The effect of GPNMB on morphology of melanocytes
A. Normal melanocytes (100×). B. Normal melanocytes (200×). C. The melanocytes transfected with empty vector (vector-GFP) (200×). D. The melanocytes transfected with GPNMB (vector-GFP-GPNMB) (200×)
-->
2.2.3 Real-time PCR和Western blot检测GPNMB在黑色素细胞系的转染效率 设计了3个试验组:正常组、空载组与试验组,选择对数生长期的细胞分别进行转染,结果表明试验组GPNMB的表达量极显著的提高(P<0.01,图4)。
2.2.4 转染后黑色素含量测定 每组黑色素细胞的黑色素含量检测结果经分析可知,空载组与正常组无显著差异,试验组黑色素含量明显增加,相对于空载组(Vector- GFP)黑色素含量增加1.34倍(P<0.01)(图5)。
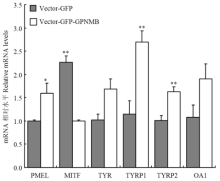
2.2.5 Real-time PCR检测转染后PMEL、MITF、TYR、TYRP1、TYRP2和OA1 的mRNA在黑色素细胞中的表达 使用Real-time PCR的方法检测GPNMB过表达对PMEL、MITF、TYR、TYRP1、TYRP2和OA1 mRNA的影响。结果表明:与空载组对比,试验组的PMEL mRNA升高1.59倍(P<0.05);MITF mRNA降低2.25倍(P<0.01);TYR mRNA升高1.65倍,变化不明显;TYRP1 mRNA升高2.35倍(P<0.01);TYRP2 mRNA升高1.60倍(P<0.01);OA1 mRNA升高1.5倍,变化不明显(图6)。由此可以得出,GPNMB过表达可以显著降低MITF的mRNA水平,显著升高PMEL、TYRP1和TYRP2的mRNA水平,但对TYR和OA1 mRNA影响不明显。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3GPNMB转染黑色素细胞的效率
Control 组为正常培养的黑色素细胞;Vector-GFP 组为只转染空载体的黑色素细胞;Vector-GFP-GPNMB组为转染GPNMB的黑色素细胞。下同
-->Fig. 3The efficiency of transfected melanocytes by GPNMB
Control group: Normal melanocytes. Vector-GFP: The melanocytes transfected with empty vector. Vector-GFP-GPNMB: The melanocytes transfected with GPNMB. The same as below
-->
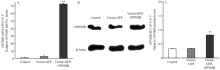 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4GPNMB转染后黑色素细胞中GPNMB mRNA水平和蛋白水平
-->Fig. 4GPNMB mRNA levels and protein level in melanocytes transfected by the GPNMB
-->
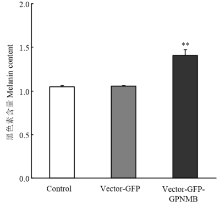 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5GPNMB转染后黑色素细胞中黑色素含量
-->Fig. 5Melanin content in melanocytes transfected with the GPNMB
-->
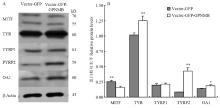
2.2.6 Western blot检测转染后MITF、TYR、TYRP1、TYRP2和OA1蛋白在黑色素细胞中的表达 通过Western blot检测GPNMB过表达对MITF、TYR、TYRP1、TYRP2和OA1蛋白的影响(图7),结果显示:与空载组对比,试验组的MITF蛋白降低1.59倍(P<0.01);TYR蛋白升高1.23倍(P<0.01);TYRP1蛋白升高1.05倍,变化不明显;TYRP2蛋白升高4.35倍(P<0.01);OA1蛋白升高1.31倍(P<0.05),由此得出,GPNMB过表达可以显著降低MITF的蛋白水平,显著升高TYR、TYRP2、OA1的蛋白水平,TYRP1蛋白水平变化不明显。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6Real-time PCR检测转染后黑色素细胞中PMEL、MITF、TYR、TYRP1、TYRP2和OA1 mRNA的表达
-->Fig. 6Real-time PCR analysis of PMEL, MITF, TYR, TYRP1, TYRP2 and OA1 expression in melanocytes transfected by the GPNMB
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7Western blot 检测转染后黑色素细胞中MITF、TYR、TYRP1、TYRP2和OA1蛋白的表达
-->Fig. 7Western blot analysis of MITF, TYR, TYRP1, TYRP2 and OA1expression in melanocytes transfected by the GPNMB
-->
3 讨论
表皮和眼部黑色素细胞以及眼睛的虹膜、睫状体、视网膜色素上皮细胞中的黑色素合成发生在黑素体内[23]。黑素体的形成经历了形态学上可界定的几个阶段,起始于含纤维基质的无色素前体,终止于管腔内充满黑色素的成熟的黑素体[24]。受MITF调控的黑素体特异性蛋白有OA1、PMEL、TYR、TYRP1、TYRP2和GPNMB等[1,16,25]。OA1编码G蛋白偶联受体位于黑素体膜,控制黑素体的成熟与大小[26]。PMEL17发生在黑素体Ⅰ期和II期作为原纤维的结构基础,以及黑色素相关合成酶TYR、TYRP1和多巴互变异构酶(DCT)富集在黑素体III期和 IV期 [27-28]。AN等[29]发现GPNMB存在于所有阶段(I—IV期)黑素体,但主要位于成熟阶段III / IV期黑素体,且对晚期黑素体有重要作用,其作用可能与黑素体的运输和/或转移到角化细胞有关[1]。GPNMB在不同种类的细胞扮演着不同的角色,但在黑色素细胞对色素生成的影响还没有深入的认识。本试验以小鼠黑色素细胞作为研究对象,对MITF下游色素相关基因表达影响色素的生成进行相关性分析,丰富了GPNMB在不同物种细胞水平表达的差异性及影响。相关研究表明GPNMB是一种糖基化的跨膜蛋白,不仅影响小鼠青光眼和人的黑色素瘤的发育[8],还与人的黑色素瘤转移能力呈负相关[3]。在小鼠色素性青光眼中,GPNMB(GPNMBR150X)基因终止密码子提前突变可引起虹膜色素分散[17]。LOFTUS等[30]发现,GPNMB-MCS3包含两个MITF保守序列位点,其位点 5′大部分缺失显著降低了增强子的活性,说明这个位点在GPNMB转录调控有重要的作用。RIPOLL等[18]通过报告基因分析得出MITF共表达反式激活GPNMB启动子,然而GPNMB M-盒子突变阻止了MITF转录。本试验通过构建小鼠GPNMB过量表达载体,利用细胞转染技术,对GPNMB通过调控MITF下游色素相关基因对黑色素的生成进行了研究。结果表明,GPNMB过量表达增加了MITF下游基因PMEL、TYR、TYRP1、TYRP2和OA1的表达;降低了MITF的表达,说明GPNMB表达与MITF无关。众所周知,在黑色素合成主要机制中,黑色素细胞刺激素(α-MSH)激活其下游信号转录因子MITF刺激相关色素基因表达。由此可知,GPNMB过量表达可能影响GPNMB上游基因来参与MITF转录。这与ZHANG等[19]发现GPNMB对PMEL、TYR等表达影响的结果相符合。上述研究说明,GPNMB作为一种I型跨膜糖蛋白,对黑素体的生成以及黑色素的生成起着重要的作用。GPNMB在黑色素细胞的表达是否受其他调控路径和/或因素的影响还需进一步深入研究。
4 结论
通过GPNMB过量表达,在黑色素细胞中检测MITF下游相关色素基因,发现过表达GPNMB使PMEL、TYR、TYRP1、TYRP2和OA1的表达水平以及黑色素的含量升高,然而MITF表达水平发生了下降。本研究表明,GPNMB可能受非MITF调控路径调节色素基因进而影响黑色素的生成,这为进一步弄清GPNMB对黑色素生成发生的机理奠定了基础。The authors have declared that no competing interests exist.
