0 引言
【研究意义】核糖体失活蛋白(ribosome- inactivating proteins,RIPs)是一类在植物中广泛存在的毒蛋白,大部分核糖体失活蛋白都来自于高等植物,也有少部分的几种来自于真菌、细菌以及藻类等[1]。RIPs作用于核糖体大亚基RNA的3′端茎环结构中一个高度保守的核苷酸区域sarcin/ricin结构域,破坏核糖体大亚基RNA的结构,使核糖体失活。RIPs发挥功能主要通过两方面,一是RNA N-糖苷酶活性,具有脱嘌呤作用,从而抑制蛋白质合成[2];二是RNA水解酶的活性,研究发现从巨曲霉(Aspergillus giganteus)中分离出来的α-sarcin蛋白是一种RNase,几乎可以水解所有生物来源的核糖体,导致核糖体失活[3]。近几年的研究已经证实,植物基因编码的RIPs在体外实验以及转基因植物中对病害都具有一定的抗性,包括广谱性的抗病毒、抗真菌以及对昆虫也有一定的抗性等[4-7]。因此,选择核糖体失活蛋白苦瓜素α-MC,研究异源表达α-MC的抗病毒功能对于防治植物病毒病有重要的理论和实践意义。【前人研究进展】目前,可以将核糖体失活蛋白分为3类[8],第1类是I型RIPs,由分子量约为30 kD的单肽链蛋白组成;第2类是II型RIPs,由一个类似I型RIPs的酶活性A链和一个稍大的凝聚素B链组成[9];第3类是III型RIPs,但此类并不常见,仅在玉米和大麦中发现[10]。商陆抗病毒蛋白PAP和苦瓜素α-MC均是I型RIPs,分子量约为29 kD。目前认为PAP是一种广谱性的抗病毒蛋白,可以抗多种植物病毒,如TMV、黄瓜花叶病毒(Cucumber mosaic virus)、苜蓿花叶病毒(Alfalfa mosaic virus)、非洲木薯花叶病毒(African cassava mosaic virus)以及花椰菜花叶病毒(Cauliflower mosaic virus)等[11]。对动物病毒如巨细胞病毒(Cytomegalovirus)、流感病毒(Influenza virus)、脊髓灰质炎病毒(Poliovirus)、疱疹病毒(Herpesvirus)、人体免疫缺损病毒(Human immunodeficiency virus)也有一定的抑制作用[12-13]。但早前就有研究证明,全长的PAP对植物细胞具有一定的毒性,将克隆的PAP导入烟草,转基因烟草出现明显的生理变化,表现为矮化,叶片斑点及不育[14]。α-MC生物学活性包括rRNA N-糖苷酶活性、RNA水解酶活性、DNA水解酶活性、抗肿瘤活性以及抗病毒活性等[15-16]。植物被病原物入侵时,能够通过植物抗性基因产物和病原菌无毒基因的互作识别病原菌,同时激活局部和系统抗性反应[17]。RIPs可能参与植物这一防御反应的过程,从而对植物病毒具有一定的抗性。例如,已报道的在转基因植物中商路抗病毒蛋白能够引起PR蛋白的表达[18]。【本研究切入点】ZHU等[19]研究发现从苦瓜籽提纯的α-苦瓜素在浓度为0.5 mg·mL-1时对植物病毒具有明显的抑制作用,对玉米、小麦上的病原真菌也有潜在的抗性,提纯的苦瓜素可作为一种农作物保护药物抵抗植物病害。但若将苦瓜素开发成农药,仅从苦瓜籽中提取苦瓜素,明显无法满足生产需求,转基因异源表达α-MC可以提供丰富的α-MC,而目前对于异源表达α-MC对TMV的抗性效果和机制尚不明确,且α-MC在植物中的细胞定位及其表达后对植物细胞的影响还不确定。【拟解决的关键问题】在本氏烟中异源表达α-MC、PAP,明确二者亚细胞定位情况,并观察异源表达α-MC是否与PAP一样引起植物的细胞死亡;分析在本氏烟中异源表达的α-MC是否具有抗病毒作用,并明确其抗病毒机理,为更好地开发利用核糖体失活蛋白控制植物病毒病提供参考依据。1 材料与方法
试验于2015—2016年在西南大学植物保护学院植物病毒研究室完成。1.1 材料
1.1.1 菌株与质粒 供试大肠杆菌DH5α购自北京全式金生物技术有限公司;根癌土壤农杆菌株EHA105由笔者实验室保存;植物表达载体pPZP- RCS1、中间载体pSAT6-DsRed2-N1由美国纽约州立大学石溪分校Vitaly教授赠送;植物表达载体pCV-mGFP-C1由浙江省农业科学院陈剑平研究员实验室馈赠;烟草花叶病毒荧光标记载体TMV-GFP(pSPDK661)由清华大学刘玉乐教授实验室馈赠;供试本氏烟,在温室育苗盆中播种,培养至4—6叶期备用。1.1.2 试剂与引物 植物总RNA提取试剂盒购自北京艾德莱生物科技有限公司;DNA纯化回收试剂盒和质粒提取试剂盒购自天根生化科技(北京)有限公司;反转录试剂盒、高保真Ex TaqTM DNA聚合酶、T4 DNA连接酶购自大连宝生物工程公司;T-载体试剂盒购自普洛麦格(北京)生物技术有限公司;限制性内切酶购自NEB公司。
1.2 方法
1.2.1 RT-PCR获得目的基因 利用植物总RNA提取试剂盒,从美洲商陆叶片和苦瓜叶肉提取总RNA,根据已报道的商陆抗病毒蛋白PAP基因全序列(登录号X55383)和苦瓜素基因全序列(登录号X57682.1),设计并合成扩增PAP和α-MC基因全序列引物,引物序列如表1,使用反转录试剂盒合成cDNA第一条链,进行PCR反应:95℃预变性4 min,进入循环94℃ 30 s,58℃ 40 s,35个循环;72℃ 1.5 min,共35个循环,72℃延伸10 min,16℃结束反应,扩增产物经DNA纯化回收试剂盒纯化后连接T载体克隆,挑取阳性单菌落测序分析。1.2.2 植物表达载体构建 提取测序正确的阳性克隆质粒,质粒经限制性内切酶Bgl II、Sal I和BamH I、Sal I双酶切后割胶回收基因组片段,将酶切后的PAP片段插入经Bgl II和Sal I双酶切的pSAT6-DsRed2-N1载体中,酶切后的α-MC片段插入经BamH I、Sal I双酶切的pCV-mGFP-C1的载体中。转化大肠杆菌DH5α感受态细胞,挑取阳性单菌落进行PCR验证并测序,试剂盒提取质粒得到pSAT6-PAP-DsRed2和pCV-α-MC-mGFP重组质粒。测序成功的重组质粒pSAT6-PAP-DsRed2用单酶切酶PI-PsP I切下表达框,插入经PI-PsP I酶切并去磷酸化后的植物表达载体pPZP- RCS1上,克隆后PCR鉴定并提取质粒酶切鉴定是否构建成功,由此构建植物表达载体pPZP-PAP-DsRed2。
Table 1
表1
表1RT-PCR扩增目标基因序列引物
Table 1Primer sequences used in reverse transcription PCR for amplifying target gene
| 基因名 Gene | 上游引物 Forward primer sequences | 下游引物 Reverse primer sequences |
|---|---|---|
| PAP | CTCAGATCTCGATGAAGTC GATGCTTG (Bgl II) | ACCGTCGACTGAATCCTTC AAATAG (Sal I) |
| α-MC | CGCGGATCCATGAGTAGAT TCTCAGTTC (BamH I) | ACGCGTCGACGTAGCTCGA AAAGCCAT (Sal I) |
新窗口打开
1.2.3 农杆菌转化 从-80℃冰箱取出保存的EHA105菌株,划线平板,挑选单菌落接种于无抗生素的YEP液体培养基中摇菌12—16 h,CaCl2法制备感受态细胞。参考刘兆明等[20]方法,将pPZP-PAP-DsRed2和pCV-α-MC-mGFP以热击法转化到根癌土壤杆菌EHA105感受态细胞中,将含有pPZP-PAP-DsRed2的农杆菌菌液均匀涂布于含有100 μg·mL-1壮观霉素和50 μg·mL-1利福平的YEP固体培养基上,将含有pCV-α-MC-mGFP的农杆菌菌液涂布于含有卡那霉素和利福平的YEP固体培养基上,28℃培养48 h,观察菌落生长情况。挑取阳性单菌落进行PCR鉴定。
1.2.4 PAP和α-MC蛋白的定位观察 参考LI等[21]方法,采用根癌土壤杆菌渗入法将含pPZP-PAP-DsRed2和pCV-α-MC-mGFP的菌体用瞬时转染液悬浮并将OD600调到1.0—1.2左右,用重悬液分别浸润四叶期本氏烟,置于培养箱中培养,每个处理重复3次。浸润48—72 h即可在Zeiss LSM780共聚焦荧光显微镜下观察浸润的组织荧光。
1.2.5 α-MC对TMV的抗性检测 先用含有pCV-α- MC-mGFP的重悬液浸润本氏烟,进行预处理,48 h后再于原接种叶注射含有TMV-GFP的重悬液,以含GFP空表达载体的农杆菌重悬液预处理植物再接种TMV-GFP为阳性对照,空表达载体重悬液处理作为空白对照。注射TMV-GFP 48 h后,在紫外灯下观察TMV-GFP的移动情况,拍照记录并收集接种叶片,连续观察。利用间接ELISA法检测病毒的含量,包被液研磨叶片,离心,取上清加入ELISA板包被,洗涤后依次加入一抗、二抗,分别在37℃孵育2 h,最后加入含有邻苯二胺的底物缓冲液在37℃恒温箱避光显色,显色结束用浓硫酸终止反应。底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅进行定性或定量分析[22-23]。用酶标仪(BIO-Tek;USA)测定OD492,当OD492处理组与健康植株对照相对比值>2时,待测样品为阳性,且OD492大小与颜色深浅直接正相关从而进行定量分析。
1.2.6 RNA提取和实时荧光定量PCR 本氏烟中异源表达α-MC再接种TMV-GFP,72 h后收集接种叶片,用植物总RNA提取试剂盒提取植物叶片总RNA,RNA浓度通过酶标仪(Biotek,USA)测定,并用1.0%的琼脂糖凝胶电泳检测总RNA的完整性。用Prime ScriptTM RT reagent Kit(TaKaRa,Japan)试剂盒提供的方法将总RNA反转录成cDNA。实时荧光定量PCR使用QuantinovaTM SYBR Green PCR Kit(QIAGEN,GER)扩增,内参基因选用actin,实时荧光定量PCR所用引物列见表2,每个试验进行3次生物学重复。
Table 2
表2
表2实时荧光定量PCR引物序列检测基因的表达
Table 2Primer sequences used for quantitative real-time PCR (qRT-PCR) analysis of gene expression
| 基因 Gene | 上游引物 Forward primer sequences | 下游引物 Reverse primer sequences |
|---|---|---|
| actin | CTTGAAACAGCAAAGACC AGC | CATCCTATCAGCAATGCC CG |
| TMV-GFP | GACCTGACAAAAATGGAG AAGATCT | GAAAGCGGACAGAAACC CGCTG |
| NPR1 | TAGCGTATTGCGATGCAA AG | TAGTGAGCCTCTTGGCGA TT |
| PR1 | ATGGTCAATACGGCGAAA AC | CCTAGCACATCCAACAC GAA |
| PR2 | CAACCCGCCCAAAGATAG TA | TCCAAAAGGGCATCAAA AAG |
新窗口打开
2 结果
2.1 PAP和α-MC目的基因的克隆
用设计的PAP和α-MC特异引物,以美洲商陆叶子和苦瓜叶肉的总RNA反转录产物为模板进行PCR,产物用1%琼脂糖凝胶电泳检测,结果显示均扩增出与目的基因大小一致的条带。回收目的片段,连接至pGEM-T载体,转化大肠杆菌,筛选阳性克隆测序,序列分析显示所得基因分别为PAP和α-MC,PAP为939 bp,α-MC为861 bp。将目的基因和载体分别用相应的内切酶酶切后连接,构建分别与DsRed2和GFP融合表达的植物表达重组载体。用载体通用引物测序,结果表明目的基因成功构建入植物表达载体,分别命名为pPZP-PAP-DsRed2和pCV-α-MC-mGFP。2.2 PAP和α-MC蛋白的亚细胞定位
2.2.1 PAP和α-MC蛋白的亚细胞定位的预测 确定蛋白在细胞内的分布是揭示蛋白功能的重要环节,为了解PAP和α-MC蛋白的亚细胞定位,利用Wolf PSORT对其进行预测,结果表明PAP和α-MC均有68.5%的机率定位在细胞质膜上,还可能在内质网膜和内质网内腔有少量分布(表3)。Table 3
表3
表3PAP和α-MC蛋白的亚细胞定位预测
Table 3Subcellular localization prediction of PAP and α-MC
| 名称 Name | 细胞质膜 Plasma membrane | 内质网膜 Endoplasmic reticulum (membrane) | 内质网内腔 Endoplasmic reticulum (lumen) |
|---|---|---|---|
| PAP | 68.5% | 10% | 10% |
| α-MC | 68.5% | 55% | 10% |
新窗口打开
2.2.2 PAP和α-MC蛋白的亚细胞定位的验证 为验证核糖体失活蛋白PAP和α-MC在细胞中的定位预测,将成功构建的pPZP-PAP-DsRed2和pCV-α-MC-mGFP用热击法导入农杆菌EHA105,利用农杆菌介导的瞬时表达方法使其在本氏烟叶片中表达,48—72 h后在激光共聚焦显微镜下观察。结果显示,融合PAP- DsRed2和α-MC-GFP融合蛋白的荧光均于细胞膜上分布,PAP-DsRed2在细胞质中也有少量分布(图1),说明核糖体失活蛋白PAP和α-MC在细胞中主要定位在细胞膜上,与预测结果基本一致。在本氏烟中表达PAP 48 h后,蛋白表达部位叶片大部分坏死(图2),在共聚焦显微镜下虽可以观察到红色荧光,但只有极少数细胞完整。72 h后,表达蛋白部位叶片全部坏死,共聚焦显微镜下看不到完整表皮细胞,说明全长PAP对植物细胞具有明显毒性。在本氏烟叶片中表达α-MC 48 h后,蛋白表达部位颜色与周边出现差异,共聚焦显微镜下可以观察到完整的叶片表皮细胞;72 h后,叶片蛋白表达部位颜色没有进一步改变,仍然没有细胞崩解,表明全长α-MC对本氏烟叶片细胞没有可见毒性(图2)。因此,后续试验中可以用异源表达α-MC分析其对TMV的抑制作用。
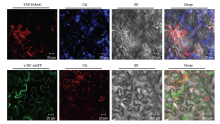 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1PAP和α-MC在本氏烟中的亚细胞定位
-->Fig. 1The subcellular location of PAP and α-MC in N. benthamiana
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2瞬时表达PAP和α-MC 48 h本氏烟的症状
-->Fig. 2Symptoms of transiently expression PAP and α-MC in N. benthamiana
-->
2.3 异源表达α-MC蛋白在本氏烟中对TMV的抑制作用
为明确在本氏烟中异源表达α-MC蛋白是否对TMV有抑制作用,先对本氏烟进行预处理,将α-MC瞬时表达48 h后,再接种TMV-GFP,在紫外灯下观察TMV-GFP的移动情况。结果显示,先注射α-MC处理后的本氏烟在接种TMV-GFP 48 h后没有任何荧光出现,而对照组出现绿色荧光。72 h后处理组开始出现零星荧光,而对照组的绿色荧光开始扩散,连续观察,处理组几乎没有变化,在接种6 d后,处理组的零星荧光有略微的扩大,而对照组的绿色荧光已经扩散至心叶(图3-A),表明异源表达α-MC蛋白对TMV具有抑制作用。为确定处理组和对照组中病毒的含量,分别采集48、72、144 h后的接种叶用间接ELISA法进行检测。结果显示,注射TMV-GFP 48 h后,处理组与健康植物的OD492比值<2,表明没有检测到病毒,而对照组的OD492比值已经达到5;72 h后,处理组才检测到病毒,而对照组与健康植物的OD492比值几乎是处理组的5倍左右;144 h后,对照组的OD492比值是处理组的10倍以上(图3-B),空白对照健康植株的OD492比值均在1左右,说明α-MC瞬时表达对TMV侵染有明显的抑制作用。为进一步验证α-MC的表达是否影响了病毒RNA的积累,采集接种TMV-GFP 72 h后的接种叶提取RNA,利用qRT-PCR检测。结果发现,对照组TMV-GFP表达量是处理组的149倍左右,达到显著水平(P<0.05),空白对照健康植株中没有检测到TMV-GFP(图3-C),说明α-MC表达后会影响病毒RNA的积累。
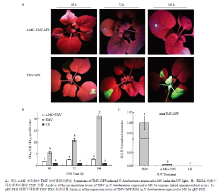 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3α-MC在本氏烟中表达对TMV的抑制作用
-->Fig. 3The effect of α-MC on inhibiting TMV in N. benthamiana
-->
2.4 防卫相关基因的表达
已有报道称转基因植物中商陆抗病毒蛋白PAP可以诱导PR蛋白的表达[18],α-MC也是I型核糖体失活蛋白。因此本试验中,为评估异源表达的α-MC与防卫相关基因之间的关系,选用NPR1、PR1、PR2 3个基因,检测接种TMV-GFP 72 h后的本氏烟中3个基因的表达量。收集接种叶,进行qRT-PCR反应,结果发现,NPR1在只注射TMV、单独表达α-MC以及表达α-MC后注射TMV的本氏烟中都被诱导表达,但后者的表达量是前两个处理的约2.5倍左右,达到显著水平(P<0.05)(图4)。在只接种α-MC和表达α-MC后注射TMV的本氏烟中检测到PR1、PR2,但后者的表达量显著高出前者5—7倍,达到显著水平(P<0.05)。与对照组相比,单独注射TMV的植物中也检测到两个基因的表达量增加。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4qRT-PCR检测α-MC预处理的本氏烟植物中NPR1、PR1、PR2的表达量
-->Fig. 4Analysis of the expression levels of NPR1, PR1 and PR2 by qRT-PCR in N. benthamiana plants pre-treated with α-MC
-->
3 讨论
苦瓜核糖体失活蛋白包括苦瓜凝集素、map30、α-苦瓜素、β-苦瓜素、γ-苦瓜素等,其中α-苦瓜素和β-苦瓜素都从苦瓜籽中分离出来,具有相似的结构和生物学特性[24-25]。研究表明,α-苦瓜素具有抗HIV、抗HSV的特性并对尖镰孢和瓜果腐霉均有抗性[4]。在本试验中,通过农杆菌介导法将α-MC在本氏烟中异源表达,接种TMV-GFP后,在紫外灯下观察TMV-GFP的移动情况,结果显示,异源表达α-MC能够抑制TMV的复制,表明可以进一步利用基因工程异源表达α-MC来满足开发利用所需。现有的研究认为苦瓜RIPs可能是通过3种机制来发挥抗病毒作用的。一是使受感染细胞自身的核糖体失活而阻止蛋白质合成引起细胞死亡,进而抑制病毒的繁殖;二是直接作用于病毒的DNA和RNA,使其丧失转运和复制功能;三是抑制与病毒复制有关的逆转录酶和整合酶的活性[26]。在本氏烟叶片中瞬时表达α-MC和PAP,发现PAP表现出强烈的细胞毒性,与前人所报道一致[14]。而α-MC对本氏烟叶片细胞没有毒性,因而α-MC应该不是通过引起细胞死亡来抑制病毒繁殖。在共聚焦显微镜下发现α-MC定位在细胞质膜,而TMV运动蛋白是内质网膜跨膜蛋白,可与病毒核酸结合形成膜-运动蛋白-病毒核酸复合体,在细胞壁附近介导病毒核酸通过细胞胞间连丝[27-29],因此,α-MC抗病毒机制可能与VANDENBUSSCHE等[30]观点类似,其在细胞膜上作用于病毒的这一复合体中的病毒核酸,抑制病毒移动。还有报道认为RIP可能作用于受侵染植物细胞的核糖体,从而抑制病毒蛋白的合成[31]。笔者在ELISA和qRT-PCR检测后发现α-MC处理的植株病毒和病毒RNA含量都非常低,这说明异源表达α-MC不但能够抑制病毒TMV蛋白质合成,也抑制RNA的复制积累。
核糖体失活蛋白也被认为是一种具有诱导系统抗性的多功能蛋白[7]。系统获得性抗性的特点是活性氧的迸发、水杨酸的积累以及病程相关基因例如PR1和PR2的表达等[32]。有研究表明,核糖体失活蛋白MAP30可通过调节病毒和肿瘤细胞的基因表达而发挥作用,上调与细胞程序化死亡直接相关的Bax、CRADD、caspase-3的表达,以干扰病毒对肿瘤细胞程序化死亡的抑制[33]。ZHU等[19]研究发现自苦瓜籽中提纯的苦瓜素喷洒本氏烟,再接种植物病毒,也会诱导防卫相关基因的表达。本试验中,在异源表达α-MC的本氏烟接种叶片中检测到NPR1、PR1和PR2的表达,且表达量远远大于对照组,说明异源表达α-MC在抑制TMV的同时也激活了植物的系统性抗性,这一系统抗性是否也抗其他植物病原的侵染有待进一步研究。
4 结论
α-MC和PAP一样均定位于植物细胞质膜。本氏烟中异源瞬时表达α-MC具有抑制TMV侵染移动的作用,同时也可诱导本氏烟产生系统抗性。The authors have declared that no competing interests exist.
