0 引言
【研究意义】昆虫在漫长的自然繁衍进程中,逐渐衍变出了复杂的信息感受机制来对外界环境作出响应,使其在取食、交配、产卵等多种行为中占据有利形势,从而能够生存下来并保持其自身种群的顺利繁衍[1],昆虫通过各种信息素来传递种间或种内信息,因此信息素对昆虫的集合、防御、觅食、产卵、交配等行为起到调控作用[2]。其中作为雌雄昆虫性行为的微量调控物质[3],昆虫性信息素又称性外激素,一般为雌虫性腺释放,雄性通过嗅觉感受和识别[4],因此在雌雄成虫之间的求偶和交配行为中发挥着重要的作用[5]。雄虫对这种性信息素的响应主要依赖其嗅觉器官(如触角)上的嗅觉感受器以及其内部相应的识别蛋白,因此研究其感受器内受体蛋白与性信息素的特异识别和结合关系,对于深入探讨昆虫性信息素的信息传递和规律具有重要的理论意义。【前人研究进展】昆虫嗅觉感受器的淋巴液中含有两种水溶性球蛋白:气味结合蛋白(odorant-binding proteins,OBPs)和化学感受蛋白(chemosensory proteins,CSPs)[6],其中OBPs根据功能差异又主要分为信息素结合蛋白(pheromone binding proteins,PBPs)和普通气味结合蛋白(general odorant binding proteins,GOBPs)[7],GOBPs一般认为主要与普通的气味分子识别有关,而PBPs是VOGT等[8]于1981年首先在雄性多音大蚕蛾(Antheraea polyphemus)触角中发现的一种能够特异结合雌性释放的性信息素蛋白;其结合过程一般认为PBPs先与脂溶性的性信息素小分子结合,随后运输至特异的嗅觉神经元信息素嗅觉受体(pheromone receptors,PRs),PRs被激活后,触发神经元引发神经冲动继而引发嗅觉反应,随后信息素分子被感器支持细胞或感器淋巴腔中的气味降解酶降解[9]。鳞翅目昆虫中广泛存在着性信息素,典型的如马尾松毛虫(Dendrolimus punctatus)的(顺,反)-5, 7-十二碳双烯基乙酸酯((Z, E)-5, 7-dodecadieny acetate)、家蚕(Bombyx mori)的(反,顺)-8, 10-十六碳双烯-1-醇((E, Z)-8, 10-Hexadecam-1-ol)以及棉红铃虫(Pectinophora gossypiella)(顺,反)-11-十六碳双烯乙酸酯((Z, E)-11-hexadecadieny1 acetate)[10]等,利用这些信息素可通过开发性诱剂来诱捕雄虫,以达到生态防控的目的。中国是世界茶树栽培和茶叶生产的主要国家之一,同时茶产业也在中国经济作物产业中重要地位。茶尺蠖(Ectropis obliqua)是危害茶树的主要害虫之一,其幼虫以茶叶为食,若幼虫危害十分严重时,有可能造成茶树嫩芽以及茶叶绝收,影响茶叶的质量以及产量,对茶叶生产带来巨大损失[11]。目前茶尺蠖的防治方法基本仍以化学防治为主,但随着茶尺蠖逐渐产生的抗药性,使化学防治效果越来越差,同时也对茶树和生态环境带来严重污染[12]。由于雌性鳞翅目昆虫广泛存在着性信息素,因此可以将其设计成诱芯来引诱和毒杀雄蛾[13]。茶尺蠖性信息素已于20世纪末由中国科学家完成了分离、鉴定以及人工合成,如(Z, Z, Z)-3, 6, 9-十八碳三烯(Z, Z, Z)-3, 6, 9-octadecatriene、(Z, Z)-6, 7-环氧-3, 9-十八碳二烯(Z, Z)-6, 7-epoxy-(Z, Z)-3, 9-octadecadien、(Z, Z, Z)-3, 6, 9-二十二碳三烯(Z, Z, Z)-3, 6, 9-docosatriene和(Z, Z, Z)-3, 6, 9-二十四碳三烯(Z, Z, Z)-3, 6, 9-teracosatriene等[14-15]。但无论是室内生物测定,还是茶园试验,引诱率均不是特别理想,故一直未能在茶园得到有效地推广[16],其中一个关键难题是茶尺蠖所属的尺蛾科尽管是鳞翅目中最大的科之一,但是与鳞翅目其他科害虫的性信息素为单一成分不同的是,尺蛾科的性信息素为多元成分的混合物组成,由于其由多双键体系的化学结构和多元混合成分组成,各种成分的作用的生物学意义很难以通过实验来判断,从而阻碍了茶尺蠖性信息素的应用和推广[17]。【本研究切入点】因此,通过研究茶尺蠖性信息素的识别和传递途径的解析,其对茶尺蠖性信息素的各种可能成分进行梳理和筛选,是最终实现茶尺蠖性信息素田间成功利用的新思路。【拟解决的关键问题】以前期笔者实验室从茶尺蠖雄虫触角中提取的cDNA为模板,克隆得到EoblPBP2目的基因,成功实现原核表达后,利用纯化后获得的EoblPBP2重组蛋白,结合竞争性荧光光谱技术探究茶尺蠖EoblPBP2与茶树挥发物以及性信息素的结合谱,为系统研究茶尺蠖的性信息素识别途径机理提供理论支持。1 材料与方法
试验于2015—2016年在中国计量大学生命科学学院生物计量及检验检疫技术浙江省重点实验室进行。1.1 材料与主要试剂
茶尺蠖雄虫触角cDNA为实验室前期保存备 用[18]。主要试剂为镍NTA琼脂糖凝胶柱、DNA凝胶回收试剂盒、质粒小量抽提试剂盒、IPTG、尿素、氨苄青霉素和EDTA等均购于生工生物工程(上海)股份有限公司;SDS-PAGE凝胶配制试剂盒购于碧云天生物技术有限公司;N-苯基-1-萘胺(N-phenyl -1-naphthylamine,1-NPN)购于TCI公司(纯度>97%);茶树挥发物质标准品购于上海百灵威化学技术有限公司(纯度均>95%);茶尺蠖主要性信息素成分(Z, Z, Z)-3, 6, 9-十八碳三烯购自漳州市英格尔农业科技有限公司。由于茶尺蠖性信息素成分为长链烯烃,疏水性强而不溶于水和醇类,因此以正己烷作为溶剂进行稀释,其他配基则均以甲醇稀释。pMD18-T载体、T4 DNA Ligase、DNA marker、限制性内切酶BamH I、Xho I购自TaKaRa公司。pET32a(+)载体以及感受态细胞DH5α和BL21(DE3)均为笔者实验室自行制备保存。其他试剂均为国产分析纯。1.2 茶尺蠖EoblPBP2基因克隆和表达载体的构建
以实验室前期得到的茶尺蠖雄虫触角cDNA为模板[18],5′-CCGGATCCATGACTAAGCTAAAGGAAC TAC-3′为上游引物,5′-TTCTCGAGCTAAGCTTCGG CCAAGACTTCAG-3′为下游引物进行PBP2的基因扩增。最终得到的PCR扩增产物进行1%琼脂糖凝胶电泳检测。将目的分子量位置的明亮条带割胶回收,与pMD18-T克隆载体在16℃的反应条件下连接过夜。经菌液PCR鉴定后进行测序。测序成功的pMD18-T/EoblPBP2质粒和表达载体pET-32a(+)经限制性核酸内切酶BamH I、Xho I进行双酶切,37℃反应1 h。经计算后,将载体片段与目的片段以1﹕3的摩尔比加入到PCR管中,16℃连接30 min。将连接产物全部转入大肠杆菌DH5α感受态细胞中,鉴定为阳性的克隆送于上海桑尼公司测序。1.3 茶尺蠖EoblPBP2重组蛋白的诱导表达及分离纯化
将测序验证后的pET32a/EoblPBP2表达质粒转化入大肠杆菌(Escherichia coli)BL21(DE3)感受态细胞中,在氨苄抗性的LB培养基平板中挑选单菌落,并进行PCR验证。挑选阳性克隆菌按1﹕100(V/W)的比例接种于10 mL氨苄抗性的LB液体培养基中。翌日以1﹕50(V/W)的比例将过夜活化的菌液接种至200 mL LB培养基中(含50 μg·mL-1氨苄青霉素),摇床振荡培养3 h左右利用紫外分光光度计检测OD值。当OD600值达到0.8左右时,取1 mL菌液作为对照,向剩余菌液中加入IPTG使其终浓度达到1 mmol·L-1,12% SDS-PAGE凝胶电泳检测目的蛋白所处的位置是上清或包涵体以此确定重组蛋白的表达形式。将确定表达形式的液体全部移至镍NTA琼脂糖凝胶柱,用含有不同浓度咪唑的上清缓冲液洗脱,并用SDS-PAGE检测并确定目的蛋白所在洗脱管。将含有EoblPBP2重组蛋白的洗脱液全部转移至透析袋内,在PBS缓冲液(pH 7.4)中4℃透析72 h,将最终得到的重组蛋白利用酶标仪测定浓度,并以PBS缓冲液稀释至终浓度为1 μmol·L-1。1.4 茶尺蠖EoblPBP2重组蛋白的配基结合试验
用岛津RF-5301 PC分子荧光光度计测试EoblPBP2重组蛋白和1-NPN相互作用以确定1-NPN能否作为荧光竞争试验的报告子。取3 mL 1 μmol·L-1的EoblPBP2重组蛋白溶液于石英比色皿中。扫描时激发波长设定为290 nm,发射与激发狭缝为5 nm,逐次加入1 mmol·L-1的1-NPN溶液,每次反应2 min,并进行光谱扫描,直至随着1-NPN的加入,EoblPBP2重组蛋白荧光强度不再上升,记录此时1-NPN的浓度以及荧光强度。根据Scatchard方程进行线性化光谱数据[19]。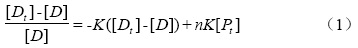
式中,[Dt]为EoblPBP2重组蛋白与1-NPN混合体系中加入的1-NPN总浓度,[D]为体系中未结合的1-NPN浓度,K为EoblPBP2重组蛋白与1-NPN的结合常数,n为EoblPBP2重组蛋白与1-NPN的结合位点数,[Pt]为试验中EoblPBP2重组蛋白的浓度。
采用1-NPN作为荧光报告子,扫描时激发波长为290 nm,发射与激发狭缝分别为5 nm,逐次向1-NPN与EoblPBP2重组蛋白混合液中加入浓度为10 mmol·L-1的茶树挥发物质以及性信息素,充分反应2 min,记录相应的荧光发射光谱与荧光强度,并利用公式(2)计算每种配基的解离常数[20]。
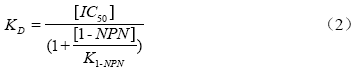
式中,KD为各种配基的解离常数,[IC50]为1-NPN荧光强度降至50%时加入的各配基的浓度,[1-NPN]为反应平衡时体系中游离的1-NPN的浓度,K1-NPN为EoblPBP2重组蛋白与1-NPN进行结合试验时的解离常数。
2 结果
2.1 茶尺蠖EoblPBP2序列分析
EoblPBP2的测序结果已提交至NCBI注册,序列号为KX421383。经PCR扩增得到的EoblPBP2全长如图1所示。其氨基酸序列显示于核苷酸序列下方。茶尺蠖PBP2基因全长492 bp,其可编码163个氨基酸,蛋白相对分子质量为15.9 kD,等电点为4.983,其中含有6个保守的半胱氨酸(Cys)(图1圆圈标注)。其氨基酸残基中含有16个带正电的氨基酸,24个带负电的氨基酸,48个疏水性氨基酸,28个极性氨基酸。利用SignalP 4.1预测EoblPBP2蛋白的信号肽,发现其含有明显的信号肽(图1长框标注),信号肽切割位点位于多肽链N端第21与22位氨基酸(VQS-SQ)之间。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1EoblPBP2核酸序列及其氨基酸序列
-->Fig.1Nucleotide and amino acid sequence of EoblPBP2
-->
利用Mega 7.0软件[21]的邻接法(neighbour-joining,NJ)对EoblPBP2氨基酸序列进行系统进化树的构建(图2)。进化树结果表明,EoblPBP2与桑青尺蠖(Ascotis selenaria cretacea)PBP2的亲缘关系 最近,与其余昆虫的PBPs或OBPs亲缘关系均较远。且与EoblPBP2亲缘关系较近的序列几乎均为PBPs,由此可以明确EoblPBP2为茶尺蠖PBPs家族成员。
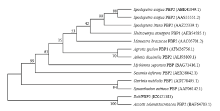 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2EoblPBP2与其他昆虫气味结合蛋白的系统进化树分析(邻接法) Ascotis selenariacretacea:桑青尺蠖;Spodopetra exigua:甜菜夜蛾;Spodoptera litura:斜纹夜蛾;Helicoverpa armigera:棉铃虫;Mamestra brassicae:甘蓝夜蛾;Mythimna separata:水稻黏虫;Athetis dissimilis:双委夜蛾;Agrotis ipsilon:小地老虎;Sesamia inferens:水稻大螟;Synanthedon exitiosa:桃透翅蛾;Ostrinia nubilalis:玉米螟
-->Fig.2The neighbor-joining (NJ) tree of EoblPBP2 with odorant-binding proteins from other insect species
-->
2.2 茶尺蠖EoblPBP2重组蛋白的表达以及分离纯化
对含有pET32/EoblPBP2重组表达质粒的大肠杆菌BL21(DE3)菌株进行培养和诱导,结果表明,EoblPBP2重组蛋白在上清(泳道3)与包涵体(泳道4)中均有表达,因此采用上清进行蛋白的纯化分离。将上清液全部移至镍NTA琼脂糖凝胶柱,用含有不同浓度咪唑的上清缓冲液洗脱杂蛋白。泳道10为纯化后的重组蛋白(图3)。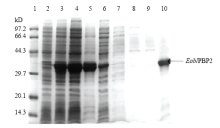 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3EoblPBP2重组蛋白的分离纯化M:蛋白分子量标准Standard protein marker;1:未诱导对照组Control group without induction;2:诱导表达产物Expressed products with induction;3:上清蛋白Proteins in bacterial supernatant;4:包涵体蛋白Proteins in bacterial inclusion;5:第一次过柱后的洗脱液Supernatant of expression product after the first operation of affinity column;6—9:不同浓度梯度PBS洗脱的杂蛋白Different concentrations contaminating proteins eluted with PBS;10:EoblPBP2重组蛋白Recombinant protein of EoblPBP2 in high concentration
-->Fig. 3Separation and purification of recombinant protein EoblPBP2
-->
2.3 茶尺蠖EoblPBP2重组蛋白配基结合试验
图4为随1-NPN浓度的增加,EoblPBP2重组蛋白在420 nm处的荧光强度多项式曲线拟合图,其相关系数为0.9970。根据Scatchard方程对光谱数据进行线性回归处理,得到的线性拟合相关系数为0.9846,相关性较好,通过计算可得1-NPN的解离常数K1-NPN为5.24 μmol·L-1,结合位点数n为0.9340。由此可证明1-NPN与EoblPBP2重组蛋白结合良好,能够作为后续EoblPBP2荧光竞争结合试验的报告子。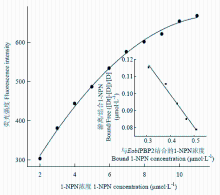 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4EoblPBP2重组蛋白与1-NPN的结合曲线
-->Fig. 4Binding curve of EoblPBP2 recombinant protein and 1-NPN
-->
选择9种茶树挥发物质[18,22]和1种茶尺蠖性信息素进行荧光竞争性结合试验。将1-NPN作为荧光报告子,逐次向1-NPN与EoblPBP2蛋白混合液中加入10 mmol·L-1的配基,充分反应2 min,扫描时激发波长为290 nm,发射与激发狭缝为5 nm。结果如图5所示,10种配基均能将1-NPN与茶尺蠖EoblPBP2重组蛋白的混合体系于420 nm处的相对荧光值降至50%以下。其中,邻苯二甲酸二丁酯、苯乙醛、β-紫罗兰酮、癸醛、反-2-癸烯醛与EoblPBP2重组蛋白的结合能力较强。5种茶树挥发物中,β-紫罗兰酮的结合能力最强,其解离常数KD值为7.923 μmol·L-1,其次为邻苯二甲酸二丁酯,KD值为14.830 μmol·L-1。茶尺蠖性信息素成分之一的(Z, Z, Z)-3, 6, 9-十八碳三烯虽能使相对荧光强度降至50%,但是其[IC50]浓度以及解离常数均大于上述5种物质,其与EoblPBP2重组蛋白的结合能力较这5种物质弱。10种配基的[IC50]浓度与解离常数见表1。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5配基与EoblPBP2重组蛋白和1-NPN的竞争结合曲线
-->Fig. 5Competition and bound of ligands with 1-NPN and recombinant protein EoblPBP2
-->
Table 1
表1
表1配基与EoblPBP2重组蛋白和1-NPN的荧光竞争试验
Table 1Competition and bound of ligands with 1-NPN and recombinant protein EoblPBP2
| 化学配基 Chemical ligand | 最大竞争力 Maximum competition (%) | IC50 (μmol·L-1) | 解离常数KD Dissociation constant (μmol·L-1) |
|---|---|---|---|
| (Z, Z, Z)-3, 6, 9-十八碳三烯 (Z, Z, Z)-3, 6, 9-Octadecatriene | 40.742 | 285.13 | 172.591 |
| β-紫罗兰酮β-ionone | 20.450 | 13.09 | 7.923 |
| 邻苯二甲酸二丁酯 Dibutyl phthalate | 45.927 | 24.5 | 14.830 |
| 反-2-癸烯醛 E-2-decenal | 25.804 | 43.94 | 27.597 |
| 癸醛 Decanal | 20.985 | 46.37 | 28.068 |
| 苯乙醛 Bhenylacetaldehyde | 31.490 | 50.17 | 30.368 |
| 柠檬烯 Cinene | 47.471 | 92.01 | 55.694 |
| 反-2-己烯醛 E-2-hexenal | 35.514 | 122.44 | 74.114 |
| 1-戊烯-3-醇 1-Penten-3-ol | 38.716 | 232.76 | 140.891 |
| 苯甲醇Benzyl alcohol | 49.410 | 381.43 | 230.880 |
新窗口打开
3 讨论
本研究以前期从茶尺蠖触角中提取的总RNA反转录得到的cDNA第一链为模板,进行PCR扩增,克隆得到了一个茶尺蠖PBP2基因。该基因全长492 bp,编码163个氨基酸。荧光竞争性结合试验表明,10种配基均能将1-NPN与茶尺蠖EoblPBP2重组蛋白的混合体系于420 nm处的相对荧光值降至50%以下,邻苯二甲酸二丁酯、苯乙醛、β-紫罗兰酮、癸醛与反-2-癸烯醛和EoblPBP2重组蛋白的结合能力较强,解离常数KD均<31 μmol·L-1。5种茶树挥发物中,β-紫罗兰酮、邻苯二甲酸二丁酯和反-2-癸烯醛的结合能力最强(KD值分别为7.923、14.830和27.597 μmol·L-1),这与笔者实验室前期对茶尺蠖GOBP2与茶树挥发物的结合研究[18]结果一致。上述配基中,β-紫罗兰酮是一种与多种昆虫PBPs[23]、GOBPs[24]与CSPs[25]均有较强结合能力的气味分子,其结合的普遍性于茶尺蠖防治研究并没有指导作用。这种普遍性是否与其分子结构有关将有待进一步的分子对接研究分析;而邻苯二甲酸二丁酯与反-2-癸烯醛在茶树挥发物质种的相对含量都较低(≤1%)[23],因此推断邻苯二甲酸二丁酯以及反-2-癸烯醛与茶尺蠖OBPs家族蛋白的这种高亲合力似乎具有普遍性,但是有关这两种配基在茶尺蠖嗅觉系统中的具体作用仍有待进一步研究,而根据其他已报道的配基与蛋白结合的分子对接结果[26]可以推测邻苯二甲酸二丁酯、反-2-癸烯醛与PBP2之间应该有强烈的氢键以及疏水结合位点,从分子进化分析来看,EoblPBP2应属于昆虫性信息素结合蛋白PBPs家族成员(图2),而EoblPBP2在最近报道的茶尺蠖足转录组的基因中也被证实属于茶尺蠖PBPs家族(EoblPBP1-4)成员[27]。昆虫PBPs蛋白一般而言是一类具有特异识别昆虫性信息素的结合转运蛋白[27-28],因此理论上也应与茶尺蠖性信息素具有较特异的结合能力,但从EoblPBP2与各种测试化学物质的结合谱来看(表1),茶尺蠖性信息素成分之一的(Z, Z, Z)-3, 6, 9-十八碳三烯虽能与EoblPBP2产生一定程度的结合(KD值达到172.591 μmol·L-1),但其亲和力较上述5种挥发物质弱。同时这种结合谱又有别于茶尺蠖的另外一种GOBPs(茶树挥发物与EoblPBP2的亲和力普遍弱于EoblGOBP2[18])的配基结合功能,说明EoblPBP2可能并非是一种典型的PBPs蛋白,这种情况与桃蛀螟Cpun-PBP1有所类似,即Cpun-PBP1与植物挥发物(莰烯)的结合能力也高于两种性信息素组分(顺-10-十六碳烯醛、十六醛)[29]。另外,本研究采用的荧光配基结合试验为水相体系,由于性信息素成分不溶于水(本试验以正己烷作为溶剂),因此是否是此原因导致其与EoblPBP2结合力低有待进一步证实。除此之外,由于昆虫PBPs家族还存在其他成员[30-31],也有可能那些具有典型的性信息素结合功能的茶尺蠖PBPs尚未鉴定出来,亦或尽管(Z, Z, Z)-3, 6, 9-十八碳三烯是主要的茶尺蠖性信息素成分[32],但由于茶尺蠖性信息素存在多元情况[14-15],因此那些未测试的茶尺蠖性信息素成分是否能与EoblPBP2或其他PBPs成员产生更特异的给合等,均有待进一步测试与研究。
4 结论
EoblPBP2为茶尺蠖性信息素结合蛋白PBPs家族功能研究的第一个成员。由于尺蛾科性信息素的复杂性和特殊性,EoblPBP2也显示了能与包括性信息素成分在内的多种配基结合的能力,表明其是一种具备特殊复合功能的信息素结合蛋白,至于是否存在茶尺蠖性信息素特异结合的PBP蛋白,仍需进一步研究。The authors have declared that no competing interests exist.
