0 引言
【研究意义】异三聚体GTP结合蛋白(Heterotrimeric GTP binding proteins),又名G蛋白,是细胞质膜信号传递组分中重要的组成部分,在跨膜信号转导途径起着非常重要的作用[1]。因此,研究G蛋白有助于了解植物响应外界环境的分子机制,为果树基因工程遗传改良、获得抗逆新品种提供参考。【前人研究进展】G蛋白由Gα、Gβ、Gγ三个亚基构成[2],其中G蛋白α亚基在信号转导过程中发挥主导作用,且G蛋白α亚基基因GPA1最先在拟南芥中被克隆[3]。在植物中,G蛋白参与的跨膜信号转导途径是一种保守且常见的作用机制[4]。G蛋白的主要作用是转导胞外信号并产生第二信使激活下游的效应器,形成跨质膜的胞内信使系统[5]。研究表明,G蛋白可以影响K+通道和ABA信号。WANG等[6]发现野生型拟南芥中常见的由ABA抑制K+内流的效应在Gα亚基基因缺失突变体GPA1中消失,表明K+通道可能与有活性的G蛋白相关联。PANDEY等[7]用免疫共沉淀技术发现Gα与GCR1可以在体外结合,提示Gα和GCR1的结合可能参与了ABA调控气孔运动的信号传递过程。进一步研究表明G蛋白参与了植物体内许多信号转导过程,包括调节根系发育[8],影响气孔运动[9],参与植物光信号反应[10],调控细胞周期[11],参与激素应答等[12]。这些都对植物的生长、发育、分化和抗逆等方面起着重要作用。此外,植物G蛋白信号转导的基本模式也已经被发现,与哺乳动物类似,都是通过调节与Gα亚基结合的鸟苷酸分子的状态来调节G蛋白的活性[13]。相关研究表明,Gα几乎在植物所有组织中都有表达,只是在不同组织或发育阶段有所差异[14]。Gα在导管和筛管中大量表达,这表明Gα有可能参与了物质摄取过程的信号转导。进一步说明了G蛋白在植物生长发育中具有十分广泛的功能。有关G蛋白的研究开始较早,在G蛋白结构、受体及其效应器之间的作用机制等方面取得了许多研究结果。但是由于植物细胞中广泛存在信号之间的串扰,使得专一研究G蛋白系统信号转导过程变得较为困难[15]。所以,植物G蛋白信号转导的一般规律仍需进一步研究。【本研究切入点】虽然目前关于G蛋白已有大量研究,但主要集中在拟南芥、水稻[16]、番茄等植物。在多年生木本果树中的相关研究鲜有报道。【拟解决的关键问题】以‘嘎啦’苹果(Malus×domestica‘Royal Gala’)为材料,通过基因克隆获得苹果异三聚体G蛋白α亚基基因MdGPA1,并对其进行生物信息学和转基因分析,运用分子生物学手段验证MdGPA1在苹果响应环境因子过程中的重要作用。1 材料与方法
试验于2015—2016年在山东农业大学园艺科学与工程学院进行。1.1 材料收集与处理
本试验所用到的植物材料有嘎拉(Malus×domestica‘Royal Gala’),野生型烟草NC89(Nicotiana tabaccum L. cv. ‘NC89’)。10年生‘嘎啦’苹果种植在山东果树科学研究所的果树试验田(山东泰安)。2015年4月开始,分别对‘嘎啦’苹果当年新生长的根、幼茎、新生叶、初花时的花和花后30 d的幼果取样,取样后用液氮速冻保存。分别用低温(4℃)、NaCl(150 mmol·L-1)、甘露醇(150 mmol·L-1)、10% PEG、5% H2O2处理生长两周、长势一致的‘嘎啦’组培苗,以正常生长的‘嘎啦’组培苗作为对照,6 h后取样,用液氮冷冻备用。1.2 MdGPA1的克隆与同源性分析
根据在苹果基因组数据库中检索到的序列设计引物(表1),以‘嘎拉’组培苗的cDNA为模板进行PCR扩增。PCR扩增反应条件:95℃预变性10 min,95℃变性40 s,56℃退火40 s,72℃延伸2 min,34次循环,72℃后延伸2 min。PCR产物用1.5%的琼脂糖凝胶进行电泳并回收目的条带,连接到pMD18-T克隆载体进行测序。根据扩增到的DNA序列,从NCBI数据库(http://www.ncbi. nlm. nih. gov/)中检索并下载对应的其他物种的核酸和蛋白序列。通过MEGA5.0软件构建Neighbor-Joining系统进化树。Table 1
表1
表1本研究中所用的引物
Table 1Primers used in this study
| 基因 Gene | 引物名称 Primer name | 引物序列 Primer sequence |
|---|---|---|
| MdGPA1 | MdGPA1-F | GATTGCGATTCAGCTCAAT |
| MdGPA1-R | GTGCTCAAAGATGTGATGTCCT | |
| MdGPA1 (RT) | MdGPA1(qRT)-F | ACAACGAAGAGGACAATGAAGAGAACG |
| MdGPA1(qRT)-R | TGGCGTGGATGACTGAGATGTAGC | |
| MdActin | MdActin-F | AGGCGCGAAATTACCAATCC |
| MdActin-R | GCCCTCCAATTGTTCCTCGTTAAG |
新窗口打开
1.3 总RNA的提取以及实时荧光定量PCR分析
苹果各组织的RNA以及转基因烟草的RNA提取采用康为世纪科技有限公司的全能型植物RNA提取试剂盒(DNase I)。以提取的总RNA为模板,利用Clontech SMARTTM Library反转录试剂盒合成cDNA第1链。选取MdActin(GenBank accession number CN938024)为内参基因。用Ultra SYBR Mixture(with ROX)试剂盒(康为世纪)进行实时荧光定量PCR分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR反应都设3次重复。PCR反应体系为:2×UltraSYBR Mixture 10.0 μL,上游引物(10 μmol·L-1)1.0 μL,下游引物(10 μmol·L-1)1.0 μL,cDNA 1.0 μL。加去离子水至20 μL。PCR反应程序为:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸10 s,40个循环;每次循环第2步进行荧光采集。最后采用2-∆∆CT法进行定量数据分析。1.4 载体构建及烟草转化和鉴定
转基因烟草通过侵染烟草叶片的方法获得。将野生型烟草切成小块,放置在预培养培养基(MS培养基+3 mg·L-1 6-BA+0.2 mg·L-1NAA)上培养1—2 d。通过农杆菌介导的遗传转化侵染烟草叶片;随后,将叶片转移至筛选培养基(MS培养基+3 mg·L-1 6-BA+0.2 mg·L-1 NAA+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测获得阳性转基因植株,收取种子,播种后选择长势一致的植株进行表型观察。1.5 转基因烟草干旱处理及生理指标测定
1.5.1 转基因烟草干旱处理与表型观察 选择3周左右、生长状态一致的野生型和MdGPA1转基因烟草进行干旱处理。连续干旱处理20 d后,观察植株生长状态,复水3 d后,观察植株生长状况并拍照。1.5.2 转基因烟草生理指标测定
1.5.2.1 烟草叶片叶绿体色素提取 称取剪碎的烟草叶片,放入研钵中,加少量石英砂和碳酸钙粉及2—3 mL 96%乙醇研成匀浆。用滤纸过滤匀浆到棕色容量瓶中,并用乙醇定容。以96%乙醇为空白,在波长652 nm下测定提取液光密度。利用公式计算叶绿体色素含量。
叶绿素总量浓度CT=(D625×1000)/34.5
叶绿体色素含量=(CT×提取液体积×稀释倍数)/样品鲜重
1.5.2.2 烟草叶片脯氨酸含量测定 脯氨酸含量测定采用横基水杨酸比色法:取50—100 mg剪碎的烟草叶片,置于10 mL EP管中,加入5 mL 3%磺基水杨酸溶液,沸水浴10 min。冷却至室温后吸取上清液2 mL,加入2 mL冰乙酸,3 mL 2.5%酸性茚三酮溶液显色液(冰乙酸和6 mol·L-1磷酸以3﹕2比例配制,两日内有效)。振荡均匀后沸水浴40 min,加入5 mL甲苯萃取红色物质,测定520 nm波长处的吸光度。将吸光度代入标准曲线,即可计算样品提取液中的脯氨酸浓度。利用公式计算样品中脯氨酸含量百分数。
脯氨酸(μg·g-1 FW)=提取液中脯氨酸浓度×提取液总体积/(测定时所吸取体积×样品重)
1.6 数据分析
使用SPSS 22.0数据分析软件,进行单因素ANOVA方差分析比较叶片鲜重、叶绿素含量、脯氨酸含量和根系干重。当差异P<0.05和P<0.01时,有统计学意义。所有试验均重复3次。2 结果
2.1 苹果MdGPA1克隆及进化树分析
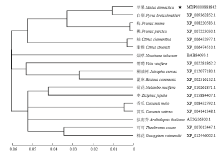
以‘嘎拉’组培苗的cDNA为模板,RT-PCR克隆到一条大约1 000 bp的条带。对克隆得到的片段进行回收测序分析。分析结果表明,目的基因片段含有一个完整的开放阅读框,长度为1 173 bp。该基因编码390个氨基酸,命名为MdGPA1。这是从苹果中分离到的第一个G蛋白α亚基基因。将苹果MdGPA1氨基酸序列与白梨、梅、桃、拟南芥、烟草等16种不同植物的GPA1氨基酸序列比对构建进化树。进化树分析结果表明,苹果MdGPA1与白梨PbGPA1亲缘关系最近,同源性最高(图1)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1MdGPA1与其他植物GPA1蛋白的系统进化树
-->Fig. 1Phylogenetic tree constructed using MdGPA1 and GPA1 proteins of other plants
-->
2.2 苹果MdGPA1的表达分析
qRT-PCR分析MdGPA1在10年生‘嘎啦’苹果不同器官中的表达情况。结果表明,MdGPA1在苹果叶片中的表达量最高,在根中的表达量次之,在茎与果实中的表达量相对较低(图2)。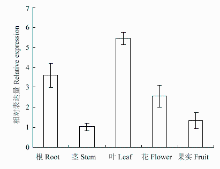 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2MdGPA1在苹果不同器官中的相对表达量
-->Fig. 2Relative expression of MdGPA1 in different organs of apple
-->
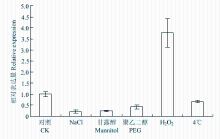
分别用NaCl(150 mmol·L-1)、甘露醇(150 mmol·L-1)、10% PEG、5% H2O2、低温(4℃)处理‘嘎啦’组培苗6 h,检测植株中MdGPA1的相对表达量。结果表明,在NaCl、甘露醇、PEG、4℃胁迫条件下,MdGPA1的表达量明显下调,其中在NaCl胁迫条件下MdGPA1下调最明显,甘露醇胁迫次之。在H2O2胁迫处理下,MdGPA1表达量明显上调(图3)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3MdGPA1在不同逆境条件下的相对表达量
-->Fig. 3Relative expression of MdGPA1 in response to various stresses
-->
2.3 载体构建与转基因烟草鉴定
用Pst I和BamH I限制性内切酶分别对pMD18-T中间载体和pCAMBIA-1300表达载体进行酶切反应,将酶切产物回收后在16℃进行连接反应。连接产物转化大肠杆菌感受态细胞。成功筛选到阳性克隆,获得MdGPA1-pCAMBIA-1300植物过表达载体(图4)。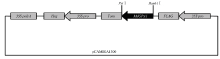 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4MdGPA1-pCAMBIA-1300结构示意图35S pro:花椰菜花叶病毒(CaMV)35S启动子;FLAG:标签蛋白基因;Tnos:终止子;Hyg:筛选标记基因;35S polyA:CaMV 35S终止子
-->Fig. 4Schematic diagram of the MdGPA1-pCAMBIA-1300 structure35S Pro: Cauliflower mosaic virus (CaMV) 35S promoter; FLAG: tagged sequence; Tnos: Terminater; Hyg: Hygromycin resistance gene; 35S polyA: Terminator of CaMV 35S gene
-->
将构建的MdGPA1过表达载体转化农杆菌LBA4404,进而用筛选到的阳性农杆菌侵染烟草叶片,通过PCR鉴定MdGPA1转基因烟草(图5-A),并通过半定量RT-PCR检测MdGPA1转基因烟草表达水平(图5-B)。获得L1、L3和L4三个转基因株系(图5)。
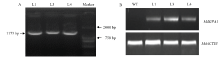 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5转基因烟草鉴定(A)及MdGPA1表达水平检测(B)WT:野生型烟草;L1、L3、L4:转基因株系。下同
-->Fig. 5Identification of transgenic tobacco (A) and detection of MdGPA1 expression in transgenic tobacco (B)WT: Wild type tobacco; L1, L3, L4: Transgenic lines. The same as below
-->
2.4 过量表达MdGPA1基因提高烟草对干旱的敏感性
同时干旱处理野生型烟草和MdGPA1 T1代转基因烟草。20 d后转基因烟草表现出更为严重的萎蔫,而野生型烟草仅出现部分萎蔫性状(图6)。对干旱处理的烟草进行复水,3 d后,野生型烟草恢复正常生长状态,而MdGPA1过量表达的烟草仍然保持萎蔫状态,无法恢复。为了进一步分析,对复水处理后烟草的鲜重、叶绿素含量以及脯氨酸含量进行了统计。结果显示,干旱处理后的MdGPA1转基因烟草的叶片鲜重、叶绿素含量以及脯氨酸含量均显著低于野生型(图6)。同时,对根系的观察结果表明干旱处理后MdGPA1转基因烟草根系的形态与干重(图7)都显著小于野生型。以上结果说明MdGPA1转基因烟草对干旱胁迫更加敏感,过量表达MdGPA1基因降低了烟草的抗旱能力。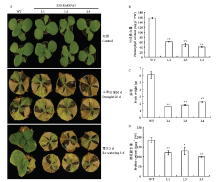 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6野生型和MdGPA1转基因烟草干旱处理(A)及其叶片鲜重(B)、叶绿素含量(C)、脯氨酸含量测定(D)*差异显著(P<0.05);**差异极显著(P<0.01)。下同
-->Fig. 6Drought treatment of wild type and transgenic tobacco (A) and the measurement on fresh weight (B), chlorophyll content (C) and proline content (D) of wild type and transgenic tobacco*Significant difference (P<0.05); **Highly significant difference (P<0.01). The same as below
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7野生型和MdGPA1转基因烟草干旱处理后根系形态(A)和根系干重(B)
-->Fig.7Root morphology (A) and dry weight (B) of wild type and transgenic tobacco after drought treatment
-->
3 讨论
植物所生长的环境是动态变化的,所以植物必须能够感受外界环境刺激,并对外界环境产生响应。G蛋白是细胞质膜上重要的跨膜信号转导分子,将胞外信号转导为胞内信号,并激活下游相应的效应器。虽然其在植物体内的编码基因相对于动物较少,但它却在植物体内发挥了重要作用[12]。对于G蛋白已有大量较为深入的研究。前人研究结果表明,G蛋白参与植物多个信号转导过程,包括响应植物体内的激素信号与糖信号[11];参与调控气孔运动和离子通道[17];参与植物对病原体的防卫[18];参与植物光信号转导[19]等。G蛋白同样可以调控植物的形态发育,包括影响植物侧根的生长[20],花和果荚的形成[21],花粉管的发育[22],叶片的形态[23]和下胚轴的长度[24]。
G蛋白α亚基作为最先被克隆出来的G蛋白亚基,在G蛋白参与的信号转导过程中起到了关键作用,在植物体内几乎所有组织中都有表达。CHOUDHURY等[25]研究发现G蛋白α亚基基因GPA1影响植物节间发育。ULLAH等[26]在拟南芥中过量表达GPA1,增强了拟南芥对GA的敏感性,推测GPA1可能参与GA信号转导途径进而影响种子萌发。WARPEHA等[27]发现GCR1、GPA1、PRN1、NF-Y信号链能够参与植物的蓝光响应。ZHANG等[28]发现激活GPA1能够通过叶绿体蛋白酶FtsH抑制叶绿体的形成。NILSON等[29]通过试验验证了GPA1能够调控植物的蒸腾效率。CHAKRABORTY等[30]最近研究结果表明GPA1调控的基因参与了多达79个生物学过程,包含了生物与非生物胁迫[31]、植物发育、类黄酮的生物合成、硝酸盐和磷酸盐响应等过程。结合本研究结果表明,G蛋白作为植物体内非常重要的跨膜信号转导蛋白,在将胞外信号转为胞内信号过程中扮演着极其关键的角色。GPA1的过量表达,会导致植物对干旱胁迫的过度响应。
4 结论
克隆获得了MdGPA1,该基因编码390个氨基酸。进化树分析表明苹果MdGPA1与白梨PbGPA1亲缘关系最近。定量表达分析结果显示MdGPA1在苹果根、茎、叶、花和果实中均有表达,并且在叶中表达量最高;MdGPA1受多种胁迫响应,在NaCl、甘露醇、PEG、4℃胁迫条件下表达量明显下调,在H2O2胁迫处理下表达量明显上调;MdGPA1转基因烟草表现出对干旱敏感的表型特征,表明MdGPA1在响应植物抗旱胁迫中发挥着重要的负调控作用。The authors have declared that no competing interests exist.
