0 引言
【研究意义】盐害是危害农业生产的主要因素之一。作为典型的非生物胁迫,盐害会破坏作物的离子平衡,引起离子毒性、高渗和氧化胁迫等,从而影响种子萌发和幼苗生长,导致产量和品质下降[1]。诸多研究表明,甘蓝型油菜耐盐能力较强,因此,挖掘油菜耐盐调控位点和基因,培育耐盐油菜品种,以开发利用盐碱地,对缓解中国植物油供应压力、维护国家食物安全具有重要意义[2]。【前人研究进展】目前,油菜耐盐性的遗传和分子机制报道较少[3-4]。龙卫华等[5]对芥菜型油菜(Brassica juncea)、白菜型油菜(Brassica rapa)和甘蓝型油菜(B. napus)共203份种质资源进行盐胁迫比较研究,筛选出1份白菜型油菜和2份甘蓝型油菜材料用于培育耐盐油菜品种。刘国红等[2]发现盐胁迫对油菜光合作用的抑制主要来自气孔因素,但在长期高盐条件下,非气孔因素对光合抑制的贡献也很明显。在遗传定位方面,荐红举等[6]利用高世代重组自交系群体和SNP遗传图谱定位到11个盐胁迫下油菜种子发芽率相关的QTL。YONG等[7]对85个油菜自交系开展了基于多样性芯片技术(diversity arrays technology,DArT)和DArTseq基因型分析的研究,利用GWAS检测到62个耐盐性、地上部生物量及离子平衡相关的QTL,并鉴定出可能的候选基因TSN1。【本研究切入点】尽管甘蓝型油菜耐盐相关QTL有少量报道,但盐胁迫下油菜发芽期根长和下胚轴长度的GWAS研究尚未见报道。【拟解决的关键问题】为解析控制油菜发芽期根和下胚轴发育及耐盐性的关键位点和候选基因,本研究采用GWAS鉴定目标性状显著关联SNP,结合转录组分析,筛选连锁不平衡(linkage disequilibrium,LD)区间内的盐胁迫诱导差异表达基因,初步确定控制性状变异的候选基因。以实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析候选基因的组织特异性和盐胁迫诱导表达模式,提高候选基因筛选的准确性。本研究将为分子标记辅助选择和基因工程改良等方式培育耐盐油菜新品种提供理论依据和新的基因资源。1 材料与方法
1.1 试验材料
供试材料共317份(电子附表1),均为国内外广泛收集的代表性油菜资源,其中,国内材料283份,主要来自重庆、湖北和湖南等地,国外材料34份,主要来自德国和加拿大。所有材料均由重庆市油菜工程技术研究中心保存。2015年收获的当年自交种用于本研究。Supplementary Table 1
附表1
附表1本研究所用的植物材料
Supplementary Table 1Plant materials used in this study
| 材料编号 Accession number | 材料名 Accession name | 国家,地区 Country, region | 亚群 Sub-population |
|---|---|---|---|
| B1 | Ganyou5 | 中国重庆 Chongqing, China | P1 |
| B2 | Nonglin42 | 中国重庆 Chongqing, China | P1 |
| B4 | Huaiyou6 | 中国重庆 Chongqing, China | P1 |
| B5 | Yan81-2 | 中国重庆 Chongqing, China | P1 |
| B6 | 28887 | 中国重庆 Chongqing, China | P1 |
| B7 | Qianyou4 | 中国重庆 Chongqing, China | P1 |
| B8 | Qianyou331 | 中国重庆 Chongqing, China | P1 |
| B10 | Niuerduo | 中国重庆 Chongqing, China | P1 |
| B14 | SWU43 | 中国重庆 Chongqing, China | P1 |
| B16 | SWU45 | 中国重庆 Chongqing, China | P1 |
| B17 | SWU46 | 中国重庆 Chongqing, China | P1 |
| B18 | SWU47 | 中国重庆 Chongqing, China | P1 |
| B19 | SWU48 | 中国重庆 Chongqing, China | P1 |
| B20 | SWU52 | 中国重庆 Chongqing, China | P1 |
| B21 | SWU53 | 中国重庆 Chongqing, China | P1 |
| B23 | SWU59 | 中国重庆 Chongqing, China | P1 |
| B24 | SWU65 | 中国重庆 Chongqing, China | P1 |
| B25 | SWU82 | 中国重庆 Chongqing, China | P1 |
| B26 | SWU83 | 中国重庆 Chongqing, China | P1 |
| B27 | SWU92 | 中国重庆 Chongqing, China | P1 |
| B28 | SWU101 | 中国重庆 Chongqing, China | P1 |
| B29 | SWU106 | 中国重庆 Chongqing, China | P1 |
| B30 | SWU108 | 中国重庆 Chongqing, China | P1 |
| B31 | Chuanyou20 | 中国四川 Sichuan, China | P1 |
| B33 | CY12NY-7 | 中国四川 Sichuan, China | P1 |
| B35 | CY12Q8-7 | 中国四川 Sichuan, China | P1 |
| B36 | CY12QSZ06 | 中国四川 Sichuan, China | P1 |
| B38 | CY12Q95108 | 中国四川 Sichuan, China | P1 |
| B39 | CY12Q21535-N3 | 中国四川 Sichuan, China | P1 |
| B40 | CY12PXW-4 | 中国四川 Sichuan, China | P1 |
| B41 | CY12PXW-6 | 中国四川 Sichuan, China | P1 |
| B43 | CY13PXW-17 | 中国四川 Sichuan, China | P1 |
| B44 | CY14PXW-18 | 中国四川 Sichuan, China | P1 |
| B45 | CY15PXW-31 | 中国四川 Sichuan, China | P1 |
| B46 | CY16PXW-35 | 中国四川 Sichuan, China | P1 |
| B47 | CY17PXW-58 | 中国四川 Sichuan, China | P1 |
| B49 | CY19PXW-65 | 中国四川 Sichuan, China | P1 |
| B52 | CY12GJ-1 | 中国四川 Sichuan, China | P1 |
| B53 | wx1025 | 中国湖南 Hunan, China | P1 |
| B54 | wx10213 | 中国湖南 Hunan, China | P1 |
| B55 | wx10296 | 中国湖南 Hunan, China | P1 |
| B56 | wx10315 | 中国湖南 Hunan, China | P1 |
| B57 | 10-1043 | 中国湖南 Hunan, China | P1 |
| B60 | 10-1070 | 中国湖南 Hunan, China | P1 |
| B61 | 10-804 | 中国湖南 Hunan, China | P1 |
| B62 | 10-1358 | 中国湖南 Hunan, China | P1 |
| B64 | Xiangyou13 | 中国湖南 Hunan, China | P1 |
| B65 | Xiangyou15 | 中国湖南 Hunan, China | P1 |
| B66 | Xiangyou11 | 中国湖南 Hunan, China | P1 |
| B67 | 740 | 中国湖南 Hunan, China | P1 |
| B69 | 613 | 中国湖南 Hunan, China | P1 |
| B70 | 783 | 中国湖南 Hunan, China | P1 |
| B71 | 782 | 中国湖南 Hunan, China | P1 |
| B72 | YB3 | 中国湖南 Hunan, China | P1 |
| B73 | 1360 | 中国湖南 Hunan, China | P1 |
| B75 | WX10329 | 中国湖南 Hunan, China | P1 |
| B76 | santana | 中国湖南 Hunan, China | P1 |
| B77 | 1281 | 中国湖南 Hunan, China | P1 |
| B79 | 1368 | 中国湖南 Hunan, China | P1 |
| B80 | 1322 | 中国湖南 Hunan, China | P1 |
| B81 | 1252 | 中国湖南 Hunan, China | P1 |
| B82 | 1321 | 中国湖南 Hunan, China | P1 |
| B84 | 07094 | 中国湖北 Hubei, China | P1 |
| B85 | 07016 | 中国湖北 Hubei, China | P1 |
| B86 | 9F087 | 中国湖北 Hubei, China | P1 |
| B87 | 97096 | 中国湖北 Hubei, China | P1 |
| B88 | 97097 | 中国湖北 Hubei, China | P1 |
| B90 | 07191 | 中国湖北 Hubei, China | P1 |
| B91 | 07037 | 中国湖北 Hubei, China | P1 |
| B92 | RQ011 | 中国湖北 Hubei, China | P1 |
| B97 | 96063 | 中国湖北 Hubei, China | P1 |
| B98 | 01111 | 中国湖北 Hubei, China | P1 |
| B99 | 01570 | 中国湖北 Hubei, China | P1 |
| B102 | 02354 | 中国湖北 Hubei, China | P1 |
| B105 | 93205 | 中国湖北 Hubei, China | P1 |
| B106 | 93210 | 中国湖北 Hubei, China | P1 |
| B107 | Nca | 中国湖北 Hubei, China | P1 |
| B108 | Zhongshuang4 | 中国湖北 Hubei, China | P1 |
| B109 | Zhongshuang9 | 中国湖北 Hubei, China | P1 |
| B110 | Zhongshuang11 | 中国湖北 Hubei, China | P1 |
| B111 | 2011-6200 | 中国湖北 Hubei, China | P1 |
| B115 | 2012-3448 | 中国湖北 Hubei, China | P2 |
| B116 | 2012-3546 | 中国湖北 Hubei, China | P1 |
| B118 | 2012-5086 | 中国湖北 Hubei, China | P1 |
| B119 | 2012-5113 | 中国湖北 Hubei, China | P1 |
| B120 | 2012-8327 | 中国湖北 Hubei, China | P1 |
| B121 | 2012-8355 | 中国湖北 Hubei, China | P1 |
| B122 | 2012-8380 | 中国湖北 Hubei, China | P1 |
| B124 | 2012-9323 | 中国湖北 Hubei, China | P1 |
| B127 | 2012-9478 | 中国湖北 Hubei, China | P1 |
| B128 | 2012-9542 | 中国湖北 Hubei, China | P1 |
| B129 | 2012-K8053 | 中国湖北 Hubei, China | P1 |
| B130 | R2 | 中国湖北 Hubei, China | P1 |
| B131 | Xiwang106 | 中国湖北 Hubei, China | P1 |
| B132 | Yangguang198 | 中国湖北 Hubei, China | P1 |
| B133 | Yangguang2009 | 中国湖北 Hubei, China | P1 |
| B134 | Zhongshuang10 | 中国湖北 Hubei, China | P1 |
| B135 | Zhongshuang12 | 中国湖北 Hubei, China | P1 |
| B136 | Zhongshuang4 | 中国湖北 Hubei, China | P1 |
| B137 | Zhongshuang6 | 中国湖北 Hubei, China | P1 |
| B138 | Zhongshuang7 | 中国湖北 Hubei, China | P1 |
| B139 | Zhongyou589 | 中国湖北 Hubei, China | P1 |
| B140 | Zhongyou821 | 中国湖北 Hubei, China | P1 |
| B141 | Huayou2 | 中国湖北 Hubei, China | P1 |
| B142 | Major | 中国湖北 Hubei, China | P1 |
| B143 | Huashuang2 | 中国湖北 Hubei, China | P1 |
| B144 | Aurora | 中国湖北 Hubei, China | P1 |
| B145 | Huayou13 | 中国湖北 Hubei, China | P1 |
| B146 | Rucabo | 中国湖北 Hubei, China | P2 |
| B147 | Huayou3 | 中国湖北 Hubei, China | P1 |
| B149 | Ningyou1 | 中国湖北 Hubei, China | P1 |
| B151 | 11-9-700 | 中国湖北 Hubei, China | P1 |
| B153 | 11-9-702 | 中国湖北 Hubei, China | P1 |
| B154 | 11-9-703 | 中国湖北 Hubei, China | P1 |
| B155 | 11-9-704 | 中国湖北 Hubei, China | P1 |
| B156 | 11-9-705 | 中国湖北 Hubei, China | P1 |
| B157 | 11-9-706 | 中国湖北 Hubei, China | P1 |
| B158 | 11-9-707 | 中国湖北 Hubei, China | P1 |
| B159 | 11-P63-5 | 中国湖北 Hubei, China | P1 |
| B160 | 11-P63-8 | 中国湖北 Hubei, China | P1 |
| B163 | 09-P64-1 | 中国湖北 Hubei, China | P1 |
| B164 | 10-Cong23 | 中国湖北 Hubei, China | P1 |
| B165 | 10-Cong24 | 中国湖北 Hubei, China | P1 |
| B166 | 10-Cong25 | 中国湖北 Hubei, China | P1 |
| B167 | 10-Cong29 | 中国湖北 Hubei, China | P1 |
| B168 | 10-Cong32 | 中国湖北 Hubei, China | P1 |
| B169 | 10-Cong33 | 中国湖北 Hubei, China | P1 |
| B170 | 10-Cong34 | 中国湖北 Hubei, China | P1 |
| B171 | 10-Jiangpeng2 | 中国湖北 Hubei, China | P1 |
| B172 | 10-Jiangpeng3 | 中国湖北 Hubei, China | P1 |
| B173 | 11-7-103 | 中国湖北 Hubei, China | P1 |
| B174 | 11-7-117 | 中国湖北 Hubei, China | P1 |
| B175 | 11-7-125 | 中国湖北 Hubei, China | P1 |
| B178 | 7-7766-74 | 中国湖北 Hubei, China | P1 |
| B180 | 64Peng-10 | 中国湖北 Hubei, China | P1 |
| B181 | Shengguang77 | 中国湖北 Hubei, China | P1 |
| B182 | Jiayu17 | 中国湖北 Hubei, China | P1 |
| B183 | Jiayu25 | 中国湖北 Hubei, China | P1 |
| B184 | Jiayu16 | 中国湖北 Hubei, China | P1 |
| B185 | Jiayu31 | 中国湖北 Hubei, China | P1 |
| B186 | Huashuang5 | 中国湖北 Hubei, China | P1 |
| B187 | Huashuang4 | 中国湖北 Hubei, China | P1 |
| B188 | Jia972 | 中国湖北 Hubei, China | P1 |
| B189 | Huashuang128 | 中国湖北 Hubei, China | P1 |
| B190 | Jia904 | 中国湖北 Hubei, China | P1 |
| B192 | JiaPF190 | 中国湖北 Hubei, China | P1 |
| B195 | Jia951 | 中国湖北 Hubei, China | P1 |
| B196 | Jia917 | 中国湖北 Hubei, China | P1 |
| B197 | Jia923 | 中国湖北 Hubei, China | P1 |
| B198 | Jia931 | 中国湖北 Hubei, China | P1 |
| B200 | Jia963 | 中国湖北 Hubei, China | P2 |
| B201 | Huyou17 | 中国上海 Shanghai, China | P1 |
| B202 | Huyou15 | 中国上海 Shanghai, China | P1 |
| B204 | Ningyou18 | 中国江苏 Jiangsu, China | P1 |
| B206 | Ningyou14 | 中国江苏 Jiangsu, China | P1 |
| B209 | Shilifeng | 中国江苏 Jiangsu, China | P1 |
| B211 | Yangyou5 | 中国江苏 Jiangsu, China | P1 |
| B212 | Zhenyou3 | 中国浙江 Zhejiang, China | P1 |
| B213 | Hongyou3 | 中国江苏 Jiangsu, China | P1 |
| B215 | Zheyou18 | 中国浙江 Zhejiang, China | P1 |
| B216 | Zheshuang72 | 中国浙江 Zhejiang, China | P1 |
| B217 | Zheshuang8 | 中国浙江 Zhejiang, China | P1 |
| B218 | Zheyou758 | 中国浙江 Zhejiang, China | P1 |
| B219 | Huyou14 | 中国上海 Shanghai, China | P1 |
| B220 | Huyou18 | 中国上海 Shanghai, China | P1 |
| B221 | Huyou19 | 中国上海 Shanghai, China | P1 |
| B222 | Zheyou19 | 中国浙江 Zhejiang, China | P1 |
| B223 | Zheyou21 | 中国浙江 Zhejiang, China | P1 |
| B224 | Zheshuang6 | 中国浙江 Zhejiang, China | P1 |
| B226 | Wanyou16 | 中国安徽 Anhui, China | P1 |
| B227 | Wanyou20 | 中国安徽 Anhui, China | P1 |
| B228 | Wanyou29 | 中国安徽 Anhui, China | P1 |
| B241 | Weijie | 加拿大 Canada | P2 |
| B243 | Zhizun | 加拿大 Canada | P1 |
| B244 | Haisheng | 加拿大 Canada | P2 |
| B245 | D2 | 丹麦 Denmark | P2 |
| B262 | P310 | 中国陕西 Shanxi, China | P1 |
| B263 | P312 | 中国陕西 Shanxi, China | P2 |
| B264 | P668 | 中国陕西 Shanxi, China | P1 |
| B265 | P685 | 中国陕西 Shanxi, China | P1 |
| B266 | A117 | 中国陕西 Shanxi, China | P1 |
| B267 | A172 | 中国陕西 Shanxi, China | P1 |
| B268 | B250 | 中国陕西 Shanxi, China | P1 |
| B269 | B265 | 中国陕西 Shanxi, China | P1 |
| B271 | B285 | 中国陕西 Shanxi, China | P2 |
| B273 | GY270 | 中国陕西 Shanxi, China | P1 |
| B274 | GY282 | 中国陕西 Shanxi, China | P1 |
| B275 | GY284 | 中国陕西 Shanxi, China | P1 |
| B279 | B414 | 中国新疆 Xinjiang, China | P1 |
| B291 | 11-P30 | 中国湖北 Hubei, China | P1 |
| B303 | 03LF1 | 中国甘肃 Gansu, China | P2 |
| B313 | SWU01 | 中国湖北 Hubei, China | P1 |
| B326 | Nonglin43 | 中国重庆 Chongqing, China | P1 |
| B327 | SWU25 | 中国西藏 Tibet, China | P1 |
| B328 | Youyan2 | 中国重庆 Chongqing, China | P1 |
| B330 | SWU41 | 中国重庆 Chongqing, China | P1 |
| B333 | SWU57 | 中国重庆 Chongqing, China | P1 |
| B334 | SWU60 | 中国重庆 Chongqing, China | P1 |
| B337 | SWU63 | 中国重庆 Chongqing, China | P1 |
| B339 | SWU66 | 中国重庆 Chongqing, China | P1 |
| B340 | SWU67 | 中国重庆 Chongqing, China | P1 |
| B341 | SWU68 | 中国重庆 Chongqing, China | P1 |
| B342 | SWU69 | 中国重庆 Chongqing, China | P1 |
| B343 | SWU70 | 中国重庆 Chongqing, China | P1 |
| B345 | SWU74 | 中国重庆 Chongqing, China | P1 |
| B346 | SWU75 | 中国重庆 Chongqing, China | P1 |
| B349 | SWU80 | 中国重庆 Chongqing, China | P1 |
| B350 | SWU81 | 中国重庆 Chongqing, China | P1 |
| B351 | SWU84 | 中国重庆 Chongqing, China | P1 |
| B354 | SWU88 | 中国重庆 Chongqing, China | P1 |
| B357 | SWU93 | 中国重庆 Chongqing, China | P1 |
| B358 | SWU94 | 中国重庆 Chongqing, China | P1 |
| B360 | SWU96 | 中国重庆 Chongqing, China | P1 |
| B361 | SWU99 | 中国重庆 Chongqing, China | P1 |
| B362 | SWU100 | 中国重庆 Chongqing, China | P1 |
| B363 | SWU102 | 中国重庆 Chongqing, China | P1 |
| B365 | SWU104 | 中国重庆 Chongqing, China | P1 |
| B366 | SWU105 | 中国重庆 Chongqing, China | P1 |
| B367 | SWU107 | 中国重庆 Chongqing, China | P1 |
| B368 | SWU110 | 中国重庆 Chongqing, China | P1 |
| B369 | SWU111 | 中国重庆 Chongqing, China | P1 |
| B370 | SWU112 | 中国重庆 Chongqing, China | P1 |
| B371 | SWU113 | 中国重庆 Chongqing, China | P1 |
| B373 | Zhongshuang10 | 中国湖北 Hubei, China | P1 |
| B375 | Zhongshuang7 | 中国湖北 Hubei, China | P1 |
| B376 | Zhongshuang12 | 中国湖北 Hubei, China | P1 |
| B377 | Zhongyou589 | 中国湖北 Hubei, China | P1 |
| B378 | Fuyou4 | 中国湖北 Hubei, China | P1 |
| B380 | Zhen2609 | 中国江苏 Jiangsu, China | P1 |
| B381 | HX0352 | 中国江苏 Jiangsu, China | P1 |
| B382 | Yangguang2009 | 中国湖北 Hubei, China | P1 |
| B383 | Huyou21 | 中国上海 Shanghai, China | P1 |
| B384 | Zheshuang3 | 中国浙江 Zhejiang, China | P1 |
| B385 | Zheyou21 | 中国浙江 Zhejiang, China | P1 |
| B386 | Wanyou20 | 中国安徽 Anhui, China | P1 |
| B387 | Wanyou12 | 中国安徽 Anhui, China | P1 |
| B389 | Hongyou3 | 中国江苏 Jiangsu, China | P1 |
| B390 | Zhenyou5 | 中国湖北 Hubei, China | P1 |
| B391 | Yangyou4 | 中国湖北 Hubei, China | P1 |
| B392 | Huyou15 | 中国上海 Shanghai, China | P1 |
| B393 | Huyou16 | 中国上海 Shanghai, China | P1 |
| B395 | Huyou18 | 中国浙江 Zhejiang, China | P1 |
| B396 | Zheshuang72 | 中国浙江 Zhejiang, China | P1 |
| B397 | Zheshuang8 | 中国浙江 Zhejiang, China | P1 |
| B398 | Zheyou50 | 中国浙江 Zhejiang, China | P1 |
| B399 | Suyou1 | 中国江苏 Jiangsu, China | P1 |
| B400 | Zhongshuang4 | 中国湖北 Hubei, China | P1 |
| B401 | Zhongshuang11 | 中国湖北 Hubei, China | P1 |
| B402 | Yangguang198 | 中国湖北 Hubei, China | P1 |
| B403 | Huahang901 | 中国湖北 Hubei, China | P1 |
| B404 | YangJ6711 | 中国江苏 Jiangsu, China | P1 |
| B406 | Yangjian8 | 中国江苏 Jiangsu, China | P1 |
| B407 | Xiwang106 | 中国湖北 Hubei, China | P1 |
| B408 | Zheyou17 | 中国浙江 Zhejiang, China | P1 |
| B409 | Zhongshuang5 | 中国湖北 Hubei, China | P1 |
| B410 | Zhongyou821 | 中国湖北 Hubei, China | P1 |
| B411 | Qinyou1 | 中国湖北 Hubei, China | P1 |
| B412 | Weilong88 | 中国湖北 Hubei, China | P1 |
| B414 | Qinyou5 | 中国湖北 Hubei, China | P1 |
| B415 | Suyou4 | 中国江苏 Jiangsu, China | P1 |
| B416 | Fengyou9 | 中国湖北 Hubei, China | P1 |
| B424 | Ningyou10 | 中国湖北 Hubei, China | P1 |
| B425 | Helios | 中国湖北 Hubei, China | P1 |
| B427 | Mian96-203 | 中国青海 Qinghai, China | P1 |
| B428 | Qing662A | 中国湖北 Hubei, China | P1 |
| B429 | 699 | 中国湖北 Hubei, China | P1 |
| B430 | Canada2 | 中国湖北 Hubei, China | P1 |
| B432 | Zhongshuang9 | 中国湖北 Hubei, China | P1 |
| B433 | WH-12 | 中国湖北 Hubei, China | P1 |
| B435 | WH-17 | 中国湖北 Hubei, China | P1 |
| B436 | WH-19 | 中国湖北 Hubei, China | P1 |
| B437 | WH-20 | 中国湖北 Hubei, China | P1 |
| B438 | WH-23 | 中国湖北 Hubei, China | P1 |
| B439 | WH-24 | 中国湖北 Hubei, China | P1 |
| B440 | WH-25 | 中国湖北 Hubei, China | P1 |
| B442 | WH-27 | 中国湖北 Hubei, China | P1 |
| B443 | WH-28 | 中国湖北 Hubei, China | P1 |
| B445 | WH-30 | 中国湖北 Hubei, China | P1 |
| B446 | WH-31 | 中国湖北 Hubei, China | P1 |
| B447 | WH-33 | 中国湖北 Hubei, China | P1 |
| B451 | WH-42 | 中国湖北 Hubei, China | P2 |
| B452 | WH-43 | 中国湖北 Hubei, China | P2 |
| B453 | WH-45 | 中国湖北 Hubei, China | P2 |
| B454 | WH-49 | 中国湖北 Hubei, China | P1 |
| B455 | WH-50 | 中国湖北 Hubei, China | P2 |
| B458 | WH-57 | 中国湖北 Hubei, China | P1 |
| B459 | WH-58 | 中国湖北 Hubei, China | P1 |
| B460 | WH-59 | 中国湖北 Hubei, China | P1 |
| B466 | WH-83 | 中国湖北 Hubei, China | P1 |
| B475 | NY7 | 中国湖北 Hubei, China | P1 |
| B479 | Cubs root | 中国湖北 Hubei, China | P1 |
| B482 | Shengli | 中国湖北 Hubei, China | P1 |
| B486 | Daichousen | 中国湖北 Hubei, China | P1 |
| B487 | comet | 中国湖北 Hubei, China | P2 |
| B488 | Niklas | 中国湖北 Hubei, China | P2 |
| B491 | WESBROOK | 中国湖北 Hubei, China | P2 |
| B492 | Suigenshu | 中国湖北 Hubei, China | P1 |
| B493 | Huayou4 | 中国湖北 Hubei, China | P1 |
| B494 | Y1 | 中国上海 Shanghai, China | P1 |
| B499 | Shaoyeqing | 中国上海 Shanghai, China | P1 |
| B501 | Hujizao | 中国上海 Shanghai, China | P1 |
| B504 | Fengding 240 | 中国江苏 Jiangsu, China | P1 |
| B506 | Dahuaqiu | 中国江苏 Jiangsu, China | P1 |
| B508 | Ningyou 10 | 中国江苏 Jiangsu, China | P1 |
| B509 | Ningyou 8 | 中国江苏 Jiangsu, China | P1 |
| B510 | Ningyou 6 | 中国江苏 Jiangsu, China | P1 |
| B511 | Duoyou 1 | 中国江苏 Jiangsu, China | P1 |
| B513 | Huaiyou 12 | 中国江苏 Jiangsu, China | P1 |
| B514 | Peixuan 170 | 中国江苏 Jiangsu, China | P1 |
| B516 | Guangde 8104 | 中国安徽 Anhui, China | P1 |
| B517 | Dangyouzao 1 | 中国安徽 Anhui, China | P1 |
| B518 | Guangde 761 | 中国安徽 Anhui, China | P1 |
| B521 | Chu 107 | 中国安徽 Anhui, China | P1 |
| B526 | Jie 65-1 | 中国浙江 Zhejiang, China | P1 |
| B527 | Shenhuang1 | 中国上海 Shanghai, China | P1 |
| B528 | Zheyou 601 | 中国浙江 Zhejiang, China | P1 |
| B529 | Sangao rapeseed | 中国浙江 Zhejiang, China | P1 |
新窗口打开
1.2 胁迫处理和性状调查
试验于2015年在西南大学油菜培养间进行,整个试验重复2次,生长条件为昼夜温度25℃,光照/黑暗时间16 h/8 h,光照强度5 000 lx。从供试材料中挑选大小均匀、健康饱满的种子各120粒,将种子浸泡24 h后分为2份,分别播种在100 mmol·L-1 NaCl和对照蒸馏水充分浸润的蛭石上,覆盖保鲜膜。播种5 d后,选取长势一致的10株幼苗测定根长(root length,RL)和下胚轴长(hypocotyl length,HL),正常萌发条件下的RL和HL以RLW和HLW表示,盐胁迫下萌发的RL和HL以RLN和HLN表示。两性状差值(RLD和HLD)为对照与盐胁迫环境测定值之差。以SPSS 20.0(美国IBM公司)软件对表型数据进行描述性统计分析和Kolmogorov-Smirnov正态分布检验。利用R脚本(www.eXtension.org/pages/61006)对2次重复试验的性状值进行基于线性模型的最佳线性无偏预测。1.3 基因型分析及SNP标记定位
参考QU等[8]的方法,利用芸薹属60K SNP芯片进行SNP检测,去除最小基因型频率(minor allele frequency,MAF)低于0.05和SNP得率(call frequency)小于80%的标记。为确定SNP在染色体上的位置,利用探针序列与基因组进行BLASTN比对[9-10],E-value设为1e-5。去除Bit-Score相同的SNP,最终获得31 468个在基因组上具有唯一位置的高质量SNP用于后续分析。1.4 群体结构分析与全基因组关联分析
在TASSEL 5[11]中进行主成分分析(PCA矩阵),计算亲缘关系矩阵(K)。群体结构Q值矩阵采用QU等[8]的结果。以K、Q和PCA矩阵为协变量,采用基于一般线性模型(general linear model,GLM)的GLM+P和GLM+Q模型及混合线性模型(mixed linear model,MLM)的MLM+K和MLM+P+K和MLM+Q+K共5种模型进行GWAS。显著关联SNP宽松阈值设为1/31468=3.18e-5,严谨阈值设为0.05/31468=1.59e-6。根据所有SNP的-log10(P)观察值和期望值,以ggplot2[12]绘制Quantile-Quantile散点图,确定GWAS最佳模型。基于最优模型的关联分析结果,利用qqman[13]绘制曼哈顿图。1.5 LD区间确定及候选基因分析
以Haploview 4.2[14]计算显著关联SNP所在染色体的LD,HW阈值(Hardy Weinberg P-value cutoff)设定为0.001;非缺失标记的比例为75%,MAF设定为0.05;单倍型块(haplotype block)分析采用Four Gamete Rule算法,第4配子频率(4th gamete frequency)>0.1。将显著关联SNP所在单倍型块作为候选基因所在LD区间。若显著关联SNP不属于任何单倍型块,则以SNP标记上下游各100 kb侧翼序列区间作为LD区间。候选基因筛选利用YONG等[15]的转录组数据,将LD区间内的盐胁迫诱导表达基因作为候选基因。主要分析流程为利用STAR 2.4.2a将reads比对至油菜参考基因组[16],采用Cufflinks中的cuffdiff筛选差异表达基因(differentially expressed genes,DEGs)[17],筛选标准为差异表达倍数大于2,错误发现率(false discovery rate,FDR)q-value小于0.05。1.6 候选基因组织特异及诱导表达模式
为分析候选基因组织特异性及盐胁迫诱导表达模式,于2015年盛花期取常规品种中双11的根、茎、成熟叶片和蕾,灌浆期取花后7、14、21、30和40 d种子和角果皮。按照1.2的方法进行砂培,并分别取正常和盐胁迫处理72 h的根和下胚轴。总RNA提取参照卢坤等[18]的方法。cDNA模板采用PrimeScript RT reagent Kit(宝生生物工程有限公司,大连)合成。利用SYBR Premix Ex Taq(宝生生物工程有限公司,大连)在CFX96定量PCR系统(美国Bio-Rad公司)上按照MIQE国际化标准进行qRT-PCR[19],内参为BnaACTIN7和BnaUBC21[20]。引物采用Geneious Pro 8.1.5设计(表1)。为保证扩增片段特异性,所有引物与同源基因至少相差2—3个碱基。Table 1
表1
表1本研究采用的qRT-PCR鉴定引物
Table 1qRT-PCR primers used in this study
| 基因名 Gene name | 基因编号 Gene ID | 引物序列 Sequence of primer (5′-3′) | 扩增长度 Amplification length (bp) |
|---|---|---|---|
| BnaSRO1 | BnaC04g44420D | F: ATATCGCGAGAGGGATTCTCGAAG R: GGTTCCATTTTCACAGCAGTGTGTG | 116 |
| BnaPAGR2 | BnaA05g11130D | F: ATACTCTCTTTAGAACAAGATCATTCTGGCCT R: CGAAGAGCGCCGCCTCCTAAAT | 182 |
| BnaNPH3 | BnaA06g35230D | F: GGAATCATCAGAAAGTGTATAGATTCTATAGTAG R: GATAATACAGCGGAATAAGTCCAAGTCGA | 183 |
| BnaMYB124 | BnaA06g09160D | F: GGCAACCTGATCTCCATGATTCAC R: CCCGAGGTGGGCATATTCTCTT | 196 |
| BnaSAM-Mtase | BnaA07g03510D | F: GGAATCTCAGCAAAATCCGGACAAT R: CTGTCTCGAGGAAGAACACGACTA | 165 |
| BnaBIN2 | BnaC03g62810D | F: GCTTCAGCTGATGCGCGTCA R: GACAAGAGGCATTCTCTGGTTGG | 175 |
| BnaUMAMIT11 | BnaC03g22990D | F: GGAAAGCACGTAGACGATATCGG R: GATTCCTTCTCAGCTGCCTGAACT | 167 |
| BnaEXPA7 | BnaA08g24690D | F: CATGGCCGTGAAAGGTAGTCG R: GCACTACTCTTGTAAGTCATGCCAG | 195 |
| BnaRPT3 | BnaC03g49850D | F: AGCCCCTTACCTCGCCG R: GTTGGCTGCTCTGAGGAGGC | 136 |
| BnaEF-hand | BnaA06g37340D | F: GTGAGGATCTGTCGGAGTTTATCC R: CATGGATCGTTAGGAGGAGGC | 169 |
| BnaF3H | BnaC08g22640D | F: CTCGAGAAAGAGGCACTCACCA R: CTCGTGTGGCTTGTAAACCACCAA | 175 |
| BnaUBC21 | BnaA06g27860D/ BnaA09g04490D | F: CCTCTGCAGCCTCCTCAAGT R: CATATCTCCCCTGTCTTGAAATGC | 77 |
| BnaACTIN7 | BnaA03g55890D/ BnaC02g00690D/ BnaA10g22340D | F: CCCTGGAATTGCTGACCGTA R: TGGAAAGTGCTGAGGGATGC | 141 |
新窗口打开
2 结果
2.1 油菜萌发相关性状表型数据
正常和盐胁迫条件下,幼苗平均根长分别为4.92和3.94 cm,变异系数为16.86%和42.48%(表2),胁迫处理前后根长差值平均为1.01 cm,变异系数为199.57%。正常萌发条件下,下胚轴平均长4.48 cm,变异系数为25.75%;盐胁迫处理后降至3.03 cm,变异系数为31.41%;胁迫处理前后下胚轴长差值平均为1.49 cm,变异系数为67.07%。结果表明,不同材料间的萌发性状差异较大,为GWAS分析奠定基础。Table 2
表2
表2盐胁迫下甘蓝型油菜发芽期幼苗根长和下胚轴长的统计分析
Table 2Statistical analysis of RL and HL of B. napus seedlings at germination stage under salt stress treatment
| 表型 Phenotype | 材料数 Number of accessions | 均值±标准差 Mean±SD | 最小值 Minimum | 中位数 Median | 最大值 Maximum | Kolmogorov-Smirnov | 相关系数 Correlation coefficient | |
|---|---|---|---|---|---|---|---|---|
| Z | P值P-value | |||||||
| RLW1 | 295 | 4.928±0.819 | 2.692 | 4.937 | 8.012 | 0.722 | 0.674 | 0.879** |
| RLW2 | 281 | 4.916±0.803 | 2.572 | 4.841 | 8.025 | 0.676 | 0.751 | |
| RLN1 | 295 | 3.942±1.669 | 0.483 | 4.563 | 7.058 | 2.874 | 0.000 | 0.936** |
| RLN2 | 281 | 3.936±1.693 | 0.481 | 4.499 | 7.163 | 2.834 | 0.000 | |
| RLD1 | 295 | 1.016±2.014 | -3.446 | 0.238 | 6.150 | 2.746 | 0.000 | 0.926** |
| RLD2 | 281 | 1.010±2.064 | -3.469 | 0.411 | 6.531 | 2.389 | 0.000 | |
| HLW1 | 295 | 4.463±1.136 | 1.592 | 4.463 | 7.188 | 0.919 | 0.367 | 0.925** |
| HLW2 | 281 | 4.500±1.196 | 1.725 | 4.508 | 7.643 | 0.548 | 0.925 | |
| HLN1 | 295 | 3.005±0.926 | 0.475 | 3.025 | 5.300 | 0.616 | 0.843 | 0.915** |
| HLN2 | 281 | 3.059±0.990 | 0.452 | 3.096 | 5.835 | 0.603 | 0.860 | |
| HLD1 | 295 | 1.495±0.973 | -0.913 | 1.463 | 4.138 | 0.889 | 0.408 | 0.934** |
| HLD2 | 281 | 1.482±1.063 | -1.089 | 1.458 | 4.201 | 0.703 | 0.705 | |
新窗口打开
正态分布检验表明(表2),RLW、HLW、HLN和HLD的P-value大于0.05,符合正态分布。RLN和RLD的P-value为0,但其频次分布呈单峰偏态或双峰分布,表现为主基因+多基因的数量遗传特征(图1)。上述结果表明,本研究目标性状均为数量性状,受多基因调控。
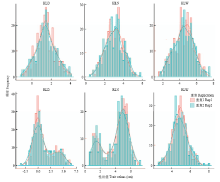 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1盐胁迫下甘蓝型油菜发芽期幼苗根长和下胚轴长的频次分布
-->Fig. 1Frequency distribution of HL and RL of B. napus seedlings at germination stage under salt stress treatment
-->
2.2 关联分析模型选择
GWAS最优模型分析表明,GLM模型控制假阳性的能力较差,与MLM模型相比,GLM+P和GLM+Q模型均严重偏离期望值。3种MLM模型对根长的解析能力差别不大,但在下胚轴长的GWAS分析中,MLM+P+K模型检测到的P-value较其他模型更接近期望值,能更好地控制假阳性(图2),因此,采用MLM+P+K模型进行GWAS分析。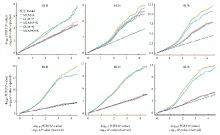 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同性状5种模型比较的QQ图
-->Fig. 2Quantile-quantile plots of estimated -log10(p) from association analysis using five methods for different traits
-->
2.3 萌发性状的全基因组关联分析
利用MLM+P+K模型对目标性状进行GWAS分析。由于HLW和HLN检出位点较多,筛选显著关联SNP时采用严谨阈值,其他4个性状采用宽松阈值(表3和图3)。结果表明,共检测到45个显著关联SNP,其中独立SNP 36个,重复检测SNP 7个。与HL显著关联SNP共40个,其中HLW和HLN存在17和21个显著相关SNP,C03染色体紧密相邻的2个SNP与HLD显著关联。与RLW、RLN和RLD显著关联的SNP各有3个、1个和1个。HL和RL的单一SNP表型贡献率分别为9.12%—14.46%和7.67%—8.93%。Table 3
表3
表3盐胁迫下甘蓝型油菜发芽期幼苗下胚轴长和根长的的显著关联SNPs
Table 3Significant associated SNPs of HL and RL of B. napus seedlings at germination stage under salt stress treatment
| 性状 Trait | SNP探针号 SNP probe number | 染色体 Chr. | 位置 Position (bp) | 等位基因 Allele | 最小等位基因频率 MAF | P值 P-value | 贡献率 R2 |
|---|---|---|---|---|---|---|---|
| HLW | rs37979 | A02 | 3131494 | C/T | 0.312 | 1.57E-07 | 12.638 |
| HLN | rs6186 | A03 | 19247585 | A/G | 0.325 | 1.11E-07 | 13.498 |
| HLN | rs9466 | A04 | 1752487 | A/G | 0.128 | 1.63E-07 | 13.174 |
| HLN | rs12473 | A05 | 6205280 | A/G | 0.343 | 6.86E-07 | 11.976 |
| HLW | rs12473 | A05 | 6205280 | A/G | 0.343 | 6.07E-08 | 13.400 |
| HLW | rs11476 | A05 | 18651193 | G/T | 0.339 | 4.71E-07 | 11.761 |
| HLN | rs14494 | A06 | 4964207 | C/T | 0.435 | 1.92E-07 | 13.038 |
| HLW | rs14494 | A06 | 4964207 | C/T | 0.435 | 1.64E-08 | 14.458 |
| HLW | rs14751 | A06 | 6091946 | A/G | 0.270 | 1.01E-06 | 11.159 |
| HLW | rs13546 | A06 | 15512773 | C/T | 0.492 | 6.13E-07 | 11.552 |
| HLN | rs14037 | A06 | 23444533 | A/C | 0.410 | 2.65E-07 | 12.769 |
| HLW | rs14037 | A06 | 23444533 | A/C | 0.410 | 1.53E-06 | 10.825 |
| HLN | rs14147 | A06 | 24366028 | G/A | 0.435 | 5.21E-08 | 14.136 |
| HLN | rs22322 | A07 | 3477622 | A/G | 0.434 | 3.56E-07 | 12.521 |
| HLW | rs22322 | A07 | 3477622 | A/G | 0.434 | 8.48E-07 | 11.295 |
| HLN | rs15434 | A07 | 14975988 | T/C | 0.499 | 3.57E-07 | 12.521 |
| RLW | rs16139 | A07 | 19310174 | C/T | 0.161 | 1.45E-05 | 8.932 |
| HLN | rs16427 | A07 | 22517611 | A/G | 0.296 | 1.03E-06 | 11.641 |
| HLN | rs18707 | A08 | 2513455 | G/A | 0.439 | 5.84E-08 | 14.039 |
| HLN | rs18038 | A08 | 13575343 | A/G | 0.391 | 9.94E-07 | 11.668 |
| HLN | rs18442 | A08 | 17007108 | T/C | 0.260 | 1.04E-06 | 11.634 |
| HLW | rs18448 | A08 | 17026237 | A/C | 0.280 | 4.30E-07 | 11.833 |
| HLW | rs8570 | A10 | 4047120 | T/C | 0.469 | 1.11E-06 | 11.078 |
| HLN | rs23615 | A10 | 9082874 | T/C | 0.271 | 1.54E-06 | 11.308 |
| HLW | rs48171 | C01 | 30305788 | T/C | 0.291 | 4.53E-07 | 11.792 |
| HLN | rs38255 | C02 | 42483650 | C/T | 0.473 | 1.13E-07 | 13.482 |
| HLN | rs27904 | C03 | 12839150 | G/T | 0.297 | 1.47E-06 | 11.343 |
| HLW | rs27904 | C03 | 12839150 | G/T | 0.297 | 1.71E-07 | 12.570 |
| HLD | rs40823 | C03 | 34607618 | G/A | 0.091 | 2.59E-05 | 9.148 |
| HLD | rs40822 | C03 | 34607739 | T/C | 0.185 | 2.67E-05 | 9.124 |
| HLW | rs38161 | C03 | 37040348 | T/C | 0.387 | 7.31E-07 | 11.412 |
| HLW | rs29836 | C03 | 51969206 | T/C | 0.263 | 1.46E-07 | 12.697 |
| HLN | rs24406 | C03 | 52357539 | A/C | 0.254 | 1.08E-06 | 11.597 |
| HLW | rs24406 | C03 | 52357539 | A/C | 0.254 | 2.61E-08 | 14.081 |
| HLN | rs39277 | C04 | 9129425 | A/C | 0.311 | 1.91E-07 | 13.043 |
| HLN | rs8970 | C04 | 44583867 | G/A | 0.293 | 1.53E-06 | 10.130 |
| HLW | rs8970 | C04 | 44583867 | G/A | 0.293 | 4.88E-08 | 12.345 |
| RLD | rs8970 | C04 | 44583867 | G/A | 0.293 | 3.47E-05 | 7.674 |
| RLW | rs8970 | C04 | 44583867 | G/A | 0.293 | 1.01E-05 | 8.160 |
| HLN | rs47181 | C05 | 4305731 | A/G | 0.369 | 1.41E-07 | 13.297 |
| HLW | rs35157 | C05 | 35242768 | C/A | 0.255 | 1.51E-06 | 9.711 |
| HLN | rs37430 | C06 | 8299084 | A/C | 0.243 | 6.14E-07 | 12.069 |
| RLN | rs35083 | C08 | 25295395 | G/A | 0.364 | 3.62E-05 | 8.594 |
| HLN | rs32417 | C08 | 35812498 | G/A | 0.360 | 9.13E-07 | 11.739 |
| RLW | rs39358 | C09 | 15755706 | A/C | 0.415 | 1.68E-05 | 8.818 |
新窗口打开
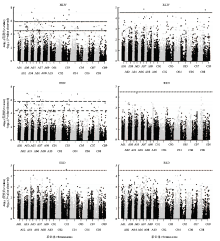 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3盐胁迫下甘蓝型油菜发芽期下胚轴长和根长全基因组关联分析的曼哈顿图
-->Fig. 3Manhattan plots of GWAS for HL and RL of B. napus seedlings at germination stage under salt stress treatment
-->
重复检测的显著相关SNP中,6个为HLW和HLN间的重复,位于A05、A06、A07和C03染色体,其很可能与控制下胚轴发育的基因紧密连锁。A08染色体上分别与HLN和HLW显著关联的rs18442和rs18448为相邻SNP,其可能同时与HLN和HLW紧密连锁。值得注意的是C04染色体的rs8970,其同时与HLW、HLN、RLW和RLD 4个性状显著关联,表型贡献率为7.67%—12.35%,是唯一在HL和RL间重复检测到的显著关联SNP。
2.4 盐胁迫下油菜幼苗叶片和根部差异表达基因分析
转录组分析表明,盐胁迫处理12 h后幼叶和根部有大量基因诱导表达,其中上调表达基因分别为1 304和1 334个,下调表达基因为220和336个。在叶片和根部同时上调和下调表达的基因分别为202和12个,而在叶片和根部特异上调表达的基因分别为1 125和1 097个。2.5 LD区间内候选基因的筛选
利用Haploview 4.2[14]分析各性状贡献率最高或性状间重复检测到的显著关联SNP所在LD区块。结果表明,11个重要的显著关联SNP中有6个位于LD区块中,长度分别为10—442 kb(表4)。GWAS与差异表达基因比较分析发现,在11个LD区间的447个基因中有15个受盐胁迫诱导表达,但无显著关联SNP位于这些基因内。此外,分析与HLW和HLN相关的6个LD区段时,重点关注苗期发育调控基因。剩余区段重点选择与非生物胁迫相关基因。最终初步筛选的候选基因中BnaSRO1与盐胁迫和发育调控相关,BnaPAGR2、BnaNPH3、BnaMYB124、BnaSAM-Mtase、BnaBIN2、BnaUMAMIT11和BnaEXPA7与发芽阶段的发育过程有关,BnaRPT3、BnaEF-hand和BnaF3H可能与油菜发芽期的盐胁迫适应性相关。Table 4
表4
表4显著关联标记所在LD区间及候选基因
Table 4LD intervals and candidate genes of significant association markers
| 关联性状 Associated trait | SNP探针 SNP probe | 染色体 Chr. | LD区间 LD interval (kb) | 单倍型块大小 Haplotype block size (kb) | 候选基因 Candidate genes | 对应拟南芥基因 Corresponding Arabidopsis genes |
|---|---|---|---|---|---|---|
| HLN、HLW、RLD、RLW | rs8970 | C04 | 44439943—44796243 | 356 | BnaSRO1 | AT2G35510 |
| HLW、HLN | rs12473 | A05 | 6105280—6305280 | BnaPAGR2 | AT2G31865 | |
| HLW、HLN | rs14037 | A06 | 23213061—23444533 | 231 | BnaNPH3 | AT5G47800 |
| HLW、HLN | rs14494 | A06 | 4864207—5064207 | BnaMYB124 | AT1G14350 | |
| HLW、HLN | rs22322 | A07 | 3040896—3477622 | 436 | BnaSAM-Mtase | AT3G44840 |
| HLW、HLN | rs24406 | C03 | 51969206—52357539 | 388 | BnaBIN2 | AT4G18710 |
| HLW、HLN | rs27904 | C03 | 12739150—12939150 | BnaUMAMIT11 | AT2G40900 | |
| HLW、HLN | rs18442/rs18448 | A08 | 17007108—17449913 | 442 | BnaEXPA7 | AT1G12560 |
| HLD | rs40822/rs40823 | C03 | 34507618—34707739 | BnaRPT3 | AT5G64330 | |
| HLN | rs14147 | A06 | 24355445—24366028 | 10 | BnaEF-hand | AT4G38810 |
| RLN | rs35083 | C08 | 25195395—25395395 | BnaF3H | AT3G51240 |
新窗口打开
2.6 候选基因的组织特异和诱导表达模式
qRT-PCR检测结果表明(图4),11个基因均在萌发后72 h的根和下胚轴中有不同程度表达, BnaPAGR2、BnaEF-hand、BnaSAM-Mtase和BnaEXPA7在萌发后72 h根的表达量高于下胚轴,而BnaMYB124、BnaRPT3、BnaBIN2和BnaF3H则刚好相反。盐胁迫处理后,BnaPAGR2、BnaSAM-Mtase、BnaRPT3、BnaBIN2、BnaSRO1和BnaF3H在根部显著上调表达,BnaEF-hand、BnaEXPA7、BnaUMAMIT11、BnaRPT3和BnaSRO1在下胚轴中显著上调表达。此外,BnaUMAMIT11、BnaPAGR2和BnaEXPA7在萌发的根和下胚轴中特异表达,表明其可能与油菜萌发阶段根和下胚轴的发育调控有关。BnaRPT3、BnaBIN2和BnaMYB124虽然呈组成型表达,但在下胚轴中表达量最高。BnaSAM-Mtase在萌发阶段的根和花后40 d种子中表达量较高,说明该基因同时参与种子成熟及萌发。BnaEF-hand、BnaSRO1和BnaF3H在除萌发阶段的根和下胚轴外的其他组织器官中也有较高的转录水平,表明其除了在萌发阶段发挥功能以外,还参与油菜叶片、蕾、种子和角果皮的发育调控。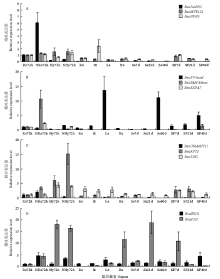 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4荧光定量PCR检测11个候选基因的表达模式A:BnaPAGR2、BnaMYB124和BnaNPH3的表达模式;B:BnaEF-hand、BnaSAM-Mtase和BnaEXPA7的表达模式;C:BnaUMAMIT11、BnaRPT3和BnaBIN2的表达模式;D:BnaSRO1和BnaF3H的表达模式;Ro72h:发芽72 h的根;NRo72h:盐胁迫下发芽72 h的根;Hy72h:发芽72 h的下胚轴;NHy72h:盐胁迫下发芽72 h的下胚轴;Ro:花期的根;St:花期的茎;Le:花期成熟叶片;Bu:蕾;Se7d:花后7 d种子;Se21d:花后21 d种子;Se40d:花后40 d种子;SP7d:花后7 d荚果皮;SP21d:花后21 d荚果皮;SP40d:花后40 d荚果皮。误差线表示平均值的标准差(n=3)
-->Fig. 4Expression patterns of 11 candidate genes by qRT-PCRA: Expression patterns of BnaPAGR2, BnaMYB124 and BnaNPH3; B: Expression patterns of BnaEF-hand, BnaSAM-Mtase and BnaEXPA7; C: Expression patterns of BnaUMAMIT11, BnaRPT3 and BnaBIN2; D: Expression patterns of BnaSRO1 and BnaF3H; Ro72h: root of 72 h after germination; NRo72h: Root of 72 h after germination under salt stress condition; Hy72h: hypocotyl of 72 h after germination; NHy72h: hypocotyl of 72 h after germination under salt stress condition; Ro: root at flowering stage; St: stem at flowering stage; Le: mature leaf at flowering stage; Bu: bud; Se7d: seed of 7 d after flowering; Se21d: seed of 21 d after flowering; Se40d: seed of 40 d after flowering; SP7d: silique pericarp of 7 d after flowering; SP21d: silique pericarp of 21 d after flowering; SP40d: silique pericarp of 40 d after flowering. Error bars in qRT-PCR detection results represent the standard error of the mean (n = 3)
-->
3 讨论
甘蓝型油菜基因组序列的公布及SNP芯片的开发促进了油菜重要数量性状的定位研究[9]。目前,有****已开展了油菜种子重量和品质[21]、干旱胁迫抗性[22]、种子萌发和活力[23]、收获指数[24]、株高、一次分枝数[25]、单株产量、生物产量和开花时间[26]等性状的GWAS分析,鉴定了大量控制油菜重要性状的位点。本研究利用砂培试验,对正常和盐胁迫萌发条件下幼苗下胚轴长和根长性状进行GWAS分析,鉴定出45个显著关联的SNP,分布在油菜基因组的16条染色体,其中A03染色体上的rs6816与荐红举等[6]利用重组自交系群体检测到的控制盐胁迫下油菜种子发芽率的QTL位点qD4-A03-1非常接近,仅相距348 kb,很可能为同一QTL区间。ZHANG等[22]对模拟干旱胁迫条件下油菜萌发的根长、茎长、根茎长度比和鲜重进行了GWAS分析,鉴定出的显著关联标记Bn-A10-p3063220、Bn-scaff_16394_2- p1222322、Bn-scaff_17623_1-p657238和Bn-scaff_ 16445_1-p1834116与笔者在相同染色体发现的显著关联SNP均在1 Mb范围内。由于ZHANG等[22]的GWAS群体仅包含66个自交系,表型数据较少,关联分析准确性受影响,因此,其鉴定的位点与本研究结果可能一致,但还需要进一步比较研究。HATZIG等[23]利用GWAS对油菜种子萌发和种子活力进行了解析,其中A05和C08染色体的显著关联SNP与本研究定位结果一致。虽然,本研究检测到的位点与前人定位QTL部分重叠,但仍有多个显著关联标记无法与其他研究对应,可能与鉴定方法及调查性状不同有关,这些位点可作为新的候选基因区域作进一步研究。不同油菜品种对盐胁迫的抗(耐)性存在显著差异[2],这是解析油菜耐盐性关键遗传因子和耐盐基因的基础。本研究利用GWAS和转录组综合分析方法,最终确定了11个重要LD区间的候选基因。其中,显著关联SNP rs22322所在LD区间的候选基因BnaSAM-Mtase(BnaA07g03510)位于A07染色体,编码S-腺苷基甲硫氨酸依赖的甲基转移酶(S- adenosyl-L-methionine-dependent methyltransferase),其被证实对维持细胞功能,提高植株抗氧化胁迫能力具有重要作用[27]。本研究中BnaA07g03510在根和下胚轴均受盐胁迫显著上调表达,提示其可能也以类似的方式提高油菜发芽期下胚轴和根部的耐盐性。而rs18442和rs18448标记LD区间的候选基因BnaA08g24690D编码α-扩张蛋白7(BnaEXPA7),在根和下胚轴中特异表达,并在下胚轴中受盐胁迫诱导上调表达,由于α-扩张蛋白家族主要具有松弛细胞壁,决定器官大小和形态建成的作用,因此其对油菜下胚轴伸长和盐胁迫适应性可能也起到了重要作用[28]。BnaSRO1(BnaC04g44420D)是最值得关注的候选基因,其位于显著关联SNP rs8970的LD区段内,与HLN、HLW、RLD和RLW 4个性状均紧密连锁,编码具有多聚(ADP-核糖)聚合酶催化结构域和WWE蛋白互作结构域的RCD1类蛋白(SIMILAR TO RCD ONE1,SRO1)。有研究表明,RCD1能与AP2/ERF、NAC和bHLH(basic helix-loop-helix)转录因子互作,调节植物的发育 和胁迫响应[29]。此外,RCD1还能质膜Na+/H+逆向转运蛋白SOS1互作,提高拟南芥氧化胁迫适应能力[30]。本研究发现,BnaSRO1在根和下胚轴中受盐胁迫诱导表达,其转录水平在叶和花后40 d角果皮中也具有较高的转录水平,提示其不仅对油菜发芽期下胚轴的发育及盐胁迫适应性具有重要作用,可能也参与叶片和角果皮的发育调控。类黄酮合成途径的关键蛋白黄烷酮3-羟化酶(flavanone 3- hydroxylase gene,F3H)具有提高植物抵抗干旱、盐胁迫和紫外辐射的能力[31]。位于显著关联标记rs35083 LD区间内的BnaF3H(BnaC08g22640D)在油菜发芽期根部受盐胁迫诱导上调表达,提示其可能对油菜发芽期根部的盐胁迫适应也具有重要作用。除上述4个基因外,基因表达模式和基因功能注释分析显示另外7个候选基因很可能也参与了油菜发芽阶段根和下胚轴的发育调节或与苗期盐胁迫适应相关。因此,深入开展上述候选基因的基因功能研究将有助于准确揭示油菜发芽期根和下胚轴的发育及盐胁迫适应机制,为提高油菜耐盐性和选育耐盐品种奠定基础。
4 结论
GWAS分析检测到45个与油菜发芽期根和下胚轴发育及盐胁迫适应性显著关联的SNP,其中40个和5个分别与下胚轴长和根长显著关联。重要显著关联SNP的11个LD区间共含447个基因,转录组分析和基因功能注释综合分析进一步筛选出11个重要候选基因。除BnaNPH3,其余10个候选基因均在根或下胚轴中受盐胁迫诱导上调表达,部分基因具有根或下胚轴特异表达特性,说明这些基因很可能参与油菜发芽期根和下胚轴生长发育及耐盐性的调节。The authors have declared that no competing interests exist.
