0 引言
【研究意义】水稻是稳定中国经济增长和保障粮食安全的重要作物之一。在种植过程中,颖果胚乳细胞生长发育和新陈代谢都与其内部水分状态密切相关[1-2]。核磁共振技术具有操作方便、快速无损的优点,可以有效地检测植物体系中水分状态和分布差异[3]。因此,利用核磁共振技术探究水稻灌浆过程中籽粒水分变化和品质形成规律具有重要意义。【前人研究进展】水稻的生长发育及品质特性受到品种基因和环境条件等因素影响。李栋梁等[4]发现粳稻与籼稻在颖果发育进程上存在差异,糯稻与非糯稻在淀粉体形态与灌浆充实程度上有区别。通常灌浆速率相对平缓,前期和中期持续时间较长,会产生较好的稻米品质[5]。然而,高温胁迫和水分胁迫都会影响水稻正常灌浆,前者会改变谷蛋白的代谢和积累形态,后者会不同程度地抑制可溶性淀粉合成酶、Q酶和ADPG焦磷酸化酶的活性[6-7]。目前,核磁共振技术已经在分析小麦器官水分动态[8]、种子浸泡吸水[9]、玉米漂烫处理[10]、果蔬成熟度[11-12]等方面得到广泛应用。HORIGANE等[13]观察到形态结构、淀粉颗粒填充和裂隙形成决定米粒在浸泡过程中水分渗透途径和速率。HWANG等[14]利用MRI图像证实稻谷在缓苏操作中水分分布不均匀而且有间隔。SEEFELDT等[15]基于核磁信号的主成分分析,发现葡聚糖含量对大麦中的水分分布和流动性存在显著影响。【本研究切入点】以往研究水稻生长过程中的水分仅是测定整体含水量,核磁共振技术能够从氢质子的水平,提供非常丰富的信息,检测到籽粒内部的水分状态和分布差异,以及与淀粉、蛋白质等大分子的结合作用。目前,对水稻灌浆过程中水分动态与物质积累关系的分析研究未见报道。【拟解决的关键问题】本文通过低场核磁共振(LF-NMR)技术,观察水稻在抽穗不同生长时期的籽粒水分动态和分布差异,试图阐明淀粉、蛋白质等积累效应对水分状态的影响,探讨水稻品质形成过程和水分状态的相关联系,为合理制定高品质水稻的田间栽培管理技术措施提供理论依据。1 材料与方法
1.1 试验材料与试验地概况
试验样品为“越光”有机稻;试验于南京市江宁区汤山镇孟墓村藏龙湾农场(119°06″N,32°06″E)进行,该地属于亚热带季风气候区,气候温和,雨量适中。该地土壤属下蜀黄土,土壤平均容重1.36 g·cm-3,耕作层土壤含有机质23.5 g·kg-1,速效磷40.6 mg·kg-1,速效钾117.5 mg·kg-1,全氮0.19 g·kg-1,pH 6.65。2015年5月15号播种育秧,施基肥600 kg·hm-2(N、P2O5和K2O比例2﹕1﹕1),6月6号移植插秧,种植密度225 000 穴/hm2,一周后施分蘖肥390 kg·hm-2(尿素,46%),抽穗期间追加穗肥225 kg·hm-2(尿素,46%),田间持水量30 cm3·cm-3左右,病虫害等管理按当地常规方法。9月3号抽穗80%后开始田间随机取样,之后每隔7 d一次,试验期间气候正常,10月15号开始排水晒田,采样时间截止到11月5号。每次上午10点前后采集新鲜的稻穗,采后试验在南京财经大学食品科学与工程学院粮食储运国家工程试验室进行,经过人工脱粒,选出大小较一致完整的带壳籽粒,密封袋包装储藏于4℃冰箱中。试验所用化学试剂均为分析纯。1.2 主要仪器与设备
TP-114型分析天平(北京丹佛仪器有限公司);101-电热恒温鼓风干燥箱(上海苏进仪器设备厂);高速万能磨粉机FW100(天津泰斯特仪器有限公司);TA.XT.Plus.质构仪(英国Stable Micro System公司);Buchi凯氏定氮仪K-360(瑞士Buchi公司);NMI-20 Analyst 型核磁共振分析仪(上海纽迈电子科技有限公司)。1.3 测定方法
1.3.1 百粒重测定 随机选取100颗新鲜带壳的籽粒,通过分析天平测定重量,每组3次平行。1.3.2 硬度测定 采用TA.XT.Plus.质构仪对新鲜带壳的籽粒进行硬度测试,测试选用P/36R探头,操作模式为压力测定,操作类型为Compression,触发力设置为10 g,测试前速度1 mm·s-1,测试速度0.5 mm·s-1,测试后速度1 mm·s-1,压缩程度设置为50%。
1.3.3 水分含量测定 根据国标GB/T 21305—2007,经过预处理后采用130℃烘箱法,烘干至恒重。
1.3.4 淀粉和蛋白质含量测定 称量新鲜的籽粒置于105℃烘箱中杀青0.5 h,于80℃烘干至恒重,带壳磨粉处理过80目筛,得到样品细粉,淀粉含量根据国标GB/T 5514—2008,采用酶解法测定,蛋白质含量根据国标GB 5009.5—2010,通过凯氏定氮法测定样品的全氮含量,再乘以换算系数5.95,即为粗蛋白质含量。
1.3.5 横向弛豫参数测定 试验前,通过核磁共振波谱分析软件中的FID(free induction decay)脉冲序列校准中心频率。然后称取(1.00±0.01)g新鲜带壳的籽粒置于直径15 mm的核磁管中,采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的横向弛豫参数,每组样品5个平行,重复3次,取平均值。CPMG脉冲序列的参数设置为:主频SF1=19 MHz,采样频率SW=200 kHz,90°硬脉冲射频脉宽P1=13 μs,180°硬脉冲射频脉宽P2=25 μs,信号采样点数TD=135 014,重复采样等待时间TW=1 500 ms,重复采样次数NS=16,回波个数NECH=3 000。
1.3.6 数据分析 SPSS22.0软件对数据指标进行单因素方差分析(One-way ANOVA)和Pearson相关性分析,方差分析效应显著采用最小显著差异法(least significant difference,LSD)进行多重比较(P<0.05),对样品横向弛豫信号前1 000个点的数据进行主成分分析(principal component analysis, PCA),特征值大于1的主成分被保留;图表采用office 2003软件绘制。
2 结果
2.1 水稻籽粒的主要物理性质和化学成分变化
表1可以看出,“越光”有机稻的灌浆速率在抽穗后7—14 d内最快,期间每粒平均值达到1.727 mg·d-1,抽穗后28 d,百粒重增长至峰值3.437 g,整体灌浆呈现出“缓-快-慢”的趋势;干物质含量在抽穗后42 d才增长至峰值2.416 g干基/100粒。随着颖果发育,淀粉和蛋白质等大分子充实胚乳细胞,籽粒硬度在抽穗后42 d内线性地从717.63 g增长到24 505.53 g,基本形成饱满坚硬的质构特性。抽穗后7 d内,水分含量从55.34%略微上升至57.16%,随后7—49 d内显著性地下降至22.76%,后期随自然气候条件小范围内波动。水稻灌浆实际上主要是淀粉颗粒充实胚乳细胞的过程,淀粉含量在抽穗后的42 d内增长至峰值50.47 g/100 g湿基,总体呈现“S”型曲线变化。蛋白质含量整体呈现“V”型变化,在抽穗后7 d内,从5.21 g/100g湿基下降到3.79 g/100g湿基,随后7—49 d内线性地增长至峰值6.56 g/100g湿基,单粒蛋白质含量则呈现“S”型曲线增长。总体而言,“越光”有机稻在抽穗后49 d内基本品质已经形成,主要物理性质和化学成分含量后期趋于稳定。Table 1
表1
表1水稻籽粒在抽穗后不同生长时期主要物理性质和化学成分统计
Table 1The main physical properties and chemical conponents statistics of rice grains at different growth periods after heading
| 生长时期 Growth period (d) | 主要物理性质 Main physical properties | 主要化学成分(湿基) Main chemical components (wet-basis) | |||
|---|---|---|---|---|---|
| 百粒重 100-grain weight (g) | 硬度 Hardness (g) | 水分含量 Moisture content (%) | 淀粉含量 Starch content (g/100g) | 蛋白质含量 Protein content (g/100g) | |
| 1 | 0.830±0.010f | 717.63±30.34g | 55.34±0.45b | 4.56±0.24g | 5.21±0.16d |
| 7 | 1.501±0.076e | 3615.19±197.40f | 57.16±0.20a | 13.65±0.81f | 3.79±0.12f |
| 14 | 2.710±0.093d | 9481.70±330.47e | 49.10±0.36c | 28.07±0.82e | 3.83±0.11f |
| 21 | 3.231±0.045b | 14818.41±768.56d | 40.42±0.50d | 34.23±0.72d | 4.68±0.10e |
| 28 | 3.437±0.129a | 18453.61±926.64c | 35.80±0.21e | 40.82±0.57c | 5.22±0.13d |
| 35 | 3.333±0.128ab | 21598.51±1040.44b | 31.04±0.23f | 46.60±0.90b | 5.76±0.15c |
| 42 | 3.255±0.034b | 24505.53±1205.52a | 25.75±0.13g | 50.47±1.51a | 6.12±0.16b |
| 49 | 3.083±0.035c | 25857.66±603.27a | 22.76±0.27i | 49.93±2.22a | 6.56±0.21a |
| 56 | 3.000±0.039c | 24995.22±1144.80a | 22.39±0.23i | 49.43±1.83a | 6.34±0.09ab |
| 63 | 3.067±0.107c | 25464.47±1154.24a | 25.17±0.17h | 48.92±1.23a | 6.36±0.11a |
新窗口打开
2.2 水稻籽粒的横向弛豫参数与水分状态变化
图1反映出抽穗后不同生长时期单位质量水稻籽粒的LF-NMR总信号强度和水分含量存在极显著(P<0.01)的线性关系,通过LF-NMR的总信号强度能准确地去预测籽粒中的水分含量。同时,低场核磁技术也可以测定谷物、油料种子等样品中的脂肪含量[16]。考虑稻谷中油脂含量较低,大约2%—3%,主要集中在麸皮和糠层中[17],对本试验核磁信号影响非常小,故未作探讨。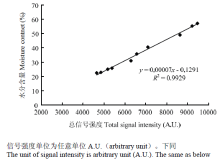 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同生长时期单位质量水稻籽粒的总信号强度与水分含量线性拟合
-->Fig. 1Linear relationship between total signal intensity for one gram of rice grains and moisture content at different growth periods
-->
水稻籽粒本身是一种非均匀相体系,较传统干燥法,LF-NMR技术可以利用氢质子在磁场中的自旋-弛豫特性,微观地分析其中的水分状态及与淀粉、蛋白质等大分子结合作用[18]。由图2可知,水稻籽粒在生长过程中横向弛豫信号反演图谱先后出现4个峰,分别代表4种流动性不同的水分,其中T2b<T21<T22<T23,T23流动性最强,T2b流动性最弱。出于方便描述考虑,T2b峰(0.1—1 ms)和T21峰(1—10 ms)表征籽粒内部被淀粉、蛋白质等大分子包围或与其极性基团作用紧密的“结合水”;T22峰(18—45 ms)表征毛细管束缚和部分淀粉等大分子颗粒表面羟基氢质子快速交换形成的束缚水;T23峰(80—170 ms)表征籽粒的液泡、原生质和细胞间隙中流动性最强的自由水。
图2-A观察出水稻籽粒在抽穗后7 d内的反演图谱呈现T21和T22两个峰的形式,横向弛豫时间T21和T22分别平均从4.239 ms和41.408 ms降低至3.862 ms和36.015 ms(表2),但是出现部分A21峰面积向A22峰面积转移的现象。这表明在抽穗后7 d内,籽粒中部分水分向着高自由度方向移动,可能是由于在颖果形成期间,胚乳内部的细胞生理活性增强,分裂分化作用需要更多的自由水分。图2-B中显示表征流动性最弱“结合水”的T2b峰在第14 d左右出现,弛豫时间T2b在0.414 ms左右,A2b峰面积达到320.651左右,主要原因是在抽穗后7-14 d,水稻进入乳熟期,灌浆速率加快,少量水分子开始被胚乳内积累的淀粉颗粒包围形成流动性最弱的“结合水”。在此期间,A21峰面积从2 758.616 A.U.增长到3 247.764 A.U.,A22峰面积从6 681.004 A.U.下降至5 079.684 A.U.(表3),整体水分状态逐渐向左迁移。在抽穗后14—21 d,LF-NMR反演图谱在69.793 ms左右出现峰的分化,产生表征自由水的T23峰(图2-C)。这是因为水分含量最大幅度地从49.10%下降至40.42%,使得总体信号强度下降,和淀粉、蛋白质等的持续增长效应,共同产生峰的分化现象。抽穗后14 d内籽粒中实际存在自由水的形式,只是被T22峰掩盖而已。在抽穗后35 d左右,4种反演峰基本呈现彼此完全分离的状态(图2-D)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同生长时期的单位质量水稻籽粒低场核磁信号强度与横向弛豫时间T2反演图谱
-->Fig. 2The inversion spectrum of normalization LF-NMR signal intensity for one gram of rice grains and transverse relaxation time T2 at different gorwth periods
-->
Table 2
表2
表2不同生长时期的水稻籽粒横向弛豫时间T2变化
Table 2Changes of transverse relaxation time T2 for rice grains at different growth periods
| 生长时期 Growth period (d) | 横向弛豫时间T2b Transverse relaxation time T2b (ms) | 横向弛豫时间T21 Transverse relaxation time T21 (ms) | 横向弛豫时间T22 Transverse relaxation time T22 (ms) | 横向弛豫时间T23 Transverse relaxation time T23 (ms) |
|---|---|---|---|---|
| 1 | - | 4.239±0.349a | 41.408±3.255a | - |
| 7 | - | 3.862±0.304b | 36.015±2.831b | - |
| 14 | 0.414±0.033a | 3.206±0.264c | 31.324±2.462c | - |
| 21 | 0.344±0.028b | 3.054±0.000cd | 27.244± 2.142d | 167.166±13.141a |
| 28 | 0.299±0.025c | 2.921±0.230cde | 26.007±2.142de | 159.578±13.141a |
| 35 | 0.260±0.021d | 2.789±0.230de | 24.771±0.000de | 138.793±11.430b |
| 42 | 0.226±0.019d | 2.656±0.000ef | 23.695±1.863ef | 104.992±8.646c |
| 49 | 0.171±0.014e | 2.425±0.200fg | 20.609±1.620fg | 95.658±7.520c |
| 56 | 0.171±0.014e | 2.310±0.000g | 19.674±1.620g | 91.317±7.520c |
| 63 | 0.179±0.014e | 2.310±0.000g | 20.609±1.620fg | 95.658±7.520c |
新窗口打开
Table 3
表3
表3不同生长时期的水稻籽粒归一化后LF-NMR峰面积变化
Table 3Changes of normalization LF-NMR peak area for rice grains at different growth periods (A.U.)
| 生长时期 Growth period (d) | A2b峰面积 A2b peak area | A21峰面积 A21 peak area | A22峰面积 A22 peak area | A23峰面积 A23 peak area |
|---|---|---|---|---|
| 1 | - | 4848.266±91.415a | 4310.720±196.537c | - |
| 7 | - | 2758.616±169.092h | 6681.004±219.383a | - |
| 14 | 320.651±24.645e | 3247.764±74.526g | 5079.684±277.619b | - |
| 21 | 294.743±15.449e | 4141.467±146.574d | 1712.761±162.533d | 955.744±64.280a |
| 28 | 382.231±17.106d | 4310.182±106.658c | 1188.372±92.805e | 693.357±18.530b |
| 35 | 533.151±44.436c | 4596.872±22.529b | 721.645±21.434f | 431.409±17.680c |
| 42 | 640.937±34.079b | 4165.927±113.242cd | 351.037±24.979g | 226.606±16.337e |
| 49 | 724.057±14.753a | 3697.319±65.981f | 233.393±3.792g | 193.026±16.962e |
| 56 | 612.908±43.797b | 3616.636±21.416f | 232.519±25.703g | 182.493±17.271e |
| 63 | 707.972±18.702a | 3882.323±31.830e | 302.994±8.398g | 298.606±14.260d |
新窗口打开
抽穗后49 d内,T2b、T21、T22和T23都整体随生长时期显著地缩短,分别稳定在0.171、2.425、20.609和95.658 ms左右,说明期间籽粒内的氢质子自由度和水分流动性在逐渐降低。LSD法多重比较发现49 d后的4种横向弛豫时间变化差异不显著,保持稳定(表2)。A2b峰面积在抽穗后14—49 d内从320.651 A.U.增长至724.057 A.U.,A2b峰比例从3.68%上升至14.93%,后期峰面积变化较小,峰比例基本保持在14%左右;A21峰面积在抽穗后7 d内出现显著下降,A21峰比例从52.59%下降至29.08%,随后7—49 d内峰面积上下波动,峰比例却从29.08%逐步增长至73.05%(表3和图3)。第21天前后,“结合水”的A2b和A21峰比例总和超过束缚水的A22和自由水的A23峰比例总和,表明水分子更多可能会被淀粉、蛋白质等大分子包围或键合形成“结合水”。A22峰面积在7—49 d内从6 681.004 A.U.急剧地下降至233.393 A.U.,峰比例从70.48%降低到4.82%;A23峰面积在21—49 d内从955.74 A.U.下降至193.026 A.U.,峰比例从13.19%降低到3.98%。这说明随着灌浆充实,整体水分含量降低,束缚水和自由水的含量和比例都会明显降低。
2.3 水稻籽粒的LF-NMR数据主成分分析
选取水稻籽粒横向弛豫信号的前1 000个数据点(0.225—225 ms)有效代表整体数据信息进行主成分分析。表4显示出通过降维处理,主成分1清楚地解释97.413%的水稻在抽穗后不同生长时期LF-NMR数据信息变化,主成分2的解释方差2.388%可以表征平行样品之间的差异,两者共同保留了99.800%的原始数据信息。图4反映出在抽穗后42 d内,不同生长时期的籽粒横向弛豫特性存在显著性差异;42 d以后,样品差异不明显,整体性质进入一个较稳定的状态。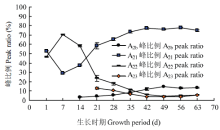 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同生长时期的水稻籽粒4种低场核磁信号峰比例折线图
-->Fig. 3The line chart of four LF-NMR signal peak ratios for rice grains at different growth periods
-->
Table 4
表4
表4不同生长时期的水稻籽粒横向弛豫信号的主成分分析
Table 4Principal component analysis of transverse relaxation signals for rice grains at different growth periods
| 主成分 Principal component | 特征值 Eigenvalue | 解释方差 Explained variance (%) | 累积解释方差 Cumulative explained variance (%) |
|---|---|---|---|
| 1 | 974.102 | 97.413 | 97.413 |
| 2 | 22.901 | 2.388 | 99.800 |
新窗口打开
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同生长时期水稻籽粒低场核横向弛豫磁信号的PCA图
-->Fig. 4The PCA image of LF-NMR transverse relaxation signals for rice grains at different growth periods
-->
2.4 水稻籽粒的理化数据与横向弛豫特性变化关系
在表5中,百粒重与淀粉含量极显著正相关(P<0.01),与水分含量极显著负相关(P<0.01),表明水稻灌浆过程主要是淀粉充实胚乳细胞作用,同时伴随水分含量显著下降。硬度分别与水分含量、T2b、T21、T22、T23、A22和A23都极显著负相关(P<0.01),与A2b、淀粉含量和蛋白质含量都极显著正相关(P<0.01),说明籽粒的结构特性不仅与水分含量有关,而且受到水分状态影响,淀粉和蛋白质的增长促使籽粒形成饱满坚硬的品质和结构。淀粉含量和蛋白质含量分别与T2b、T21、T22、T23、A22和A23都极显著负相关(P<0.01),与A2b极显著正相关(P<0.01)。这些表明淀粉累积是降低籽粒中氢质子自由度和促使水分向“结合水”方向迁移的主要因素,同时蛋白质的少量增长也会帮助束缚水分子自由流动。Table 5
表5
表5水稻生长过程中理化数据和横向弛豫参数相关性分析
Table 5The correlation between physicochemical data and transverse relaxation parameters of grains during the growth process of rice
| 生长时期 GP | 百粒重 HGW | 硬度 H | 水分含量 MC | 淀粉含量 SC | 蛋白质含量 PC | |
|---|---|---|---|---|---|---|
| 百粒重 HGW | 0.678* | |||||
| 硬度 H | 0.946** | 0.844** | ||||
| 水分含量 MC | -0.952** | -0.775** | -0.988** | |||
| 淀粉含量 SC | 0.904** | 0.905** | 0.989** | -0.960** | ||
| 蛋白质含量 PC | 0.842** | 0.432 | 0.814** | -0.883** | 0.727* | |
| T2b | -0.956** | -0.194 | -0.985** | 0.991** | -0.958** | -0.991** |
| T21 | -0.946** | -0.862** | -0.975** | 0.952** | -0.977** | -0.717* |
| T22 | -0.939** | -0.868** | -0.980** | 0.957** | -0.979** | -0.723* |
| T23 | -0.935** | 0.790* | -0.964** | 0.981** | -0.910** | -0.965** |
| A2b | 0.916** | 0.009 | 0.928** | -0.918** | 0.913** | 0.932** |
| A21 | 0.005 | 0.087 | 0.110 | -0.172 | 0.071 | 0.409 |
| A22 | -0.850** | -0.765** | -0.924** | 0.947** | -0.890** | -0.887** |
| A23 | -0.846* | 0.582 | -0.985** | 0.984** | -0.990** | -0.978** |
新窗口打开
3 讨论
3.1 水稻生长过程中水分状态与物质积累的相关联系探讨
在水稻生长过程中,颖果基本经历形成期、乳熟期、蜡熟期和完熟期后形成最终品质特性。抽穗后7 d内,籽粒内部水分在反演图谱上向右迁移,部分“结合水”的A21峰面积向束缚水的A22峰面积转化,整体水分含量略有上升(表1和图2-A)。原因是在颖果形成期间,细胞分裂、分化成内胚乳细胞和糊粉层,需要更多自由水分进行新陈代谢和反应[4]。前人研究发现细胞内的液态水在稻谷和小麦种子萌芽过程中起着关键作用,尤其是胚在早期会快速吸收水分,在充分水合作用下提高内部酶的生理活性[19-20]。抽穗后7—14 d内,反溃图谱则开始整体往左移动,部分束缚水向“结合水”迁移,出现表征流动性最弱“结合水”的T2b峰(图2-B)。在此期间,“越光”有机稻的籽粒百粒重和淀粉含量都增速最快,分别达到1.727 mg·d-1/粒和2.06 g·d-1/100g湿基。这与孙金才等[5]发现花后10 d左右是水稻灌浆速率最大时期的结果相符。有****观察到ADPG焦磷酸化酶、可溶性淀粉合成酶、Q酶和过氧化氢酶等在淀粉合成中起主导作用,淀粉积累最快阶段与大多数酶活性最高时期基本同步[21]。第21天左右,反演图谱分化出表征自由水的T23峰,呈现4种反演峰的形态。同时“结合水”的比例超过束缚水和自由水的比例总和,这与同期淀粉和蛋白质等大分子含量超过水分含量表现一致(表1和图3)。这表明淀粉快速灌浆会显著地改变籽粒水分迁移方向和分布状态。李栋梁等[4]观察到淀粉颗粒在花后4—15 d内从呈卵状或球形,彼此有间隙,到相互挤压而呈多面体形,更大程度地充实内胚乳细胞。ISHIMARU等[22]通过MRI图像发现高温胁迫会使得早期胚乳中心水分含量较低,中期时垩白部位的水分又较高,产生更多的垩白粒。因此,水稻籽粒的正常灌浆是最终品质形成的前提条件,淀粉和蛋白质等物质积累和内部水分迁移共同形成水稻最终的品质。水分含量在抽穗后7—49 d内呈指数式下降的趋势,从57.16%下降至21.74%,因为胚乳细胞的细胞核、液泡和细胞器逐渐消亡、降解,淀粉等大分子充实,整体持水能力下降导致[4]。T2b、T21、T22、T23、A22和A23分别与水分含量都呈极显著正相关(P<0.01)。因此,籽粒内部氢质子自由度和流动性强的水分比例都会随水分减少而显著降低。TANAKA等[23]发现在花后耐热性和热敏感性水稻品种的弛豫时间(T1和T2)都在逐渐降低,这与本文结果一致。CASTRO等[24]比较3种小麦籽粒在花后7、21和42 d的反演图谱,整体也随生长时期向左移动。淀粉和蛋白质含量分别与横向弛豫时间(T2b、T21、T22和T23)和峰面积(A2b、A22和A23)都极显著相关(P<0.01)。抽穗后7—49 d内,随着淀粉和蛋白质持续累积,A2b和A21峰比例总和不断升高,A22和A23的峰面积及峰比例显著下降。KRISHNAN等[25]有类似发现,提高施氮水平会增长同期玉米的淀粉和蛋白质含量,使得“结合水”比例提高、自由水和细胞质水比例下降。KASAI等[26]通过核磁成像观察到高淀粉的籼米在蒸煮过程中具有完好形态,水分吸收和扩散速率降低。因此,淀粉充实胚乳程度不仅决定籽粒水分分布差异,还影响后期稻米蒸煮品质。籽粒硬度不仅随水分含量降低而升高,而且与横向弛豫参数(T2b、T21、T22、T23、A22、A23和A2b)极显著相关(P<0.01),表明水分状态对其影响明显。陈银基等[27]发现在动态储运过程中,稻谷初始含水量越低,蒸煮后米饭硬度越大,食味品质变差。这表明水分状态对水稻生长过程中籽粒结构特性和后期储藏品质都有重要影响。
3.2 水稻生长过程中LF-NMR数据和品质变化的相关联系探讨
随着排水晒田,水分含量在抽穗后42—49 d内从25.75%进一步下降至22.76%,抽穗49 d后,表1中的百粒重、硬度、淀粉含量和蛋白质含量变化差异不显著,但是籽粒干物质含量呈现下降的趋势,在抽穗后49—63 d内从2.381 g干基/100粒降低到2.295 g干基/100粒,这说明收割过晚会直接影响水稻产量。THOMPSON和MUTTERS[28]研究发现水稻随着收割时期延迟,整体水分降低且分布不均匀,使得干燥后的整精米率和品质下降。徐兴凤等[29]认为适当提前晚籼米的采收时期,有利于提高籼米的食味品质,后期直链淀粉和蛋白质的增长会降低口感和芳香气味。主成分分析通过降维后的特征向量代表原始数据信息的基础上,利用散点图表达样品之间的整体性质差异[30-31]。本研究中主成分1和2共同累积解释方差达99.800%,清楚地反映“越光”有机稻在抽穗后42 d内不同生长时期的籽粒水分状态差异显著,42 d后趋于稳定(图4),这与前面理化指标分析籽粒品质变化的结果基本一致。MUSSE等[12]通过弛豫时间和MRI图像分析采摘后的西红柿成熟度差异,观察其组织结构变化。LI等[32]发现在糯米固态发酵过程中,由于淀粉等多糖分子被酶分解,整体结构受到破坏,自由水比例上升,束缚水和“结合水”比例下降,PCA图显示样品水分状态随发酵时间变化显著。因此,LF-NMR技术可以作为监测和分析水稻灌浆过程中的籽粒整体水分状态和品质变化的一种技术手段。
4 结论
水稻生长过程中,淀粉和蛋白质等物质积累与籽粒内部水分状态、峰的分化和峰面积转移等核磁信号变化密切相关,籽粒内部整体水分动态向“结合水”方向迁移,束缚水和自由水的比例显著降低。通过理化指标和LF-NMR数据的分析,可以清楚地反映抽穗后42 d内的水稻籽粒水分状态变化显著,49 d左右籽粒整体品质趋于稳定。The authors have declared that no competing interests exist.
